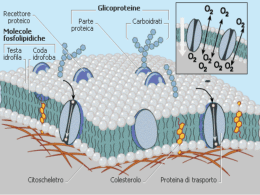
prof.ssa Loredana Del Fabbro LA CONCENTRAZIONE DELLE SOLUZIONI La concentrazione di una soluzione esprime la quantità di soluto (in grammi, moli, volume) contenuta in una determinata quantità (litri, kg, grammi..) di solvente. Una soluzione può essere diluita quando contiene una quantità di soluto relativamente piccola oppure concentrata quando contiene una elevata quantità di soluto. In laboratorio si preparano spesso soluzioni a minor concentrazione diluendo le soluzioni concentrate. Esistono diversi modi per esprimere la concentrazione di una soluzione. 1. Percentuale in massa (%m/m); Parti per Milione E' il rapporto percentuale tra la massa del soluto ed la massa della soluzione (grammi di soluto per 100 g di soluzione) %m/m = msoluto 100 msoluto +msolvente Ad esempio in una soluzione preparata sciogliendo 24 g di NaCl in 152 g di acqua: %m/m = 24 g 100 = 14% 24 g+ 152 g Quando la quantità è molto piccola, come per le tracce di diserbanti nell’acqua, la concentrazione viene spesso espressa in parti per milione (ppm) ppm soluto = msoluto (mg) 100 m soluzione (kg) 2. Percentuale in volume (v/V) E' il rapporto percentuale tra il volume del soluto ed il volume della soluzione (ml di soluto per 100 ml di soluzione). Viene spesso utilizzata nelle soluzioni in cui tutti i componenti sono liquidi. La gradazione delle bevande alcoliche è ad esempio espressa come percentuale in volume. % V/V= Vsoluto 100 Vsoluzione Ad esempio un superalcolico che ha un grado alcolico del 40% contiene 40 mL di alcol etilico puro su 100 mL di soluzione. 3. Rapporto massa – volume (m/V) E' il rapporto tra il peso del soluto espresso in grammi ed il volume della soluzione espresso in litri (g/L). m/V = msoluto g L Vsoluzione prof.ssa Loredana Del Fabbro Frazione molare (X) E' il rapporto tra il numero di moli di soluto ed il numero di moli totali. x soluto = n soluto n soluto = n totali n soluto +n solvente La somma delle frazioni molari di tutti i componenti una miscela è uguale a 1. XA + XB + XC +…… =1 Riprendendo l’esempio precedente della soluzione ottenuta sciogliendo 24 g di NaCl in 152 g di H2O, calcoliamo le frazioni molari di soluto e di solvente 24 g = 0,414 mol 58 g/mol 0,414 = 0, 0490 0, 414 8, 44 n NaCl = x NaCl nH O = 2 152 g = 8,44 mol 18 g/mol x H O =1 0,0490 = 0,951 2 4. MOLARITÀ (M) E' la misura più importante della concentrazione di una soluzione. Essa rappresenta il rapporto tra il numero di moli di soluto ed il volume della soluzione espresso in litri. Indica il numero di moli di soluto presenti in un litro di soluzione (mol/L). M nsoluto mol Vsoluzione L da cui nsoluto M V e Vsoluzione n M Calcolare la molarità di una soluzione acquosa di NaOH ottenuta sciogliendo 4,00 g di NaOH in 250 mL di H2O (si suppone che non vi sia variazione di volume dopo l’aggiunta del solido) 4,00 g = 0,100 mol 40 g/mol 0,100 mol M = 0, 400 mol/L 0, 250 L n NaOH = 5. Molalità (m) E' il rapporto tra il numero di moli di soluto ed il peso del solvente espresso in kg. Indica il numero di moli di soluto presenti per chilogrammo di solvente (mol/kg). m= n soluto Wsolvente mol kg prof.ssa Loredana Del Fabbro Una soluzione usata per fleboclisi contiene 4,80 g di glucosio C6H12O6 per 90,0 g di H2O. Qual è la molalità del glucosio? 4,80 g = 0,0266 mol 180 g/mol 0,0266 mol m= 0, 296 mol/kg 0, 090 kg n glu cos io = Densità delle soluzioni È un dato molto importante, che dipende dalla quantità di soluto disciolto in un certo volume di soluzione. d msoluzione g mL Vsoluzione ELETTROLITI E NON-ELETTROLITI Le soluzioni sono sempre e comunque neutre dal punto di vista elettrico sia che derivino da soluti ionici che da soluti ionizzati ( ovvero che hanno formato ioni in soluzione).Nelle soluzioni di sali, ad esempio, il numero totale delle cariche positive è sempre uguale al numero totale delle cariche negative (principio dell’elettroneutralità delle soluzioni). Questo non vuol dire che non esistono cariche nelle soluzioni. Esiste tuttavia una differenza significativa fra soluzioni di sostanze non ionizzate e soluzioni di sostanze ioniche o ionizzate: Le soluzioni di sostanze non ionizzate non conducono la corrente elettrica Le soluzioni di sostanze ioniche o ionizzate conducono la corrente elettrica Questo consente di suddividere le sostanze chimiche i due categorie: ELETTROLITI: sostanze le cui soluzioni conducono la corrente elettrica in quanto contengono ioni; NON ELETTROLITI: sostanze le cui soluzioni non conducono la corrente elettrica in quanto esse passano in soluzione formando particelle solvatate neutre e non contengono ioni. Gli elettroliti a loro volta si suddividono in : ELETTROLITI FORTI quando sono completamente dissociati . Sono elettroliti forti : tutti i sali (anche quelli poco solubili, per la parte che si solubilizza) alcuni acidi (come HClO4, HCl, HNO3, H2SO4) ed alcune basi ( ovvero gli idrossidi come NaOH, LiOH, KOH, Ca(OH)2 ed Mg(OH)2 ) e che vengono indicati come acidi e basi forti. NaCl + H2O Na+(aq) + Cl(aq) Mg(NO3)2 + H2O Mg2+(aq) + 2NO3(aq) Na3PO4 + H2O 3Na+(aq) + PO43(aq) HCl + H2O H3O+(aq) + Cl(aq) HClO4 + H2O H3O+(aq) + ClO4(aq) H2SO4 +2 H2O 2 H3O+(aq) + SO42(aq) NaOH(aq) Na+(aq) + OH(aq) Ca(OH)2 (aq) Ca2+(aq) + 2OH(aq) prof.ssa Loredana Del Fabbro ELETTROLITI DEBOLI quando sono parzialmente dissociati in ioni ( una parte di esso è presente sottoforma di molecole indissociate). Sono elettroliti deboli: Soltanto alcuni acidi e basi detti acidi e basi deboli. Il loro equilibrio di ionizzazione viene così rappresentato: HCN + H2O H3O+(aq) + Cl(aq) HClO +H2O H3O+(aq) + ClO(aq) HIO3 +H2O H3O+(aq) + IO3(aq) CH3COOH +H2O H3O+(aq) + CH3COO(aq) Questi sono acidi deboli. NH4+(aq) + OH(aq) NH3 + H2O L’ammoniaca è invece una base debole. Prove di conducibilità elettrica delle soluzioni acquose ci permettono di stabilire se una sostanza è un elettrolita o un non-elettrolita e se è un elettrolita forte o debole. Si definisce grado di dissociazione il rapporto tra il numero di moli dissociate ed il numero di moli inizialmente presenti. = =0 n dissociate n iniziali soluto non elettrolita assenza di dissociazione 01 elettroliti deboli soluto completamente dissociato =1 (teoricamente a diluizione infinita) La dissociazione aumenta con la diluizione Se una sostanza presenta ad esempio un grado di dissociazione pari a 0,3 significa che per ogni 100 molecole che sono state poste in soluzione, 30 si sono dissociate in ioni, mentre 70 sono disciolte senza essere dissociate. Il grado di dissociazione non è una buona misura della forza di un elettrolita debole, in quanto, come affermato, aumenta con la diluizione. In altre parole il grado di dissociazione di un elettrolita debole aumenta progressivamente man mano che diluiamo la soluzione. Per confrontare la forza di due elettroliti deboli possiamo confrontarne il grado di dissociazione solo se le due soluzioni presentano la stessa concentrazione. DILUIZIONE E MISCELAZIONE DELLE SOLUZIONI Un’operazione molto comune in laboratorio chimico consiste nella preparazione di soluzioni di una determinata concentrazione a partire da una soluzione più concentrata disponibile commercialmente. Ad esempio sono disponibili in commercio soluzioni concentrate di H 2SO4 18 M, HCl 11 M, HNO3 16M, ecc. Da queste è possibile preparare soluzioni di concentrazione desiderata a seconda delle necessità. Si effettua pertanto una diluizione. prof.ssa Loredana Del Fabbro Come? Si preleva un certo volume di soluzione concentrata, lo si trasferisce in un matraccio tarato e si aggiunge acqua. È importante osservare che, in questa operazione, la quantità chimica di soluto (moli) non cambia. moli di soluto nella soluzione concentrata = moli di soluto nella soluzione diluita Indicate con n1 le moli di soluto nella soluzione concentrata e con n2 le moli di soluto nella soluzione diluita, risulterà allora che n1 = n2 e ricordando che n = M·V sarà M1·V1 = M2·V2 dove: M1 = molarità della soluzione concentrata V1 = volume della soluzione concentrata da prelevare M2 = molarità desiderata della soluzione diluita V1 = volume desiderato della soluzione diluita Attenzione! La quantità di H2O da aggiungere ad un volume noto di soluzione concentrata V1 per preparare un volume V2 di soluzione diluita sarà data dalla differenza: V H2O = V2 – V1 Calcolare il volume di acqua che bisogna aggiungere a 600,7 mL di una soluzione di cloruro di potassio (KCl) 2,75 M per ottenere una soluzione 1,29 M. Calcoliamo le moli di KCl nella soluzione concentrata. 2,75 mol/L · 0,6007 L = 1,65 mol che devono essere le stesse nella soluzione diluita di molarità nota 1,29M. da cui pertanto
Scarica