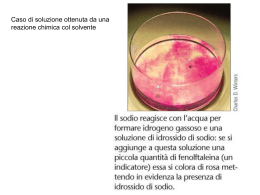
Le soluzioni Una soluzione viene definita come un sistema omogeneo costituito da due o più componenti Il componente presente in maggiore quantità viene detto solvente, quello/i in minore quantità soluto/i Ci occuperemo di soluzioni in cui almeno un componente si trova allo stato liquido La composizione di una soluzione viene definita precisando le quantità relative dei componenti che la costituiscono, o le loro quantità contenute in un volume unitario di soluzione, ossia definendone la concentrazione La concentrazione è una proprietà intensiva Modi usuali di esprimere la composizione delle soluzioni 1. Percento in massa, o peso %. Rappresenta il rapporto % tra la massa di soluto, ms, o di solvente, mS, e la massa della soluzione: Peso % di soluto = ms /(ms + mS) · 100 Peso % di solvente = mS /(ms + mS) · 100 2. Percento in volume, o volume %. Rappresenta il rapporto % tra il volume v di un componente e il volume V della soluzione: Volume % = (v / V) · 100 E’ da notare che i volumi dei componenti non sono additivi: per esempio sciogliendo 500 mL di etanolo in 500 mL di acqua si ottengono solo 966 mL di soluzione 3. Massa di soluto per unità di volume di soluzione. Questa concentrazione è data dal rapporto tra la massa di soluto ms (spesso espressa in g) e il volume di soluzione, V (di solito espresso in dm3 o L) in cui questo è disciolto: c = ms/ V (g /dm3 o g / L) La concetrazione così espressa dipende dalla temperatura 4. Parti per milione (ppm). E’ un modo per esprimere la concentrazione di soluzioni molto diluite. Esprime le parti di soluto ogni milione di parti di soluzione (es mg di un componente ogni kg di soluzione). Modi di esprimere la concentrazione delle soluzioni • Molarità (M). E’ definita dal rapporto tra il numero di moli di soluto (ns) e il volume V (espresso in dm3 o L) di soluzione in cui è disciolto: C = [soluto] = ns / V (mol /dm3 o mol /L) o M Come simbolo della concentrazione molare si usa la formula del soluto racchiusa tra parentesi quadre. Es. le scritture [Na2CO3]; [Na+]; [CO32-] indicano che le concentrazioni di carbonato di sodio o dei suoi ioni sono espresse in mol/dm3 o mol/L Anche la molarità dipende dalla temperatura • Molalità (m). E’ data dal rapporto tra il numero di moli di soluto (ns) e la massa di solvente (mS) espressa in kg, in cui sono disciolte: m = ns / mS (mol/kg) La molalità di una soluzione rappresenta il numero di moli di soluto disciolte in un kg di solvente puro (non dipende dalla temperatura) • Frazione molare (X). Rappresenta il rapporto tra il numero di moli di un componente (soluto o solvente) e il numero totale di moli presenti nel sistema L’acqua come solvente La natura dipolare delle molecole di acqua rende questo solvente particolarmente adatto alla solubilizzazione di sostanze ioniche Nel solido ionico, es. NaCl, gli ioni costituenti formano una struttura ordinata in cui ogni cationi è attorniato da un numero definito di anioni, in stretto contatto, occupando posizioni regolari nel reticolo cristallino In soluzione i singoli ioni sono indipendenti, ognuno attorniato da molecole di acqua (ioni solvatati), muovendosi in tutte le direzioni, disperdendosi uniformemente nel volume della soluzione. La concentrazione massima di soluto per unità di volume di soluzione, ad una data temperatura, definisce la solubilità di quella sostanza in quel definito solvente. Modalità di preparazione di una soluzione Soluzioni di gas in liquidi Mentre i gas sono miscibili in tutti i rapporti, la quantità di gas che si può sciogliere in un liquido è limitata. La massima concentrazione di gas in un liquido (espressa in numero di moli per litro di soluzione), ad una data temperatura, definisce la solubilità del gas in quel solvente. La solubilità (S) di un gas è direttamente proporzionale alla sua pressione parziale (p) nella fase gassosa soprastante la soluzione: Legge di Henry: S = K· p La costante di proporzionalità K (costante di Henry; mol-1 L-1 atm-1) dipende dalla natura del gas (vedi tabella), dal solvente e dalla temperatura La legge di Henry è valida rigorosamente solo per soluzioni diluite di gas poco solubili che non reagiscono con il solvente: non è quindi applicabile ai gas HCl, NH3, SO2 Effetto della temperatura sulla solubilità di un gas In generale la solubilità (S) dei gas nei liquidi è modesta e diminuisce all’aumentare della temperatura
Scarica