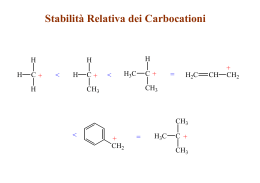
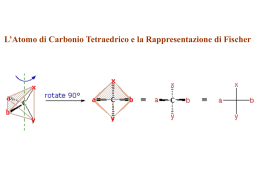
Idrocarburi Alifatici Alcano R-CH2-CH2-R CnH2n+2 Questo è il massimo rapporto H/C per un dato numero di atomi di carbonio. Alchene R-CH=CH-R CnH2n Ogni doppio legame riduce il numero di atomi di idrogeno di 2. Alchino R-C@C-R CnH2n-2 Ogni triplo legame riduce il numero di atomi di idrogeno di 4. REGOLE IUPAC PER LA NOMENCLATURA DI ALCHENI E CICLOALCHENI Il suffisso ene indica un alchene o un cicloalchene. La catena più lunga scelta per denominare il composto deve comprendere entrambi gli atomi di carbonio del doppio legame. La catena deve essere numerata cominciando dal carbonio terminale più vicino al doppio legame. Se il doppio legame è al centro della catena, e se un sostituente è presente, si numera la catena in modo che il sostituente abbia il numero più basso. Il più piccolo dei due numeri che designano il doppio legame viene usato per individuare la posizione del doppio legame all'interno della catena. Nei cicloalcheni, agli atomi di carbonio del doppio legame vengono assegnati i numeri 1 e 2. Quale dei due sia il numero 1 si decide in base alla regola del sostituente più vicino. Gruppi sostituenti contenenti doppi legami sono: H2C=CH- gruppo vinile H2C=CH-CH2- gruppo allile Esempi di Nomenclatura di Alcheni Esempi di Nomenclatura di Alcheni Esempi di Nomenclatura di Cicloalcheni ed Alchini Orbitali Atomici del Carbonio C:1s2 2s2 2p2 Orbitali Ibridi sp2 e Formazione del Doppio Legame C=C L’Isomeria Cis-Trans negli Alcheni Esempi di Isomeria Cis-Trans negli Alcheni Le Regole di Sequenza per l'Assegnamento della Configurazione degli Alcheni Assegnare le priorità ai gruppi sostituenti legati a ciascun atomo di carbonio, osservando gli atomi legati direttamente ai carboni costituenti il doppio legame. Più elevato è il numero atomico dell'atomo legato direttamente al carbonio, più elevata è la sua priorità. Per esempio, H- < C- < N- < O- < Cl-. Se due sostituenti hanno la stessa priorità considerando gli atomi legati direttamente al carbonio del doppio legame bisogna considerare i sostituenti sugli atomi via via più distanti dal doppio legame fino a che non si trova una differenza. Per esempio, CH3- < C2H5- < ClCH2- < BrCH2- < CH3O-. Gli atomi dei sostituenti legati con legami multipli si considerano equivalenti ad atomi recanti solo legami semplici. Per esempio, C=O equivale a C(-O)2. Se il sostituente con la più alta priorità presente sul carbonio 1 ed il sostituente con la più alta priorità presente sul carbonio 2 si trovano dalla stessa parte del doppio legame l'isomero è Z altrimenti l'isomero è E. Le Quattro Classi Principali di Reazioni Addizione Eliminazione Sostituzione Trasposizione Processi Omolitici ed Eterolitici Rottura di un Legame Formazione di un Legame Elettrofili e Nucleofili Elettrofilo: Si definisce elettrofilo un atomo, uno ione o una molecola elettron-deficiente che mostra affinità per una coppia elettronica e che perciò cercherà di legarsi ad un nucleofilo (o base di Lewis). Nucleofilo: Si definisce nucleofilo un atomo, ione o molecola che possiede una coppia di elettroni che può impegnare nella formazione di un legame chimico per reazione con un elettrofilo (o acido di Lewis). Basicità e Nucleofilicità Base I (-) Cl (-) H2O CH3CO2(-) RS(-) CN(-) RO(-) NH2(-) CH3(-) Acido Coniugato HI HCl H3O(+) CH3CO2H RSH HCN ROH NH3 CH4 pKa -9 -7 -1.7 4.8 8 9.1 16 33 48 Nucleophilicity: CH3CO2 (-) < Cl(-) < Br(-) < N3(-) < CH3O(-) < CN(-) < I(-) < CH3S(-) In soluzione di DMSO Nucleophilicity: I(-) < Br(-) < Cl(-) ~ N3(-) < CH3CO2 (-) < CN(-) ~ CH3S(-) < CH3O(-) Equilibrio e Velocità di una Reazione aA + bB [C]c[D]d Keq. = . a b [A] [B] -E/RT Keq. = e Reazione ad un singolo stadio, endotermica cC + dD E = 0, Keq. =1 E > 0, Keq. <1 -E/RT V= cost. e E < 0, Keq. >1 Reazione ad un singolo stadio, esotermica Reazione a due stadi, esotermica Addizione di HBr all'Etilene Meccanismo dell'Addizione Elettrofila di HBr agli Alcheni H H C H C + H + H H C + H + H H C + 1o Stadio H H H H H - Br H H H H Br C C H 2o Stadio H Diagramma Energetico per l'Addizione di HX all'Etilene Intermedi Reattivi Orientazione nelle Reazioni di Addizione agli Alcheni: La regola di Markovnikov H Cl H H H C C H3C Propene + HCl H H C H3C H H C H C H 2-Cloropropano Cl H3C C H 1-Cloropropano non si forma Razionalizzazione della Regola di Markovnikov Diagramma Energetico per l’Attacco Markovnikov ed Anti-Markovnikov al Propene
Scarica