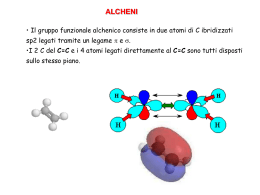
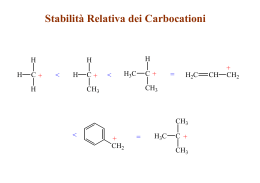
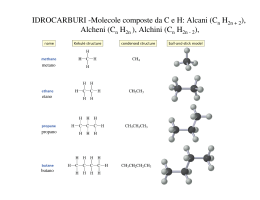
Idrocarburi insaturi Alcheni Idrocarburi insaturi • Un idrocarburo si dice insaturo quando possiede un numero di atomi di idrogeno minore al numero massimo possibile per un dato numero di atomi di carbonio. – Gli alcheni contengono almeno un doppio legame – Gli alchini contengono almeno un triplo legame Alcheni Alchini H2C CH2 HC CH Fonti e usi • Composti contenenti doppi legami carbonio-carbonio sono particolarmente diffusi in natura. • L’etilene ad esempio è un ormone delle piante che induce la maturazione dei frutti, e l’α-pinene è il costituente principale della trementina. • La vita stessa non sarebbe possibile senza alcheni come il β-carotene, carotene un composto che contiene 11 doppi legami che è il pigmento arancione responsabile del colore delle carote e di molti frutti arancioni. Il β-carotene è un precursore della vitamina A e si ritiene che assicuri una qualche protezione contro alcuni tipi di neoplasia maligna. H H H H Etilene H3C CH3 α-pinene H3C β-carotene Fonti e usi • Inoltre, diversi alcheni a basso peso molecolare, come l'etilene e il propene, rivestono un'importanza commerciale fondamentale nella nostra società industrializzata. • L'industria chimica mondiale produce quantità di etilene che, su base ponderale, superano qualunque altro prodotto chimico. • Un aspetto peculiare dell'etilene è che in natura esso è presente soltanto in tracce. tracce Le enormi quantità di etilene richieste per venire incontro alle necessità dell'industria chimica vengono ricavate tramite il cracking termico degli idrocarburi. Alcheni • Gli alcheni contenenti un solo doppio legame hanno formula bruta CnH2n • Possono contenere anche più doppi legami • Se contengono 2 doppi legami vengono detti dieni. dieni • Se contengono più doppi legami vengono detti polieni. polieni Alchene Diene Poliene Alcheni Più doppi legami possono essere: • cumulati (uno vicino all’altro) • coniugati (intervallati da un legame singolo) • isolati (intervallati da più legami singoli) Diene cumulato Diene coniugato Diene isolato Nomenclatura: Alcheni • I nomi IUPAC degli alcheni si ottengono cambiando il suffisso -ano del corrispondente alcano in -ene. ene H2C CH2 Etene o etilene H2C C C CH3 H H2 H2C C CH3 H Propene o propilene Butene H3C C C CH3 H H Nomenclatura: Alcheni • Per gli alcheni superiori, per i quali esistono isomeri che differiscono per la posizione del doppio legame, è necessario usare un sistema di numerazione. • La posizione del doppio legame è indicata dal numero del primo carbonio del doppio legame. legame H2C C C CH3 H H2 H3C C C CH3 H H 1-butene 2-butene Nomenclatura: Alcheni • Bisogna numerare la catena carboniosa più lunga contenente il doppio legame in modo da assegnare agli atomi di carbonio del doppio legame i numeri più bassi. 6-metil-2-eptene 3-metil-4-ottene 4-etil-3-ottene 4-etil-2-metil-2-esene Nomenclatura: Alcheni • Se è presente un doppio legame va scelta la catena più lunga che lo contiene. 2-etil-3-metil-1-pentene • Se il doppio legame è in posizione 1 a volte il numero viene omesso 4-metil-nonene Nomenclatura: Alcheni • Alcuni gruppi contenenti doppi legami sono storicamente noti con un nome comune: H2C gruppo metilenico H2C C H gruppo vinilico H2C C C H H2 gruppo allilico COOH COOH Acido 3-metilenglutarico Cl Cloruro di vinile Cl Cloruro di allile Nomenclatura: Cicloalcheni • I cicloalcheni sono anelli che contengono uno o più doppi legami. • Nell'assegnare il nome ai cicloalcheni, gli atomi di carbonio del doppio legame del ciclo sono numerati 1 e 2 nella direzione che consente di dare il numero più basso al sostituente incontrato per primo. 3-metil-cicloesene 2,3-dimetilciclopentene Nomenclatura: Polieni • Gli alcheni che contengono più di un doppio legame sono denominati dieni, trieni, di tri tetraeni e così via. tetra • Nel nominarli va specificata la posizione di tutti i doppi legami 2,3-esadiene 2,4-ottadiene 2,4,6-decatriene Etilene.mov Struttura • Ogni atomo di carbonio che partecipa al doppio legame di un alchene possiede tre orbitali ibridi sp2 che giacciono in un piano e presentano angoli di 120° e che formano i legami σ Etilene.mov Struttura • L’orbitale p che non partecipa all’ibridazione e che contiene un elettrone forma il legame π per sovrapposizione laterale. Etilene.mov Struttura • Per ottenere il massimo grado di sovrapposizione tra loro, i due orbitali p devono essere paralleli tra loro; di conseguenza, tutti e sei gli atomi che gravitano intorno al doppio legame si trovano sullo stesso piano. piano Rotazione del legame π • Dal momento che i due orbitali p che formano il legame π devono essere paralleli, la rotazione intorno al doppio legame non può avvenire. Se ci fosse tale rotazione, i due orbitali p non sarebbero più sovrapposti e ciò porterebbe alla rottura del legame π. Isomeri cis e trans • Un alchene che ha su ognuno dei due atomi di carbonio sp2 due sostituenti diversi presenta quindi due diversi isomeri configurazionali (cis e trans ) in maniera analoga a quanto abbiamo visto per i cicloalcani. • Gli isomeri cis-trans hanno la stessa formula molecolare ma differiscono nella maniera in cui i loro atomi sono disposti nello spazio e sono quindi isomeri geometrici o diastereoisomeri. diastereoisomeri • Se ad uno dei due carboni sp2 del doppio legame sono legati due sostituenti uguali, esiste una sola struttura possibile per tale alchene. H3C H H CH3 H H3C H H H H CH3 CH3 H CH3 H H trans-2-butene cis-2-butene 1-propene ISOMERI Diversa sequenza degli atomi Diversa disposizione tridimensionale degli atomi STRUTTURALI GEOMETRICI (Stereoisomeri) CH3 CH3 CH2 CH2 CH3 CH3 C CH3 H n-butano Interconvertibili per rotazione intorno a legami semplici Interconvertibili soltanto per rottura e riformazione di legami semplici iso-butano CONFIGURAZIONALI CONFORMAZIONALI Non immagini speculari Immagini speculari Eclissata e sfalsata dell’etano DIASTEREOISOMERI ENANTIOMERI Composti ciclici cis o trans Composti con un atomo di carbonio CH3 chiraleCH3 H Composti con più di un atomo di carbonio chirale Alcheni Cis e Trans C C H cis-2-butene CH3 H C C H CH3 trans-2-butene Isomeri cis e trans • Gli isomeri cis e trans non possono interconvertire (se non rompendo il legame π). • I due isomeri sono quindi due composti diversi ed hanno diverse proprietà fisiche, come i punti di ebollizione (p.e.) ed i momenti dipolari. • Gli alcheni cis sono meno stabili dei loro isomeri trans a causa della tensione sterica tra sostituenti ingombranti dallo stesso lato del doppio legame. cis-2-butene Pf = -139°C, Pe = 4°C μ = 0.33 D trans-2-butene Pf = -106°C,Pe = 1°C μ=0D Nomenclatura IUPAC (E-Z) • Nel caso in cui sul doppio legame siano presenti sostituenti diversi la nomenclatura cis-trans potrebbe non essere esaustiva. • Per la nomenclatura IUPAC tali isomeri vengono denominati in maniera analoga ai cicloalcani sostituito come E (da parti opposte) o Z (dalla stessa parte) confrontando i sostituenti con priorità maggiore legati ai due atomi di carbonio che formano il doppio legame. Polieni cis e trans • • • • Per un alchene con n doppi legami carbonio-carbonio, ciascuno dei quali può mostrare isomeria cis-trans, sono possibili 2n isomeri cistrans. La vitamina A è un esempio di composto biologicamente importante per il quale sono possibili numerosi isomeri cis-trans. Nella catena di atomi legata all'anello cicloesenico sostituito vi sono quattro doppi legami carbonio-carbonio e ciascuno di essi può generare isomeria cis-trans. Sono possibili, quindi, 24 = 16 isomeri cis-trans con questa formula di struttura. La vitamina A è l'isomero tutto trans. OH Vitamina A (poliene tutto trans) Proprietà fisiche • Gli alcheni e gli alchini sono composti non polari e le sole forze attrattive tra le molecole sono le forze di dispersione di London. • Pertanto, le proprietà fisiche degli alcheni sono simili a quelle degli alcani con lo stesso scheletro carbonioso. • Gli alcheni e gli alchini che sono liquidi a temperatura ambiente. • Hanno densità inferiori a 1.0 g/mL e quindi sono meno densi dell'acqua. dell'acqua • Come gli alcani, gli alcheni e gli alchini sono apolari e sono solubili l'uno nell'altro. A causa della loro contrastante natura rispetto all'acqua, sono insolubili in acqua. acqua Terpeni • Tra i composti presenti negli oli essenziali delle piante, si trova un gruppo di sostanze chiamate terpeni la cui caratteristica comune è quella di avere uno scheletro di atomi di carbonio che può essere scomposto in due o più unità identiche allo scheletro carbonioso dell'isoprene. isoprene Il carbonio 1 di un'unità isoprenica è chiamato testa, mentre il carbonio 4 è chiamato coda. Un terpene è un composto in cui la coda di un'unità isoprenica è legata alla testa di un'altra unità. 4 1 2 3 isoprene o 2-metil-1,3-butadiene Terpeni • I terpeni più familiari, almeno per l'odore, sono i componenti dei cosiddetti oli essenziali ottenuti dalle piante. • Il farnesolo, un terpene di formula molecolare C15H26O, consiste di tre unità isopreniche: isopreniche derivati del farnesolo e del geraniolo sono intermedi nella biosintesi del colesterolo. • La vitamina A, un terpene di formula molecolare C20H30O, consiste di quattro unità isopreniche legate testa-coda e legate ulteriormente in un altro punto per formare un anello a sei termini. OH OH Farnesolo Vitamina A
Scarica