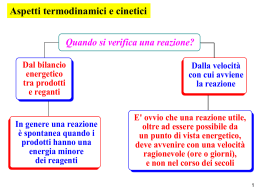
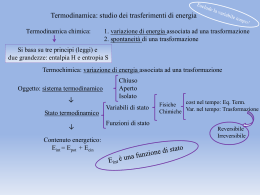
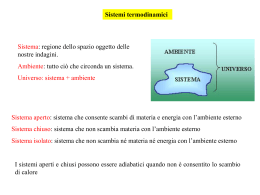
Lezione 25 – Termochimica 1 Energia interna (E) L'energia posseduta da un sistema viene definita Energia interna E (spesso indicata anche come U). L'energia interna di un sistema dipende esclusivamente dalla pressione, dalla temperatura, dal volume e dalla composizione chimica del sistema (tipo ed intensità delle interazioni tra particelle costituenti). Per questo motivo l'energia interna è una funzione di stato. Inoltre l'energia interna è una proprietà estensiva, è cioè proporzionale alla quantità di materia presente nel sistema. L'energia interna di un sistema chimico è uguale alla somma dell'energia cinetica e dell'energia potenziale di tutte le molecole che formano il sistema.ed è associata ai moti traslatori, rotazionali, vibrazionali, elettronici e nucleari delle molecole, nonché alle interazioni interatomiche (legami intramolecolari) ed intermolecolari. E(tot) = E(cin) + E(pot) L’energia interna non include invece l'energia cinetica e potenziale associata al sistema nel suo complesso, ad esempio, se il sistema è in movimento o si trova in un campo gravitazionale o elettromagnetico. la variazione di energia interna E che accompagna una reazione chimica risulta uguale alla somma del calore Q e del lavoro meccanico W messi in gioco nella reazione: E = Q - W Secondo la convenzione oggigiorno più comunemente impiegata, si considera positiva l'energia termica assorbita dal sistema e negativa quella da esso perduta, e quindi dovranno essere considerati positivi le quantità di calore somministrate al sistema durante la reazione e viceversa negative le quantità di calore sviluppate. Se ad esempio un sistema chimico reagisce trasformando dei reagenti in prodotti di reazione, noi siamo in grado di misurare solo la variazione di energia interna E che si verifica durante la reazione, espressa come differenza tra l'energia interna dei prodotti di reazione (energia interna dello stato finale, Ef) e l'energia interna dei reagenti (energia interna dello stato iniziale, Ei) ΔE = Ef − Ei Non ci è invece possibile misurare i valori assoluti di Ef ed Ei. In un sistema isolato E = 0 e la reazione avviene per conversione interna di una forma di energia in un'altra (cinetica in potenziale, o viceversa). E = Q PV Abbiamo già visto che se un sistema (chiuso) si espande a pressione costante il lavoro meccanico di espansione può essere espresso come prodotto della pressione gravante sul sistema per la variazione di volume da esso subita; se V1 è il volume a reazione avvenuta, V2 il volume iniziale e P la pressione dell'ambiente in cui avviene la reazione avremo dunque che il lavoro compiuto dal sistema durante la reazione sarà pari a P·(V2-V1) = P·V. Per la convenzione sopra ricordata (positivo il lavoro sviluppato, negativo il lavoro assorbito) si ha W = PV, da cui E = Q - PV Qualora la reazione avvenga senza variazione apprezzabile di volume PV = 0 e dunque E = Q (a volume costante) Ovvero: nelle reazioni che hanno luogo a volume costante, per esempio in un recipiente chiuso, la variazione di energia interna è uguale al calore assorbito nel corso della reazione. Solitamente però le reazioni vengono fatte avvenire in condizioni di pressione costante; in questo caso la quantità di calore assorbita o ceduta dal sistema reagente nel corso della reazione viene chiamata variazione di entalpia o, più brevemente, entalpia di reazione e indicata con il simbolo H, avremo allora H = Q (a pressione costante) Secondo la solita convenzione H si considera positivo quando la reazione avviene con assorbimento di calore, negativo quando la reazione avviene con sviluppo di calore. E = H - PV Combustione del metano CH4(g) + 2O2(g) CO2(g) + 2H2O (g) H(298 K) = -802 kJ CH4(g) + 2O2(g) CO2(g) + 2H2O (l) H(298 K) = -890 kJ La relazione che intercorre tra il calore di reazione a volume costante e il calore di reazione a pressione costante: E = H-PV dove V = V2 – V1 Ammettendo che sia valida la legge dei gas perfetti possiamo porre : V2 = n2·R·T / P e V1 = n1·R·T / P dove n2 e n1 rappresentano il numero di molecole gassose a reazione avvenuta e prima della reazione, da cui V2 - V1 = (n2 - n1) · R · T / P In definitiva P·V = (n2 - n1) · R · T = n·R·T dove n è la variazione del numero delle molecole gassose nel corso della reazione. Come esempio consideriamo la reazione : Ni(s) + H2SO4(aq) NiSO4 + H2(g) H a 25 °C = -64 kJoule. Poiché per questa reazione n = 1, il valore di E sarà dato da E = -64 – (1 · 8,314 · 298/1000) = -66,5 kJoule. Si indica con il nome di entalpia standard di formazione il valore che si ottiene nel caso in cui le sostanze interessate alla reazione si trovino nel loro stato standard e alla temperatura di 25 °C. Così, ad esempio, quando si afferma che l'entalpia di formazione standard dell'anidride carbonica vale –393500 Joule si intende che per la reazione : C(s, grafite) + O2(g) CO2(g) a 25 °C il H è pari a -393,5 kJoule. Questo appunto perché a 25 °C e 1 atmosfera la forma stabile del carbonio è rappresentata dalla grafite, quella dell'ossigeno e della CO2 dal gas. legge di Hess MgO(s) + 2HCl(aq) MgCl2(aq) + H2O(l) il cui H a 25 °C vale -34.900 kJoule. La reazione può essere scissa in due reazioni parziali. In un primo tempo si può fare reagire l'ossido di magnesio con acqua ottenendo così l'idrossido Mg(OH)2. Questo può poi essere fatto reagire con una soluzione acquosa di acido cloridrico con formazione di cloruro di magnesio e acqua: MgO(s) + H2O(l) Mg(OH)2 H = -8,800 kJ Mg(OH)2(s) + 2HCl(aq) MgCl2(aq) + 2H2O(l) H = -26,100 kJ La somma dei H delle reazioni parziali è appunto uguale a –34,900 kJoule, entalpia di reazione della reazione complessiva. Si voglia ad esempio conoscere il H della reazione di formazione del metano a partire da carbonio grafitico e idrogeno a 25 °C. C(s,grafite) + 2H2(g) CH4(g) Questa reazione non avviene direttamente in modo completo ed è dunque impossibile una misura sperimentale dell'effetto termico che l'accompagna. Sono però accessibili a una misura diretta i H delle reazioni seguenti, che avvengono tutte con rapidità e in modo completo. 1) CH4(g) + 2 O2(g) CO2(g) + 2 H2O(l) H = - 890 kJ 2) C(s,grafite) + O2(g) CO2(g) H = - 393,5 kJ 3) 2 H2(g) + O2(g) 2 H2O(l) H = - 571,6 kJ Sommando le reazioni 2) e 3) e sottraendo la 1) si ricava la reazione di formazione del metano dagli elementi. Il suo H è dunque pari a - 75,1 kJ·mol-1. CH4(g) + 2O2(g) CO2(g) + 2H2O (g) Come conseguenza immediata della legge di Hess abbiamo che il H di una qualunque reazione è uguale alla somma delle entalpie di formazione dei composti che si originano nella reazione stessa meno la somma delle entalpie di formazione delle sostanze reagenti. Ciò perché una qualunque reazione può essere teoricamente suddivisa in due processi parziali: uno nel corso del quale le sostanze reagenti vengono scisse negli elementi costituenti, per il quale la variazione di entalpia è pari all'opposto della somma delle entalpie di formazione dei reagenti, e un secondo nel corso del quale gli elementi si ricombinano fra loro per dare i prodotti di reazione, per il quale la variazione di entalpia è pari alla somma delle entalpie di formazione dei prodotti. Fe2O3(s) + 3CO(g) 2Fe(s) + 3CO2(g) H = 2·Hf(Fe) + 3· Hf(CO2) - Hf(Fe2O3) - Hf(CO) 3x C + O2 CO2 2x Fe Fe -3 x C + 1,5·O2 CO -1 x 2·Fe + 1,5·O2 Fe2O3
Scarica