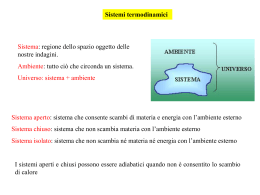
Termochimica (Cap. 14) Energia, lavoro e calore Energia interna ed Entalpia Variazioni di Entalpia Entalpia molare di formazione Entalpie molari di legame Capacità termica Calorimetria Termodinamica e Termochimica La termodinamica è quella parte della chimica che si occupa delle variazioni di energia nelle reazioni chimiche e nei cambiamenti dello stato fisico delle sostanze. La termochimica è quella parte della termodinamica che si occupa della produzione o assorbimento di energia sotto forma di calore nei processi chimici. Sistema e ambiente Nelle reazioni chimiche c’è un trasferimento di energia tra il sistema di reazione e l’ambiente. Il sistema di reazione comprende tutte le sostanze chimiche che prendono parte alla reazione. L’ambiente consiste di tutto il resto, come recipienti di reazione, bagni di acqua e l’atmosfera. Tra un sistema di reazione e l’ambiente l’energia può essere scambiata in due modi: come lavoro o come calore. La termodinamica è lo studio di questi scambi di energia. Il trasferimento di energia come lavoro (w) richiede l’azione di una forza lungo una distanza. Un sistema costituito da un gas racchiuso in un cilindro munito di pistone. Si applica una forza F al pistone, provocando uno spostamento del pistone h. L’area della superficie del pistone è A. Il lavoro di tipo PV è il lavoro fatto sul sistema o dal sistema quando è compresso o espanso a P cost. w = - PV (1) L’equazione (1) è molto utile nella termochimica, perché molte reazioni avvengono in recipienti aperti verso l’atmosfera, e l’atmosfera esercita una pressione costante nel corso della reazione. Il trasferimento di energia come calore (q) non richiede l’applicazione di una forza. Il trasferimento di calore avviene ogni volta che c’è una differenza di temperatura tra il sistema e l’ambiente. L’energia fluisce spontaneamente come calore dalle regioni a temperatura più alta alle regioni a temperatura più bassa. Calore e lavoro sono i modi in cui l’energia è trasferita. L’energia può essere classificata come cinetica o potenziale. L’energia cinetica è associata al moto, per esempio: -Il moto di atomi, molecole o ioni a livello particellare (energia termica). Tutta la materia possiede energia termica. -Il moto di un oggetto macroscopico in movimento (energia meccanica). - Il moto degli elettroni in un conduttore (energia elettrica). L’energia potenziale deriva dalla posizione dell’oggetto ed include: - L’energia posseduta da una palla tenuta in alto rispetto al pavimento (energia gravitazionale). - L’energia immagazzinata nei combustibili (energia chimica). Tutte le reazioni chimiche implicano una variazione di energia chimica. - L’energia associata alla separazione di due cariche elettriche (energia elettrostatica). L’energia potenziale e l’energia cinetica possono essere interconvertite. Primo Principio della Termodinamica Il primo principio della termodinamica postula che l’energia non può essere né creata né distrutta ma può essere solo convertita da una forma in un’altra: ciò ha portato R. Clausius (1865) ad affermare che il contenuto di energia dell’Universo (considerato come un sistema isolato) è costante. Ogni sistema ha un suo contenuto di energia, energia interna (U), nella quale si sommano tutte le forme di energia legate al suo stato (energia dovuta ai legami fra nucleo ed elettroni, fra atomi, energia cinetica, energia nucleare , etc.). Il valore assoluto della U di un determinato sistema in un determinato stato, non è noto, ma la termodinamica si interessa solo alle differenze tra i valori dell’energia del sistema stesso prima e dopo una trasformazione. Primo Principio della Termodinamica Per un qualsiasi sistema si possono individuare i trasferimenti di energia sia come calore che come lavoro tra il sistema e l’ambiente. Questa relazione può essere espressa dall’equazione: U = q + w (1) U = variazione del contenuto energetico q = energia trasferita come calore al o dal sistema w = energia trasferita come lavoro al o dal sistema L’equazione (1) è l’espressione matematica del primo principio della termodinamica: la variazione di energia interna di un sistema (U) è la somma dell’energia trasferita sotto forma di calore tra il sistema e l’ambiente (q) e dell’energia trasferita come lavoro tra il sistema e l’ambiente (w). L’energia interna U di un sistema chimico è la somma delle energie potenziale e cinetica degli atomi, molecole o ioni del sistema. L’energia potenziale è l’energia associata alle forze attrattive e repulsive tra i nuclei e gli elettroni del sistema. Essa include l’energia associata ai legami nelle molecole, alle forze tra gli ioni ed alle forze tra le molecole nello stato liquido e solido. L’energia cinetica è l’energia associata al moto degli atomi, ioni e molecole del sistema. Quello che si valuta è la variazione di energia interna U, che è una quantità misurabile. L’energia interna U è una funzione di stato in quanto il U dipende soltanto dallo stato iniziale e finale del sistema. Il lavoro e il calore sono funzioni di trasferimento di energia. Per convenzione: quando si trasferisce energia sotto forma di lavoro dal sistema all’ambiente il segno del lavoro è negativo (w < 0) e quando si trasferisce dall’ambiente al sistema il segno è positivo (w > 0). Analogamente: quando si trasferisce energia sotto forma di calore dal sistema all’ambiente il segno del calore è negativo (q < 0) (reazione esotermica), e quando si trasferisce dall’ambiente al sistema il segno è positivo (q > 0) (reazione endotermica). Poiché U = q + w, quando il flusso netto di energia è dal sistema all’ambiente U < 0, e quando il flusso netto di energia è dall’ambiente al sistema U > 0. Convenzioni sui segni per q e w del sistema Variazione Convenzione sul segno Effetto su Usistema Energia trasferita in q > 0 (+) forma di calore al sistema (endotermico) U aumenta Energia trasferita in forma di calore dal sistema (esotermico) q < 0 (-) U diminuisce Energia trasferita in forma di lavoro al sistema w > 0 (+) U aumenta Energia trasferita in forma di lavoro dal sistema w < 0 (-) U diminuisce Funzione di stato entalpia, H Nel caso di reazioni che si svolgono a pressione costante, conviene introdurre una nuova funzione di stato termodinamica H, chiamata entalpia, definita dall’equazione: H = U + PV In un sistema chimico, la variazione di entalpia ΔH è uguale al calore qp scambiato a pressione costante qp = ΔH = Hprodotti – Hreagenti ΔH < 0 ΔH > 0 reazioni esotermiche reazioni endotermiche Esempio di reazione esotermica, H < 0 (si libera calore). Combustione del metano in aria con un becco Bunsen. La reazione è a pressione costante perché condotta all’aperto nell’atmosfera. Esempio di reazione endotermica H > 0 (si assorbe calore). Impacco freddo commerciale usato in medicina dello sport per rimediare rapidamente agli incidenti, senza bisogno di ghiaccio. Questi impacchi freddi contengono sostanze chimiche in camere separate. Quando l’impacco viene piegato si rompe una barriera di plastica permettendo al contenuto di mescolarsi. Le sostanze reagiscono e raffreddano rapidamente l’impacco. Es. nitrato di ammonio solido e acqua. Funzione di stato entalpia, H Diagramma delle entalpie per a) una reazione esotermica e b) una reazione endotermica. a) In una reazione esotermica, l’entalpia dei prodotti è minore di quella dei reagenti. La differenza di entalpia è liberata come energia sotto forma di calore durante la reazione a P costante. b) In una reazione endotermica, l’entalpia dei prodotti è maggiore di quella dei reagenti. La differenza di entalpia deve essere fornita come energia sotto forma di calore per far avvenire la reazione a P costante. Entalpia di reazione L’entalpia di reazione dipende dalla temperatura e dalla pressione. I valori generalmente riportati nelle tabelle si riferiscono alla temperatura di 25 °C e alla pressione di 1 bar. La variazione di entalpia standard di reazione H°reaz si riferisce ai reagenti puri alla pressione di 1bar e ai prodotti puri alla pressione di 1 bar. Questi stati sono detti stati standard delle sostanze. Lo stato standard di un soluto è la soluzione 1 M del soluto. Quando scriviamo il valore numerico della variazione di entalpia standard di una reazione dobbiamo specificare sempre sia il valore di H°reaz sia l’equazione chimica corrispondente. Le entalpie di reazione possono essere usate per prevedere la quantità di energia trasferita sotto forma di calore in un dato processo: es. reazione della termite: è una delle reazioni più esotermiche conosciute. Una volta che questa reazione è iniziata da una sorgente di calore, procede sviluppando tanto calore che il ferro che si forma è fuso. Unità di misura dell’energia L’unità di misura dell’energia del SI è il joule (J). 1 J = 1 kg · m2 · s-2 Il kilojoule (kJ) è equivalente a 1000 J. La caloria (cal) è un’unità di misura del calore usata in passato. E’ definita come la quantità di energia sotto forma di calore necessaria per innalzare di 1,00 °C, da 14,5 a 15,5 °C, la temperatura di 1,00 g di acqua liquida pura. La kilocaloria (kcal) è equivalente a 1000 cal. Il fattore di conversione tra joule e calorie è: 1 caloria (cal) = 4,184 joule (J) La Caloria alimentare viene utilizzata per rappresentare l’energia contenuta nei cibi. La calori alimenatre (Cal) è un’unità equivalente alla kilocaloria o a 1000 calorie. Legge di Hess Un’importante proprietà dei valori di H°reaz delle reazioni chimiche è la loro additività, che è conseguenza diretta del fatto ch l’entalpia è una funzione di stato. La proprietà di additività dei valori di H°reaz è nota come legge di Hess. Le legge di Hess stabilisce che se una reazione è la somma di due reazioni o più reazioni, il H°reaz per il processo complessivo è pari alla somma dei valori di H°reaz di quelle reazioni. Illustrazione schematica dell’applicazione della legge di Hess Legge di Hess Illustrazione schematica dell’applicazione della legge di Hess. Regole per usare la legge di Hess nei calcoli per le equazioni chimiche Operazione Risultato Sommare due o più equazioni chimiche H°reaz(1+2) = H°reaz(1) + H°reaz(2) Moltiplicare un’equazione chimica per un fattore n H°reaz = nH°reaz(1) Usare l’equazione chimica inversa H°reaz (inversa) = -H°reaz(diretta) Entalpia molare standard di formazione L’entalpia molare standard di formazione, H°f, di un composto è la variazione di entalpia che accompagna la formazione di una mole di un composto nel suo stato standard a 1 bar, a partire dalle forme più stabili degli elementi che lo costituiscono, ciascuno nel proprio stato standard a 1 bar. Per convenzione, l’entalpia standard di formazione di un elemento nel suo stato fisico più stabile a 25 °C e 1 bar, è uguale a zero. Entalpie molari standard di formazione Variazioni di entalpie di formazione per tre diverse reazioni Variazioni di entalpia di una reazione Usando le entalpie molari standard di formazione e l’equazione (1) si può calcolare la variazione di entalpia di una reazione in condizioni standard. H°reaz = H°f (prodotti) - H°f (reagenti) (1) Per calcolare il H°reaz bisogna sommare le entalpie molari standard di formazione dei prodotti, ciascuno moltiplicato per il suo coefficiente stechiometrico, e sottrarre da questa la somma delle entalpie molari standard di formazione dei reagenti, ciascun moltiplicata per il suo coefficiente stechiometrico. Questa equazione è una conseguenza della definizione di H°f e della legge di Hess. Il valore di H°reaz è determinato dalla differenza delle entalpie molari di legame delle molecole di reagenti e prodotti La variazione di entalpia di una reazione è data approssimativamente dalla differenza tra l’energia necessaria come calore per rompere tutti i legami chimici delle molecole dei reagenti e l’energia liberata come calore nella formazione di tutti i legami chimici delle molecole dei prodotti. H°reaz Hleg (reagenti) - Hleg (prodotti) Se nella formazione dei legami dei prodotti si libera più energia di quella richiesta per rompere i legami dei reagenti, il valore di H°reaz è negativo (reazione esotermica). Se nella formazione dei prodotti si libera meno energia di quella necessaria per rompere i legami dei reagenti, il valore di H°reaz è positivo (reazione endotermica). L’entalpia di dissociazione di legame (o entalpia molare di legame) è la variazione di entalpia richiesta per rompere il legame in una molecola in fase gassosa. Il calcolo dei valori dei H°reaz dalle entalpie molari di legame si può fare solo per le reazioni in fase gassosa. I valori di entalpie molari di legame sono valori medi, e i valori di H°reaz calcolati usando le entalpie molari di legame sono solo approssimazioni dei valori veri misurati sperimentalmente. Entalpia di atomizzazione: variazione di entalpia che accompagna il processo di dissociazione di un composto in atomi isolati allo stato gassoso Capacità termica La capacità termica di un campione di sostanza è definita come l’energia sotto forma di calore necessaria per aumentare la temperatura del campione di un grado Celsius o un kelvin (T = t) cP = qP/T = H / T qP = H = cP T dove qP è l’energia somministrata come calore a P costante e T è l’aumento di temperatura Per misurare cP di una sostanza basta somministrare una quantità nota di energia come calore e misurare l’aumento di temperatura ottenuto ad una certa pressione CP = capacità termica molare = cP/n qP = H = cP T= n CP T con n = numero di moli di sostanza che acquista o perde energia Il calore specifico è la capacità termica per grammo di una sostanza e si indica come csp L’energia passa spontaneamente sotto forma di calore da un oggetto a temperatura più alta ad uno a temperatura più bassa, finché si raggiunge l’equilibrio termico. Calorimetro: permette di determinare il H di una reazione chimica Calorimetro costituito da: un vaso di Dewar (bottiglia termostatica) con coperchio; un termometro di alta precisione; un agitatore ad anello; una resistenza elettrica per il riscaldamento. Si mette uno dei reagenti nel Dewar e poi si aggiunge l’altro reagente, alla stessa temperatura. Dopo aver agitato la miscela di reazione si misura la variazione di temperatura. La resistenza riscaldante è usata per misurare la capacità termica del calorimetro. Il calorimetro si basa sul principio che l’energia totale è sempre conservata. Se una reazione avviene a P cost, il valore di H è uguale all’energia emessa o assorbita come calore dalla reazione. Se per es. in un vaso di Dewar avviene una reazione esotermica, l’energia emessa come calore non può uscire dal vaso, ed è assorbita dal contenuto del calorimetro (miscela di reazione, termometro, agitatore, etc.). L’assorbimento di energia da parte del contenuto del calorimetro porta ad un aumento di T, T. Calorimetro a bomba a) Calorimetro a bomba b) schema in sezione Il recipiente interno (la “bomba”) in cui avviene la reazione di combustione, è posto in un recipiente esterno pieno d’acqua. La variazione di temperatura del bagno d’acqua circostante si misura con un termometro ad alta precisione. L’acqua è in agitazione per assicurare una distribuzione uniforme del calore Calorimetro a bomba Il calorimetro a bomba può essere utilizzato per misurare il U di una reazione di combustione. Una massa nota della sostanza di cui si vuole determinare l’energia di combustione si carica nel calorimetro a bomba insieme a un filo di accensione. Il calorimetro è poi riempito con ossigeno gassoso in eccesso alla pressione di 30 bar. La reazione di combustione inizia facendo passare una breve scarica di corrente ad alta tensione nel filo di accensione. Il valore di U si determina misurando l’aumento di temperatura del calorimetro e dell’acqua in cui è immerso. Conoscendo la capacità termica del calorimetro e dal T osservato si calcola il valore di U. Interpretazione molecolare delle capacità termiche Il moto delle molecole può essere traslazionale, rotazionale o vibrazionale. a) La traslazione è lo spostamento dell’intera molecola attraverso lo spazio. b) La rotazione è il girare su se stessa della molecola nello spazio. c) La vibrazione è il movimento avanti e indietro dei nuclei intorno a posizioni relative fisse nella molecola. Le molecole poliatomiche possono assumere energia in vari modi. Più grande è la molecola, maggiore è il numero di modi in cui può ruotare e vibrare e maggiore la sua capacità termica. Interpretazione molecolare delle capacità termiche Dai dati di capacità termiche molari a pressione costante, si osserva che tutti i gas monoatomici (He(g), Ne(g), Ar(g), Hg(g)), hanno un valore di CP di 20,8 J·mol-1 · K-1. Essendo monoatomiche, queste specie possono aumentare la loro energia solo muovendosi a velocità maggiore (moto traslazionale). I gas poliatomici hanno (H2(g), NH3(g), CH4(g)), hanno valori di CP > 20,8 J·mol-1 · K-1. Possiamo calcolare la CP dei gas monoatomici dalla teoria cinetica dei gas che dice che l’energia cinetica media per mole di gas è correlata alla temperatura assoluta. A parte l’energia elettronica, l’unica energia disponibile per un gas monoatomico è l’energia cinetica, per cui possiamo identificare Ec media con l’energia termodinamica U. Valori di CP dei metalli solidi: Al(s), Au(s), Cu(s), Fe(s), Ag(s), Li(s) Per questi metalli solidi il valore di CP è circa uguale a 3R (regola di Dulong e Petit) CP dell’acqua liquida è il doppio di quella del ghiaccio (l’acqua è un eccellente refrigerante).
Scarica