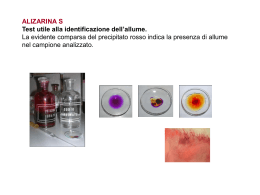
Determinazione dell’affinità ligando-proteina • Stechiometria: numero di ligandi per proteina • Affinità: stabilità relativa del complesso. Descritta dalla costante termodinamica di equilibrio P+L PL PL Ka P L P L Kd PL L P Kd PL PL L P L P PL P L P K d P L P K d L CP Kd L K d L C P L PL K d L x y ax [PL] 10 9 8 7 6 5 4 3 2 1 0 Kd 0 20 40 60 [L] 80 100 120 [PL] La concentrazione di proteina deve essere dell’ordine di grandezza della Kd 10 9 8 7 6 5 4 3 2 1 0 CP=2 CP=10 CP=50 CP=100 0 20 40 60 [L] 80 100 120 [PL] Grafico semilogaritmico 10 9 8 7 6 5 4 3 2 1 0 1 10 100 [L] Doppi reciproci [PL] 10 9 8 7 6 5 4 3 C P L PL K d L 2 1 50 100 150 200 [L] K d L K d 1 1 1 PL CP L CP L CP [PL] Determinazione della stechiometria 10 9 8 7 6 5 4 3 2 1 0 0 50 100 [L] Se ho metà proteina, ma due siti per proteina, apparentemente non cambia nulla Determinazione della stechiometria Scatchard plot P L Kd PL PL CP PL L K d K d K d PL P L CP PL L PL L CP [PL] PL L Due siti equivalenti (stessa Kd) 2CP [PL] PL L Due siti non equivalenti (diversa Kd) CP 2CP [PL] [L] e CL Bassa affinità (Kd grande) assumo [L] ~ CL Altrimenti: L CL PL P CP PL C P L C P C L PL PL K d L K d C L PL PL K d CL CP K d C L C P 2 2 4 CL CP Cooperatività P + 2L PL + L P’ + 2L P’L + L PL2 P’L2 Grafico di Hill P L h PLn K Y P PLn P P Lh h L h K L K Y L 1 Y K h Y log h log L log K 1 Y
Scarica