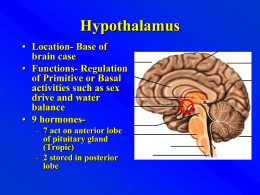
Ipotalamo e ipofisi posteriore • L’ipotalamo è la regione cerebrale che fornisce risposte neuro endocrine integrando segnali provenienti dall’ambiente, da altre aree cerebrali e dagli organi periferici. Trasforma impulsi nervosi in informazioni ormono mediate • L’ipotalamo influenza numerosi aspetti della vita quotidiana: l’introito alimentare, il dispendio energetico, il peso corporeo, l’introito di liquidi, la pressione arteriosa, la sete, la temperatura corporea, il ciclo sonno veglia • L’ipotalamo regola l’attività secretoria dell’ipofisi che a sua volta regola altre ghiandole (tiroide, corteccia surrenalica, gonadi) • Il controllo è attivato da due meccanismi: la secrezione di neuropeptidi ipotalamici trasportati lungo il peduncolo ipofisario all’ipofisi posteriore • e la secrezione di peptidi che mediano la secrezione ormonale adenoipofisaria Anatomia funzionale • L’ipotalamo è una parte del diencefalo localizzata sotto il talamo e tra la lamina terminale e i corpi mammillari che formano le pareti e il pavimento del 3° ventricolo. • Sul pavimento del terzo ventricolo le due halves dell’ipotalamo si riuniscono a dare una struttura nota come eminenza mediana. • L’eminenza mediana è importante in quanto è la sede dove hanno termine gli assoni che originano dai neuroni ipotalamici. È la sede dove sono secreti i neuropeptidi coinvolti nel controllo della funzione adenoipofisaria. L’eminenza mediana forma la porzione infundibolare della neuroipofisi; è attraversata dagli assoni che terminano nell’ipofisi posteriore Nuclei ipotalamici Nell’ipotalamo i corpi neuronali sono organizzati in nuclei: i magnocellulari (sopraottico e paraventricolare) secernono ossitocina e vasopressina; i parvicellulari secernono neurormoni ad azione stimolatoria o inibitoria dell’adenoipofisi Vascolarizzazione • L’ipotalamo è irrorato dai rami arteriosi derivati dal poligono cerebrale di Willis, il sangue refluo è drenato in parte dal sistema portale ipofisario e in parte dalla vena basale di Rosenthal • Il network capillare che fornisce un adeguato apporto ematico all’eminenza mediana, al peduncolo ipofisario e all’ipofisi ha un ruolo chiave nel trasporto dei neurormoni ipotalamici all’adenoipofisi Regolazione della secrezione ormonale • L’ipotalamo riceve e integra segnali provenienti da molteplici aree cerebrali. • Alcuni di questi segnali afferenti trasportano informazioni sensoriali provenienti dall’ambiente esterno quali luce, calore, freddo, rumore. Altri segnali percepiti dall’ipotalamo provengono da organi interni quali intestino,cuore, fegato e stomaco. • I segnali vengono trasmessi grazie a neurotrasmettitori (dopa, noradrenalina, serotonina) • Gli ormoni circolanti prodotti dagli organi bersaglio e i substrati (quali il glucosio) regolano la funzione • La regolazione della secrezione ormonale è un evento dinamico. Si adatta di continuo a modificazioni ambientali e a modificazioni del milieu interno di un soggetto Funzioni non endocrine • Temperatura corporea: regolata prevalentemente da meccanismi nervosi di feedback che operano quasi tutti attraverso centri termoregolatori situati nell’ipotalamo. • Nella regione pre ottica e dell’ipotalamo anteriore sono situati neuroni sensibili che ricevono da recettori periferici gli stimoli. • Febbre- tumori • Appetito: controllo assunzione di cibo in risposta al consumo energetico. Centro della sazietà localizzato nel nucleo ventromediale e centro della fame localizzato nell’ipotalamo laterale. • Nell’ipotalamo ci sono neuroni sensibili ai livelli di glucosio e in risposta all’ipoglicemia inducono l’aumento degli ormoni controregolatori (GH) e tramite il sistema nervoso autonono stimolano la glicogenolisi e la neoglucogenesi al livello epatico • Bilancio idroelettrolitico: ottenuto dal bilancio di due attività: una il centro antidiuretico che promuove la sintesi e il rilascio di vasopressina, l’altra il centro della sete. • Ritmo sonno-veglia: lesioni nell’area ipotalamica mesencefalica causano ipersonnia o inversione del ritmo sonnoveglia • Memoria: l’ipotalamo è strettamente correlato alle strutture nervose associate alla memoria • Funzione cardiovascolare: la stimolazione dell’area preottica, causa bradicardia, ipotensione e alterazioni ECG, mentre una sua lesione può provocare ipertensione (l’ipotalamo potrebbe intervenire nella ipertensione e aritmie legati all’emozione) • Funzione gastrointestinale: connessioni ipotalamo con intestino tramite il vago (fase cefalica della digestione) • Ritmi biologici: l’integrità delle vie retinoipotalamiche è essenziale per il mantenimento dei ritmi circadiani Ormoni ipotalamici • GHRH: stimola la sintesi e la secrezione di GH da parte delle cellule somatotrope dell’adenoipofisi. Deriva da un precursone il pre-proGH il cui gene è localizzato sul cromosoma 20. I neuroni deputati sono nel nucleo arcuato, ma è presente anche in altre aree ipotalamiche, nel GE e nella placenta. • Secreto in modo pulsatile, agisce dopo il legame col recettore specifico attivamdo un meccanismo AMPc dipendente • Somatostatina: inibisce la secrezione di GH e TSH, le cellule secernenti sono localizzate nel nuclo arcuato, periventricolare e ventromediale, ma anche GE , pancreas, tiroide, ghiandole salivari e apparato urinario. • Breve emivita, riduce la produzione di AMPc e la diminuzione dell’introito di calcio nella cellula. inibisce inoltre la secrezione di insulina, glucagone e di molti ormoni intestinali • farmaco • GnRH: gonadotropin releasing Hormone (gene localizzato sul cromosoma 8), la maggiror parte localizzato sul nucleo arcuato, secreto in maniera pulsatile stimola la secrezione di LH e in minor misura di FSH interviene nella gametogenesi e nella steroidogenesi. • E’ responsabile del comportamento sessuale • Farmaci: utilizzati (gli analoghi ) nell’ipogonadismo, nell’induzione di fertilità; gli antagonisti: castrazione farmacologica, carcinoma della prostata • TRH: sintetizzato dai neuroni parvicellulari, gene localizzato sul cromosoma 3. • L’interazione col recettore promuove l’idrolisi dell’inositolo trifosfato e l’attivazione della proteinchinasi C con mobilizzazione del calcio all’interno della cellula. • Ha emivita molto breve: stimola la secrezine di TSH, inibisce il GH e stimola la prolattina. • farmaco • CRH: corticotropin releasing Hormone. Gene localizzato sul cromosoma 8 • Stimola la sintesi e la secrezione di ACTH inducendo un aumento di AMPc • È identificato anche in altre aree cerebrali dove agisce come neuro trasmettitore nella regolazione della risposta allo stress • Farmaco • PIH: prolactin inhibiting hormone: il controllo ipotalamico sulla secrezione della prolattina è prevalentemente di tipo inibitorio. L’ipotalamo esercita una azione inibitoria essenzialmente tramite la dopamina • PRH: numerosi peptidi regolano la secrezione di prolattina agendo direttamente sulle cellule lattotrope • MSH. Melanocito stimolante Malattie ipotalamiche Malformazioni displasia setto-ottica, encefalocele Tumori: craniofaringioma, glioma, amartoma, disgerminoma, meningioma… Traumi: patologie iatrogene (chirurgia e radioterapia) Infezioni: encefaliti e meningiti Malattie infiltrative: sarcoidosim istiocitosi X, TBC Idrocefalo Malattie familiari (Prader Willi, Kallmann) Segni e sintomi dei tumori ipotalmamici • Sistema endocrino: bassa statura, ritardo di crescita, diabete insipido, ipogonadismo, pubertà ritardata o precoce, iperprolattinemia • Sistema vegetativo: amnesia, disturbi del comportamento, ipersonnia, sete diminuita o aumentata, alterazione della fame e peso corporeo, alterazione dell’omeostasi termica • Alterazioni dovute all’effetto massa: ipertensione endocranica, diminuzione dell’acuità visiva, segni neurologici (emiparesi) Ipofisi posteriore • L’Ossitocina e vasopressina (o ormone antidiuretico) sono sintetizzati come preormoni nel RE dei N. magnocellulari dell’ipotalamo. Inclusi in granuli secretori del Golgi e trasportati lungo il peduncolo ipofisario. Nel corso di tale trasporto i pre ormoni vengono processati a dare l’ormone con la specifica neurofisina. Il contenuto delle vescicole neurosecretorie viene rilasciato per esocitosi in corrispondenza dell’ipofisi posteriore con l’apertura di canali di Ca++ Ossitocina • Secreta durante l’allattamento e durante il parto • I due principali organi bersaglio sono la mammella e l’utero. • Stimola la secrezione del latte e induce ritmiche contrazioni dell’utero, promuove la regressione dell’utero al termine del parto, ha effetti sul comportamento materno e l’amnesia Controllo • La secrezione di ossitocina è principalmente indotta dalla stimolazione meccanica della cervice uterina ad opera del feto al termine della gestazione. L’attività contrattile dell’utero agisce con un meccanismo di feed back positivo durante il parto sulla secrezione di ossitocina. • L’aumentata responsività uterina è anche dovuta all’aumentata formazione di gap-junction tra le fibre muscolari lisce e l’aumentata sintesi di prostaglandine • La secrezione di ossitocina viene indotta dalla stimolazione dei recettori tattili localizzati sui capezzoli durante la suzione nel corso dell’allattamento • La secrezione di ossitocina viene inibita dal dolore, dall’aumento della temperatura corporea, dal rumore • Recettori: gli effetti fisiologici si manifestano dopo il legame con un recettore accoppiato alla proteina G Arginina vasopressina • Peptide prodotto da neuroni magnocellulari. Agisce sul riassorbimento di acqua aumentando la permeabilità dell’acqua dei tubuli contorti distale e dei dotti collettori. • Il risultato è la produzione di un ridotto volume di urine maggiormente concentrate. • Determina anche l’aumento delle resistenze vascolari • Il tubulo prossimale è responsabile del riassorbimento di circa il 90% dell’acqua filtrata. Il riassorbimento del restante 10% nei dotti collettori distali è sotto il controllo dell’AVP. • L’importanza dell’AVP è evidente se si considera al quantità di urine che verrebbe escreta in sua assenza. • Controllo – L’AVP è secreta in risposta all’aumento dell’osmolarità plasmatica o alla riduzione del volume ematico – La secrezione di AVP è stimolata da una riduzione della PA del 10% recettori • Gli effetti dell’AVP sono mediati dal legame dell’ormone con recettori accoppiati alle proteine G. Diabete insipido È caratterizzato dall’escrezione di abnormi volumi di urine diluite e da sete eccessiva • Ridotta secrezione di AVP: centrale o neurogeno per cause traumatiche, infiammatorie o infettive e neoplastiche • Ridotta sensibilità renale all’AVP: forme acquisite (ipokaliemia, poliuria post ostruttiva, trattamento con litio) o congenite (queste legati al cromosoma X alterazioni di un gene codificante per il recettore V2R) • Eccesso di introito d’acqua Meccanismi patogenetici 1. Deficit di solito non assoluto di AVP: diabete insipido ipotalamico o centrale 2. Resistenza parziale o totale all’AVP: diabete insipido nefrogenico 3. Eccesiva introduzione di liquidi: diabete insipido dipsogeno o polidipsia primaria Diabete insipido centrale e chirurgia ipofisaria 50-60% dei pazienti presenta un diabete insipido transitorio entro le prime 24 h dall’intervento La resezione completa del peduncolo ipofisario può portare al cosiddetto “diabete insipido trifasico”, che può essere permanente o divenire parziale o clinicamente inapparente 10% dei pazienti presenta solo una fase di iponatremia transitoria ~ 7 gg dopo un intervento di chirurgia ipofisaria, detta anche “isolated second phase “ Diabete insipido centrale e traumi cranici I pazienti traumatizzati possono sviluppare anch’essi il pattern del diabete insipido trifasico I pazienti incoscienti non possono beneficiare del normale senso di sete Il rischio di non riconoscere la seconda fase del diabete insipido trifasico è maggiore in tali pazienti in quanto l’ipoNa+ può indurre edema cerebrale e peggiorare gli edemi causati dal trauma Maggiore incidenza di insufficienza ipofisaria anteriore in associazione al diabete insipido Diabete insipido nefrogenico Quadro clinico Comparsa precoce, entro primo anno Poliuria, polidipsia, disidratazione, vomito, stipsi, episodi febbrili, pianto continuo, ritardo dell’accrescimento staturo-ponderale, megavescica, idronefrosi Diagnosi Poliuria ipostenurica Ipernatriemia e iperosmolarità plasmatica Test DDAVP: mancato aumento dell’osmolarità urinaria (< 200 mOsm/kg) Analisi genetica del probando e della famiglia Diabete insipido nefrogenico Le forme acquisite di DI nefrogenico sono molto più frequenti delle forme congenite Farmaci •Litio meccanismo AVP dipendente e AVP indipendente Si scambia con Na+ intracellulare AVP subunità Gα del recettore V2 eliminazione di Na+ e H2O di AQ2 adenilato ciclasi di membrana •Demeclociclina Li Inibizione adenilato ciclasi Altri meccanismi •Diuretici osmotici: glucosio, mannitolo, (alimentazione iperproteica naso-gastrica) •Antivirali Ipopotassiemia (associata a iperkaliuria) Ipercalcemia (associata a ipercalciuria) Sindrome paraneoplastica Anemia falciforme Sarcoidosi: Di centrale, DI nefrogenico S.Sjögren Gravidanza: vasopressinasi placentare nel 3° trimestre clearance di AVP AMPC AQ2 Diagnosi di diabete insipido Non esistono caratteristiche cliniche specifiche in grado di orientare sulla possibile eziologia di una poliuria Test di prima linea per confermare la presenza di diabete insipido: •Volume urinario delle 24 h (elevato sospetto con un volume > 3L/die) •Esame chimico-fisico delle urine: peso specifico, se è ci permette di escludere la presenza di una poliuria osmotica (es. diabete mellito) •Osmolarità urinaria e plasmatica •In base all’anamnesi: funzione ipofisaria (cortisolo, PRL, TSH, steroidi sessuali ecc.), marker tumorali (es. β-hCG nel sospetto di germinoma) Diagnosi • Determinazione livelli circolanti di AVP • Test dell’assetamento • Infusione di desmopressina Diagnosi differenziale Osmolarità plasmatica (v.n. 280-295 mOsm/kg) Osmolarità urinaria ADH (v.n. 600-900 mOsm/kg) (v. .n 1-5 pg/ml) DI neurogenico ≥ < < DI nefrogenico ≥ < ≥ Polidipsia nervosa < < < NB: il dosaggio dell’arginina-vasopressina è praticato in modo affidabile in pochi laboratori Test di deprivazione idrica seguito dalla somministrazione di desmopressina •Eseguire preferibilmente al mattino •Interrompere l’idratazione 2-3 h prima del test •Tenere sotto controllo il paziente per evitare l’introduzione di liquidi (polidipsie psicogene) •Somministrare la desmopressina (1 µg sc o 10 in) almeno del 2% del peso corporeo o una differenza nell’osmolarità urinaria al 10% in 2-3 raccolte consecutive NB: Il test va sospeso in caso di del peso corporeo > 5% o di Na+ > 145 mmol/L Terapia del diabete insipido Obbiettivi principali 1. Correzione del deficit idrico 2. Riduzione delle perdite idriche urinarie La terapia specifica varia in rapporto alla diversa situazione clinica Terapia del diabete insipido Idratazione adeguata Riduzione del carico osmolare alimentare Risoluzione dei possibili fattori scatenanti Farmaci a) Risparmiatori di acqua Arginin-vasopressina Desmopressina Clorpropamide > rilascio centrale di AVP > Azione renale di AVP Indometacina (anti PG) < diuresi 50-70% Sindrome da inappropriata secrezione di ADH • Caratterizzata da ipoosmolarità plasmatica, iposodiemia da emodiluizione e osmolarità urinaria inappropriatamente elevata. • Come conseguenza di un tumore secernente AVP. • Può aver sede nell’encefalo, ma anche nel polmone Table 9–3. Common Causes of Syndrome of Inappropriate Antidiuretic Hormone Secretion Tumors 1. Pulmonary-mediastinal (bronchogenic carcinoma; mesothelioma;thymoma) 2. Nonchest (duodenal; pancreatic; ureteral/prostate; uterine;nasopharyngeal) Central Nervous System Disorders 1. Mass lesions (tumors; brain abscesses; subdural hematoma) 2. Inflammatory diseases (encephalitis; meningitis; systemic lupus; 3. Degenerative-demyelinative diseases (Guillain-Barre´; spinal cord lesions) 4. Miscellaneous (subarachnoid hemorrhage; head trauma; hydrocephalus) Drug Induced 1. Stimulated AVP release (nicotine; phenothiazines; tricyclics) 2. Direct renal effects and/or potentiation of AVP antidiuretic effects (dDAVP; oxytocin; prostaglandin synthesis inhibitors) 3. Mixed or uncertain actions (angiotensin-converting enzyme,Ecstasy…) Pulmonary Diseases 1. Infections (tuberculosis; acute bacterial and viral pneumonia;…) 2. Mechanical-ventilatory Other 1. AIDS,2. Prolonged strenuous exercise,3. Senile atrophy,4. Idiopathic AVP,arginine vasopressin; COPD, chronic obstructive pulmonary disease; dDAVP,1-deamino(8- D-arginine) vasopressin. Clinica della SIADH • Sodio ematico > o= 125 mEq/l: asintomatica • Sodio ematico< 125 mEq/l: anoressia, nausea, vomito, cefalea, irratabilità, depressione, letargia, confusione, convulsioni, coma
Scarica