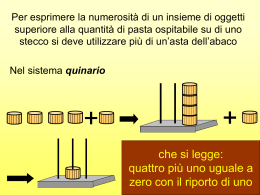
Corso di Laurea in Scienze Chimiche Corso di Laurea in Tecnologie Chimiche P.A.R. Laboratorio di Chimica Generale e Inorganica 1 Lezione 2 – 3 ottobre 2006 Esercizio 1.1 Sommare le seguenti forze: 10 kg-forza e 5102 dine, e esprimere il risultato in Newton Esercizio 1.2 Sommare le seguenti pressioni: 0.750 atm e 250 torr, e esprimere il risultato in Pascal Numeri esatti e numeri approssimati (ogni numero che usiamo in un problema viene, in linea di principio, da una misurazione strumentale (massa, volume, densità, etc…) Caratteristiche degli strumenti: • sensibilità (minima differenza che lo strumento può apprezzare tra due misure di una stessa grandezza) misure di volume, cilindro da 50 mL, distanza tra le tacche = 1 mL, sensibilità 1 mL (sensibilità minore) misure di volume, pipetta da 2 mL, distanza tra le tacche = 0.01 mL, sensibilità 0.01 mL (sensibilità maggiore) • accuratezza (differenza tra valore grandezza vero e quello misurato sperimentalmente). • precisione (riproducibilità di una misura, cioè differenza tra valore misurato e valore medio) errore casuale errore sistematico Il risultato di una misura è sempre un valore approssimato (non è un numero esatto) e deve essere espresso con il giusto numero di cifre dettato dalla sensibilità dello strumento utilizzato: cifre significative Informazioni contenute nel valore di una misura = unità di misura, rapporto con l’unità, sensibilità bilancia tecnica, lettura 57.81 g: 4 cifre significative, 2 decimali Bilancia analitica, 3.9585g, 5 cifre significative (e 4 decimali) Il concetto di “numero esatto”: non è affetto da errore, le sue cifre sono tutte significative e non influenza nei calcoli (vedi dopo) il numero di cifre significative del risultato. Proviene da conteggi o da definizioni (p.es. i 12 protoni in un atomo di 12C, il volume di un recipiente immaginario di 1 L) Come considerare gli “zeri” nel conto delle cifre significative di un dato: quelli prima delle cifre decimali non contano, quelli dopo sì 0.00348g : tre cifre significative 0.5200g : quattro cifre significative Cifre significative nei calcoli: la sensibilità delle misure non va alterata nè “inventata” Somma e sottrazione: il risultato deve avere tante cifre decimali quante sono quelle dell’addendo che ne ha di meno 1.34575 g + 5 decimali 3.43 g + 2 decimali 15.887 g = 3 decimali 20.66275 g : risultato da “calcolatrice” occorre tenere solo due decimali, tagliare, e approssimare secondo le regole: 20.66275 g = 20.66 g regole per l’approssimazione: • se la prima cifra scartata è < 5, la prima cifra che rimane non viene cambiata. Es. 2.54338 = 2.54 (scarto 338) • se la prima cifra scartata è > 5, la prima cifra che rimane viene aumentata di 1. Es. 2.54716 = 2.55 (scarto 716) • se la prima cifra scartata è = 5… la prima cifra che rimane non cambia se è pari Es. 2.54500 = 2.54 la prima cifra che rimane è aumentata di 1 se è dispari Es. 2.55500 = 2.56 moltiplicazione e divisione: il risultato deve avere lo stesso numero di cifre significative del fattore (o dividendo) che ne ha di meno Es. 12.435 (5 cifre significative) x 7.34 (3 cifre significative) = 91.2729 (risultato da calcolatrice) Il risultato deve avere solo 3 cifre significative: si taglia (con le regole di approssimazione già viste) 91.2729 91.3 Logaritmi: la caratteristica non conta (p.es. nei logaritmi base 10 è dettata dal valore dell’esponenziale), mentre la mantissa ha lo stesso numero di cifre significative del numero di cui si estrae il logaritmo Es. Log 4.8121012 = 12.6823 4 cifr. sign. caratteristica mantissa Es 2.1 Sommare la massa in grammi di tre campioni di K2CO3 del peso di 8.54 g, 10.0000g e 0.027g. Es 2.2 Definiamo la “percentuale di massa di una sostanza (elemento o composto) in un campione” = 100×massa della sostanza/massa totale del campione. Un campione 12.53g di una lega Au/Cu/Al contiene 3.47g di Au. Qual è la percentuale in massa dell’oro all’interno della lega? Es. 2.3 Un campione della stessa lega pesa 38.567g. Da altre misure sappiamo che il rame è il 35.71% in peso. Quanti g di rame sono contenuti nel campione? Utilizzando il dato del problema precedente determinare anche il peso di oro e di alluminio contenuti.
Scarica