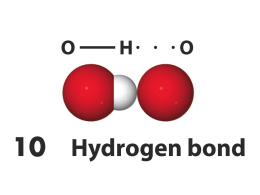
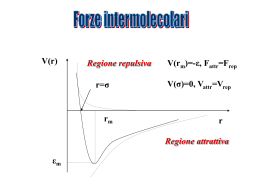
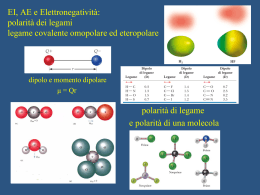
POLARIZZAZIONE DI LEGAME E DIPOLI CASI LIMITE IDEALI DEI TRE PRINCIPALI TIPI DI LEGAME CHIMICO 100% METALLICO Li Legame tra atomi ad elettroni delocalizzati condivisi da tutti gli atomi del reticolo cristallino Legame tra ioni dotati di carica elettrostatica (+,-) opposta Legame tra atomi in cui vengono condivise una o più coppie di elettroni di valenza H2 100% COVALENTE CsF 100% IONICO COVALENTE POLARIZZATO Distribuzione del potenziale elettrostatico d+ dH2 HCl d- d- 2d H2 O I comuni forni a microonde sfruttano le proprietà dipolari delle molecole d’acqua L’energia rotazionale si converte in energia termica LEGAMI INTERMOLACOLARI Legami intermolecolari Interagendo molecole o ioni Sono coinvolte molecole polari ? NO NO Sono coinvolti ioni ? SI Sono coinvolte molecole polari e ioni ? SI Ci sono atomi di Idrogeno legati ad N, O, F ? NO Forze di London (dipoli indotti) Es.: Ar(l), I2(s) Forze di van der Waals NO Forze ione-dipolo Legame ionico Es.: KBr in H2O Es.: NaCl SI Forze dipolo-dipolo Legame a idrogeno Es.: H2S, CH3Cl SI Es.: H2O, NH3, HF LEGAME DIPOLO INDOTTO - DIPOLO INDOTTO Molecole non polari avvicinamento diventano polari per l’effetto attrattivo che il nucleo di una molecola esercita sulla nube elettronica di una seconda molecola in avvicinamento D- D+ D- D+ LEGAME DIPOLO - DIPOLO D+ D- D+ D+ D- D+ D- attrazione repulsione D- Glucosio O H H “ASINUS ASINUM FRICAT” ovvero il simile sgioglie il suo simile Vitamina idrosolubile Vitamina liposolubile LEGAME IONE - DIPOLO LEGAME IONE - DIPOLO LEGAME AD IDROGENO Legami ad idrogeno nell’acqua Stato liquido Stato solido Clatrato Interazioni idrofobiche Diminuizione delle regioni di contatto tra molecole idrofobiche e molecole d’acqua
Scarica