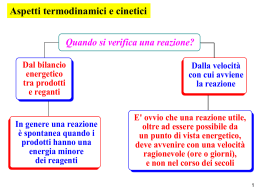
Fabio Paparoni Indirizzato a: Biennio Istituto Tecnico Industriale Federico Sorana Tipologie di REAZIONI CHIMICHE IN UNA REAZIONE CHIMICA I PRODOTTI HANNO UN’ UN’ENERGIA DIVERSA DA QUELLA DEI REAGENTI. Energia crescente REAGENTI Cioè L’ENERGIA CINETICA e POTENZIALE delle molecole dei prodotti è diversa da quella dei reagenti. Poiché vale sempre il principio di conservazione, la differenza di energia tra reagenti e prodotti viene compensata da uno scambio di energia tra il sistema e l’ambiente. In particolare: • Se i prodotti hanno MENO energia dei reagenti, la reazione è ESOERGONICA (dal greco exo, “verso l’esterno”), cioè il sistema sviluppa energia (solitamente sono reazioni spontanee); • Se i prodotti hanno PIÙ energia dei reagenti, la reazione è ENDOERGONICA (dal greco endon, “posto nell’interno”), cioè il sistema assorbe energia. ENERGIA ceduta Reazione ESOERGONICA ENERGIA assorbita PRODOTTI PRODOTTI In entrambi i casi, l’ l’energia scambiata tra sistema e ambiente è uguale alla differenza tra l’ l’energia dei prodotti e quella dei reagenti. REAGENTI Se ENERGIA = CALORE: • Le reazioni che lo producono vengono dette ESOTERMICHE; • Le reazioni che lo assorbono sono dette ENDOTERMICHE. In natura esistono tuttavia anche trasformazioni ENDOERGONICHE SPONTANEE. SPONTANEE Ad esempio l’evaporazione dell’acqua e la fusione del ghiaccio, che assorbono calore dai corpi a contatto, raffreddandoli; oppure la dissoluzione in acqua di alcuni soluti solidi, come ad esempio il nitrato di ammonio (NH4NO3). In questi casi il sistema non evolve verso stati di minor energia, perché perché l’energia assorbita dall’ dall’esterno resta immagazzinata nei prodotti finali della trasformazione. La tendenza che guida tali trasformazioni è quella verso L’AUMENTO DEL DISORDINE, ovvero dell’ dell’ENTROPIA. I sistemi naturali infatti evolvono spontaneamente sia verso la MASSIMA STABILITÀ (minima energia), che verso il MASSIMO DISORDINE (massima entropia). PRESENTAZIONE REATTIVI PRINCIPIO PROCEDIMENTO [1]. G. Bonati , A. Caragliano, F. Curreri, A. Distefano, L. Fabbrini, Invito alla chimica per temi, Marietti editore, 1996 [2]. J.C. Kotz, P. Treichel, Chimica, EdiSES editore, 1998 Reazione ENDOERGONICA
Scarica















![Capitolato tecnico [file]](http://s2.diazilla.com/store/data/001107285_1-e946b47c84701e2410442744a1d6c48b-260x520.png)



