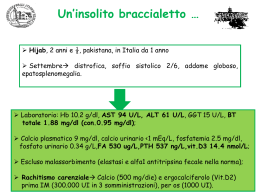
Diagnostics Division
13 Mountain View Avenue
Orangeburg, NY 10962
http://www.diagnostics.com
Sistema a componenti in fase
solida per il dosaggio degli
Acidi Biliari Coniugati
Catalog No.: 06B-242918 (100 Tubes)
RIA HOT LINE U.S. ONLY: 1-800-431-1237
Customer support and technical information can be
obtained at local ICN Pharmaceuticals offices
Kundenberatung und technische Informationen bei
den ICN Pharmaceuticals Niederlassungen erhältlich
Pour toute aide et information techniques contactez
votre agence locale de ICN Pharmaceuticals
Per qualsiasi informazione o esigenza si prega di
rivolgersi agli uffici locali della ICN Pharmaceuticals
Para información y soporte técnico dirijase a las
oficinas locales de ICN Pharmaceuticals
3
SISTEMA A COMPONENTI PER IL DOSAGGIO DEGLI ACIDI BILIARI CONIUGATI
Per la determinazione quantitativa degli acidi biliari coniugati nel siero o plasma
Generalita' e Metodologia di Dosaggio
Gli acidi biliari sono steroidi C 24 derivati dal colesterolo. Nell'uomo, gli acidi colico e
chenodesossicolico sono i due acidi biliari primari. Nella bile essi sono coniugati con gli aminoacidi
glicina e taurina formando i quattro acidi biliari coniugati rilevabili con questo dosaggio: acido
glicocolico, acido taurocolico, acido glicocheno-desossicolico e acido taurocheno-desossicolico.
Gli acidi biliari primari subiscono una degradazione batterica nell'intestino formando gli acidi biliari
secondari, desossicolico, litocolico e prodotti di ossidazione.
I sali degli acidi biliari coniugati sono potenti detergenti che coadiuvano nell'assorbimento
intestinale dei lipidi. Essi sono quasi interamente assorbiti dall'intestino e ritornano al fegato e alla
cistifellea attraverso la circo-lazione enteroepatica. Normalmente, meno dell'1% del pool degli acidi
biliari si ritrova nel circolo sistemico.
E' noto da parecchi anni che la concentrazione di acidi biliari nel siero è aumentata nei pazienti con
malattia epatica, a causa della incapacità del fegato malato di estrarre efficiente-mente gli acidi
biliari dal sangue portale1. I livelli sierici di acidi biliari coniugati notoriamente aumentano in molte
forme di malattia strutturale del fegato.
Malattie epatiche metaboliche coinvolgenti anioni organici non sembrano causare anormali
concentrazioni di acidi biliari2. Nei pazienti presentanti malassorbimento intestinale, come a seguito
di resezione ileale o by-pass, non si notano aumenti nei livelli ematici di acidi biliari coniugati, anche
in presenza di malattia epatica2,3. E' stato suggerito che la valutazione del livello di acidi biliari
costituisca l'indicatore più sensibile e specifico di malattia epatica mentre altri test chimici ed
enzimatici sono spesso normali2,4-9, consigliandone pertanto l'esecuzione per monitorare il recupero
o per predire la riacuzie in stati morbosi quali l'epatite o per controllare la tossicità da farmaci.
Principio Di Dosaggio
In radioimmunologia, l'antisiero impiegato dovrebbe presentare uguale affinità per la forma standard
e per l'analita presente nel siero. L'analita non marcato compete con il tracciante per i siti
anticorpali in difetto, inducendo pertanto una riduzione della quota di tracciante legato all'anticorpo. Il livello di radioattività associata agli immunocomplessi risulterà pertanto inversamente
correlato alla concentrazione di analita del campione o dello standard.
Nel procedimento in fase solida ICN Pharmaceuticals, provette sensibilizzate con anticorpo e
tracciante radioiodato10 sono impiegati per la determinazione degli acidi biliari coniugati in piccoli
volumi di siero.
1
Reagenti
Per uso diagnostico in vitro
1.
2.
Provette in fase solida per acidi biliari, Catalogo nE 06B243011. Contenenti 100 provette
in poli-stirene ricoperte con anticorpo (coniglio). Conservazione: refrige-rare a 2-8EC ben
chiuse nella confezione originale. Riscaldare a temperatura ambiente prima della apertura.
NON MESCOLARE DIFFERENTI LOTTI DI PROVETTE
N E L L O
S T E S S O
DOSAGGIO.Stabilità:
vedi la
data
di
scadenza
sulla
confezione.
Gruppo di Standard Acidi Biliari, Catalogo nE 06B262056, contenenti taurocolato di sodio
in tampone con siero-albumina umana*, sodio-azide allo 0,05%** ed altri conservanti.
Volume minimo 2,0 ml/flacone per lo standard A; 1,5 ml/flacone per gli standard B-F.
Pronto per l'uso. Conservazione: refrigerare a 2-8EC. Stabilità: vedi la data di scadenza
sul flacone.
Standard
Livello standard
(Fmoli/l)
A
B
C
D
E
F
0
0,4
2,0
6,0
15
50
3.
Tracciante per Acidi Biliari (125), Catalogo nE 06B229717, contenente derivato dell'acido
glicocolico I 125 in tampone con gamma-globuline bovine, sodio-azide allo 0,1%**,
conservanti e colorante. Il flacone contiene <5 uCi (185 kBq) di I 125; 110 ml/flacone.
Pronto per l'uso. Conservazione: refrigerare a 2-8EC. Stabilità: vedi la data di scadenza
sul flacone.
*
ATTENZIONE: MANEGGIARE COME SE FOSSE CAPACE DI TRASMETTERE INFEZIONE. Il
materiale da cui è derivato questo prodotto è stato trovato non reattivo per HBsAg e
negativo per l'anticorpo Anti-HIV quando testato con reagenti autorizzati. Nessun test puo
offrire garanzia che i prodotti derivati da sangue umano non siano infettivi. Far riferimento
a Biosicurezza CDC/NIH Nei Laboratori di Microbiologia di Biomedica (Pubblicazione NHS nE
84-8395).
**
ATTENZIONE: i reagenti conten-gono sodio-azide. Il sodio-azide può reagire con il piombo
e il rame delle tubature idrauliche formando composti metallici altamente esplosivi. All'atto
dello scarico, far defluire grandi volumi d'aqua così
da prevenire l'accumulo. Altamente tossico per ingestione. A contatto con acidi libera gas
altamente tossico.
In caso di contatto con la pelle lavarsi dimmediatemente ed
abbondantemente con d'acqua.
IMPIEGO DI MATERIALE RADIOATTIVO: AVVERTENZE
L'acquisto, la ricezione, la detenzione, l'uso, il trasferimento e lo smaltimento di materiale
2
radioattivo, sono soggetti ai regolamenti ed ai permessi previsti dalle autorità legislative. Nella
mani-polazione di sostanze radioattive devono essere osservate le seguenti precauzioni:
Il materiale radioattivo deve essere conservato e manipolato in un'area del laboratorio
specificatamente designata a tale uso. L'ambiente di lavoro deve essere ben illuminato e
arieggiato. Le superfici di lavoro devono essere non porose in modo da ridurre al minimo la
contaminazione dovuta allo spargimento di liquidi* radioattivi. Considerata la piccola radioattività
contenuta nel flacone del tracciante (circa 5 FCi), l'uso del kit non pone alcun problema di pericolo
di radiazioni. Tuttavia per evitare inalazione e ingestione di materiale radioattivo è necessario
rispettare le buone norme generali di laboratorio. In particolare si raccomanda di: non pipettare
con la bocca soluzioni radio-attive; non mangiare, bere, fumare o usare cosmetici nell'area di lavoro
designata; pulire immediatamente le superfici di lavoro di materiali radio-attivi eventualmente
versati; raccogliere il materiale contaminato solido e liquido in appositi contenitori ed effettuarne
lo smaltimento secondo le procedure previste; lavarsi accuratamente le mani dopo l'uso di materiale
radioattivo.
Attrezzature e reagenti richiesti ma non forniti
1.
2.
3.
4.
5.
6.
7.
8.
Provette per raccolta ematica tipo contenenti EDTA o eparina.
Acqua distillata.
Portaprovette.
Pipette semiautomatiche o pipettatore-diluitore automatico in grado di dispensare 25 e 1000
Fl.
Bagno termostatico in grado di mantenere 37 ± 1EC.
Aspiratore.
Contatore a scintillazione per la rilevazione delle radiazioni gamma dello iodio 125.
Grafici tipo lineare, semi-logaritmico o logit-logaritmico
Raccolta Dei Campioni
Dovrebbe essere specificato se il campione è prelevato a digiuno oppure dopo due ore dal pasto.
In alcuni studi, sono stati usati pasti standard11. Maneggiare sangue e siero come materiali infetti.
1.
Preparazione dei campioni per l'analisi: raccogliere il campione in una siringa (con EDTA o
eparina se si desidera il plasma) da 5 o 10 ml. Qualora si utilizzi il siero, attendere la
coagulazione a temperatura ambiente. Centri-fugare e raccogliere il siero.
2.
Conservazione: prima dell'analisi, il siero o il plasma può essere conservato a 2-8EC.
Qualora il tempo di conservazione superi le 48 ore, si raccomanda di congelare ad almeno
-20EC sgelando una volta soltanto. Congelamenti e sgelamenti ripetuti o conservazioni per
lunghi periodi non sotto forma congelata possono rendere torbido il siero. Tale
deterioramento del campione può ingenerare risultati errati.
3.
Spedizione dei campioni: Il siero dovrebbe essere spedito a 2-8EC. Qualora il tempo di
spedizione dovesse superare le 48 ore, si raccomanda il congelamento.
Procedimento Di Dosaggio
Portare le provette sensibilizzate, i reagenti e i campioni a temperatura ambiente prima dell'uso.
Al fine di ridurre il deterioramento, evitare di mantenerli non refrigerati se non per il tempo
3
necessario al loro uso. Si consiglia di eseguire le analisi in duplicato. L'allestimento delle provette
dei campioni e degli standard, così come dei controlli deve essere effettuato simultaneamente.
SI RACCOMANDA DI ATTENERSI ALLE ISTRUZIONI PER L'USO. E' ESSENZIALE PIPETTARE CON
CURA.
Il dosaggio prevede l'impiego di 25 Fl di campione non diluito. I campioni risultanti >50 umoli/l
possono essere diluiti e ridosati. Se un siero appare giallognolo o se il paziente presenta
notoriamente alti livelli di acidi biliari coniugati può essere utilizzata una diluizione 1:8 o maggiore.
1.
2.
3.
4.
5.
6.
*
Numerare 12 provette sensibi-lizzate per la curva standard. A partire dal nE 13, numerare
due provette sensibilizzate per ogni campione.
Pipettare 25 Fl di standard Acidi Biliari e campioni secondo lo schema più avanti riportato.
Aggiungere 1,0 ml di tracciante Acidi Biliari I 125 ad ogni provetta*. Non mescolare.
Incubare contemporaneamente tutte le provette per 60 minuti in bagno termostatico a 37
± 1EC dal momento dell'ultima aggiunta al passaggio precedente. Non usare stufe o
termostati ad aria.
Al termine dell'incubazione, aspirare o decantare tutte le provette. Aggiungere 1,0 ml di
acqua distillata a tutte le provette e aspirare o decantare nuova-mente.
Determinare la radioattività di fondo del contatore gamma.
Contare le provette
sequenzialmente per 0,5-2 minuti con il contatore. Le provette 1 e 2 sono espres-sione della
capacità legante (Bo). I conteggi di queste provette dovrebbero essere compresi fra 7.000
e 30.000 cpm. L'efficienza del contatore gamma condizionerà il tempo di conteggio. Il
tempo di conteggio richiesto per accumulare circa 10.000 colpi per le provette 1 e 2
indicherà il tempo di conteggio per tutte le altre provette.
Qualora sia impiegato un dispensatore automatico per combinare i passaggi 2 e 3, dovrebbe
essere scelto un puntale di diametro sufficiente al fine di evitare eccessiva turbolenza o
formazione di bolle. Si raccomandano i puntali MICRO-MEDIC da 1,0 mm o CORDIS da 1,5
mm. Il puntale può toccare l'interno della provetta approssimativamente al centro durante
il pipett-amento.
DOSAGGIO RADIOIMMUNOLOGICO IN FASE SOLIDA
PER GLI ACIDI BILIARI
Standard Campion
Provettt
(Fl)
e
Traccian Incubazi Lavaggi
a nE
(Fl)
te
one
o
1, 2
3, 4
5, 6
7, 8
9,10
11,12
Campio
ne
25 A
25 B
25 C
25 D
25 E
25 F
Aggiung
er
1000 Fl
a tutte
le
provette
. Non
mescolar
e.
------------25
4
Incubare Aspirare
tutte le
o
provette decanta
a 37 ±
re e
1EC per lavare
60 min. tutte le
provette
- Contare la radioattività di tutte le provette
5
Calcolo Dei Risultati
Calcolo logit-log
1.
2.
3.
4.
5.
6.
7.
8.
Determinare il conteggio di fondo del contatore gamma.
Sottrarre il conteggio di fondo da tutti i conteggi ottenendo così i conteggi corretti per
minuto (o per tempo uniforme). Impiegare soltanto i conteggi corretti nei calcoli.
Mediare i conteggi corretti delle provette 1 e 2 ottenendo così il conteggio "Bo" del saggio.
Dividere i conteggi corretti di ciascuna provetta ("B") per il conteggio Bo ottenendo così la
percentuale rispetto a Bo (B/Bo). Dovrebbe essere ottenuto un valore separato per ogni
duplicato.
La curva standard può essere riportata su grafico logit-log interpolando i valori B/Bo in
funzione delle concentrazioni di Acidi Biliari Coniugati standard in Fmoli/l sulla scala
logaritmica. In tabella 1 sono riportati dati tipici di conteggio e calcolo dei valori B/Bo. In
figura 1 è illustrata la curva standard derivata da tali dati.
La concentrazione di Acidi Biliari Coniugati dei campioni è determinata per interpolazione
sulla curva standard.
Calcolo per i campioni diluiti: Fmoli/l del campione diluito (dalla curva standard) x fattore di
diluizione = Fmoli Acidi Biliari Coniugati/l del campione non diluito.
Esempio di calcolo per un campione:
Conteggio (trovato) = 5663
Fondo = 288
(B/Bo) x 100 = 5663 - 288 x 100 = 55.0%
9772
La curva standard in coordinate logit-log di figura 1 mostra che 55,0% corrisponde ad una
con-centrazione in acidi biliari coniugati di 1,9 Fmoli/l per il campione. La media fra questo
valore ed il valore del duplicato è riportato come concentrazione di Acidi Biliari Coniugati per
il campione.
Considerazioni Procedurali
Il sistema ICN Pharmaceuticals a com-ponenti in fase solida per il dosaggio degli Acidi biliari
Coniugati può essere usato per misurare la concentrazione dei principali acidi biliari coniugati che
si presenta elevata nella maggior parte delle condizioni di patologia epatica. Gli acidi biliari
coniugati minori e gli acidi biliari non coniugati hanno effetto minimo sui risultati essendo a
concentrazione più bassa e/o per la minor reattività crociata con l'anti-corpo.
Nonostante la variabilità delle reazioni crociate degli acidi biliari coniugati sierici, questo sistema
presenta sod-disfacente correlazione con il dosaggio della 3"-idrossisteroide deidrogenasi che
notoriamente misura i livelli sierici dei sali biliari totali.
6
Valori Attesi
I valori sierici riscontrati per volontari sani a digiuno sono risultati:
N = 162
Media = 2,23 Fmoli/l
D.S. = 1,95 Fmoli/l
In figura 2 sono riportati graficamente tipici livelli sierici ottenuti con questo sistema per specifiche
malattie epatiche.
Per la standardizzazione della metodologia può essere adottato l'uso della determinazione dei livelli
sierici di acidi biliari a due ore da un pasto standard11.
I seguenti intervalli di valori attesi ottenuti con questo sistema possono essere adottati come guida:
Normali : fino a 6 Fmoli/l
Anormali : superiori a 6 Fmoli/l
Caratteristiche tecnologiche
Accuratezza
1.
Un'analisi di regressione lineare elaborata confrontando i risultati ottenuti per 45 sieri usando
questo prodotto con i risultati corrispondenti ottenuti presso un ospedale universitario con
il metodo della 3"-idrossisteroide deidrogenasi, ha fornito i seguenti risultati:
Coefficiente di correlazione = 0,94
Pendenza = 1,18
Ordinata all'origine = 6,4
2.
Lo studio del recupero è stato realizzato aggiungendo un volume di una miscela di acido
glicolico e acido taurocolico (3:1) a vari volumi di un pool di sieri a bassa concentrazione:
Acidi biliari
aggiunti
(Fmoli/l)
Acidi biliari
trovati (corretti)
(Fmoli/l)
Recupero %
20,9
10,5
5,2
3,8
17,6
9,3
5,2
3,4
84,2
88,6
100
89,5
7
Precisione
Se alti sono stati dosati al fine di determinare le variazioni "fra i saggi" e "nel saggio".
"fra i saggi"
Campione
nE di determinazioni
Media, Fmoli/l
D.S.
% CV
1
25
3,2
0,6
18
2
19
6,9
1,0
14
"nel saggio"
3
25
13,2
1,9
14
1
20
3,8
0,5
12
2
20
6,8
0,7
11
3
20
11,4
0,7
7
Sensibilità
0,2 umoli/l, determinata alla concentrazione di acido taurocolico corrispondente al 90% di (B/Bo).
8
Specificità
Analita
Reazione
crociata %
(in peso)
1. Acidi biliari coniugati
Acido taurocolico
Acido glicocolico (in siero)
100.0
85
Acido taurochenodesossicolico
210
Acido glicochenodesossicolico
62
Acido taurodesossicolico
4,0
Acido glicolitocolico
3,3
Acido glicodesossicolico
3,3
2. Acidi biliari non coniugati
Acido chenodesossicolico
8,1
Acido colico
3,1
Acido desossicolico
0,2
Acido litocolico
0,7
Acido diidrocolico
0,03
3. Steroidi (a liveli 10 volte il
normale fisiologico)
N.D.*
Cortisolo
N.D.
Aldosterone
N.D.
Estriolo
N.D.
Testosterone
4. Miscellanea (a livelli specificati)
N.D.
Colesterolo (1 mg/ml)
<1
Etanolo (1,5 mg/ml)
N.D.
Digossina (20 ng/ml)
N.D.
Spironolattone (20 ng/ml)
<1
Eparina (1 mg/ml)
(*) Nessun effetto rilevabile su Bo
9
TABLE 1
Conjugated Bile Acids Radioimmunoassay
Counts per
Minute
Tube No.
Background
Corrected
Counts
A
% of Trace
Level
A x 100
B
288
Standard
Curve
Concentration
Fmole/L
---
Trace
1
10050
9762
Level
2
10070
3
Patient
Average
Counts
B
9772
---
0
9782
---
0
8025
7737
79.2
0.4
4
8252
7964
81.5
0.4
5
5713
5425
55.5
2.0
6
5936
5648
57.8
2.0
7
3526
3238
33.1
6.0
8
3499
3211
32.8
6.0
9
2133
1845
18.9
15
10
2002
1714
17.5
15
11
1207
919
9.4
50
12
1272
984
10.1
50
5663
5375
55.0
Sample
10
1.9
FIGURE 1
Typical Standard Curve with Logit Log Transformation
11
FIGURE 2
12
References
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
Sherlock, S. and Walshe, V., Blood Cholates in Normal Subjects and in Liver Disease. Clin.
Sci., 6, 223-234, 1948.
Barnes, S., Gallo, G.A., Trash, D.B. and Morris, J.S., Diagnostic Value of Serum Bile Acid
Estimations in Liver Disease. J. Clin. Path., 28, 506-509, 1975.
LaRusso, N.F., Korman, M.G., Hoffman, N.E. and Hoffman, A.F. Dynamics of the
Enterohepatic Circulation of Bile Salts. Postprandial Serum Concentrations of Conjugates
of Cholic Acid in Health, Cholecystectomized Patients and Patients with Bile Acid
Malabsorption. New Eng. J. Med., 291, 689-692, 1974.
Kaplowitz, N., Kok, E. and Javitt, N.B., Postprandial Serum Bile Acid for the Detection of
Hepatobiliary Disease. J. Amer. Med. Assoc., 225, 292-293, 1973.
Korman, M.G., Hoffman, A.F. and Summerskill, W.H.J., Assessment of Activity in Chronic
Active Liver Disease: Serum Bile Acids Compared with Conventional Tests and Histology.
N. Engl. J. Med., 290, 1399-1402, 1974.
Hoffman, A.F., Korman, MG. and Krugman, S., Senstivity of Serum Bile Acid Assay for
Detection of Liver Damage in Viral Hepatitis Type B. Dig. Dis., 19, 908-910, 1974.
Mashige, F., Imai, K. and Osuga, T., A Simple and Sensitive Assay of Total Serum Bile
Acids. Clin. Chim. Acta, 70, 79-86, 1976.
Siskos, P.A., Cahill, P.T. and Javitt, N.B., Serum Bile Acid Analysis: A Rapid, Direct
Enzymatic Method Using Dual-Beam Spectrophotofluorimetry. J. Lipid Res., 18, 666-671,
1977.
Gibson, R.G., Bodenheimer, H., Block, E. and Rutner, H. Comparison of Liver Function
Tests in Active and Inactive Liver Disease. Clin. Chem, 25, 1081, 1979.
Spenney, J.G., Johnson, B.J., Hirschowitz, B.I., Mihas, A.A. and Gibson, R., An 125I
Radioimmunoassay for Primary Conjugated Bile Salts. Gastroenterology 72, 305-311, 1977.
Block, E., Rutner, H. and Gibson, R.G. Efficacy of Postprandial Bile Acids Levels as
Diagnostic Tool for Hepatobiliary Disease. Clin. Chem, 25, 1081, 1979.
13
Manufactured by:
Hergestellt von:
Fabriqué par:
Prodotto da:
Fabricado por:
ICN Pharmaceuticals, Diagnostics Division
13 Mountain View Avenue
Orangeburg, New York 10962-1294
USA
Customer Service:
FAX:
Technical Service:
(800) 888-7008
(949) 851-0563
(800) 437-1705
Distributed by:
Vertrieb durch:
Distribué par:
Distribuito da:
Distrubuido por:
ICN Pharmaceuticals, Inc.
Costa Mesa, CA 92626
USA
ICN Biomedicals GmbH
Thüringer Straße 15
37269 Eschwege
Telefon 05651/921-0
FAX 05651/921-151
Auftragsannahme:
Tel: 0180/2306160
FAX 0130/868366
LB-06B49824R12
QER NO.: Q00-303
5/30/01
14
Scarica