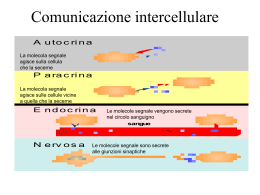
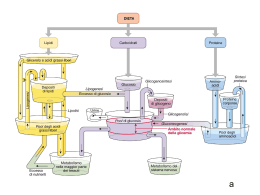
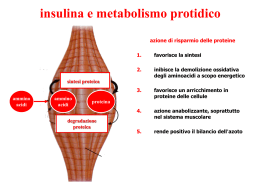
1 Il pancreas è costituito da due tipi principali di tessuto: gli Acini che secernono succo digestivo destinato a riversarsi nel duodeno gli Isolotti di Langherans che secernono insulina e glucagone direttamente nel sangue Il pancreas umano contiene da 1 a 2 milioni di Isole di Langherans, ciascuna con diametro di 0,3 mm in stretto contatto con i capillari sanguigni Contengono 3 tipi principali di cellule: alfa, beta, delta. 2 Alfa sono circa il 25% del totale, secernono glucagone Beta sono le più numerose, il 60% del totale, secernono insulina Delta il 10% secernono somatostatina È presente inoltre almeno un altro tipo di cellule, denominato PP che secernono un ormone a funzione incerta chiamato peptide pancreatico Legato probabilmente alla regolazione della secrezione esocrina del pancreas. 3 GLI ORMONI - Classificazione - Ormoni di derivazione aminoacidica (tirosina) catecolamine (adrenalina, nor-adrenalina), ormoni tiroidei - Ormoni peptidici ( 3 - 200 AA) ormoni dell’ipotalamo e dell’ipofisi, insulina, glucagone, paratormone, calcitonina - Ormoni steroidei (derivati del colesterolo) ormoni della corteccia surrenale, androgeni, estrogeni - Ormoni eicosanoidi (derivati dall’acido arachidonico) prostaglandine pag. 5 IL MECCANISMO D’AZIONE DEGLI ORMONI PEPTIDICI E CATECOLAMINICI ormone Primo messaggero Recettore proteico Adenilico ciclasi ATP AMPc PROTEINA ENZIMATICA Secondo messaggero PROTEINA ENZIMATICA FOSFORILATA pag. 6 IL MECCANISMO D’AZIONE DEGLI ORMONI STEROIDEI ormone DNA trascrizione ormone recettore RNAm traduzione Sintesi della proteina enzimatica pag. 7 OMEOSTASI DEL GLUCOSIO La concentrazione plasmatica di glucosio riflette l’equilibrio tra: l’assorbimento intestinale, l’utilizzazione a livello dei tessuti e la produzione endogena A digiuno un individuo di 70 kg ne utilizza circa 2mg/kg/min ( 200g/24 ore ). Il fegato produce circa 9 g di glucosio all'ora. E’ necessario un continuo apporto di glucosio come fonte di energia L’omeostasi è controllata anzitutto dall’insulina e da ormoni catabolici (glucagone, catecolammine, GH e cortisolo) Ipoglicemia Glicemia normale Glicemia alterata a digiuno (IFG) Intolleranza al glucosio (IGT) Diabete Glicemia < 60 mg/dl Glicemia a digiuno: 60-100 mg/dl Glicemia dopo 2 ore da test da carico di glucosio: < 140 mg/dl Glicemia a digiuno: 110-125 mg/dl Glicemia dopo 2 ore da test da carico di glucosio: < 140-199 mg/dl Glicemia a digiuno >= 126 mg/dl** Glicemia dopo 2 ore da test da carico di glucosio: >=200 mg/dl I globuli rossi e le cellule del cervello utilizzano glucosio per il loro metabolismo consumando ca. l’80% di tutto il glucosio introdotto ogni giorno con la dieta. Alla conc. ematica di glucosio di 4,7-5 mM GLUT3 (trasportatore di glucosio dei neuroni) è sempre saturo di glucosio permettendo così un rifornimento costante di glucosio. Quantitativamente nel plasma e nei fluidi extracellulari sono presenti ca. 10 g di glucosio che devono essere mantenuti costanti I trasportatori degli esosi Gli esosi non possono, come tali attraversare il doppio strato fosfolipidico dell’orletto a spazzola. Sono necessari per questo trasporto, proteine carrier che ne permettano l’ingresso. I carriers funzionano in modo coordinato per permettere l’ingresso degli esosi nell’orletto a spazzola e l’uscita di questi dalla membrana baso laterale dell’enterocita. In questo modo gli esosi possono essere riversati nel torrente circolatorio e raggiungere altri organi. I trasportatori degli esosi Si riconoscono diverse isoforme dei trasportatori del glucosio, questi sono denominati GLUT e le isoforme 1 e 2 sono la più espresse nell’intestino. La localizzazione di SGLUT 1 è nell’ orletto a spazzola dei villi intestinali, mentre GLUT 2 si trova nella membrana baso laterale degli enterociti. L’affinità di SGLUT 1 è maggiore nei confronti del glucosio, rispetto a GLUT 2 che permette l’uscita di glucosio dall’enterocita al sangue per diffusione. trasportatori del glucosio (GLUT) sono una famiglia di proteine transmembrana presenti nella maggior parte delle cellule mammifere. La loro azione permette il trasferimento del glucosio attraverso le membrane plasmatiche; ricordiamo, a tal proposito, che questo importantissimo substrato energetico - essendo polare - è incapace di attraversare spontaneamente il doppio strato fosfolipidico Nell'uomo il il trasporto del glucosio può avvenire secondo gradiente (diffusione facilitata) o contro gradiente (trasporto attivo). lL trasporto attivo si verifica nell'intestino e nei tubuli renali e richiede l'utilizzo indiretto di energia biochimica (Na+/glucosio simporto). La diffusione facilitata non richiede ATP e coinvolge i trasportatori del glucosio, i cosiddetti GLUT. Nell'uomo esistono numerose isoforme di GLUT, indicate con numeri crescenti (GLUT1, GLUT-2, GLUT-3, GLUT-n), le quali - sebbene siano piuttosto simili - differiscono per alcune proprietà. Il trasportatore del glucosio più conosciuto e studiato è il GLUT-4, a causa della sua sensibilità diretta all'insulina. In condizioni normali, questo carrier si trova in sede citoplasmatica e la sua traslocazione sulla membrana cellulare viene stimolata dal legame dell'insulina con il recettore di membrana. Questo processo favorisce lo spostamento del glucosio dal liquido interstiziale all'interno della cellula. Quando la concentrazione ematica di glucosio si normalizza e l'insulina viene eliminata, le molecole di GLUT 4 vengono lentamente rimosse dalla membrana plasmatica e sequestrate per endocitosi in vescicole intracellulari. Il trasportatore del glucosio GLUT-4 è presente soprattutto nel muscolo scheletrico, nel cuore e nel tessuto adiposo bianco e bruno, non a caso definiti tessuti insulino-dipendenti. A livello muscolare la traslocazione dei trasportatori GLUT-4 dai siti intracellulari (vescicole) alla membrana plasmatica è favorita anche dalla contrazione, dall'aumento del flusso ematico e dai bassi livelli di glicogeno che caratterizzano l'esercizio fisico di durata. Ciò spiega come mai l'attività sportiva sia un'utilissima medicina nella prevenzione dell'insulino resistenza e nel trattamento del diabete mellito. un trasportatore particolare del glucosio è il GLUT-2, espresso soprattutto a livello epatico; questa proteina è infatti capace di lavorare in entrambe le direzioni, favorendo il passaggio dello zucchero dalla cellula al liquido interstiziale e viceversa. Tale funzione è assai importante perché il fegato è sede primaria della gluconeogenesi, cioè della sintesi ex-novo di glucosio (che deve poi essere immesso nel sangue) a partire da aminoacidi, glicerolo e acido lattico. Il GLUT-2 può trasportatore anche galattosio, mannosio e fruttosio, capacità - quest'ultima - condivisa con il trasportatore GLUT-5. Il GLUT-2 è espresso anche a livello delle cellule B pancreatiche, e si caratterizza per una bassa affinità associata ad un'elevata capacità (non viene mai saturato dal glucosio). Sempre a livello epatico troviamo la proteina di trasporto GLUT-7, che si comporta come trasportatore intracellulare del glucosio, importante per favorire l'esportazione della quota prodotta durante la gluconeogenesi. MALTOSIO Glucosio + Glucosio LATTOSIO Galattosio + Glucosio SACCAROSIO Glucosio + fruttosio GLUCOSIO FRUTTOSIO Meccanismo d’azione per SGLUT 1 e GLUT 2 Glucosio Glucosio Galattosio 2 Na+ S G L T Galattosio Glut2 2 Na+ 1 Na/K ATPasi Enterocita Co-trasporto sodio glucosio-galattosio Capillari sanguigni I trasportatori degli esosi Il terzo principale esoso che necessita di essere trasportato è il fruttosio, nell’ enterocita è anche presente GLUT 5 che trasporta questo monosaccaride con più alta affinità rispetto al glucosio. Come per il glucosio e il galattosio anche il fruttosio esce dall’enterocita attraverso GLUT 2. Meccanismo d’azione per GLUT 5 Fruttosio Fruttosio G L U T Fruttosio Glut2 5 Enterocita Non c’è co-trasporto con il sodio Capillari sanguigni I trasportatori degli esosi Il sistema di regolazione dei trasportatori degli esosi è complesso. Ingerire carboidrati sottoforma di poli o oligosaccaridi fa aumentare i livelli di mRNA per entrambi i trasportatori SGLUT 1 e GLUT 2 nell’ enterocita. Lo stesso succede per il GLUT 5 quando sono presenti nel lume intestinale saccarosio e fruttosio I trasportatori degli esosi Si è visto che l’aumentata espressione di SGLUT 1 e GLUT 5 negli enterociti, aumenta i livelli di AMPc con la conseguente attivazione di proteine chinasi. I meccanismi di questa attivazione appaiono diversi per le due isoforme proteiche. I trasportatori degli esosi SGLUT 1 L’aumento dell’AMPc che attiva le PK è responsabile per SGLUT 1 dell’aumento della quantità e della capacità di trasporto nei confronti dell’esoso. Più SGLUT 1 viene traslocato alla membrana dal compartimento citoplasmatico I trasportatori degli esosi GLUT 5 L’aumento dell’AMPc che attiva le PK è responsabile per GLUT 5 dell’aumento della quantità di mRNA e quindi dell’espressione del trasportatore. Non c’è maggiore traslocazione di GLUT 5 alla membrana plasmatica degli enterociti. Trasportatori di glucosio Km glucosio (mmol/L) Funzione 1÷2 Captazione basale del glucosio, trasporto attraverso la barriera emato-encefailca GLUT 2 Cellule B pancreatiche, fegato, rene, intestino 15÷20 Regolazione del rilascio di insulina, altri aspetti dell’omeostasi glucidica GLUT 3 Cervello, rene, placenta, altri tessuti <1 Captazione nei neuroni e in altri tessuti GLUT 4 Muscolo, adipe =5 Captazione di glucosio mediata da insulina GLUT 5 Intestino, rene 1÷2 Assorbimento intestinale del fruttosio Trasportatore GLUT 1 Tessuti Tutti i tessuti specialmente eritrociti, cervello 30 Caratteristiche del trasporto del glucosio in vari tessuti Alcuni tessuti hanno un sistema di trasporto del glucosio indipendente dall’insulina. Per esempio gli epatociti, gli eritrociti e certe cellule del tessuto nervoso, della mucosa intestinale, dei tubuli renali e della cornea non necessitano dell’insulina per assumere glucosio. Il pancreas secerne due importanti ormoni coinvolti nella regolazione del metabolismo del glucosio, dei lipidi e delle proteine: Insulina Glucagone Aumento di glucosio nel sangue Diminuzione di glucosio nel sangue liberazione di insulina liberazione di glucagone Si lega a recettori di membrana nelle cellule epatiche Incrementa l’attività della glicogeno-sintetasi Lega recettori di membrana negli adipociti e nelle cellule muscolari Esocitosi e attivazione dei trasportatori di glucosio Incrementa la rimozione del glucosio Rimozione del glucosio dal sangue Deposito come glicogeno Si lega ai recettori di membrana Attivazione dell’adenilato ciclasi Aumento di cAMP, attivazione della chinasi cAMP-dipendente Attivazione della glicogeno fosforilasi Inibizione della glicogeno sintetasi Degradazione di glicogeno a glucosio Rilascio di glucosio nel sangue 32 L’INSULINA L’insulina è prodotta nel pancreas dalle cellule delle isole del Langerhans e viene secreta in risposta all’iperglicemia essendo il processo attivato da ioni calcio. I tessuti bersaglio sono quello epatico, muscolare ed adiposo. L’effetto dell’insulina è ipoglicemizzante. Effetti metabolici -Promuove l’ingresso del glucosio nel (fegato), nel muscolo e nel tessuto adiposo - Stimola la glicogenosintesi nel fegato e nel muscolo - Stimola la glicolisi acetil-CoA sintesi acidi grassi nel fegato e nel tessuto adiposo - Favorisce la sintesi di VLDL nel fegato - Inibisce la glicogenolisi nel fegato e nel muscolo - Inibisce la gluconeogenesi nel fegato L’abbassamento della glicemia causa diminuzione di emissione di insulina con un meccanismo a feed-back. pag. 33 INSULINA E LE SUE FUNZIONI Questo ormone, isolato per la prima volta dal pancreas nel 1922, da Banting e Best, ha mutato radicalmente il destino del diabetico grave Storicamente la nozione di insulina è associata allo zucchero nel sangue Ma sono soprattutto le turbe del metabolismo dei grassi, che sono le usuali cause di morte tra i diabetici, per aterosclerosi ed acidosi. Sono gravi anche le alterazioni del metabolismo proteico che portano il diabetico a grave consunzione Prima dell’avvento dell’insulina i soggetti con diabete mellito di tipo 1 non potevano sopravvivere più di qualche giorno o mese (solo raramente la sopravvivenza era di qualche anno). 34 INSULINA: ORMONE ANABOLIZZANTE La sua secrezione è associata ad una grande disponibilità di energia cioè viene secreta quando è abbondante l’apporto di alimenti energetici con la dieta È indispensabile per immagazzinare le sostanze energetiche in eccesso I carboidrati: vengono immagazzinati come glicogeno nel fegato e nel muscolo I grassi: l’ormone ne favorisce l’accumulo nel tessuto adiposo converte inoltre in grassi tutti gli zuccheri non depositati come glicogeno Le proteine: l’insulina favorisce la captazione degli Aa e la sintesi proteica intracellulare 35 Il meccanismo cellulare che controlla il rilascio di insulina nelle cellule beta pancreatiche 36 Il recettore dell'insulina è transmembrana e appartiene alla famiglia dei recettori tirosin-chinasici. E’ costituito da due subunità α extracellulari, legate a due subunità β intracellulari dotate di attività tirosino-chinasica. Il legame dell'insulina favorisce la fosforilazione delle subunità β. Il recettore così attivato, determina la propagazione del segnale con un effetto a cascata. Uno dei primi fattori della cascata del segnale è la proteina IRS-1 (Insuline Receptor Substrate) che attiva a sua volta l'enzima fosfoinositide 3 chinasi o PI3-K che attiva la via Akt\mTOR. L’attivazione della PI3-K comporta la fusione delle vescicole citoplasmatiche contenenti il trasportatore del glucosio GLUT-4 con la membrana plasmatica per favorire l’assorbimento del glucosio. I RECETTORI INSULINICI Meccanismo d’azione dell’insulina 3. Gli effetti dell’insulina sulle membrane (trasportatori del glucosio insulina sensibili GLUT-4) (muscolo scheletrico e tessuto adiposo). 4. La regolazione dei recettori (down-regulation) 5. I tempi delle risposte all’insulina (induzione, sintesi di glucochinasi, fosfofruttochinasi e piruvato chinasi). Azione dell’insulina sui trasportatori del glucosio Glut-4 nei tessuti bersaglio (muscolo e tessuto adiposo, ma non fegato) 40 Azione dell’insulina sul fegato, trasportatore GLUT-2 41 Un epatocita contiene 1700 recettori circa ed un adipocita ne contiene 10.000 circa; è tuttavia sufficiente che l’insulina si leghi ad un decimo circa di questi recettori per evocare nell’adipocita una sensibile risposta metabolica. La elevata affinità dell’insulina per i suoi recettori è necessaria per la cattura delle poche molecole di insulina circolanti nel sangue. Cooperatività negativa : la capacità dei recettori liberi di legare l’insulina è tanto minore quanti più recettori si sono già legati all’ormone. Regolazione secrezione insulina Livello di deposito d’insulina è elevato per cui la regolazione agisce sul suo rilascio piuttosto che sulla sintesi. L’insulina viene secreta nella quantità di 1 unità/Kg di peso/die Principale fattore di regolazione è livello di glucosio nel sangue ed il glucagone. Variazione d’insulina è parallela a quella del glucosio. STRUTTURA 2 catene polipetidiche (A e B) di 21 e 30 aa. Numerosi legami salini ed idrogeno e 2 legami disolfuro legano le 2 catene A e B. La struttura assunta è quella esamerica (Zn-insulina secreta dal pancreas). Secreta dalle cellule b-pancreatiche in forma esamerica ma la sua azione sulle cellule bersaglio è esplicata in forma monomerica. BIOSINTESI E MATURAZIONE Il gene è localizzato nel braccio corto del cromosoma 11. Viene sintetizzata in forma di precursore inattivo (preproinsulina) dalle cellule beta del pancreas. Con rimozione del peptide leader abbiamo la proinsulina, unica catena polipeptidica formata da 78 a 86 aa (secondo la specie animale). Il segmento intermedio, peptide C o peptide di interconnessione viene distaccato al momento della conversione proinsulina-insulina. I segmenti N- e C- terminale andranno a costituire le catene B e A dell’insulina Nell’uomo la vita media dell’insulina circolante è di 7-15 min Struttura dell’insulina Sintesi dell’insulina Peptide C: è indispensabile per il corretto ripiegamento della proinsulina e poiché la sua emivita plasmatica è più lunga è un buon indicatore della produzione e della secrezione dell’insulina nella diagnosi di diabete giovanile. L’insulina è conservata in granuli citoplasmatici che si liberano per esocitosi se stimolati. E’ degradata dalla insulinasi (fegato e reni). La breve emivita plasmatica (6 minuti ca.) permette la rapida variazione della concentrazione dell’ormone in circolo. Regolazione della secrezione dell’insulina La stimolazione della secrezione dell’insulina. La sintesi e la secrezione dell’insulina sono stimolate da: a) il glucosio (glucochinasi delle cellule β) b)gli amminoacidi (arginina) c)gli ormoni gastrointestinali (secretina) che provocano un aumento anticipato del livello dell’insulina nella vena porta, prima che si verifichi un effettivo aumento del livello ematico di glucosio. Insulinemia rappresenta la concentrazione di insulina presente nel sangue. Valori Normali: basale 5 - 25 micr.UI/ml dopo 30 min. 41 - 125 micr.UI/ml dopo 60 min. 20 - 120 micr.UI/ml dopo 90 min. 20 - 90 micr.UI/ml dopo 120 min. 18 - 56 micr.UI/ml • Dopo un pasto i valori insulinemici aumentano sensibilmente, per poi ritornare ai livelli basali nel giro di un paio d'ore • Il picco raggiunto è tanto più elevato quanto maggiore è la quantità di zuccheri introdotta • il picco insulinemico raggiunto dopo un pasto completo risulta inferiore a quello registrato dopo il consumo di un'analoga quantità di zuccheri, scorporata da lipidi e fibre. CONTROLLO DELLA SECREZIONE a valori normali di glicemia 80÷90 mg/100ml la secrezione di insulina è minima 25 ng/min/kg di peso quando la conc. di glucosio plasmatico sale di 2-3 volte rispetto al valore normale la secrezione dell’ormone aumenta in due fasi distinte l’aumento della conc. plasmatica di insulina indotta dal glucosio può arrivare ad essere anche 400÷600 volte superiore rispetto al basale, quindi un aumento drammatico che ricade altrettanto rapidamente quando la conc. di glucosio torna ai valori di digiuno 50 L’inibizione della secrezione dell’insulina La sintesi e la secrezione dell’insulina diminuiscono quando le sostanze nutrienti della dieta scarseggiano e nei periodi di stress (febbre o infezione). Questi effetti sono mediati principalmente dall’adrenalina secreta dalla midolla surrenale in risposta allo stress, a un trauma o a un esercizio fisico molto intenso. In tali condizioni la liberazione dell’adrenalina è controllata soprattutto dal sistema nervoso. Questo ormone ha un effetto diretto sul metabolismo energetico e provoca una rapida mobilizzazione delle riserve energetiche, tra cui il glucosio presente nel fegato (prodotto per glicogenolisi o per gluconeogenesi) e gli acidi grassi del tessuto adiposo. L’adrenalina può talvolta precedere e annullare la normale liberazione di insulina stimolata dal glucosio. Nelle situazioni di emergenza, il sistema nervoso simpatico si sostituisce al livello plasmatico del glucosio come fattore di controllo della secrezione da parte delle cellule β. La secrezione di insulina Breve periodo di digiuno. La produzione di insulina rimane a valori di base, senza picchi, nel digiuno notturno. A un certo punto, il calo della glicemia stimola le cellule alfa del pancreas a produrre glucagone, che provoca la conversione del glicogeno in glucosio e la liberazione di questo nel sangue. La richiesta minima di glucosio è pertanto assicurata dalle riserve di glicogeno. Il cervello riceve un segnale e lo traduce in sensazione di fame. Situazione normale di riposo . Appena la glicemia comincia a diminuire, la secrezione di insulina si riduce rapidamente, tornando a valori simili a quelli del digiuno dopo 2 o 3 ore dall’assunzione del pasto. Dopo un pasto ricco di carboidrati. La glicemia aumenta e il pancreas libera rapidamente insulina (picco insulinemico post-prandiale), che riporta la concentrazione del glucosio a livelli di normalità. Il picco raggiunto è tanto più consistente quanto maggiore è la quantità di zucchero introdotta e la velocità dell’ assorbimento (carico glicemico), mentre la presenza di fibra alimentare, rallentando l’assimilazione intestinale dei nutrienti, limita il picco di insulina. Una volta soddisfatta la richiesta energetica delle cellule dell’organismo, l’incremento di insulina stimola la conversione del glucosio in eccesso in depositi di glicogeno, in particolare a livello del fegato e dei muscoli. Digiuno prolungato. Quando il digiuno perdura, le riserve di glicogeno dell’organismo si esauriscono gradualmente. La secrezione di glucagone è massima e aumentano altri ormoni (adrenalina, cortisolo) che innescano ulteriori meccanismi di approvvigionamento di glucosio. Esaurite le riserve di glicogeno, l’organismo attinge energia dai lipidi (attraverso la lipolisi) e utilizza gli aminoacidi ottenuti dalla degradazione delle proteine per produrre glucosio (gluconeogenesi). Entrambi questi meccanismi sono a lungo andare deleteri per l’organismo, il primo (lipolisi) perché porta all’accumulo di corpi chetonici e il secondo (gluconeogenesi) perché, una volta esaurite le proteine introdotte con gli alimenti, l’organismo arriva a degradare le proprie proteine strutturali (per esempio quelle muscolari). Sovralimentazione. In risposta all’eccessiva assunzione di cibo, soprattutto di alimenti ad alto contenuto di zuccheri, la produzione di insulina è intensamente e costantemente stimolata. L’organismo non ha modo di eliminare il glucosio, può solo utilizzarlo o accumularlo, quindi, una volta soddisfatte le richieste energetiche e saturate le riserve di glicogeno, il glucosio è convertito in un deposito energetico alternativo, ossia in acidi grassi, accumulati nel tessuto adiposo (grasso) sotto forma di trigliceridi. Questo processo conduce nel tempo a un incremento del peso corporeo. Sovralimentazione prolungata. Se si persiste nell’eccedere con il cibo, la produzione di insulina si mantiene a livelli costantemente elevati (iperinsulinismo), ma nel tempo le cellule dell’organismo perdono gradualmente la loro sensibilità all’insulina (insulino-resistenza) e ciò si traduce in un aumento permanente dei livelli di glucosio nel sangue. Questa condizione si verifica spesso nei soggetti obesi: anche se non tutti i soggetti obesi sono insulino-resistenti e non tutti quelli insulino-resistenti sono obesi, è accertato che tra obesità e alti livelli di insulina circolante esiste una stretta correlazione e che l’eccesso ponderale riduce la sensibilità dei tessuti periferici all’insulina. Gli effetti metabolici dell’insulina 1) Gli effetti sul metabolismo dei carboidrati (fegato, muscolo e tessuto adiposo). - Fegato: l’insulina fa diminuire la sintesi di glucosio inibendo la gluconeogenesi e glicogenolisi. - Muscolo e fegato: l’insulina fa aumentare la glicogenosintesi. - Muscolo e tessuto adiposo: l’insulina fa aumentare l’assunzione di glucosio aumentando il numero dei relativi trasportatori presenti sulla membrana plasmatica. 2) Gli effetti sul metabolismo dei lipidi. -Diminuzione della degradazione dei triacilgliceroli: l’insulina fa diminuire il livello degli acidi grassi in circolo inibendo l’attività della lipasi sensibile agli ormoni nel tessuto adiposo (defosforilazione). -L’aumento della sintesi dei triacilgliceroli: l’insulina fa aumentare sia il trasporto del glucosio negli adipociti, che il suo metabolismo per produrre acidi grassi e glicerolo 3fosfato per la sintesi dei triacilgliceroli. Inoltre fa aumentare la sintesi della lipoproteina lipasi del tessuto adiposo, per cui nelle cellule si accumulano acidi grassi esterificabili. 3) Gli effetti sulla sintesi delle proteine: nella maggior parte dei tessuti l’insulina stimola l’ingresso degli amminoacidi nelle cellule e la sintesi delle proteine. Modifica dell’attività di alcuni enzimi : attivazione della glicogeno sintasi attivazione della piruvato deidrogenasi attivazione della acetil-CoA carbossilasi inibizione della fosforilasi e della lipasi adipolitica Promozione della sintesi di alcune proteine: glucochinasi. AZIONE DELL’INSULINA SUL METABOLISMO GLUCIDICO Azione sul metabolismo glucidico Nel muscolo e nel t.adiposo la maggiore utilizzazione del glucosio è primariamente dovuta ad attivazione della sua diffusione facilitata attraverso la membrana cell. Nel fegato l’azione di stimolo dell’insulina sulla utilizzazione dei glucidi consegue innanzitutto ad induzione della sintesi della glucochinasi. L’aumentato ingresso del glucosio o l’incremento della sua fosforilazione da parte della glucochinasi comporta una più intensa sintesi di glicogeno. L’incremento della glicogeno sintesi e la restrizione della glicogenolisi sono causati da stimolazione della glicogeno sintetasi e da inibizione della glicogeno fosforilasi da parte dell’insulina, per il tramite di proteine-fosfatasi attivate per azione dell’ormone. INSULINA E FEGATO uno degli effetti più importanti dell’ormone è quello di immagazzinare come glicogeno nel fegato la maggior parte del glucosio assorbito dall’intestino dopo un pasto il glicogeno immagazzinato viene poi degradato a glucosio e liberato nel sangue, quando tra un pasto e l’altro la concentrazione dello zucchero diminuisce così da impedire che la glicemia si abbassi troppo 59 INSULINA E FEGATO Meccanismo d’azione l’insulina inibisce la fosforilasi epatica che provoca la scissione del glicogeno in glucosio aumenta l’attività della glicochinasi, enzima che induce la fosforilazione del glucosio entrato nell’epatocita aumenta l’attività degli enzimi che inducono la sintesi del glicogeno, fosfofruttochinasi, glicogenosintetasi l’effetto è quello di aumentare la quantità di glicogeno nell’organo fino a 100 gr. circa il 6% della massa epatica 60 Effetti dell’ormone sul cervello le cellule cerebrali utilizzano solamente glucosio sono permeabili al glucosio senza l’intervento dell’insulina (GLUT-1) É essenziale che la glicemia sia mantenuta sopra ad un determinato livello critico. Se la quantità dello zucchero va al disotto di 20-50 mg/100 ml si ha shock ipoglicemico che si manifesta con irritabilità, convulsioni, perdita di coscienza e coma. 61 EFFETTO DELL’INSULINA SUL METABOLISMO DEI GRASSI l’insulina induce l’aumento dell’immagazzinamento dei grassi quando il glucosio nel fegato non può più essere depositato come glicogeno, viene degradato in Piruvato e convertito in Acetil CoA l’attivazione dell’acetil Coa carbossilasi converte acetilCoA in malonilCoA prima tappa della sintesi degli ac. Grassi gli ac. grassi vengono convertiti in trigliceridi che liberati dagli epatociti sono trasportati al tessuto adiposo legati a lipoproteine entrano negli adipociti grazie alla lipoprotein-lipasi che scinde i trigliceridi in ac. grassi che possono essere così assorbiti 62 Azione sul metabolismo lipidico L’insulina stimola la sintesi degli acidi grassi (lipogenesi) e la loro esterificazione in trigliceridi. Entrambe queste azioni sono conseguenza dell’aumentata utilizzazione del glucosio. L’accelerata trasformazione del glucosio in piruvato e quindi in acetil-CoA e ossaloacetato spiega l’aumento della lipogenesi. stimolazione, da parte dell’insulina, della citrato liasi e della acetil-CoA carbossilasi Accelerata sintesi di Acetil-CoA e Malonil-CoA nel citosol instaura anche l’inibizione del sistema Carnitina-dipendente di trasporto degli acili nei mitocondri con conseguente arresto della βossidazione. All’aumento dei trigliceridi concorre anche la potente azione inibitrice dell’insulina sulla lipasi del tessuto adiposo e quella attivatoria sulla lipoproteina-lipasi, con distacco dai chilomocroni degli acidi grassi (di origine alimentare) che il tessuto adiposo assume e incorpora nei trigliceridi. L’effetto antilipolitico dell’insulina si realizza a concentrazione di insulina molto più basse di quelle richieste per altri effetti metabolici dell’ormone! l’insulina ha altri due effetti importanti nell’immagazzinamento dei grassi nelle cellule adipose inibisce la lipasi ormono-sensibile e questo inibisce la liberazione degli ac. grassi nel sangue promuove il trasporto nelle cellule adipose del glucosio che è utiliz-zato sia per la sintesi di ac. grassi che di aglicerofosfato sostanza che fornisce il glicerolo per la sintesi dei trigliceridi 64 la mancanza di insulina provoca negli epatociti: 1: la rapida -ossidazione dei grassi nei mitocondri… vengono prodotte forti quantità di CoA 2: questo eccesso di CoA viene convertita in Ac. acetace- tico e liberato nel sangue viene metabolizzato in ACIDO BETA IDROSSIBUTIRRICO ACETONE INDUCENDO CHETOSI ED ACIDOSI EFFETTO DELL’INSULINA SUL METABOLISMO DELLE PROTEINE -L’insulina promuove il trasporto di molti Aa all’interno delle cellule (val, leu, isoleu, phe) **(anche l’ormone della crescita ha lo stesso effetto, ma gli Aa sono diversi) -l’insulina agisce sui ribosomi aumentando la trasduzione dell’ mRNA e aumenta inoltre la trascrizione di porzioni di DNA -inibisce il catabolismo delle proteine -deprime la gliconeogenesi epatica 66 INSULINA E MUSCOLO la membrana del muscolo a riposo è poco permeabile al glucosio durante la maggior parte della giornata, il muscolo dipende, per le sue richieste energetiche, dagli ac.grassi non dal glucosio la permeabilità della membrana muscolare al glucosio aumenta quando è sotto l’effetto dell’insulina 67 Se lo zucchero non viene utilizzato immediatamente dal muscolo per fini energetici, viene depositato sotto forma di glicogeno La quantità di glicogeno depositato non supera il 2%, ma essendo la massa muscolare corporea rilevante, i depositi di glicogeno muscolari sono ovviamente importanti Il glicogeno depositato viene utilizzato al bisogno quando cioè il muscolo si contrae in condizioni anaerobiche nelle quali il glicogeno viene degradato ad acido lattico durante l’esercizio fisico in questo caso l’utilizzo del glucosio non richiede elevate quantità di insulina poiché il muscolo in queste condizioni diviene molto permeabile al glucosio, per ragioni non ancora note, anche in assenza dell’ormone 68 L’INSULINA COME ORMONE DELLA SZIETA’ Nel sistema nervoso centrale, soprattutto nei neuroni che costituiscono il centro ipotalamico per la sazietà, troviamo i recettori per l'insulina. Nell'encefalo, infatti, quest'ormone non regola il metabolismo del glucosio, ma regola l'assunzione di cibo in quanto attenua la sensazione di fame. glucagone ormone iperglicemizzante polipeptide di 29 amminoacidi (PM 3.485) unica catena lineare che, una volta passata in circolo, si avvolge su se stessa in modo casuale la biosintesi avviene in modo analogo all’insulina con formazione di pre-pro-glucagone (PM 18.000) da cui deriva, per distacco di catene polipeptidiche, di pro-glucagone (PM 12.000) di 100 aa già parzialmente attivo, da cui deriva l’ormone attivo il proglucagone viene sintetizzato anche in certe cellule dell’intestino tenue e dell’encefalo, ma non viene trasformato in glucagone si trova accumulato nelle cellule α in granuli secretori dai quali viene liberato per esocitosi produzione giornaliera di 100-160 g che determina un livello ematico di 100-150 pg/ml ha un emivita nel sangue circolante di ~ 6 min il GLUCAGONE Ormone peptidico di 29 aa Sintetizzato dalla cellule a PARASIMPATICO aumento gluconeogenesi epatica aumento glicogenolisi epatica aumento GLICEMIA aumento lipolisi 72 IL GLUCAGONE Il glucagone è prodotto nel pancreas dalle cellule a delle isole del Langerhans; viene secreto in risposta a ipoglicemia; il suo bersaglio principale è il fegato, ma agisce anche sul tessuto adiposo. Il suo effetto è iperglicemizzante. Effetti metabolici - Attiva la glicogenolisi (fegato) - Stimola la lipolisi (tessuto adiposo) - Attiva la gluconeogenesi (fegato) - Inibisce la glicolisi (fegato, tessuto adiposo) - Inibisce la glicogenosintesi (fegato) Il glucagone è in grado di causare aumento della glicemia grazie alla presenza, esclusivamente nel fegato, dell’enzima glucoso 6-fosfatasi che permette la defosforilazione del glucoso 6-P e la fuoriuscita nel sangue di glucoso libero. pag. 73 GLUCAGONE La secrezione del glucagone (esocitosi) è stimolata da un basso livello di glucosio nel sangue (ipoglicemia). Viene anche prodotto dalle cellule L dell’intestino tenue con l’ingresso del bolo alimentare (enteroglucagone), la sua funzione è quella di produrre un anticipato stato di iperglicemia e di stimolare la secrezione dell’insulina. a sua volta la secrezione di enteroglucagone è stimolata da una elevata concentrazione di glucosio nel lume intestinale GLUCAGONE E LE SUE FUNZIONI Glucagone Diminuzione di glucosio nel sangue il glucagone, secreto dalle cellule a ha effetti diametralmente opposti a quelli dell’insulina liberazione di glucagone Si lega ai recettori di membrana Attivazione dell’adenilato ciclasi Aumento di cAMP, attivazione della chinasi cAMP-dipendente Attivazione della glicogeno fosforilasi l’effetto principale è quello di far aumentare il tasso glicemico come l’insulina il glucagone è un grosso polipeptide PM 3490 costituito da una catena di 29 Aa Inibizione della glicogeno sintetasi Degradazione di glicogeno a glucosio Rilascio di glucosio nel sangue per le sue proprietà di aumentare la glicemia viene indicato come fattore IPERGLICEMIZZANTE 75 RECETTORE DEL GLUCAGONE Il recettore del glucagone è un recettore proteico della massa di 62 kDa. Appartiene alla famiglia dei Recettori accoppiati a proteine G Quando il glucagone si lega al recettore, si ha una variazione conformazionale del recettore che viene così attivato. Dalla sua attivazione si ha il distacco della subunità α dalla proteina G. Questa a sua volta provvede all' attivazione dell'adenilato ciclasi, con aumento dei livelli intracellulari di cAMP I recettori del glucagone si trovano anche nei reni. Risposta endocrina all’ipoglicemia 77 EFFETTI SUL METABOLISMO DEL GLUCOSIO _1_AUMENTO DELLA GLICOGENOLISI Glycogen phosphorylase active 78 Accanto ed in equilibrio con il sistema insulina-glucagone, esiste il sistema cosiddetto controregolatore o controinsulare, rappresentato dalle ghiandole ipofisi e surrene. Attraverso la secrezione di ormoni come GH, ACTH, cortisolo e catecolamine (adrenalina e noradrenalina), questo sistema esercita un effetto iperglicemizzante LE CATECOLAMINE Le catecolamine, adrenalina e noradrenalina, sono prodotte nella midollare delle surrenali ed anche nel cervello e nel tessuto nervoso, dove operano come neuro-trasmettitori. Lo stimolo nervoso ne provoca l’emissione nel sangue e la loro concentrazione da 0,06 microgrammi/litro si eleva, in pochi secondi, di 1000 volte. Si possono legare a recettori alfa e beta. La sintesi delle catecolamine parte da tirosina DOPA Dopamina. Effetti fisiologici: aumento del battito cardiaco e della pressione sanguigna. Il bersaglio principale di questi ormoni è il muscolo, ma agiscono anche sul fegato e sul tessuto adiposo. Effetti metabolici - Stimolano la glicogenolisi nel fegato aumento della glicemia - Stimolano la glicogenolisi muscolare glicolisi (lattato) ATP - Stimolano la gluconeogenesi nel fegato aumento della glicemia - Mobilitano gli acidi grassi dal tessuto adiposo - Stimolano la secrezione di glucagone - Inibiscono la glicogenosintesi nel fegato e nel muscolo - Inibiscono la secrezione di insulina pag. 82 VALORI DI RIFERIMENTO Plasma Femmine: Adrenalina < 90 ng/L Noradrenalina <700 ng/L Dopamina <87 ng/L Maschi: Adrenalina < 90 ng/L Noradrenalina <700 ng/L Dopamina <87 ng/L Azione metabolica dell’adrenalina e della noradrenalina l'adrenalina è un ormone che ha effetti contrari rispetto all'insulina di cui, tra l'altro, inibisce la secrezione L’adrenalina induce iperglicemia per stimolazione della glicogenolisi epatica. A differenza del glucagone che stimola solo la fosforilasi epatica, l’adrenalina stimola anche la fosforilasi muscolare e determina conseguentemente produzione e accumulo di acido lattico. L'adrenalina aumenta la glicogenolisi e la gluconeogenesi epatica e muscolare L’adrenalina stimola inoltre la lipolisi a livello del t.adiposo inducendo un aumento dei NEFA plasmatici. Anche la noradrenalina evoca gli effetti ricordati per l’adrenalina a seguito della sua interazione con irecettori adrenergici: l’azione della noradrenalina è però molto meno efficace di quella dell’adrenalina. L'aumento della secrezione di catecolamine prepara il corpo ad un elevato stress psicofisico: • • • • • • • aumentando la glicogenolisi aumentando la gluconeogenesi aumentando la lipolisi inibendo la glicogeno sintesi diminuendo l'insulina aumentando la secrezione di glucagone aumentando la glicolisi Azione metabolica dell’adrenalina e della noradrenalina l'adrenalina è un ormone che ha effetti contrari rispetto all'insulina di cui, tra l'altro, inibisce la secrezione L’adrenalina induce iperglicemia per stimolazione della glicogenolisi epatica. A differenza del glucagone che stimola solo la fosforilasi epatica, l’adrenalina stimola anche la fosforilasi muscolare e determina conseguentemente produzione e accumulo di acido lattico. L'adrenalina aumenta la glicogenolisi e la gluconeogenesi epatica e muscolare L’adrenalina stimola inoltre la lipolisi a livello del t.adiposo inducendo un aumento dei NEFA plasmatici. Anche la noradrenalina evoca gli effetti ricordati per l’adrenalina a seguito della sua interazione con irecettori adrenergici: l’azione della noradrenalina è però molto meno efficace di quella dell’adrenalina. Specifici centri situati nel SNC controllano i livelli di glucosio plasmatico e reagiscono ad una sua potenziale carenza aumentando rapidamente l’attività del sistema nervoso adrenergico, con conseguente rilascio di adrenalina. Risposte neuroendocrine addizionali comprendono: Aumento della secrezione di glucagone con riduzione di quella dell’insulina Aumento della secrezione di ormone della crescita (GH) e di cortisolo. L’adrenalina ed il glucagone mediano la risposta acuta all’ipoglicemia. L’aumento della secrezione di adrenalina all’ipoglicemia dura 2-4 h, quella del glucagone è invece fugace e si esaurisce nel giro di 20 min. Il GH ed il cortisolo mediano la risposta tardiva all’ipoglicemia. La loro increzione infatti aumenta dopo 3-4h. La durata della risposta tardiva è di 5-12 h. Gli ormoni controregolatori agiscono essenzialmente: Stimolando la metabolizzazione del glicogeno epatico a glucosio e la gluconeogenesi epatica Riducendo l’utilizzazione del glucosio da parte dei tessuti non-nervosi per aumentare la disponibilità per le cellule cerebrali Il legame con l'adrenalina modifica la conformazione del recettore che diviene in grado di catalizzare la sostituzione del GDP , legato ad una proteina stimolatrice, Gs, con il GTP. La proteina stimolatrice, composta da tre unità monomeriche, può così lasciare le subunità β e γ e, spostandosi lungo il piano della membrana con la sola subunità α, raggiungere una proteina integrale di membrana chiamata adenil ciclasi attivandola. Il sito attivo della AC è rivolto verso il citosol e catalizza la conversione dell'ATP in AMPc (AMP ciclico). L'AMPc stimola l'azione di una proteina chinasi AMPc dipendente (PKA) in grado di fosforilare le proteine cellulari e causare la risposta all'adrenalina. Effetti dell’adrenalina sul metabolismo • • • • Aumentata glicogenolisi nel fegato e nel muscolo Aumentata lipolisi nel tessuto adiposo Diminuita secrezione di insulina Aumentata secrezione di glucagone SOMATOTROPINA O GH ormone peptidico dell'adenoipofisi composto da 191 amminoacidi • • • E' un ormone prodotto dalla ghiandola pituitaria (ipofisi) su stimolazione del growth hormone-releasing factor o GHRF, sostanza prodotta dall'ipotalamo. Lo stimolo essenziale per la liberazione del GHRF è l'ipoglicemia (causata ad es. dal digiuno o da somministrazione di insulina). Circola nel sangue in concentrazioni molto basse (circa 10 milionesimi di grammo per litro). La vita media è di circa 20-30 minuti. Lo stimolo alla sua produzione è fondamentalmente legato all'ipoglicemia, ma può essere aumentato dall'esercizio fisico, dal sonno profondo, da una dieta proteica, da condizioni iperpiretiche, da una sana e regolare attività fisica soprattutto di carattere aerobico. Viene prodotto per tutto il decorso della propria vita, ma superati i 30 anni i suoi livelli iniziano a calare di circa il 15 per cento ogni decennio. SINTESI PROTEICA Collabora con gli ormoni tiroidei, con gli ormoni sessuali steroidei e con l'IGF-1 al processo di sviluppo e accrescimento dell'apparato scheletrico Garantisce il trofismo muscolare ed osseo nell'adulto Risparmia le riserve di proteine TESSUTO ADIPOSO Il GH favorisce la mobilizzazione dei grassi, stimola la lipolisi. Aumenta l'ossidazione degli acidi grassi, favorendo il dimagrimento e la sintesi di corpi chetonici nei tessuti stimola l'utilizzo dei lipidi e acetil-CoA allo scopo di produrre energia EFFETTI CONTROINSULARI La somministrazione cronica di GH ha effetti iperglicemizzanti con ridotta utilizzazione di glucosio, soprattutto del muscolo e del tessuto adiposo ridotta glicogenosintesi ed insulino resistenza. Risparmia le riserve di carboidrati effetto diabetogeno. Ilrecettore, presente in tutto l’organismo, appartiene alla famiglia dei recettori delle citochine. Una molecola di GH lega dure recettori adiacenti e ne determina la dimerizzazione, l’interazione e l’attivazione. Il dimero attivato recluta e attiva proteine dotate di attività tirosin-chinasica intrinseca della famiglia delle JAK (Janus-chinasi). Queste proteine fosforilano fattori di trascrizione che, attivano l’espressione genica di alcune proteine, in particolare del fattore di crescita insulino-simile di tipo 1 (IGF-1) La pulsatilità dell' ormone della crescita GH determina, in condizioni fisiologiche, una finestra d’attività durante il sonno notturno. un aumento della glicemia serale causa un effetto antagonista alla sua secrezione, riducendo la finestra utile all'azione più rilevante dell' ormone, ne consegue una degradazione della funzione anabolica GLUCOCORTICOIDI ormoni steroidi a 21 atomi di carbonio prodotti dalla corteccia surrenale l cortisolo è senza dubbio il glucocorticoide più conosciuto, nonostante nella stessa famiglia rientrino diversi ormoni, come il cortisone ed il corticosterone. Tutti questi glucocorticoidi agiscono per innalzare la glicemia, incrementando la produzione di glucosio a partire da alcuni amminoacidi e diminuendo il suo utilizzo periferico; questi ormoni stimolano inoltre il deposito di glicogeno nel fegato RECETTORE GLUCORTICOIDI Il recettore per i glucocorticoidi è un recettore intracellulare Una volta che il glucocorticoide è entrato nella cellula, a seguito del legame con il recettore GR si verifica un cambiamento conformazionale tale per cui si determina il distacco della proteina inibitrice, e la formazione di un dimero. A seguito di questo evento il complesso citoplasmatico può migrare nel nucleo, dove va a legarsi a delle specifiche sequenze di riconoscimento in grado di riconoscere tali complessi. Le sequenze di riconoscimento per i glucocorticoidi prendono il nome di elementi responsivi glucocorticoidi (GRE, Glucocorticoids Responsive Elements). C I B O Effetti del cortisolo sui flussi energetici •facilita la mobilizzazione di nutrienti (catabolico) •mantiene la produzione di glucosio dalle proteine •facilita il metabolismo dei grassi STIMOLA INIBISCE Effetti dei glucocorticoidi su altri ormoni Insulina: eccessi cronici di cortisolo portano ad aumentare il rilascio di insulina da parte del pancreas, riducendo la sensibilità del tessuto muscolare ed adiposo all'azione della stessa. L'iperinsulinemia porta a depositare più grasso nonostante il cortisolo sia un ormone lipolitico. 10-25 µg/dl ore 8 2-14 µg/dl ore 15 ORMONI TIROIDEI Gli ormoni tiroidei sono prodotti dai tireociti della tiroide. Gli ormoni prodotti sono: la tetra-iodotironina o tiroxina (T4), circa il 90% del totale e forma inattiva; la tri-iodotironina (T3), circa il 10%. Nelle loro molecole sono contenuti rispettivamente 4 e 3 atomi di iodio. La tiroide produce T4 in concentrazioni molto maggiori rispetto a T3. Quest’ultima è però molto più attiva e può essere a sua volta ottenuta dall’ormone T4 per una trasformazione enzimatica che avviene nel circolo sanguigno, a seconda delle necessità dell’organismo. In condizioni fisiologiche gli ormoni tiroidei stimolano i processi anabolici. Valori tiroidei normali Tiroxina (T4) totale (TT4) 60 - 150 nmoli/L Tiroxina (T4) libera (fT4) 10 - 25 pmoli/L Triiodotironina (T3) totale (TT3) 1,1 - 2,6 nmoli/L Triiodotironina (T3) libera (fT3) 3,0 - 8,0 pmoli/L Ormone tireo-stimolante (o tireotropina) (TSH) 0.15 - 3,5 mU/ inducono la produzione epatica di glucosio aumentano la glicogenolisi e la gluconeogenesi; promuovono l'utilizzazione del glucosio aumentando l'attività di enzimi coinvolti nell'ossidazione del glucosio stimolano l'attività della lipasi ormono-sensibile → lipolisi stimolano la sintesi e l'ossidazione del colesterolo e la sua conversione in acidi bilari favorita la sintesi di acidi grassi Aumento delle sintesi proteiche Stimolano l'ossificazione endocondrale, la crescita lineare mediata dalla loro azione sulla secrezione di GH e di IGF-1 ORMONI TIROIDEI ED INSULINA a livelli normali, T3 e T4 migliorano la sensibilità delle cellule all’ insulina favorendo la glicogenosintesi, agendo sui recettori livelli elevati di T3 e T4 invece portano a glicogenolisi con conseguente innalzamento della glicemia ORMONI TIROIDEI E ADRENALINA alti livelli di adrenalina innalzano il TSH aumentando la produzione di ormoni iodati. Allo stesso modo alti livelli di T3 e T4 rendono le cellule più sensibili all'azione delle catecolamine. Il risultato netto è un aumento della frequenza cardiaca, della sua contrazione, della glicogenolisi e lipolisi, del metabolismo in generale. Allo stato attuale della conoscenza, esistono 4 forme recettoriali per gli ormoni tiroidei, dei quali solo 3 sono in grado di legare gli ormoni: Recettore alfa-1: recettore ampiamente espresso e presente particolarmente nel muscolo cardiaco e scheletrico. Recettore alfa-2: omologo all'oncogene virale v-erb-A, ma non in grado di legare l' ormone. Recettore beta-1. espresso principalmente nel cervello, fegato e reni. Recettore beta-2: presente in regioni limitate del corpo umano come ipotalamo e ghiandola pituitaria. la localizzazione è sempre nucleare e si trovano legati alla cromatina nucleare Quando arriva l’ormone e lega il recettore viene stabilizzata ancora di più il legame con la cromatina a livello degli elementi di risposta all’ormone tiroideo TRE. Gli ormoni tiroidei sono lipofili e attraversano facilmente la membrana plasmatica ed entrano in contatto con il recettore nucleare che una volta attivato prende contatto con la sequenza TRE ed in seguito al reclutamento di fattori trascrizionali si attiva la trascrizione di geni specifici per l’ormone tiroideo.
Scarica