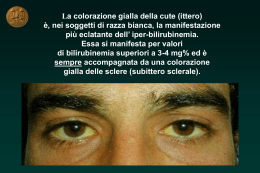
Quaderni acp 2014; 21(2): 51-59 La colestasi nella prima infanzia Martina Fornaro, Enrico Valletta AUSL della Romagna, Ospedale “G.B. Morgagni-L. Pierantoni”, UO di Pediatria, Forlì La colestasi è una condizione di ridotta produzione o flusso di bile che determina l’accumulo nel sangue e nei tessuti delle sostanze normalmente escrete attraverso la bile stessa. La colestasi e la conseguente iperbilirubinemia coniugata possono dipendere da un’anormale captazione, metabolismo, trasporto ed escrezione dei sali biliari e della bilirubina da parte degli epatociti, oppure dall’interruzione del flusso intra/extraepatico. La bilirubina non coniugata (indiretta), prodotto del catabolismo dell’eme, viene captata dagli epatociti, accoppiata a un residuo di acido glucuronico e trasformata in bilirubina coniugata idrosolubile. La bilirubina coniugata (diretta) è una componente relativamente modesta della bile che contiene anche colesterolo, fosfolipidi, anioni organici, metaboliti di farmaci, xenobiotici e acidi biliari. Il loro passaggio nel canalicolo biliare avviene attraverso la superficie apicale degli epatociti per poi fluire nell’albero extraepatico e nel dotto biliare comune fino al duodeno. Si ha iperbilirubinemia diretta se il livello della bilirubina coniugata è uguale o superiore a 2 mg/dl o è superiore al 20% della bilirubinemia totale. Valutazione del bambino con ittero L’ittero neonatale non è sempre “fisiologico”, ma può sottendere un ittero colestatico secondario a un’epatopatia clinicamente rilevante. Fino al 15% dei neonati allattati al seno può avere un ittero prolungato oltre le tre settimane e solo lo 0,04-0,2% presenta un ittero colestatico. Tuttavia, è prudente indagare, valutando la bilirubinemia diretta, i neonati che presentino ittero persistente oltre le due settimane, per escludere che si tratti di ittero colestatico. La rapidità richiesta nel riconoscere un ittero “non fisiologico” è legata soprattutto alla necessità di escludere l’atresia delle vie biliari (AVB) che richiede diagnosi e terapia chirurgica in tempi stretti, oltre a prevenire o trattare eventuali complicanze della colestasi. TABELLA 1: INDICAZIONI UTILI PER UN PRIMO INQUADRAMENTO ANAMNESTICO E OBIETTIVO IN UN NEONATO-LATTANTE CON ITTERO COLESTATICO Elementi di valutazione Consanguineità dei genitori; storia familiare di malattia neurologica progressiva; steatosi epatica gravidica Anamnesi ostetrica infettiva Colestasi gravidica; ittero o epatopatia con prurito nei familiari Irritabilità; difficoltà di alimentazione; vomito e letargia Indicazioni di sospetto clinico • Malattia mitocondriale o difetto della beta-ossidazione degli acidi grassi • Complesso TORCH, virus epatite • Colestasi intraepatica familiare progressiva (PFIC) • Infezione sistemica • Ipopituitarismo • Malattia metabolica (galattosemia, tirosinemia) • Encefalopatia Diarrea • PFIC Ileo da meconio • Fibrosi cistica Insorgenza dell’ittero dopo l’introduzione • Galattosemia di latte materno/formula • Fruttosemia o dopo fruttosio/saccarosio Dismorfismi facciali • Sindrome di Alagille o altre anomalie congenite • Malattie cromosomiche Microcefalia; basso peso alla nascita; • Infezioni congenite scarso accrescimento Porpora/ecchimosi; • Deficit di vitamina K sanguinamento (moncone ombelicale, gastrointestinale, intracranico) Splenomegalia • Fibrosi epatica • Ipertensione portale • Malattia da accumulo (Nieman-Pick) • Infezioni congenite Feci ipo-acoliche • Atresia delle vie biliari Segni di cardiopatia associata • Sindrome di Alagille • Atresia delle vie biliari • Infezioni congenite Valutazione oculistica • Embriotoxon posteriore (s. di Alagille) • Ipoplasia nervo ottico (panipopituitarismo) • Corioretinite (infezioni) • Cataratta (infezioni, galattosemia) Ritardo psicomotorio; ipotonia; • Malattie metaboliche convulsioni • Malattie mitocondriali La valutazione è finalizzata a: – differenziare la colestasi dall’ittero fisiologico e dare un primo inquadramento della patologia; – riconoscere le cause di colestasi che possono configurarsi come vere emergenze mediche; – identificare precocemente l’AVB; – trattare le complicanze della colestasi, se presenti; – individuare i pazienti con malattia epatica avanzata che meritano il riferimento a un centro specialistico. Per corrispondenza: Martina Fornaro e-mail: [email protected] a distanza 51 F A D formazione a distanza Anamnesi ed esame obiettivo Elementi importanti vengono dalla storia familiare, dall’andamento clinico perinatale e dall’esame obiettivo. Nella tabella 1 sono elencate alcune correlazioni che possono risultare utili a un primo inquadramento. Vanno indagati possibili rapporti di consanguineità e l’eventuale familiarità per malattia neurologica progressiva, l’anamnesi ostetrica materna soprattutto sul versante infettivo e riguardo alla presenza di colestasi gravidica. Nel neonato vanno valorizzati il peso alla nascita, la difficoltà nell’alimentazione, l’accrescimento, l’irritabilità, la comparsa di vomito o letargia, la diarrea. Va verificato se l’ittero ha qualche relazione temporale con l’introduzione del galattosio o del fruttosio/saccarosio. Dismorfismi facciali o altre anomalie congenite possono suggerire quadri sindromici. Lesioni purpuriche o segni di sanguinamento possono essere legati alla coagulopatia da difettoso assorbimento della vitamina K. L’epatomegalia è spesso precoce e progressivamente ingravescente. La milza è di solito di dimensioni normali all’esordio, mentre la splenomegalia compare nelle fasi avanzate come segno indiretto di ipertensione portale. La presenza di feci ipo-acoliche suggerisce un’ostruzione biliare e può essere il primo segnale di allarme. Inizialmente le feci possono essere normopigmentate o incostantemente ipocoliche ed è quindi importante valutare ripetutamente il colore delle feci ottenute eventualmente anche tramite sondino rettale. A questo scopo può essere utile l’utilizzo di un apposito colorimetro (vedi “Info genitori” in questo numero di Quaderni acp). È da ricordare che l’utilizzo di latti formulati a base di idrolisati può modificare il normale colore delle feci. Normalmente le urine di un neonato sono trasparenti ma, sebbene la presenza di urine ipercromiche sia sospetta in un neonato itterico, l’assenza di questo dato non deve trattenere da ulteriori indagini. Ritardo psico-motorio, ipotonia o convulsioni possono indicare patologie del metabolismo o dei mitocondri. Esami di laboratorio Il laboratorio mira a stabilire la possibile natura colestatica dell’ittero attraverso i Quaderni acp 2014; 21(2) livelli di bilirubinemia totale e diretta. La gravità della patologia epatica emerge dallo studio delle funzioni di sintesi: albuminemia, PT-INR, ammoniemia, glicemia e colesterolemia. Alanino-aminotransferasi (ALT) e aspartato-aminotransferasi (AST) sono indicatori sensibili ma poco specifici di danno epatocellulare e con basso valore prognostico. L’incremento della gamma-glutamiltransferasi (GGT) è marker specifico di ostruzione biliare, ma livelli bassi o normali di GGT sono presenti in alcune forme di colestasi intraepatica progressiva familiare (PFIC) e in alcuni disturbi del metabolismo degli acidi biliari. La fosfatasi alcalina (ALP) può essere elevata ma è un reperto poco specifico poiché si localizza anche nell’osso e nel rene. Il dosaggio dei sali biliari è molto utile: un incremento marcato si ha nelle PFIC, mentre bassi livelli associati a iperbilirubinemia coniugata persistente suggeriscono un difetto della sintesi degli acidi biliari. I livelli di colesterolo e trigliceridi sono elevati nella sindrome di Alagille e nella colangite sclerosante. È importante escludere patologie che richiedono un trattamento tempestivo, le sepsi (emo- e urocoltura) e il panipopituitarismo (elettroliti sierici, glicemia, TSH e T4). È necessario acquisire le sierologie per HBV, HCV, complesso TORCH, EBV e parvovirus B19. Dal punto di vista metabolico è bene verificare il risultato degli screening neonatali e dosare gli aminoacidi plasmatici e urinari, gli acidi organici urinari, le sostanze riducenti nelle urine, gli acidi biliari urinari e il profilo delle acilcarnitine. Emocromo, reticolociti, test di Coombs, sideremia e ferritinemia serviranno per escludere una linfoistiocitosi emofagocitica o un’emocromatosi neonatale. L’alfafetoproteina è elevata nella tirosinemia tipo 1. L’alfa-1 antitripsina (A1AT) sarà meglio valutata con la determinazione del fenotipo. Nei casi sospetti per patologie da accumulo, è indispensabile ottenere un aspirato midollare. La compromissione neurologica può indirizzare verso esami specialistici per lo studio delle malattie mitocondriali. Negli ultimi anni si è poi ampliata la possibilità di ricorrere, per molte patologie, a indagini di biologia molecolare e di genetica. 52 F A D Imaging e indagini strumentali Ecografia addominale. Fornisce informazioni importanti circa la presenza di sabbia biliare, bile spessa, calcoli della colecisti e anomalie anatomiche. Una colecisti assente o di piccole dimensioni può suggerire una AVB, così come la presenza del segno del triangular cord che identifica la fibrosi della porta hepatis (valore predittivo positivo 88-100%). L’ecografia può individuare malformazioni associate come la polisplenia o il situs viscerum inversus. Scintigrafia epatobiliare. L’assenza di escrezione intestinale del tracciante è indice di ostruzione biliare o di grave danno epatocitario. Ha un’elevata sensibilità per la diagnosi di AVB, ma la specificità è bassa, e l’escrezione del tracciante può mancare anche in assenza di un’ostruzione anatomica. È pertanto esame di relativa utilità. Risonanza magnetica (RM). I dati disponibili non sono sufficienti a giustificare il ricorso alla RM come strumento diagnostico di routine per esplorare l’albero biliare, soprattutto nei bambini piccoli. È un esame che richiede notevole esperienza in sede di valutazione. Colangiografia intraoperatoria. Nei casi in cui persista il ragionevole dubbio di una AVB, la colangiografia intraoperatoria, qualora dimostri l’ostruzione dell’albero biliare, conferma il sospetto e indica l’intervento di portoenteroanastomosi secondo Kasai. Colangiografia retrograda endoscopica (ERCP). Indagine specialistica, di raro impiego, che, attraverso l’incannulazione dell’ampolla di Vater, consente la visualizzazione dettagliata dell’albero biliare. Biopsia epatica. Indagine di fondamentale utilità diagnostica, se interpretata da un patologo esperto. Nella diagnosi di AVB la biopsia ha una sensibilità del 100% e una specificità intorno all’80%. Le tipiche lesioni dell’AVB sono rappresentate dall’ostruzione dei dotti biliari con proliferazione duttulare, “tappi” di bile nei piccoli dotti, edema e fibrosi negli spazi portali con architettura lobulare conservata. In molti pazienti con colestasi intraepatica sono comuni reperti quali l’edema cellulare diffuso, la trasformazione giganto-cellulare degli epa- formazione a distanza tociti e gradi diversi di flogosi e necrosi epatocellulare. È possibile altresì evidenziare reperti specifici utili a indirizzare l’ulteriore iter diagnostico, come ad esempio la steatosi microvescicolare (possibile malattia metabolica), o la presenza di inclusi virali. Si presta anche a studi di immunoistochimica, microscopia elettronica e analisi molecolare. Terapia medica della colestasi Il deficit di crescita è reperto comune e ha natura multifattoriale. La riduzione del flusso biliare determina il malassorbimento dei grassi e steatorrea; è indicato l’utilizzo di formule ricche in grassi MCT che hanno un assorbimento intestinale facilitato. Generalmente, vi è un incremento delle richieste energetiche che si accompagna spesso a stati di ipoanoressia. L’impiego della nutrizione enterale, esclusiva o integrativa, ha l’obiettivo di incrementare l’apporto calorico. Il deficit di vitamine liposolubili deve essere prevenuto con la supplementazione di vitamine A, D, E e K. L’acido ursodeossicolico (UDCA), 1030 mg/kg/die, è impiegato per stimolare il flusso biliare, migliorare la colestasi e ridurre il conseguente prurito. A questo scopo sono anche utilizzati la rifampicina (10 mg/kg/die), la colestiramina (240 mg/kg/die - 4 g/die) – resina chelante gli acidi biliari – gli antistaminici (idrossizina 2 mg/kg/die) e il fenobarbital. Eziologia della colestasi Le principali cause di colestasi infantile sono riconducibili a: – epatite neonatale – ostruzione extra e/o intraepatica – sindromi colestatiche genetiche – malattie metaboliche – endocrinopatie – forme sistemiche – agenti tossici Epatite neonatale Il fegato del neonato risponde in maniera abbastanza stereotipata a insulti di diversa natura. Il quadro istologico della “epatite neonatale” è identificato da un sovvertimento dell’architettura lobulare, rigonfiamento (ballooning) cellulare, necrosi focale e degenerazione gigantocellulare. Oggi questo termine si preferisce Quaderni acp 2014; 21(2) FIGURA 1: ATRESIA DELLE VIE BILIARI Tipo I, ostruzione a livello del dotto biliare comune; tipo II, ostruzione a livello del dotto epatico comune; tipo III, ostruzione a livello della porta (modificato da JIAPS 2008;13:49) TABELLA 2: MALFORMAZIONI CONGENITE ASSOCIATE AD ATRESIA DELLE VIE BILIARI Segno clinico Prevalenza nelle forme sindromiche Polisplenia 90% Asplenia 05% Situs inversus Malrotazione 50% 50% Assenza della vena cava 50% Shunt intrapolmonare 05% (può evolvere in sindrome epatopolmonare) Vena porta pre-duodenale 75% Cardiopatia 30% riferirlo alle sole epatiti infettive. Le forme di epatite neonatale “idiopatica”, nelle quali non si è in grado di risalire a un’eziologia specifica (infettiva o metabolica), rappresentano non più del 15-25% delle colestasi infantili. I casi di epatite neonatale idiopatica possono essere sporadici, con una prognosi migliore, o avere un pattern familiare; in questi casi, la prognosi è peggiore e probabilmente legata alla presenza di qualche alterazione metabolica congenita non ancora nota. È quindi importante mantenere il monitoraggio di questi bambini per cogliere la comparsa di altri sintomi suggestivi ed eventualmente ripetere, a distanza, la biopsia epatica. Ostruzione extra e/o intraepatica Atresia delle vie biliari (AVB) L’AVB (1:17-19.000 nati vivi) è una colangiopatia obliterativa infiammatoria destruente, che colpisce in diversa misura le vie biliari intra ed extraepatiche. Se non trattata, porta a cirrosi e morte entro i 2 anni di vita. È un’entità eterogenea in cui si combinano verosimilmente fattori genetici, materni, infettivi e di disregolazione immunitaria. La classificazione più utilizzata individua tre tipi di AVB (figura 1): nel tipo I (12%) l’atresia si localizza a livello del dotto biliare comune; nel tipo II (2-3%) l’atresia è a livello del dotto epatico; nel tipo III (85%) l’atresia è a livello della porta hepatis. Nel 20% dei casi si associa ad altre malformazioni congenite (tabella 2); la più comune è la cosiddetta “biliary atresia splenic malformation syndrome” (BASM) (10% dei casi) in cui si riscontrano polisplenia, situs inversus e anomalie vascolari diverse. Si tratta quasi sempre di neonati apparentemente sani, nei quali i segni della malattia epatica si sviluppano progressivamente. L’ittero è talora isolato oppure si accompagna a epatomegalia e, successivamente, splenomegalia, come effetto della progressione verso l’ipertensione portale. Il prurito è raro nella fase iniziale, ma può diventare un problema devastante con il progredire dell’epatopatia. Le feci che inizialmente possono essere coliche, diventano gradualmente ipo-acoliche e di consistenza cretacea. Le urine sono ipercromiche. Il rallentamento della crescita che consegue al malassorbimento dei grassi e allo stato catabolico si instaura progressivamente, mentre nelle prime settimane di vita l’accrescimento è spesso normale e 53 F A D formazione a distanza può pertanto trarre in inganno. GGT e transaminasi sono elevate, mentre la sintesi epatica (albumina e coagulazione) è inizialmente conservata. L’ecografia mostra un fegato ingrandito, vie biliari non dilatate, l’assenza della colecisti o una colecisti contratta a digiuno. Il reperto del triangular cord è specifico dell’AVB ma può mancare ed è operatoredipendente. La biopsia epatica consente la diagnosi e mostra l’ostruzione delle vie biliari, associata a diversi gradi di fibrosi portale, edema, proliferazione duttulare e colestasi. Sempre più spesso, nei casi dubbi, si preferisce la colangiografia intraoperatoria prima di procedere all’intervento chirurgico correttivo. L’intervento di Kasai (portoenteroanastomosi) mira al ripristino del flusso biliare, rallentando l’evoluzione della fibrosi verso la cirrosi biliare. Il successo dell’intervento è segnalato dalla normalizzazione della bilirubinemia (< 2 mg/dl) entro sei mesi dall’operazione, ma sono molti i fattori che possono influenzarne l’andamento. Tra questi, l’età (prognosi migliore se l’intervento avviene entro i 60 giorni di vita, soprattutto nelle forme sindromiche), l’estensione del danno epatico e l’esperienza specifica dell’équipe chirurgica. All’intervento si associa la terapia medica, con supplementazione delle vitamine liposolubili, ottimizzazione della nutrizione, somministrazione di UDCA e, in alcuni protocolli, di corticosteroidi. Dopo l’intervento di Kasai possono svilupparsi colangiti ricorrenti che determinano un peggioramento della funzione epatica; più avanti la progressione della malattia porta alla comparsa di ipertensione portale e quindi di varici gastroesofagee a rischio di sanguinamento, ascite, grave malassorbimento, oppure allo sviluppo della sindrome epatopolmonare o dell’encefalopatia epatica. In caso di insuccesso dell’intervento di Kasai e/o di progressione verso la malattia epatica terminale, trova indicazione il trapianto di fegato. Cisti del coledoco e dilatazioni cistiche delle vie biliari Si tratta di malformazioni delle vie biliari che possono essere presenti già in epoca prenatale oppure svilupparsi progressivamente, come effetto di una mal- Quaderni acp 2014; 21(2) formazione congenita della giunzione bilio-pancreatica. La dilatazione è prevalentemente a livello extraepatico e può porre difficoltà nella diagnosi differenziale con la AVB di tipo cistico. La diagnosi è ecografica. Il sospetto può insorgere di fronte a un ittero colestatico, con caratteristiche di recidivanza e che può associarsi a crisi dolorose e a pancreatite acuta. Talora è presente una massa palpabile addominale. La sintomatologia insorge generalmente dopo i 6 mesi fino all’età prescolare. Transaminasi, GGT e, talora, lipasi e amilasi sono elevate. L’ecografia e la RM consentono lo studio dell’albero biliare e del pancreas. L’ERCP ha un ruolo operativo nei casi in cui sia necessario rimuovere calcoli o nelle cisti di piccolo diametro. Quando precocemente sintomatiche, vi sono indicazioni al trattamento chirurgico entro i 6 mesi di vita per evitare l’evoluzione verso la cirrosi o la pancreatite cronica. Inoltre le cisti del coledoco presentano un elevato rischio di degenerazione maligna in età adulta. La prognosi è molto buona, ma nell’immediato post-operatorio possono verificarsi episodi di colangite anche gravi. Colangiopatie fibrocistiche Insieme di malattie epatiche rare, legate a un’alterazione nella morfogenesi del fegato e delle vie biliari, caratterizzate da diversi gradi di dilatazione segmentale dei dotti biliari intraepatici associata a fibrosi e, spesso, ad anomalie renali. Tra queste, la malattia renale policistica autosomica recessiva (autosomal recessive polycystic kidney disease, ARPKD) (1:20-40.000), il cui gene responsabile è PKHD1 (polycystic kidney and hepatic disease 1), localizzato sul cromosoma 6p21-p12, che codifica per una proteina denominata fibrocistina. Sono sempre presenti le anomalie cistiche dei dotti biliari e le dilatazioni fusiformi dei tubuli collettori renali. I neonati con la forma perinatale muoiono entro le prime ore di vita, mentre le forme infantili, meno gravi, progrediscono verso la fibrosi-cirrosi epatica e l’involuzione fibrotica del rene. Nelle situazioni più gravi c’è l’indicazione al trapianto combinato di fegato e rene. La fibrosi epatica congenita è una malattia autosomica recessiva, spesso associata ad ARPKD o alla malattia di Caroli. 54 F A D Clinicamente si distinguono forme latenti, forme colangitiche e forme associate a ipertensione portale. Nella forma pura, il fegato è di dimensioni normali, senza cisti macroscopicamente visibili. Dal punto di vista istologico è caratteristico l’allargamento fibroso dei tratti portali, che contengono un numero variabile di dotti biliari anormali. La malattia di Caroli causa anomalie cistiche con dilatazioni sacculari diffuse dei dotti biliari. Non si associa a patologia renale ma può accompagnarsi a cisti del coledoco. La sindrome di Caroli, invece, ha trasmissione autosomica recessiva. Nel fegato sono presenti le malformazioni dei dotti biliari già descritte, associate alle lesioni tipiche della fibrosi epatica congenita, ma sono anche presenti le lesioni renali dell’ARPKD. È possibile una diagnosi ecografica prenatale se si evidenziano cisti epatiche e iperecogenicità renale. Essenziali per la diagnosi post-natale sono l’ecografia, la colangiografia e l’istologia. Colangite sclerosante neonatale (CSN) Rappresenta un’entità clinica distinta rispetto ad altre forme di colangite sclerosante del bambino. La patogenesi è sconosciuta, ma una storia di consanguineità è riportata in circa il 40% dei casi, suggerendo un modello di trasmissione autosomica recessiva. Nel 50% dei casi la CSN è in associazione con manifestazioni extraepatiche, tra cui la stenosi aortica con o senza cardiomiopatia ipertrofica ostruttiva. Si presenta quasi sempre con ittero e feci acoliche durante le prime due settimane di vita, spesso mimando una AVB. L’istologia epatica è poco utile, perché mostra segni indistinguibili da quelli dell’AVB. La colangio-RM ha una bassa sensibilità e specificità diagnostica e, per la diagnosi definitiva, si ricorre quasi sempre alla laparotomia esplorativa con colangiografia intraoperatoria che mostra i dotti biliari intraepatici irregolari e rarefatti (figura 2) e l’opacizzazione del dotto biliare, consentendo di escludere una AVB. La progressione della malattia è verso la cirrosi biliare. La terapia con UDCA è di dubbia utilità e il trapianto epatico trova indicazione nelle fasi più avanzate della malattia. formazione a distanza Sindromi colestatiche genetiche Sindrome di Alagille La sindrome di Alagille è un disturbo multisistemico, a trasmissione autosomica dominante, caratterizzato da paucità dei dotti biliari in combinazione con malformazioni extraepatiche e caratteristici tratti del viso. L’incidenza è circa 1:100.000. La maggioranza dei casi (97%) è dovuta a mutazione o delezione del gene JAG1 (20p11,2 - 20p12), mentre una piccola percentuale è causata da mutazioni in NOTCH2. Le manifestazioni cliniche comprendono la malattia epatica, la cardiopatia congenita, i dismorfismi facciali, le anomalie scheletriche e le anomalie oculari (tabella 3). L’epatopatia è quasi sempre presente (95%), più comunemente nel periodo neonatale o prima dei tre mesi di vita, con ittero colestatico e incremento degli indici di citolisi. Gli acidi biliari sierici sono elevati. Il prurito è estremamente disturbante e possono comparire xantomi cutanei come effetto dell’ipercolesterolemia. Malnutrizione e deficit di crescita sono frequenti. Malformazioni cardiovascolari sono presenti in più del 90% dei pazienti. Tipico è l’embriotoxon posteriore (90%), ma può essere presente un’ampia varietà di anomalie oftalmiche. L’anomalia scheletrica caratteristica (80%) è costituita dalle vertebre “a farfalla”, con corpi vertebrali divisi sagittalmente in due emivertebre (figura 3). L’iter diagnostico comprende il consueto screening di laboratorio per la funzione epatica e la diagnosi differenziale rispetto a patologie infettive o metaboliche e all’AVB. I passaggi successivi includono l’ecografia, la biopsia epatica e la colangiografia, l’indagine genetica. La prognosi dipende dalla gravità dell’epatopatia, dalla sua progressione verso la cirrosi e dalla complessità della cardiopatia. I cardini del trattamento sono il sostegno alla nutrizione, la supplementazione vitaminica, il sollievo del prurito (UDCA, antistaminici, terapie topiche) e la gestione delle eventuali complicanze renali e cardiache. Laddove si sviluppi una malattia epatica terminale o i sintomi diventino incontrollabili è indicato il trapianto epatico. Colestasi intraepatica progressiva familiare (PFIC) Gruppo eterogeneo di disturbi epatici a trasmissione autosomica recessiva, nei Quaderni acp 2014; 21(2) FIGURA 2: NEONATALE COLANGITE SCLEROSANTE FIGURA 3: VERTEBRE “A FARFALLA” IN SINDROME DI ALAGILLE (modificato da www.childrennetwork.org) Albero biliare irregolare, esile e scarsamente ramificato (Clin Res Hepatol Gastroenterol 2012;36:530) TABELLA 3: CRITERI CLINICI DI SOSPETTO PER SINDROME DI ALAGILLE Dato clinico Colestasi Descrizione Ittero da bilirubina coniugata che compare nel periodo neonatale, spesso con feci ipocoliche Dismorfismi facciali Fronte ampia, occhi infossati, orecchie ampie, naso sottile con punta bulbosa, mento appuntito con viso triangolare Cardiopatia congenita Più frequentemente stenosi dell’arteria polmonare, ma anche atresia della polmonare, difetto interatriale, difetto interventricolare e tetralogia di Fallot Anomalie dello scheletro Vertebre “a farfalla”, emivertebre, fusione di vertebre e vertebrali adiacenti, spina bifida occulta Anomalie oculari Difetti della camera anteriore, embriotoxon posteriore (protrusione dell’anello di Schwalbe alla giunzione tra iride e cornea) quali compare colestasi epatocellulare già nel periodo neonatale o entro i primi anni di vita. Si distinguono tre tipi di PFIC – PFIC1, PFIC2 e PFIC3 – e la genetica ha consentito di individuare per ognuna le mutazioni responsabili, rispettivamente in ATP8B1, ABCB11 e ABCB4. Ciascuno di questi geni codifica per una proteina trasportatrice epatocanalicolare, che è essenziale per la corretta formazione della bile. Le mutazioni in ATP8B1 e ABCB11 possono condurre sia alle PFIC, ma anche a forme di colestasi episodica, denominate colestasi intraepatica benigna ricorrente (BRIC) di tipo 1 e 2. L’incidenza delle PFIC è circa 1:50-100.000 nati. Nei pazienti con PFIC1 la colestasi compare nei primi mesi di vita con ricorrenti episodi di ittero che diventa progressivamente permanente. Nella PFIC2 la presentazione e l’evoluzione sono più gravi, con ittero permanente, rapida comparsa di insufficienza epatica e rischio precoce di epatocarcinoma e colangiocarcinoma. La PFIC3 esordisce raramente nel periodo neonatale e può manifestarsi più tardi in età pediatrica o anche nel giovane adulto. Le GGT sono normali nella PFIC1 e PFIC2, mentre sono elevate nella PFIC3. L’ecografia epatica serve per escludere patologie anatomiche del tratto biliare. Se eseguita, la colangiografia può mostrare un normale albero biliare ed 55 F A D formazione a distanza escludere la colangite sclerosante. La biopsia epatica dà informazioni importanti sulla tipologia della malattia e sulla sua progressione. La genotipizzazione deve essere utilizzata per confermare la diagnosi di PFIC in tutti i casi. La terapia con UDCA è, generalmente, utile. Nei casi a evoluzione peggiore è indicato il trapianto di fegato. Malattie metaboliche In un neonato l’ittero colestatico associato a vomito, irritabilità e scarsa crescita, deve far considerare l’ipotesi di un errore congenito del metabolismo. Disordini del metabolismo dei carboidrati L’esordio può essere impegnativo: vomito, diarrea, letargia, difficoltà nell’alimentazione, ittero, ipoglicemia, scarsa crescita, epatomegalia, ipotonia, convulsioni e sindrome settica. Spesso si tratta di bambini in cattive condizioni generali che devono essere stabilizzati prima di procedere nell’iter diagnostico. Galattosemia. Difetto della galattoso-1uridil-transferasi. I lattanti presentano un ittero misto dopo l’assunzione di galattosio (latte materno o formulato). La sepsi da Escherichia coli è una modalità frequente di esordio. Altri sintomi significativi sono vomito, diarrea, scarso accrescimento ponderale, acidosi tubulare renale, coagulopatia. Può anche esserci cataratta. La diagnosi è suggerita, oltre che dalla clinica, dalla presenza di sostanze riducenti nelle urine ed è confermata dalla valutazione dell’attività dell’enzima negli eritrociti, nei leucociti o negli epatociti. Il galattosio va eliminato dalla dieta utilizzando formule speciali. Glicogenosi. Ne sono conosciuti molti tipi a seconda del difetto enzimatico sottostante, con prognosi e andamento clinico diversi. Alcuni di questi (tipo I, III, IV, VI e IX) hanno un’espressività prevalentemente, ma non esclusivamente, epatica. La glicogenosi tipo I (malattia di von Gierke) è causata dal difetto di glucosio6-fosfatasi. È una malattia autosomica recessiva, caratterizzata da intolleranza al digiuno, ritardo della crescita ed epatomegalia da accumulo di glicogeno e grassi nel fegato. La presentazione può essere acuta, neonatale, con scompenso metabolico grave, ipoglicemia e acidosi. Quaderni acp 2014; 21(2) La diagnosi si basa sul quadro clinico e sui livelli della glicemia e della lattacidemia dopo il pasto (iperglicemia e ipolattacidemia) e dopo 3-4 ore di digiuno (ipoglicemia e iperlattacidemia). Acido urico, trigliceridi e colesterolo sierici sono aumentati. La biopsia epatica può essere suggestiva di glicogenosi ma non specifica per il tipo di difetto. La diagnosi è confermata dalle indagini molecolari. Le complicazioni tardive più rilevanti sono epatiche (adenomi, epatocarcinoma) e renali (proteinuria e, talora, insufficienza renale). Il trapianto epatico e quello renale, isolati o combinati, trovano indicazione nei casi a evoluzione peggiore. Disordini del metabolismo degli aminoacidi Il metabolismo degli aminoacidi è essenzialmente epatico e pertanto il fegato è quasi sempre coinvolto. I disordini più frequenti sono quelli degli aminoacidi aromatici, degli aminoacidi a catena ramificata, i difetti del ciclo dell’urea e le alterazioni del metabolismo della lisina e dell’idrossilisina. FIGURA 4: NODULI DI DEGENERAZIONE NEOPLASTICA (EPATOCARCINOMA ) IN BAMBINA DI 14 MESI CON TIROSINEMIA Tirosinemia. La tirosinemia epato-renale (tirosinemia tipo 1) (1:100.000) causa insufficienza epatica, malattia renale e carcinoma epatocellulare. È determinata dal difetto di fumarilacetato idrolasi. Quando non diagnosticata alla nascita tramite lo screening neonatale, la presentazione clinica può essere di due tipi. Se l’esordio avviene prima dei 6 mesi, il coinvolgimento epatico è grave ed evolve rapidamente verso l’insufficienza d’organo. Le transaminasi possono esse- 56 F A D re modestamente elevate così come i livelli di bilirubinemia diretta, a testimoniare la perdita precoce della massa epatocellulare. L’alfa-fetoproteina è molto elevata. Se l’esordio è dopo i 6 mesi di vita, l’epatopatia ha un andamento cronico meno grave, prevale la patologia renale con aminoaciduria, fosfaturia e acidosi tubulare renale. Si sviluppano rachitismo e deficit di crescita. La diagnosi si basa sul riscontro dell’aumentata escrezione urinaria del succinilacetone e dell’incremento della concentrazione ematica della tirosina. La terapia è costituita da una dieta artificiale a bassissimo contenuto di fenilalanina e tirosina e dall’utilizzo del nitisone, un inibitore della sintesi del succinilacetone. La combinazione di dieta e nitisone, se avviati precocemente, migliora il decorso clinico e riduce la mortalità della malattia. Il rischio di evoluzione verso l’epatocarcinoma è comunque elevato (figura 4). Nei pazienti in cui la malattia non si corregge con la terapia o nei quali compare l’epatocarcinoma, il trapianto di fegato è l’opzione salva-vita. Malattie da accumulo La malattia di Niemann-Pick è una sfingo-lipidosi autosomica recessiva che dà organomegalia, arresto della crescita e progressivo deterioramento neurologico e conduce a morte entro i primi anni di vita. Si manifesta in età neonatale con ittero prolungato e progressiva comparsa di epatosplenomegalia, seguiti quindi da manifestazioni neurologiche e respiratorie. L’aspirato midollare evidenzia l’infiltrazione cellulare e consente di misurare l’attività enzimatica sui fibroblasti. È disponibile l’indagine molecolare per l’identificazione del difetto genetico. La malattia di Gaucher (1:60.000) è una patologia da accumulo lisosomiale secondaria al deficit di glucocerebrosidasi o dell’attivatore proteico della saposina C, trasmessa come carattere autosomico recessivo, dovuta alle mutazioni del gene GBA (1q21). I glucosilceramidi (o glucocerebrosidi) si depositano nelle cellule reticolo-endoteliali di fegato, milza e midollo osseo. Si distinguono tre fenotipi principali. Il tipo 1 (95%) è la forma cronica non neurologica, caratterizzata dall’associazione di organomegalia (milza, fegato), patologia scheletrica (dolore, infarti ossei, osteonecrosi) e formazione a distanza citopenia. Il tipo 2 è la forma neurologica acuta con esordio nel primo anno di vita, a rapida evoluzione e con organomegalia. Il tipo 3 è la forma neurologica subacuta progressiva con esordio nell’infanzia o nell’adolescenza. La diagnosi è confermata con la misurazione dei livelli della glucocerebrosidasi nei leucociti del sangue. La terapia sostitutiva enzimatica precoce per i pazienti con malattia tipo 1 e tipo 3 riduce il rischio di complicanze non reversibili. La malattia di Wolman è il più grave quadro clinico da deficit di lipasi acida lisosomiale, essenziale nell’idrolisi del colesterolo e dei trigliceridi che, nelle forme più gravi, si accumulano in diversi tessuti. La trasmissione della malattia è autosomica recessiva. Provocano il deficit enzimatico le mutazioni del gene della lipasi acida (LAL), localizzato in 10q24q25. La malattia può a volte presentarsi nel feto (epatomegalia, ascite, calcificazioni surrenali), ma l’esordio si verifica tipicamente nelle prime settimane di vita con vomito persistente, distensione addominale, epatosplenomegalia grave, ascite, febbre. Si registrano arresto della crescita ponderale e deterioramento psicomotorio progressivo. Pochi bambini superano l’anno di vita. La diagnosi può essere confermata misurando l’attività enzimatica sui leucociti o sui fibroblasti. Al momento non esiste un trattamento specifico. Malattie mitocondriali Le funzioni mitocondriali sono fondamentali per la produzione di energia attraverso i processi enzimatici della catena respiratoria e il metabolismo degli acidi grassi. Difetti della catena respiratoria. Le mitocondropatie a interessamento primariamente epatico sono legate al deficit del DNA mitocondriale e in particolare del complesso I, III o IV della catena respiratoria. Spesso si tratta di patologie sistemiche multiorgano. Le prime manifestazioni cliniche sono il vomito e la difficoltà di alimentazione e suzione, seguiti da ittero, letargia, ipotonia, pianto debole, crisi di apnea, convulsioni. Gli esami ematici mostrano colestasi, modesto incremento delle transaminasi, talora coagulopatia, acidosi lattica e ipoglicemia. La biopsia epatica evidenzia colestasi, steatosi, gradi diversi di fibrosi e, Quaderni acp 2014; 21(2) in microscopia elettronica, anomalie della distribuzione e dell’anatomia dei mitocondri. La conferma diagnostica viene dalla misurazione dell’attività enzimatica su tessuto epatico o muscolare. La prognosi è variabile e dipende dal tipo di difetto, ma è spesso infausta. Il trapianto di fegato può essere efficace in alcuni pazienti con espressività esclusivamente epatica ma non in quelli con associate manifestazioni cardiache e neurologiche. Difetti della beta-ossidazione degli acidi grassi. Sono un gruppo clinicamente eterogeneo di disordini. Il fenotipo a esordio precoce si manifesta con una combinazione di cardiomiopatia ipertrofica, encefalopatia epatica e ipoglicemia grave ipochetotica o con uno di questi elementi isolati. Con opportuni intervalli di alimentazione, evitando il catabolismo e l’ipoglicemia, è possibile prevenire l’insorgenza dell’encefalopatia epatica. Laddove presente, lo screening neonatale consente l’identificazione precoce di questi difetti. Disordini dei perossisomi La sindrome di Zellweger è la variante più grave, autosomica recessiva, caratterizzata da difetti di migrazione neuronale nel cervello, dismorfismi cranio-facciali, ipotonia profonda, convulsioni neonatali ed epatopatia. L’esordio è neonatale e si manifesta con ittero colestatico, epato-splenomegalia, coagulopatia, con evoluzione verso la cirrosi. La diagnosi è confermata dallo studio dei livelli plasmatici degli acidi grassi a catena molto lunga e dalle analisi genetiche. La prognosi è infausta. Disordini della sintesi degli acidi biliari Gli acidi biliari sono sintetizzati dal fegato attraverso una complessa catena di passaggi enzimatici. I difetti congeniti della sintesi degli acidi biliari determinano una mancata produzione di acidi biliari ‘‘normali’’ e l’accumulo di acidi biliari aberranti e di metaboliti intermedi, epatotossici. Si ha riduzione del flusso biliare e ridotta solubilizzazione intraluminale dei grassi e delle vitamine liposolubili. I neonati sviluppano un grave ittero colestatico precoce con progressiva insufficienza epatica. La diagnosi si basa sulla dimostrazione della presenza degli acidi biliari anomali nelle urine. La diagnosi precoce è importante perché la malattia epatica e il malassorbimento delle vitamine liposolubili possono essere trattati con successo, evitando il trapianto di fegato. Deficit di alfa-1 antitripsina (A1AT) Malattia genetica che si manifesta con cirrosi epatica, enfisema polmonare e, raramente, pannicolite. È causata da una mutazione del gene SERPINA1 (14q32.1), che codifica per l’A1AT e si trasmette con modalità autosomica recessiva. È caratterizzata da bassi livelli nel siero di A1AT, il principale inibitore delle proteasi sieriche umane. La prevalenza è circa 1:2500. Gli alleli della malattia più comuni in Nord Europa sono PI*Z e PI*S, e la maggior parte degli individui con la forma grave è omozigote PIZZ. La malattia epatica esordisce nei primi mesi di vita, con ittero prolungato, e può essere presente epatomegalia. Bilirubina diretta, transaminasi e GGT sono elevate. La diagnosi viene confermata con la determinazione del fenotipo tramite l’isoelettrofocalizzazione su siero e l’indagine genetica. Non esiste una terapia specifica per la malattia epatica e la progressione del danno è molto variabile. Nei casi di epatopatia severa è indicato il trapianto. Fibrosi cistica La colestasi neonatale è una presentazione della fibrosi cistica in meno del 5% dei pazienti affetti. Può essere indicativa l’associazione con ileo da meconio, steatorrea, deficit di crescita. La maggior parte dei pazienti viene individuata attraverso lo screening neonatale e la diagnosi confermata attraverso il test del sudore e le indagini genetiche. Emocromatosi neonatale Grave epatopatia a esordio neonatale che si associa a emosiderosi extraepatica. Può esserci oligoidramnios e la maggior parte dei neonati affetti nasce con basso peso o con parto prematuro. La malattia epatica si manifesta entro poche ore/giorni dalla nascita, con i segni dell’insufficienza epatica multi-organo: ittero precoce, ipoglicemia, coagulopatia, edema, ipoalbuminemia, oliguria. Le 57 F A D formazione a distanza FIGURA Quaderni acp 2014; 21(2) 5: INDICAZIONI PER IL PERCORSO DIAGNOSTICO NELL’ITTERO COLESTATICO !"##"$#%&'##%(')*&%#+&,&-./&0%##'1"$%& 2%3$'&4'&1"5"##'"&")6#"7& K*& K*(1"5%& D%0#"(%&5"&A'5'(6A'$"&)*$'63"#"C& 2'& ! 8%0#'(%&5"&9"0%&")6#"& ! :$4"3"(%;&:<=>0%?0'@& '?*?'#6'#"('01*@& %1*)(*1"#*0'&$%*$"#"5%@& 1"5"##'%&1%#"A*5')B%C& E5%F"#"&G4'(%##"&,-&13>45&*&,-HI& 4%55"&A'5'(6A'$"&#*#"5%J& :##%(*&4"&'?%(A'5'(6A'$%1'"& '$4'(%##"& & :DDELM&NM!E2DOD:NM& E0)564%(%&O<T& E0"1'&%1"#')'&?('1*&5'F%55*;& ! E0"1%&*A'%##'F*& ! N*5'"&9%)"5%&G)*5*('1%#(*J& ! 2#*('"&9"1'5'"(%&%& ?%('$"#"5%& ! 2)(%%$'$3&$%*$"#"5'& %1*)(*1*@&(%#')*5*)'#'@&)**1A0@& 9%(('#'$"@&%5%##(*5'#'@&O2D@&O!D@&88D@& O!P@&0"5'&A'5'"('@&"5A61'$"@& )*"365"Q'*$%@&35')%1'"@&"11*$'*@& E8O@&)*5%0#%(*5*@&#('35')%('4', TSH, T4. & E)*3("9'"&%?"#')"& & K*(1"5%& N'0#'&4%5&)*5%4*)*& U6AA'"&*&0*0?%##"&&O<T& :$4"3'$'&0%)*$4*&%&#%(Q*&5'F%55*;& ! '$9%##'F%&&GRT<@&RN<@&DMLNR@&ET<@& ?"(F*F'(60&TVW@&%1*)*5#6("@&6(*)*5#6("J& T'*?0'"&%?"#')"& ELNP@&)B'(6(3'"& ! 4*0"33'*&"59".V&"$#'#('?0'$"& ! #%0#&4%5&064*(%& ! 1%#"A*5')B%&G0)(%%$'$3&$%*$"#"5'@& "1'$*")'4'&?5"01"#')'&%&6('$"('@&")'4'& *(3"$')'&6('$"('@&0*0#"$Q%&('46)%$#'&$%55%& 6('$%@&")'4'&A'5'"('&6('$"('@&")'5)"($'#'$%J& && & & :0#*5*3'"&)*1?"#'A'5%&)*$&O<T& :0#*5*3'"&46AA'"& :0#*5*3'"&0*0?%##">0?%)'9')"&&?%(& ?"#*5*3'"&$*$&O<T& N*5"$3'*3("9'"&'$#("*?%("#*('"& P(*0%36'(%&)*$&5%&'$4"3'$'&0?%)'"5'0#')B%& O<T& K*&O<T& :$#%(F%$#*&4'&X"0"'& 58 F A D P(*0%36'(%&)*$&5%&'$4"3'$'& 0?%)'"5'0#')B%& formazione a distanza transaminasi non sono elevate in proporzione al danno epatico, mentre sono molto elevati i livelli di alfafetoproteina. Ci sono ipersaturazione della transferrina e marcato incremento della ferritina. La diagnosi viene confermata dal reperto di emosiderosi nei tessuti extraepatici o con la RM del fegato e del pancreas. Il trapianto di fegato è spesso indicato anche se con notevoli difficoltà legate all’età molto precoce e alla sopravvivenza nel post-trapianto. Endocrinopatie L’ipotiroidismo congenito può dare ittero colestatico in età neonatale, così come il panipopituitarismo che può associarsi a ipoglicemia, ipoplasia del nervo ottico o displasia setto-ottica. A differenza di altre cause di colestasi, le GGT sono normali. Gli elementi diagnostici da valutare sono i livelli di TSH e T4, gli elettroliti plasmatici e il profilo glicemico. Cause sistemiche e tossiche Tutte le condizioni cardiovascolari che determinano ipo-perfusione, come l’asfissia perinatale o le patologie cardiache con insufficienza congestizia, possono causare una sofferenza epatica con conseguente citolisi e colestasi. La leucemia, l’istiocitosi X, la linfoistiocitosi emofagocitica possono coinvolgere il fegato e necessitano di un iter diagnostico specialistico. Alcune cromosomopatie, come la sindrome di Turner, possono presentarsi con ittero colestatico. È nota, infine, l’epatotossicità di alcuni farmaci, in particolare quelli metabolizzati dal citocromo P450, soprattutto in epoca neonatale, per l’immaturità del fegato e la particolare suscettibilità al danno tossico. Anche la nutrizione parenterale prolungata, so- Quaderni acp 2014; 21(2) prattutto nei prematuri, è causa comune di epatopatia e colestasi. Conclusioni L’iter diagnostico di un ittero colestatico si snoda attraverso un percorso che richiede l’integrazione tra diversi livelli di competenza (figura 5). Se escludiamo le forme che si accompagnano a gravi patologie sistemiche di natura infettiva, metabolica o endocrinologica a esordio acuto e con compromissione precoce dello stato generale, la valutazione iniziale di un lattante con ittero colestatico avviene, usualmente, nell’ambulatorio del pediatra di famiglia. Il neonato ancora itterico dopo le prime due settimane di vita (tre settimane se allattato al seno, in buone condizioni e senza segni di allarme) merita una determinazione della bilirubina totale e diretta. È un’indicazione che riteniamo valida non solo per i bambini che presentano sintomatologia associata (vomito, scarsa crescita, ipotono, ipoglicemia), ma anche per quelli le cui apparenti ottime condizioni generali possono indurre a una sottovalutazione e a un ritardo diagnostico. Nei bambini allattati al seno ci può essere un ittero prolungato oltre le prime due settimane di vita, ma l’ittero da latte materno si accompagna a un esclusivo aumento della quota di bilirubina non coniugata. Accertata la colestasi, il bambino andrà indirizzato, senza indugio, a un percorso diagnostico specialistico. Questo sarà mirato anzitutto all’esclusione di una AVB, principale causa di colestasi nella prima infanzia, perché la precocità della diagnosi e quindi del trattamento chirurgico sono elementi importanti per la prognosi. u Bibliografia di riferimento Abrams SH, Shulman RJ. Approach to neonatal cholestasis. UpToDate, 24 luglio 2012. www.uptodate.com/. Idem. Causes of neonatal cholestasis. UpToDate, 17 dicembre 2012. www.uptodate.com/. Brumbaugh D, Mack C. Conjugated hyperbilirubinemia in children. Pediatr Rev 2012;33(7):291302. doi: 10.1542/pir.33-7-291. De Bruyne R, Van Biervliet SV, Vande Velde S, Van Winckel M. Clinical practice: neonatal cholestasis. Eur J Pediatr 2011;170(3):279-84. doi: 10.1007/ s00431-010-1363-8. Epub 2011 Jan 20. Girard M, Franchi-Abella S, Lacaille F, Debray D. Specificities of sclerosing cholangitis in childhood. Clin Res Hepatol Gastroenterol 2012;36(6):530-5. doi: 10.1016/j.clinre.2012.04.003. Hartley JL, Davenport M, Kelly DA. Biliary atresia. Lancet 2009;374(9702):1704-13. doi: 10.1016/ S0140-6736(09)60946-6. Jacquemin E. Progressive familial intrahepatic cholestasis. Clin Res Hepatol Gastroenterol 2012; 36(suppl 1):S26-35. doi: 10.1016/S2210-7401(12) 70018-9. Kleinman RE, Goulet OJ, Mieli-Vergani G, et al. Walker’s pediatric gastrointestinal disease. People’s Medical Publishing House - USA Shelton, CT. McKiernan P. Neonatal jaundice. Clin Res Hepatol Gastroenterol 2012;36(3)253-6. doi: 10.1016/j. clinre.2012.03.018. Moyer V, Freese DK, Whitington PF, et al. Guideline for the evaluation of cholestatic jaundice in infants: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr 2004;39:115-28. NASPGHAN. Guideline for the evaluation of cholestatic jaundice in infant. Recommendations of the North American. Nastasio S, Sciveres M, Ghione S, et al. La sindrome di Alagille. Medico e Bambino 2013;32: 635-42. Santos JL, Choquette M, Bezerra JA. Cholestatic liver disease in children. Curr Gastroenterol Rep 2010;12(1):30-9. doi: 10.1007/s11894-0090081-8. Sciveres M, Cirillo F, Nastasio S, Maggiore G. Le dilatazioni cistiche delle vie biliari. Medico e Bambino 2013;32:295-301. Suchy FJ, Sokol RJ, Balistreri WF (Eds). Liver disease in children. Cambridge University Press, UK, 20073. 59 F A D
Scarica