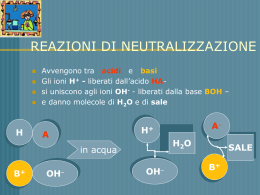
Le soluzioni elettrolitiche sono le soluzioni acquose che contengono ioni. •La solubilizzazione di una sostanza avviene per dissociazione ionica e per reazioni di ionizzazione: le basi si ionizzano producendo ioni OH-. Secondo Arrheius gli acidi si ionizzano producendo ioni H+ Una soluzione si dice acida se contiene ioni in maggioranza H+;si dice basica se ne contiene in maggioranza OH-. •Abbiamo la Neutralizzazione quando si mischiano una sostanza acida con una basica: Secondo Brönsted si definiscono acidi le specie chimiche che cedono ioni H+ si definiscono basi le specie chimiche che acquistano ioni H+ Soluzione acida Si ottiene una soluzione acida quando il sale deriva da un acido forte e da una base debole. Specie chimica che, in soluzione acquosa, e in grado di liberare uno o piu ioni H+ Soluzione basica Si ottiene una soluzione basica quando il sale deriva da un acido debole e da una base forte. in cui è coinvolta l'acqua. Il risultato è una soluzione basica, dato l'eccesso di ioni OH- (pH > 7 a 25 ºC). Il pH è una scala di misura dell'acidità o della basicità di una soluzione. Solitamente assume valori compresi tra 0 (acido forte) e 14 (base forte). Al valore intermedio di 7 corrisponde la condizione di neutralità (H2O). Il pH può essere misurato per via elettrica, sfruttando il potenziale creato dalla differenza di concentrazione di ioni idrogeno su due lati di una membrana di vetro, o per via chimica, sfruttando la capacità di alcune sostanze (dette indicatori) di modificare il loro colore in funzione del pH dell'ambiente in cui si trovano. sostanze usate in soluzione, come per esempio la fenolftaleina e il blu di bromotimolo. Cartine tornasole, indicatori universali, pHmetro. Prodotti analizzati in laboratorio 0 1 •Pomodoro •detergente •Aceto •Brioschi 2 3 Detersivo Candeggina Acqua distillata H2O H2O+NaCl 4 5 6 7 8 9 10 11 12 13 14 ACIDITA’ 0 1 2 BASICITA’ 3 4 5 6 7 Coca cola 8 9 10 11 12 13 14 Ammoniaca NH3 Succo di limone Bicarbonato di sodio Na2HCO3 H2O + NH3 (ammoniaca) Acido muriatico NaClO Sapone Queste cartine completamente impregnate con indicatori permettono di misurare il valore del pH nell' intero intervallo o in intervalli parziali con graduazioni tra 0,2 e 1 unità di pH. Strumenti utilizzati Molto spesso gli indicatori si usano anche supportati su strisce di carta (le cosiddette "cartine indicatrici“), le quali cambiano colore quando vengono immerse in sostanze acide o basiche. L'esempio più comune è quello delle "cartine di tornasole", di colore rosso in ambiente acido e blu in ambiente alcalino. Strumenti usati maggiormente •Porta provette •Provette da laboratorio •Bacchetta di vetro •Pipetta tossico esplosivo Estremamente tossico infiammabile Irritante estremamente infiammabile Corrosivo nocivo pericoloso per l'ambiente
Scarica