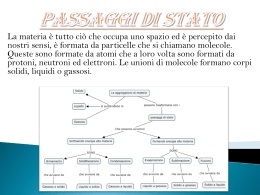
6. Gli stati fisici della materia Stati di aggregazione La materia può avere tre stati di aggregazione, spiegabili con la teoria cinetico-corpuscolare. Si ritiene che la materia sia costituita da piccolissime particelle dotate di energia cinetica, cioè si muovono continuamente. Le particelle sono attirate le une dalle altre da forze di coesione che tendono a mantenerle vicine, mentre l’energia cinetica tende ad allontanarle. Il prevalere di una o dell’altra forza determina lo stato fisico di aggregazione, che è specifico di ogni sostanza a determinate condizioni di pressione e temperatura. solido: le particelle sono molto vicine e occupano uno spazio definito e fisso; a causa delle elevate forze di coesione possono solamente oscillare, perciò il solido ha un volume e una forma propria, una densità alta e una bassa dilatazione termica: un aumento di pressione ha un effetto praticamente nullo sul volume, il solido è cioè incomprimibile. Lo stato solido cristallino si ha quando le sostanze assumono una forma poliedrica, anche se irregolare. Quando le particelle assumono una forma disordinata si parla di solido amorfo e, anche se le particelle non possono muoversi, si può considerare liquido ad altissima viscosità. 1 6. Gli stati fisici della materia Stati di aggregazione liquido: le particelle sono meno vicine rispetto allo stato solido e hanno una minore forza di coesione, per cui possono scorrere; di conseguenza, la materia ha un volume proprio ma la forma del recipiente che la contiene; ha una media densità e media dilatazione termica; all’aumento della pressione, la diminuzione di volume è trascurabile e quindi il liquido è praticamente incomprimibile. aeriforme: le particelle sono separate e in continuo rapido movimento, per cui la materia assume forma e volume del recipiente che lo contiene; ha una bassa densità ed elevata dilatazione termica; con l’aumentare della pressione il volume diminuisce sensibilmente. I corpi allo stato aeriforme si distinguono in vapori e gas: i primi sono sostanze che a temperatura ambiente esistono come solidi (naftalina) o liquidi (alcool), mentre i gas a temperatura ambiente esistono solo come aeriformi. Liquidi e aeriformi sono chiamati fluidi per la loro capacità di scorrere e di assumere la forma del recipiente. 2 6. Gli stati fisici della materia Passaggi di stato La materia, se sottoposta a variazione di temperatura e pressione, subisce una trasformazione da uno stato fisico ad un altro, chiamato passaggio di stato, una trasformazione fisica e non chimica, perché non viene alterata la composizione della sostanza, ma solo il modo in cui sono legate le particelle. Quando un corpo è riscaldato, l’energia delle particelle aumenta fino a superare le forze di coesione, determinando il passaggio di stato; viceversa, raffreddandolo, le particelle diminuiscono il loro movimento e si fanno più sentire le forze di coesione. Per quanto riguarda la pressione, un suo aumento favorisce il passaggio da vapore a liquido e da liquido a solido, perché si ha l’avvicinamento delle particelle e quindi l’aumento delle forze di coesione. Al contrario, una diminuzione di pressione favorisce i passaggi di stato opposti: fusione, vaporizzazione, sublimazione. La tabella riassume i diversi passaggi di stato. fusione passaggio da solido a liquido solidificazione passaggio da liquido a solido vaporizzazione passaggio da liquido ad aeriforme condensazione passaggio da aeriforme a liquido sublimazione passaggio diretto da solido ad aeriforme brinamento passaggio diretto da aeriforme a solido 3 6. Gli stati fisici della materia Sostanze pure, miscugli e soluzioni Una sostanza pura o specie chimica è una sostanza che presenta una composizione ben definita e costante, Ad esempio lo zucchero, è formato da atomi di carbonio, idrogeno, ossigeno ed è quindi una sostanza organica, l'acqua, formata da idrogeno ed ossigeno, il sale, formato da cloro e sodio, l'ossigeno, formato da atomi di ossigeno sono invece sostanze inorganiche. L'aria invece è una miscela, perché formata da diverse sostanze pure I miscugli possono essere omogenei ed eterogenei. Un miscuglio eterogeneo è costituito da componenti chimicamente definiti e da fasi fisicamente distinguibili (ad es. acqua e olio). Un miscuglio omogeneo di due o più sostanze è chiamato soluzione (ad es. acqua e sale). Il materiale più abbondante del miscuglio è il solvente, mentre i materiali meno abbondanti si chiamano soluti. Quando, ad una certa temperatura, non è più possibile sciogliere un soluto nel solvente, la soluzione viene detta satura. 4 7. Processi fisici e trasformazioni chimiche Proprietà fisiche e chimiche. Le proprietà della materia sono distinte in fisiche e chimiche. Proprietà fisiche: sono osservabili senza che si debba alterare la composizione chimica della sostanza. Proprietà chimiche: è necessario che la sostanza venga sottoposta a una trasformazione chimica. Trasformazioni fisiche: intervengono sulle proprietà fisiche e non alterano la composizione chimica della sostanza. Trasformazioni chimiche: cambia la composizione chimica delle sostanze coinvolte e si ha quindi la formazione di nuove sostanze. 5 7. Processi fisici e trasformazioni chimiche Trasformazioni fisiche. Con la divisione in lastre, la roccia subisce una trasformazione fisica. L’ardesia, per esempio, è una roccia che può essere tagliata facilmente in lastre. Per questa sua proprietà viene usata per realizzare tetti e altre coperture, ma anche le lavagne. 6 7. Processi fisici e trasformazioni chimiche Le trasformazioni chimiche sono dette solitamente reazioni chimiche. Le sostanze coinvolte nella trasformazione sono dette reagenti, mentre le nuove sostanze che si ottengono nel corso del processo sono dette prodotti. Esempi di reazioni: la comparsa di bollicine, un cambiamento di colore, la formazione di un solido (non per una variazione di temperatura), un aumento o una rapida diminuzione di temperatura, ecc. 7 7. Processi fisici e trasformazioni chimiche Equazioni chimiche La chimica ha un linguaggio molto sintetico che, per alcuni aspetti, ha delle somiglianze con il linguaggio matematico. Essa si serve, infatti, di simboli ed equazioni: le formule servono per rappresentare le varie sostanze; le equazioni per rappresentare le reazioni. In un’equazione chimica, a sinistra si scrivono i reagenti (se sono più di uno vengono associati con il segno +) e a destra i prodotti, che possono essere uno o più di uno. Tra i reagenti e i prodotti si scrive una freccia, che rappresenta la trasformazione. La legge fondamentale che governa le equazioni chimiche è la legge di Lavoisier o della conservazione della massa, ovvero il tipo di atomi e il loro numero non cambia, quello che cambia sono le nuove relazioni tra gli stessi atomi, cioè c’è solo un riarrangiamento della loro composizione chimica. Per fare in modo che la legge di Lavoisier sia verificata è necessario bilanciare l’equazione chimica, aggiungendo dei coefficienti, cioè dei numeri che facciano pareggiare il numero di atomi a sinistra e a destra della freccia. 8 8. L’energia e le sue trasformazioni L’energia è la capacità di un corpo di eseguire lavoro e trasferire calore Il lavoro è una grandezza fisica connessa con i concetti di movimento e di forza: una forza compie un lavoro su un corpo quando questo si sposta nella direzione lungo la quale agisce la forza. L’energia può trasformarsi da una forma ad un’altra. Il calore è un flusso di energia, ovvero è dovuto al moto disordinato e casuale di atomi e molecole, noto come agitazione termica, che si propaga trasmettendosi da una molecola all’altra. 9 8. L’energia e le sue trasformazioni La temperatura di un corpo indica il suo stato termico, ma non ci dà alcuna informazione sulla quantità di calore che ha consentito di raggiungere quel determinato stato. La temperatura è una grandezza fondamentale e la sua unità di misura nel SI è il kelvin (K) Conversioni: T (K) = t (°C) + 273,15 T (°C) = T (K) – 273,15 10 8. L’energia e le sue trasformazioni L’energia posseduta da un corpo può essere distinta in due categorie: energia cinetica, connessa con il movimento, ed energia potenziale. Quest’ultima è un’energia immagazzinata, in quanto posseduta dal corpo in virtù della sua posizione o configurazione. Per esempio, è energia potenziale quella di un masso in bilico sull’orlo di un pendio. È di tipo potenziale anche l’energia chimica contenuta nei legami tra gli atomi di un pezzo di carbone o di legno, o quella contenuta negli alimenti. 11 8. L’energia e le sue trasformazioni L’energia non si crea né si distrugge, ma unicamente passa da una forma a un’altra. Per esempio, con la fotosintesi, l’energia della luce solare non viene consumata dalle piante verdi, ma viene solo convertita, da queste, in energia chimica. Nelle trasformazioni dell’energia da una forma in un’altra, parte di tale energia viene dissipata come calore, che, perciò, rappresenta una forma di energia disordinata e dispersa. Quindi, nell’evoluzione e nel funzionamento di tutti i sistemi (cellula, organismo, motore, ecc., considerati unitamente all’ambiente circostante) l’energia passa, nel complesso, da una forma più ordinata e concentrata a una forma più disordinata e dispersa. 12
Scarica