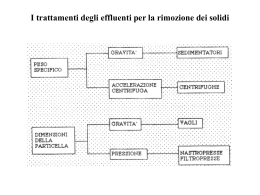
CROMATOGRAFIA LIQUIDA A FASE INVERSA Fase stazionaria e’ costituita da catene idrocarburiche apolari (butile, ottile, ottadecile) che formano un film liquido legato al supporto di silice Fase mobile è un solvente polare (puo’ essere un tampone acquoso, metanolo, acetonitrile o miscele) La fase stazionaria è essenzialmente inerte ed instaura solo interazioni apolari (idrofobiche) con gli analiti. La separazione cromatografica avviene principalmente sulla base delle caratteristiche della fase mobile. Gli analiti polari eluiscono per primi e quelli non polari per ultimi Poiché il numero di piatti teorici è correlato all’area di superficie della fase stazionaria, ne consegue che particelle di dimensioni minori forniranno un grado di risoluzione maggiore In HPLC (High Pressure Liquid Chromatography) si utilizzano resine con un diametro inferiore rispetto a quelle usate nella cromatografia classica. numero più alto di piatti teorici aumenta anche la resistenza al flusso dell'eluente (aumento di pressione) Colonna cromatografica rivestita in acciaio Le tecniche di centrifugazione si basano sul comportamento delle molecole quando esse sono sottoposte ad un campo centrifugo, assumendo che i parametri delle molecole analizzate – quali la massa molecolare relativa, la forma e la densità – siano correlati al loro comportamento in un campo gravitazionale. Particelle in soluzione, se lasciate in condizioni di quiete, tenderanno a sedimentare per effetto della gravità. Per ogni particella, la velocità alla quale essa sedimenta è proporzionale alla forza applicata, per cui le particelle sedimentano più rapidamente quando la forza applicata è maggiore di quella di gravità esercitata dalla terra. In alcuni casi (fluidi biologici) il tempo impiegato per la sedimentazione spontanea sarebbe troppo lungo ed alcune particelle impiegherebbero anni per sedimentare. Lo scopo delle tecniche centrifugative è quindi quello di esercitare una forza maggiore del campo gravitazionale terrestre, aumentando in tal modo la velocità di sedimentazione delle particelle. Ai fini della centrifugazione, le particelle di interesse sono risospese in un adatto solvente e poste in provette o bottiglie alloggiate in un rotore. Il rotore è posto centralmente sull’albero motore della centrifuga. Particelle che differiscono per densità, forma o dimensioni possono essere separate poiché sedimentano con velocità diverse quando sono sottoposte ad un campo centrifugo, ogni particella con una velocità direttamente proporzionale al campo centrifugo applicato. La velocità di sedimentazione dipende dal campo centrifugo applicato (G), diretto radialmente verso l’esterno; il campo è funzione del quadrato della velocità angolare del rotore (ω, espressa in rad s-1) e della distanza radiale (r, espressa in cm) della particella dall’asse di rotazione, in base all’equazione: G = ω2r Dunque se la provetta contenente il campione di interesse è fatta ruotare in circolo, la soluzione è sottoposta ad una forza di gravità artificiale proporzionale alla distanza dal centro di rotazione ed al quadrato della velocità di rotazione. Dal momento che ogni rivoluzione del rotore è pari a 2 radianti, la sua velocità angolare (in rad s-1) può essere espressa in termini di rivoluzioni al minuto (rev min-1), che è poi il modo più frequente di esprimere la velocità del rotore: = 2 rev min-1 60 Il campo centrifugo (G) espresso in termini di rev min-1 diventa quindi: G = 4 2 (rev min-1)2 r 3600 Generalmente il campo centrifugo è espresso come multiplo della forza gravitazionale terrestre (g = 980 cm sec-2), cioè come rapporto tra il peso della particella sottoposta al campo centrifugo ed il peso della stessa sottoposta alla sola forza di gravità. Esso è quindi riportato in termini di Campo Centrifugo Relativo (RCF) o, più semplicemente, come “numero di g”. Quindi: RCF= 4 2 (rev min-1)2 r 3600 x 980 Per il calcolo del campo centrifugo relativo in una centrifuga si utilizza la seguente formula: RCF = 1,12r (RPM/1000)2 RPM = velocità di rotazione giri min-1 (rev min-1) r = raggio dell’equipaggiamento espresso in mm Quando si riportano le condizioni per la separazione delle particelle tramite centrifugazione devono essere specificati velocità del rotore, dimensioni del raggio e tempo di centrifugazione. Dal momento che le analisi biochimiche sono condotte di solito su particelle disciolte o sospese in soluzione, la loro velocità di sedimentazione dipende non solo dal campo centrifugo applicato, ma anche da: 1. Massa della particella, una funzione del suo volume e della sua densità 2. Densità e viscosità del mezzo nel quale essa sta sedimentando 3. Da quanto la sua forma differisce da quella sferica Quando una particella sedimenta deve spostare una parte di liquido nel quale si trova sospesa, generando una spinta apparente verso l’alto, pari al peso di liquido spostato. Assumendo che una particella sia sferica, con volume e densità noti, dopo aver corretto la sua densità per la “galleggiabilità” dovuta alla densità del mezzo, allora la forza (F) che incontra quando è centrifugata con una velocità angolare ωrads-1 è data da: F 4 rp3 (ρp – ρm) ω2r 3 dove 4/3 rp3 è il volume della sfera di raggio rp, ρp è la densità della particella, ρm è la densità del mezzo in cui essa si trova sospesa, ed r è la distanza della particella dall’asse di rotazione. Tuttavia, le particelle generano attrito quando migrano nella soluzione; se si tratta di una particella rigida, di forma sferica che si sposta con una velocità nota, la forza di attrito (F0) che si oppone al suo spostamento è data da: F0 = vf dove v è la velocità di sedimentazione della particella , ed f è il coefficiente d’attrito per quella particella nel solvente. Il coefficiente d’attrito f di una particella dipende dalle sue dimensioni, forma e grado di idratazione, oltre che dalla viscosità del mezzo. Una particella sferica, non idratata, di volume e densità noti, sospesa in un mezzo a densità costante, sottoposta ad un campo centrifugo, è soggetta ad accelerazione finchè la forza applicata non diventa uguale alla forza d’attrito che si oppone al suo movimento nel mezzo. Nella pratica, l’equilibramento tra queste due forze si realizza abbastanza rapidamente, dopo di che la particella si muove con velocità costante, poiché la forza di attrito aumenta con la velocità della particella. In queste condizioni, la forza risultante che agisce sulla particella è pari a zero; perciò essa non accelera più, avendo raggiunto la velocità massima che la porta a sedimentare con una velocità costante. La velocità di sedimentazione di una particella (v) può anche essere espressa in termini di velocità di sedimentazione per unità di campo centrifugo applicato, più comunemente definita coefficiente di sedimentazione, s. Quando la composizione del mezzo di sospensione è definita, la velocità di sedimentazione è proporzionale ad ω2r (G) → v = sω2r s = v / ω2r Il valore determinato sperimentalmente per di coefficiente di sedimentazione è una funzione di temperatura, viscosità e densità della soluzione. Per convenzione il coefficiente di sedimentazione determinato è corretto in quel valore che si otterrebbe in acqua, a 20°C e viene riportato come coefficiente di sedimentazione standard (s20,w). Per la maggior parte delle molecole biologiche, i coefficienti di sedimentazione sono valori molto piccoli, quindi si utilizza come unità di misura l’unità Svedberg (S), pari a 10-13 s. Esempio: una molecola di RNA ribosomale avente coefficiente di sedimentazione pari a 5 x 10-13 s ha un valore 5 S. In generale una particella più grande ha una unità Svedberg maggiore e quindi una maggiore velocità di sedimentazione. La centrifugazione può essere adoperata per separare molecole con diversi coefficienti di sedimentazione. 1 10 102 103 104 S enzimi – ormoni peptidici proteine solubili 2 – 25 S acidi nucleici 3 - 100 S polisomi 20 - 220 S virus 40 - 1000 S lisosomi 4000 S membrane 100 - 100.000 S mitocondri 20.000 - 70.000 S nuclei 4x105 – 4x107 S da banco centrifughe separazioni rapide di sospensioni grossolane preparative separazioni preparative di particelle diverse fra loro analitiche analisi di particelle già pure per studiare le caratteristiche di sedimentazione delle macromolecole CENTRIFUGAZIONE DIFFERENZIALE • Si basa sulla diversa velocità di sedimentazione di particelle con diversa forma e densità • Il materiale è separato in un certo numero di frazioni per centrifugazioni successive aumentando gradualmente il campo centrifugo applicato • Si tratta di una metodica adoperata per l'isolamento degli organuli cellulari a partire da omogenati di tessuto CENTRIFUGAZIONE IN GRADIENTE DI DENSITÀ Consente di determinare la densità idrostatica ed il coefficiente di sedimentazione delle molecole Zonale: • dipendente dal tempo di centrifugazione • utilizza un gradiente preformato • la separazione si basa principalmente sulle diverse dimensioni molecolari Isopicnica (uguale densità): • è una tecnica all'equilibrio • indipendente dal tempo di centrifugazione • utilizza un gradiente autoformantesi • separa particelle di dimensioni simili (organuli cellulari) ma diverse in densità (non separa proteine solubili che possiedono densità molto simili) Il gradiente • è costituito da una materiale inerte nei confronti del materiale biologico (CsCl per acidi nucleici, saccarosio per proteine e particelle subcellulari) • stabilizza la colonna di liquido all'interno della provetta • previene il rimescolamento • migliora la risoluzione della separazione • consente la separazione della maggior parte o, talora, di tutti i componenti di una miscela ULTRACENTRIFUGA ANALITICA 1. determinazione della massa molecolare relativa 2. analisi delle variazioni conformazionali 3. studi sulla purezza del campione Velocità massima= 500.000 g (campo centrifugo relativo) E’ costituita da: motore, rotore contenuto in una camera refrigerata in cui sia fatto il vuoto, sistema ottico di rivelamento del campione che sedimenta durante la centrifugazione DETERMINAZIONE DELLA MASSA MOLECOLARE A) Metodo della velocità di sedimentazione Durante la sedimentazione una molecola tende a diffondere radialmente nella soluzione in funzione della sua densità. Tale fenomeno si riflette in un allargamento del picco di sedimentazione. Essendo costante la v di sedimentazione è possibile risalire al coefficiente di diffusione D misurando l’incremento dell’area del picco in funzione del tempo. Equazione di Svedberg: PM sRT D(1-vρm) volume specifico parziale = l’aumento di volume che si verifica quando 1 g di soluto è aggiunto ad un volume infinito di soluzione B) Equilibrio di sedimentazione (l’equilibrio è tra la forza centrifuga che fa sedimentare la molecola e la tendenza di questa a diffondere nel solvente) Facendo girare il rotore a basse velocità la molecola si dispone nella cella secondo un gradiente di concentrazione che va dal menisco al fondo della cella. Si misurano due valori di concentrazione della molecola (ca e cb) in due punti che distano diversamente dal centro di rotazione (ra e rb, rb>ra). PM = 2 RT ln(cb-ca) ω2(1-vρ) (r2b-r2a) ci : concentrazioni a distanza ri dall’asse di rotazione R: costante dei gas T: temperatura in Kelvin ANALISI DELLE VARIAZIONI CONFORMAZIONALI Le variazioni conformazionali di una molecola possono essere saggiate esaminando le differenze di velocità di sedimentazione. Molecola più compatta Molecola meno compatta minore attrito con il solvente maggiore attrito (sedimentazione più lenta) DNA a singola o doppia elica DNA lineare o circolare Proteine trattate con urea o altri denaturanti possono essere disaggregate nelle subunità costituenti (protomeri) Proteine allosteriche possono subire variazioni conformazionali in seguito al legame col substrato e/o piccoli ligandi (attivatori e inibitori) STUDI SULLA PUREZZA DEL CAMPIONE L'ultracentrifugazione analitica è utilizzata per determinare la purezza delle preparazioni di: • DNA • Virus • Proteine L'omogeneità della soluzione è verificata mediante l'analisi del fronte di sedimentazione (essa è generalmente caratterizzata da un unico e ben definito fronte di sedimentazione) Le impurità si traducono in picchi addizionali, spalle del picco principale o asimmetria del picco
Scarica