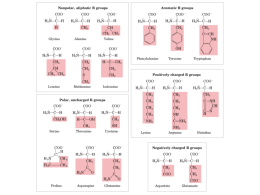
1 Le proteine possono contenere oltre agli aa altri gruppi chimici; esse sono chiamate proteine coniugate La parte non aminoacidica è detta gruppo prostetico Classe Gruppo prostetico Esempio Lipoproteine Lipidi b1-liproteina Glicoproteine Carboidrati IgG Fosfoproteine Gruppi fosforici Caseina del latte Emoproteine Eme (ferro-porfirina) Emoglobina Flavoproteine Nucleotidi flavinici Succinato DH Metalloproteine Ferro Zinco Calcio Ferritina Alcol DH Calmodulina 2 Tra le proteine coniugate hanno una maggiore importanza biomedica: glicoproteine lipoproteine emoproteine 3 Le glicoproteine sono proteine contenenti catene oligosaccaridiche (glicani) legate covalentemente alla catena polipeptidica Funzione Glicoproteina Molecole strutturali Collageno Agenti lubrificanti Mucine Molecole di trasporto Transferrina, ceruloplasmina Molecole immunitarie Immunoglobuline, antigeni di istocompatibilità Enzimi Vari (per alcalina) Siti di riconoscimento per l’attacco delle cellule Varie proteine implicate nelle interazioni cellula-cellula es. fosfatasi 4 Le funzioni delle catene oligosaccaridiche sono svariate: Modulano le proprietà chimico-fisiche (solubilità, viscosità, carica netta, partecipano ai siti di legame per batteri e virus) Proteggono dalla proteolisi intra o extracellulare Sono implicate in attività biologiche, per esempio nella gonadotropina corionarica umana (hCG) Hanno effetto sull’inserimento nelle membrane, sulla migrazione e distribuzione intracellulare e sulla secrezione Influenzano lo sviluppo e il differenziamento embrionale Possono modificare i siti delle metastasi selezionati dalle cellule cancerose 5 LIPOPROTEINE le proteine possono coniugarsi con legami covalenti ai lipidi (per esempio nelle proteine intriseche), di membrana, oppure formano dei complessi lipoproteici, in cui le proteine e i lipidi sono legati in modo instabili. questo secondo tipo di lipoproteine possono avere dimensioni e composizione variabili, si trovano nel plasma dove mediano il trasporto di lipidi non idrosolubili 6 I lipidi sono trasportati nel plasma come lipoproteine Ciò è possibile grazie all’aggregazione di lipidi con proteine idrofiliche (apolipoproteine o apoproteine) nelle lipoproteine sono presenti 4 principali classi di lipidi: Triacilgliceroli Fosfolipidi Colesterolo Esteri del colosterolo 7 I complessi lipoproteici sono classificati in 5 gruppi: • chilomicroni • VLDL (very low density lipoprotein) • IDL (intermediate density lipoprotein) • LDL (low density lipoprotein) • HDL (high density lipoprotein) 8 1) Chilomicroni, derivanti dall’assorbimento intestinale dei triacilgliceroli 2) Lipoproteine a bassissima densità (VLDL), prodotte dal fegato con funzioni di trasportatori dei triacilgliceroli. 3) IDL, che derivano dalle VLDL 4) Lipoproteine bassa densità (LDL) che rappresentano la tappa finale nel catabolismo delle VLDL. 5) Lipoproteine ad alta densità (HDL o a-lipoproteine), coinvolte nel metabolismo del VLDL e dei chilomicroni e nel trasporto del colesterolo. I triacilgliceroli rappresentano i lipidi predominanti nei chilomicroni e nelle VLDL, mentre il colesterolo e i fosfolipidi rispettivamente nelle LDL ed HDL 9 2 10 11 Oltre all’uso di tecniche basate sulla loro densità le lipoproteine possono essere classificate in base alle proprietà elettroforetiche specifiche in α β, e pre-β lipoproteine, e possono essere più accuratamente identificate per mezzo dell’immunoelettroforesi. 12 I lipidi anfipatici sono componenti essenziali delle lipoproteine Una lipoproteina tipica come un chilomicrone o una VLDL, è costituita da : 1. un nucleo di lipidi, soprattutto triacilgliceroli non polari ed esteri del colesterolo 2. circondato da un singolo strato di fosfolipidi anfipatici e molecole di colesterolo, orientati in modo che i loro gruppi polari siano rivolti verso il mezzo acquoso come nella membrana cellulare. 13 La porzione proteica di una lipoproteina è nota come apolipoproteina o apoproteina e costituisce: 1. circa il 70% di alcune HDL 2. meno dell’1% di chilomicroni Alcune apolipoproteine sono integrali e non possono essere rimosse mentre altre sono libere di passare ad altre lipoproteine 14 Sezione parziale di una lipoproteina plasmatica, nella quale un singolo strato di componenti portanti gruppi idrofilici (proteine, fosfolipidi, colesterolo libero, racchiude una massa di lipidi completamente idrofobici (trigliceridi, colesterolo esterificato) 15 16 La distribuzione delle apolipoproteine caratterizza ciascuna lipoproteina Le apolipoproteine hanno diverse funzioni: Possono formare parte della struttura delle lipoproteine come l’apo B Possono essere cofattori enzimatici come la C-II per la lipoproteina lipasi, l’A-I per la lecitina-colesterolo aciltrasferasi e Possono agire da ligandi nell’interazione con i recettori delle lipoproteine nei tessuti, come apoB-100 e apoE per il recettore delle LDL, apoE per il recettore dei residui di chilomitroni e apo A-I per il recettore delle HDL. 17 18 Emoproteine Sono proteine molto importanti, coniugate con una o più unità di eme (ferro-porfirina); questo gruppo prostetico contiene un nucleo centrale metallico (ione ferroso, Fe2+) chelato da un tetrapirrolo ciclico (porfirina). eme citocromo-c 19 Le funzioni dell’emo-proteine possono essere diverse a seconda del tipo: trasporto di O2 riserva di O2 trasporto elettronico tramite reazioni redox degradazione di radicali liberi e xenobiotici 20 fra i numerosi esempi di emo-proteine umane e animali ricordiamo: Proteina Funzione Emoglobina Trasporto dell’ossigeno nel sangue Mioglobina Riserva di ossigeno nel muscolo Citocromo C Coinvolto nella catena di trasporto degli elettroni Citocromo P450 Idrossilazione Xenobiotici Catalasi Degradazione dell’acqua ossigenata Triptofano pirrolasi Ossidazione del triptofano 21 nell’emoglobina e nella mioglobina il nucleo metallico dell’eme è sempre uno ione ferroso, l’ossidazione di questo compromette la funzione delle due emo-proteine nei citocromi invece il nucleo centrale dell’eme può alternativamente ossidarsi (ione ferrico, Fe3+) e ridursi (ione ferroso, Fe2+) permettendo il trasporto di elettroni da una molecola all’altra 22 Struttura di alcune emo-proteine di interesse biomedico: Mioglobina: piccola molecola compatta costituita da una singola catena polipeptidica (17 KDa), di forma approssimativamente sferica questa molecola è presente nel tessuto muscolare striato svolge una funzione importante: immagazzina l’ossigeno che, in condizioni di scarsa ossigenazione (per es. durante lo sforzo fisico), è rilasciato per essere utilizzato dai mitocondri per la sintesi dell’ATP 23 La mioglobina funziona come carrier di ossigeno tra il sangue extracellulare e il mitocondrio 24 L’atomo di ferro 2+ al centro del gruppo eme è coordinato a 4 atomi di azoto delle porfirine e ad un quinto atomo di azoto della catena laterale della istidina prossimale. Il sesto legame di coordinazione serve per legare l’ossigeno. 25 Il nucleo di ferro dell’eme è chelato da 2 residui istidinici, His93 e His64; la posizione dell’His93 nella mioglobina è sempre conservata. L’atomo di ferro è posizionato fuori dal piano dell’anello tetrapirrolico della porfirina. Durante il legame con l’ossigeno, il ferro si inserisce all’interno del piano della porfirina. Questo determina un effetto di trazione sulla istidina prossimale (a cui il ferro è legato) e dei residui ad esso legati 26 determinando una modificazione strutturale delle proteine. le mioglobine dei mammiferi costituiscono un esempio di proteine con identità di struttura altamente “conservata” 27 Legame dell’ossigeno sulla mioglobina l’istidina distale protegge il complesso eme-ferro2+ dall’ossidazione eme-ferro3+, incapace di legare l’ossigeno l’istidina distale inoltre protegge contro il binding con il monossido di carbonio, riducendone l’affinità di legame di circa mille volte 28 Emoglobina: le emoglobine sono proteine tetrameriche composte da coppie di polipeptidi diversi (a, b, g, d, s); le forme tetrameriche umane più comuni sono le seguenti: • HbA emoglobina normale dell’adulto (a2b2) • HbF emoglobina fetale (a2 g2) • HbS emoglobina falciformi (a2s2) delle cellule • HbA2 emoglobina minore dell’adulto (a2d2) la molecola dell’emoglobina riesce a legare 4 molecole di ossigeno grazie alla presenza di 4 gruppi eme, uno per 29 ogni subunità 30 31 Il feto ha emoglobine diverse. Poco dopo il concepimento sintetizza catene zeta, simili alla catena a e le catene ε simili alle catene β. Nel corso della vita fetale, la catena zeta è sostituita dalla catena α e la ε dalla catena γ che poi a sua volta è sostituita dalla β. L’emoglobina più importante durante gli ultimi 2/3 di vita fetale, l’emoglobina F, ha la composizioni in subunità a2γ2. Le catene a e zeta sono formate da 141 aminoacidi, le catene β γ e δ contengono 146 residui. 32 33 tetramero costituito da 2 coppie di monomeri uguali a 2 a 2; così a1 e a2 presentano strutture primaria, secondaria e terziaria 34 identiche Le associazioni tra le varie subunità dell’emoglobina sono governate da interazioni non covalenti; le subunità sono legate mediante legami ad H, le interazioni ab sono relativamente forti, 35 quelle aa e bb sono più deboli Nell’interazione ab intervengono il residuo Asn102 della catena b e il residuo Asp94 del polipeptide a 36
Scarica