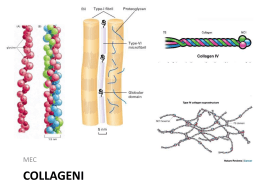
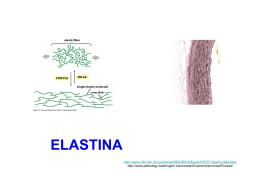
I collageni Fibre con elevata resistenza alla trazione Rappresentano circa il 50% delle proteine totali dei vertebrati Sono caratterizzati da un elevato contenuto di glicina e dalla presenza di aa rari, quali idrossilisina e idrossiprolina La stabilità delle fibrille di collagene è rinforzata da ponti idrogeno che coinvolgono gli ossidrili dei residui di idrossiprolina e idrossilisina delle catene alfa. Questi ponti idrogeno formano legami crociati sia all’interno che tra le singole molecole di collagene presenti in una fibrilla. Nei vertebrati sono note 25 catene α differenti, ciascuna delle quali è codificata da un gene specifico e possiede una sequenza aa caratteristica. Queste catene α si associano in varie combinazioni generando 14 tipi differenti di molecole di collagene, la maggioranza delle quali si trova in tessuti specifici. Tutti i collageni hanno caratteristiche specifiche: in 1) una triplica elica rigida di polipeptidiche avvolte tra loro comune 3 2 catene 2) una composizione amminoacidica inusuale: alto contenuto di glicina presenza di amminoacidi rari, assenti in altre proteine (idrossiprolina, idrossilisina) Alterazioni sintesi e secrezione del collagene sindrome della fragilità ossea (osteogenesis imperfecta) fibrosi polmonare Fibre collagene, reticolari ed elastiche: le prime due non sono chimicamente e strutturalmente diverse ma rappresentano livelli di aggregazione differenti di un’unica unità fibrosa elementare (tropocollagene). Le fibre elastiche (costituite prevalentemente da elastina) sono molto abbondanti nella tonaca elastica delle arterie e nei legamenti e nei tendini insieme alle fibre collagene. Fibre collagene e reticolari Fibre collagene [a1(I)]2 a2 (I) Fibre reticolari 10 11 In verde : fibre Collagene In viola : fibre Elastiche 12 FIBRE ELASTICHE 13
Scarica


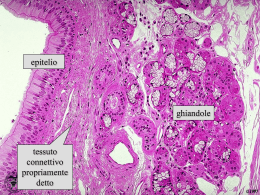

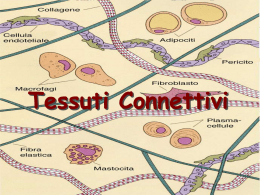




![MED-Connettivo-2-2013 [modalità compatibilità]](http://s2.diazilla.com/store/data/000508767_1-6ece3c6a8c67538136a0102b06179085-260x520.png)