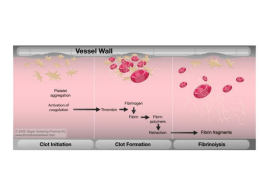
Basi molecolari delle patologie Molecular disesae Linus Pauling e l’a-elica Itano e Singer dimostrarono nel 1946 mediante elettroforesi che Hb falciforme aveva più cariche positive. Questa fu una scoperta sorprendente, alla quale Pauling diede il nome di “Malattia molecolare” Monomero emoglobina Hb falciforme (HbS) Val Val Glu Val La mutazione nel gene della b globina La presenza della valina crea una zona idrofobica che interagisce con la regione idrofobica della catena b di una Hb adiacente. Elettroforesi del DNA normali • Elettroforesi di frammenti di DNA ottenuti tramite enzimi di restrizione dal gene della globina b S S AAA Elettroforesi della proteina + _ Identificazione tramite HPLC della proteina * *= Hb glicata Le patologie congenite nel cane Introduzione • Nei cani di razza pura sono state identificate circa 500 patologie genetiche • Sito Web “Inherited Diseases in Dogs” (IDID): www.vet.cam.ac.uk/idid • Più di metà sono congeniti secondo la modalità recessiva autosomica mendeliana semplice (problema per gli allevatori!) Patologie • Atrofia retinica progressiva (Setter, Labrador, Corgi, Mastino, Bassotto, ecc) • Malattia di von Willebrand (Bovaro bernese, Doberman, Pinscher, alcuni Terrier, ecc) • Carenza di piruvato cinasi (Basenji, Chihuahua, Bassotto, ecc) • Tossicità da ivermectina (Pastore tedesco, Collie, Bobtail ecc) • Intossicazione da Cu Carenza di piruvato cinasi Piruvato cinasi Dominio B Dominio A Dominio C Struttura e caratteristiche • 4 isozimi M1, M2, R e L codificati da 2 geni distinti: LR (nell’uomo sul cromosoma 1) codifica per isoforme R (specifica per eritrociti) e L (fegato, corteccia surrenali, intestino tenue); M (nell’uomo sul cromosoma 15) codifica per isoforme M1 (muscolo scheletrico adulto, cuore cervello) e M2 (fetale in tutti i tessuti, poi viene sostituita dalle altre isoforme tranne che in rene, tessuto adiposo, leucociti). • Cinetica e regolazione Metabolismo degli eritrociti Glucosio Glucosio-6-P 6 Fosfogluconato Pentosi fosfati PEP Piruvato Lattato • Carenze negli enzimi che controllano la glicolisi risultano in una bassa produzione di ATP, riducono la vita media degli eritrociti e provocano anemia (fosfofruttocinasi-PFK e piruvato cinasi-PK) • Carenza di Glucosio-6-P deidrogenasi rende gli eritrociti suscettibili a danni ossidativi per carenza di glutatione ridotto • (nell’uomo sono note 158 diverse mutazioni del gene PK-LR e l’incidenza è 1:20.000 nella popolazione bianca). Scoperta nei primi anni ’70 in Basenji e Beagle, ma presente anche in altre razze • Questa carenza è trasmessa come carattere autosomico recessivo • Gli omozigoti presentano minor resistenza all’esercizio, tachicardia, mucose pallide e splenomegalia. Gli eritrociti hanno una vita più breve, si ha anemia rigenerativa con elevata presenza di reticolociti • Nei cani normali: Ht 48 e % Rtc 0,4 (nell’uomo 1%) • Nei cani ammalati: Ht 21 e % Rtc 40. La prolungata anemia emolitica produce un anormale assorbimento di ferro a livello intestinale, con successivo accumulo nel fegato (emosiderosi). Anche nell’uomo, un accumulo di ferro nel fegato si manifesta come complicazione della carenza di PK Iperplasia delle cellule del Kupfer contenenti granuli di emosiderina Basi molecolari • Nei cani affetti da carenza di PK negli eritrociti manca l’isoforma R dell’adulto. • Il tipo di mutazione varia a seconda della razza: ad esempio nel Basenji la mutazione è il risultato di una singola delezione che porta alla formazione di una proteina tronca che non presenta il sito catalitico funzionante. • Negli eritrociti è invece presente l’isoforma M2, che è presente normalmente nei reticolociti. Test diagnostici • Misura attività PK nell’emolisato: molto spesso normale, in quanto i reticolociti hanno attività molto alta • Dal momento che M2 ha attività molto labile può aiutare un test di stabilità termica, lasciando l’emolisato a per 1h a 50°C. • Altri test: immunoblotting, misura di intermedi glicolitici • Diagnosi molecolare basata su DNA (PennGen: w3.vet.upenn.edu/research/centers/penngen/ser vices/alldiseases.html) Anche nei gatti Abissino gatto domestico a pelo corto Malattia di von Willebrand Introduzione • La malattia di von Willebrand (vWD) è il difetto genetico della coagulazione più comune nell’uomo e nel cane. • Deriva da carenza qualitativa e/o quantitativa di una glicoproteina multimerica, il fattore di von Willebrand, necessario per il processo di adesione delle piastrine. • Ci sono 4 tipi di vWD ereditaria. • La malattia fu scoperta nel 1924 da un pediatra finlandese, E.A. von Willebrand Fattore (proteina) di von Willebrand Proteina di von Willebrand (blu) legata al recettore piastrinico (giallo) Nell’uomo: in gene per vWF si estende per 178kb e comprende 52 esoni Il monomero contiene 2050 AA organizzati in vari domini Viene glicosilato e dimerizza mediante ponti-S-S- nel reticolo Nel Golgi forma multimeri estremamente grandi >20,000 KDa che sono funzionalmente attivi Le mutazioni • Il tipo di mutazione determina la severità della patologia • Il fattore manca negli individui che presentano la forma severa della patologia (tipo III) (Scottish Terrier e Shetland Sheep). • Forme meno severe (I ) con bassi livelli nel Doberman Pinscher. Il caso del doberman • La mutazione nei doberman comporta la presenza di livellli normali di vWf intorno al 510%, mentre il restante 90-95% è patologico • La mutazione in questo caso colpisce un sito di splicing (splice site mutation) • Si tratta di una mutazione che modifica il sito di splicing portando alla permanenza di introni nel messaggero maturo con conseguente proteina aberrante
Scarica