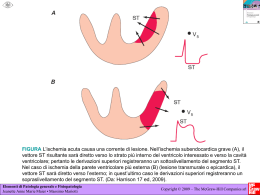
"Vasculopatie periferiche: dalla stratificazione del rischio alle nuove prospettive terapeutiche" Dott. Luca Santoro Servizio di Angiologia Complesso Integrato Columbus - Università Cattolica del Sacro Cuore Istituto di Patologia Speciale Medica e Semeiotica Medica AOP: cenni epidemiologici • Prevalenza totale: 3-10% • soggetti > 70 anni: prevalenza del 15-30% • Sintomi tipici: 10-30% dei pazienti con AOP • Sintomi atipici: 30-40% dei pazienti con AOP • Assenza sintomi: 30-50% dei pazienti con AOP Solo in 1/3 dei pazienti, AOP è diagnosticata e trattata AOP: comorbidità AOP: comorbidità Increased risk VS general population (%) Original event Myocardial infarction Myocardial infarction 5–7 x Stroke 2–3 x greater risk (includes death) greater risk Stroke greater risk (includes TIA) 3–4 x 9x greater risk (includes angina and sudden death) Peripheral arterial disease 4x greater risk (includes fatal MI and other CHD death) Il rischio di eventi CV maggiori è correlato alla severità di AOP greater risk (includes TIA) 2–3 x AOP: prognosi e storia naturale AOP: quadro clinico CLAUDICATIO INTERMITTENT Quadro clinico (descritto come stanchezza, dolore o crampo) riproducibile con l’esercizio fisico ed alleviato dal riposo Localizzazione dolore Polpaccio Anca-gluteo Malleolo-piede Gamba Coscia Localizzazioni lesioni ATS Femoro-poplitee Aorto-iliache Tibiali Poplitee Iliaco-femorali AOP: CLASSIFICAZIONE ISCHEMIA CRITICA CRONICA Condizione clinica caratterizzata da dolore ischemico cronico a riposo, ulcere cutanee e/o gangrene attribuibili a occlusione arteriosa evidenziata con metodi obiettivi ISCHEMIA CRITICA CRONICA • I dati pressori caratterizzanti sono: – pressione alla caviglia <50-70 mmHg, oppure – pressione dita piede < 30-50 mmHg, oppure – pressione parziale transcutanea di O2 < 10 mmHg • La prognosi prevede il ricorso ad amputazioni maggiori entro 6-12 mesi qualora non intervengano significativi miglioramenti emodinamici. ISCHEMIA ACUTA DEGLI ARTI INFERIORI Qualsiasi riduzione improvvisa della perfusione dell’arto che causa una minaccia potenziale alla vitalità dell’arto stesso, la cui presentazione avviene in genere entro 2 settimane dall’evento acuto 5 P → PAIN, PARALYSIS, PARESTHESIAS, PULSELESS, PALLOR AOP: fattori di rischio Tabagismo Diabete/iperglicemia Età Ipertensione arteriosa Dislipidemie Insufficienza renale Sesso maschile Etnia AOP: diagnosi ABI - Permette di individuare la AOP in pts asintomatici - Fornisce rilevanti informazioni prognostiche - Inutile per i vasi tibiali non compressibili (calcificazioni secondarie a diabete, IRC, età avanzata) Eco-color-Doppler – – – – – Metodica accurata Metodica diffusa Metodica non invasiva Metodica ripetibile Costi contenuti Esami di II livello (Angio-TC; Angio-RM; Angiografia) TERAPIA DELLE ARTERIOPATIE OBLITERANTI PERIFERICHE Terapia delle AOP FINALITA’ DEGLI INTERVENTI TERAPEUTICI PRESERVARE LA FUNZIONE DELL’ARTO: aumentando l’autonomia di marcia aumentando la pervietà a breve/lungo termine delle rivascolarizzazioni prevenendo l’ischemia cronica critica, l’ischemia acuta e le amputazioni PREVENZIONE SECONDARIA CARDIOVASCOLARE: limitando morte e disabilità dovute ad Ictus limitando morte e disabilità dovute ad cardiopatia ischemica Terapia delle AOP 1. Controllo dei fattori di rischio 2. Terapia antiaggregante 3. Esercizio fisico 4. Farmaci per la claudicatio 5. Rivascolarizzazione Controllo dei fattori di rischio: FUMO Il fumo è, insieme al diabete, il fattore di rischio più importante per la progressione dell’AOP Più dell’80% dei pazienti con AOP è fumatore o ex-fumatore “Heavy smokers” hanno rischio x 4 di claudicatio intermittent Gravità AOP aumenta con n° sigarette Il fumo è associato ad un’incidenza di amputazione 11 volte maggiore Associazione con AOP più importante che con CAD OBIETTIVO: CESSAZIONE COMPLETA METODI • Educazione sanitaria • Programmi formali di cessazione con assistenza di psicoanalisi • Terapia sostitutiva con nicotina → cerotti transdermici, gomme, spray nasali… • Farmaci → FDA si a bupropione (ZYBAN) no a clonidina (CATAPRES) e nortriptilina (PAMELOR) • Integratori: iperico e biancospino • Agopuntura Controllo dei fattori di rischio: FUMO EFFETTI Riduzione del rischio di morte per cause cardiovascolari Rallentata evoluzione AOP → CLI Miglior esito degli interventi di rivascolarizzazione Può aumentare l’autonomia di marcia Ad 1 anno 0.1% 5% 16% 30% da soli con programma educativo sanitario con terapia sostitutiva con bupoprione Jorenby DE , N Eng J Med 1999 Ma a lungo termine… …..solo il 10% riesce a smettere Rigotti NA, N Eng J Med 2002 Controllo dei fattori di rischio: DIABETE - Rischio di claudicatio intermittent x 2 -Amputazioni > 5-10 volte -Ogni 1% aumento di HbA1c – 26% aumento rischio di AOP Selvin et al, Ann Intern Med 2004 OBIETTIVO TASC II J Vasc Surg 2007 ACC\AHA 2005 Circulation 2006 Controllo dei fattori di rischio: DIABETE METODI Dieta, calo ponderale, esercizio fisico Farmaci (insulina, Ipoglicemizzanti orali, etc.) EFFETTI Favorevoli, ben documentati, sulla progressione della microangiopatia (retinopatia e nefropatia) Miglioramento degli outcome cardiovascolari Non esistono trials controllati sugli effetti della terapia antidiabetica sulla storia naturale dell’AOP Controllo dei fattori di rischio: DISLIPIDEMIA OBIETTIVO - Multipli fattori di rischio maggiori (specialmente diabete) - Fattori di rischio severi e poco controllati (es. fumo non interrotto) - Multipli fattori di rischio della sindrome metabolica - Sindrome coronarica acuta In patients with coronary artery disease and low HDL cholesterol levels, one study found that gemfibrozil reduced the risk of nonfatal myocardial infarction or cardiovascular death by 22%. N Engl J Med 1999;341:410–8. Controllo dei fattori di rischio: DISLIPIDEMIA METODI - Modifica stile vita (dieta ed attività fisica regolare) - Farmaci: - Statine Fibrati (efficacia non provata su AOP, ma solo su CAD) EFFETTI (solo statine) - Aumento autonomia di marcia Aumento ABI Rallenta progressione AOP Miglioramento qualità della vita Miglioramento outcome perioperatori Riduzione del rischio cardiovascolare Cochrane Reviews 2007 Controllo dei fattori di rischio: DISLIPIDEMIA Oltre ad abbassare i livelli di lipidi, le statine possono ridurre il grado di infiammazione come dimostrato dalla riduzione dei livelli ematici di PCR Albert MA et al: JAMA 2001 Pazienti che hanno livelli più bassi di PCR dopo terapia con statine hanno un outcome clinico migliore, a prescindere dal riscontro lipidico ottenuto Ridker PM et al: N Eng J Med 2005 “…Alte dosi di statine e livelli più bassi di LDL-colesterolo sono entrambi indipendentemente associati con un migliore outcome in pazienti con AOP. Questi risultati supportano l’idea che le statine abbiano effetti favorevoli non solo per la capacità di abbassare i livelli plasmatici di lipidi, e dovrebbero quindi essere considerati in tutti i pazienti con AOP, a prescindere dai livelli plasmatici di lipidi” Harm Feringa et al: J Vasc Surg 2007 Controllo dei fattori di rischio: IPERTENSIONE ARTERIOSA OBIETTIVO METODI Dieta Stile di vita Terapia farmacologica Ahimastos AA et al: Ann Intern Med 2006 Terapia delle AOP 1. Controllo dei fattori di rischio 2. Terapia antiaggregante 3. Esercizio fisico 4. Farmaci per la claudicatio 5. Rivascolarizzazione FARMACI ANTIAGGREGANTI OBIETTIVO • Impiego in tutti i pazienti con AOP nota FARMACI UTILIZZATI • Aspirina • Tienopiridine • Picotamide • Dipiridamolo • Cilostazolo EFFETTI Favorevoli, ben documentati, sugli outcome cardiovascolari Aumentano l’autonomia di marcia Rallentano la progressione AOP CHEST 2008 FARMACI ANTIAGGREGANTI: ASPIRINA FARMACI ANTIAGGREGANTI: ASPIRINA Libretti A, Catalano M. Treatment of claudication with dipyridamole and aspirin. Int J Clin Pharmacol Res 1986;6:59-64. 54 pazienti La combinazione di aspirina e dipiridamolo incrementa l’autonomia di marcia. GoldHaber SZ, et al. Low-dose aspirin and subsequent peripheral arterial surgery in the Physicians’Health Study. Lancet 1992;340:143-35 22071 medici sani Follow up: 60± 2 mesi. 56 soggetti (20 aspirina, 36 placebo) hanno fatto ricorso a chirurgia (OR 0.54, 95% CI 0.30 to 0.95; p=0.03) FARMACI ANTIAGGREGANTI: CLOPIDOGREL 19185 pazienti totali: Riduzione del rischio relativo di 8,7% 6452 pazienti con AOP: Riduzione del rischio relativo di 23.8% Lancet 1996;348:1329–39. FARMACI ANTIAGGREGANTI: CLOPIDOGREL Lancet 1996;348:1329–39. FARMACI ANTIAGGREGANTI: CLOPIDOGREL Lancet 1996;348:1329–39. FARMACI ANTIAGGREGANTI: TICLOPIDINA TICLOPIDINE Benefit on mortality (OR 0.68, 95% CI 0.49 to 0.95) and need for revascularisation (OR 0.62, 95% CI 0.41 to 0.93). Antithrombotic drugs in the primary medical management of intermittent claudication: a meta-analysis. Thromb Haemost 1999;81:715–22. Reduction in postoperative reocclusion (OR 0.53, 95% CI 0.33 to 0.85) and a nearsignificant reduction in amputation (OR 0.29, 95% CI 0.08 to 1.01). Antiplatelet therapy and other interventions after revascularisation procedures in patients with peripheral arterial disease: a meta-analysis. Eur J Vasc Endovasc Surg 2000;19:370–80. FARMACI ANTIAGGREGANTI: TIENOPIRIDINE … However, ticlopidine is associated with a substantial risk of leukopenia and thrombocytopenia, requiring close hematological monitoring. Because of these side effects, clopidogrel has replaced ticlopidine as the thienopyridine of choice … … monotherapy with clopidogrel may be marginally superior to aspirin, although the confidence interval in CAPRIE bordered on no effect. The cost of monotherapy with clopidogrel (especially for lifetime therapy) is much higher than that of aspirin … Doppia antiaggregazione ASA + CLOPIDOGREL vs ASA alone Riduzione del rischio raddioppiata tra i 272 pazienti con ECVD vs NO ECVD (47.9%, 95% CI 24.2% to 73.9%, vs 18.2 %, 95% CI 10.5 % to 39.5 %,) Doppia antiaggregazione STUDIO CHARISMA: ASA + CLOPIDOGREL vs ASA alone NESSUN BENEFICIO dell’associazione con clopidogrel sul rischio di eventi cardiovascolari maggiori sia considerando la totalità della popolazione (15603 pazienti; RR 0.93, 95% CI 0.83 to 1.05) sia considerando solo quelli con AOP (3531 pazienti; RR 0.87, 95% CI 0.67 to 1.13). Bhatt DL et al, N Engl J Med. 2006 Doppia antiaggregazione STUDIO MATCH: Clopidogrel +ASA vs Clopidogrel alone Differenza nel ridurre cardiovascolari maggiori significativa eventi NON Nessun dato specifico su pazienti affetti da AOP Doppia antiaggregazione … In summary, long-term combined antiplatelet therapy with clopidogrel and aspirin likely carries a higher risk of bleeding, and results have failed to convincingly demonstrate superiority of dual therapy or reducing major vascular events in the long term … Terapia delle AOP: Farmaci anticoagulanti (eparina non frazionata, eparina a basso peso molecolare ed anticoagulanti orali) Nessun beneficio di EPARINA, EBPM o anticoagulanti orali, a fronte di un aumentato rischio di eventi emorragici maggiori, in special modo con gli anticoagulanti orali. CHEST 2008 Terapia delle AOP 1. Controllo dei fattori di rischio 2. Terapia antiaggregante 3. Esercizio fisico 4. Farmaci per la claudicatio 5. Rivascolarizzazione ESERCIZIO FISICO OBIETTIVO: almeno 3 sedute alla settimana di almeno 30’ per almeno 3-6 mesi EFFETTI (mantenuti a 2 anni) Marcato aumento autonomia di marcia (+50-200%) Maggiore di quello ottenibile con pentossifillina (20-25%) Maggiore di quello ottenibile con cilostazolo (40-60%) Comparabile al bypass chirurgico Watson L et al. Cochrane Database Syst Rev 2008 ESERCIZIO FISICO …an exercise program (and treatment of modifiable risk factors) should be considered the first line therapy for intermittent claudication. Drug therapy to treat the symptoms of claudication should be considered as a second line of treatment (Livello di evidenza 1A). Terapia delle AOP 1. Controllo dei fattori di rischio 2. Terapia antiaggregante 3. Esercizio fisico 4. Farmaci per la claudicatio 5. Rivascolarizzazione TERAPIA DELLA CLAUDICATIO CILOSTAZOLO Esperienza più che ventennale in Giappone (1988) ed in seguito in altri 9 paesi Asiatici, fra cui Cina e Sud Corea, ed in America Latina con indicazioni allargate (anche ulcere, sensazione di freddo, prevenzione di restenosi) Approvazione FDA negli USA nel 1999 come farmaco anticlaudicatio Approvazione nel Regno Unito dal 2001, in uso anche in Germania ed Irlanda Approvazione in Italia e commercializzazione da aprile 2009 CILOSTAZOLO – Proprietà farmacologiche Effectors PDE3 Cilostazolo Adenylate Cyclase cAMP 5’AMP Phosphorylation of PKA substrates Interleukin 6 ↑ Contrattilità Cardiaca Lipid Hydroperoxides ↑ Rilasciamento delle CML con vasodilatazione Tumour Necrosis Factor Nitrous Oxide ↓ Proliferazione cellule muscolari lisce Transcription Factor E2F ↓ Aggregazione Piastrinica ↓ Lipidi plasmatici Multipli effetti potenziali favorevoli (..ed effetti collaterali!) CILOSTAZOLO – Proprietà farmacologiche Cilostazolo è un inibitore selettivo della fosfodiesterasi 3A Si differenza dagli altri inibitori della PDE 3 per la capacità di bloccare il reuptake della adenosina Sono stati sviluppati moltri inibitori della PDE3, tra i quali il milrinone, il vesnarinone, l’enoximone ed il pimobendano. Questi inibitori sono stati studiati come farmaci inotropi nello scompenso cardiaco grave, ma il loro uso è stato abbandonato per un aumento di mortalità nei pazienti trattati. La capacità del Cilostazolo di indurre anche un’inibizione del re-uptake dell’adenosina determina effetti sulla contrattilità miocardica e sulla frequenza cardiaca significativamente minori di quello del milrinone e di altri farmaci simili CILOSTAZOLO – Farmacocinetica L’assorbimento è rapido e non influenzato dalla dose Il cibo aumenta l’assorbimento di circa il 25% Cilostazolo deve essere assunto 30 minuti prima o due ore dopo la colazione e il pasto serale A seguito di somministrazione di dosaggi multipli di cilostazolo 100 mg due volte/die in pazienti con patologia vascolare periferica lo steady state viene raggiunto entro 4 giorni. Metabolizzazione epatica ad opera del sistema citocromo P450 Eliminazione prevalentemente renale (circa 75%); il resto con le feci La farmacocinetica del cilostazolo e dei suoi metaboliti non è stata interessata in modo significativo dall’età o dal sesso dei soggetti sani di età compresa fra 50 e 80 anni → Nessuna variazione della dose nel paziente anziano CILOSTAZOLO – Farmacocinetica Insufficienza renale Non è necessario un aggiustamento del dosaggio in pazienti con clearance della creatinina >25 ml/min Cilostazolo è controindicato nei pazienti con clearance della creatinina < 25 ml/min (l’eliminazione è renale!!). Insufficienza epatica Nei pazienti con epatopatia lieve non è necessario un adattamento del dosaggio Non sono disponibili dati su pazienti con insufficienza epatica da moderata a grave, ma essendo prevalentemente metabolizzato attraverso gli enzimi epatici, è controindicato nei pazienti con insufficienza epatica moderata o grave. CILOSTAZOLO - Interazioni Omeprazolo e lansoprazolo (induttori citocromo P450) (associazione controindicata in Europa – dosi dimezzate in USA) Diltiazem (associazione controindicata in Europa – dosi dimezzate in USA) Eritromicina (associazione controindicata in Europa – dosi dimezzate in USA) Altri (es. ketoconazolo, fluoxetina, sertralina): mancano studi ma probabile incremento delle concentrazioni di cilostazolo e suoi metaboliti (forti inibitori citocromo P450) La somministrazione di una singola dose di 100 mg di cilostazolo con 240 mg di succo di pompelmo (potente inibitore del sistema citocromo P-450 3A4) non ha determinato effetti notevoli sulla farmacocinetica del cilostazolo CILOSTAZOLO - Associazioni CILOSTAZOLO - ASPIRINA Studi a lungo termine: Numero limitato di pazienti (n= 201) Dosi e durata trattamento variabili: (75 – 80 – 325 mg per 54 – 137 g.) Non è emersa nessuna tendenza manifesta di un’incidenza maggiore di eventi emorragici avversi nei pazienti che assumevano cilostazolo e aspirina rispetto ai pazienti che assumevano placebo e dosi equivalenti di aspirina. Nessun cambiamento significativo Parametri della coagulazione Aggregazione piatrinica Si raccomanda di non superare la dose giornaliera di 80 mg. CILOSTAZOLO - Associazioni CILOSTAZOLO - ANTICOAGULANTI In uno studio clinico con dose singola assenza di inibizione del metabolismo della warfarina o effetti sui parametri della coagulazione. Tuttavia, è necessaria cautela in pazienti trattati contemporaneamente con cilostazolo e agenti anticoagulanti, rendendo necessario un monitoraggio frequente per ridurre la possibilità di emorragie. CILOSTAZOLO – STUDI CLINICI • Trial multicentrico randomizzato • DURATA: 24 SETTIMANE • 516 pts trattati con placebo, Cilostazolo 50 mg bid o Cilostazolo 100 mg bid Maximal Walking Distance Ciilostazolo100 mg bid (n=140) Cilostazolo 50 mg bid (n=139) Placebo (n=140) 26.8 Pain-free walking distance Ciilostazolo100 mg bid (n=140) Cilostazolo 50 mg bid (n=139) Placebo (n=140) Velocità =3.2 kmph 67.3 129.1 23.1 48.6 Velocità =3.2 kmph 67.5 12.5 12. 5 6.0 METs 0 Distanza in metri 6.0 METs 0 Distanza in metri Arch. Intern Med. 1999; 159: 2041-2050 CILOSTAZOLO – STUDI CLINICI Dawson DL et al. Am J Med 2000;109:523-30 CILOSTAZOLO – STUDI CLINICI Dawson DL et al. Am J Med 2000;109:523-30 CILOSTAZOLO – STUDI CLINICI Regensteiner JG et al. J Am Geriatr Soc 2002 CILOSTAZOLO – STUDI CLINICI Regensteiner JG et al. J Am Geriatr Soc 2002 CILOSTAZOLO – STUDI CLINICI Am J Cardiol 2002; 90, 1314-1319 CILOSTAZOLO – STUDI CLINICI Maximal Walking Distance * P < 0.05 Pain-free walking distance * P < 0.05 Am J Cardiol 2002; 90, 1314-1319 CILOSTAZOLO – STUDI CLINICI TVR: target vessel revascularization MACE: major adverse cardiovascular events CILOSTAZOLO – Profilo lipidico Effetto mediato da interazione con: lipoprotein-lipasi colesteril-ester-transferasi (CETP) CILOSTAZOLO – Profilo di sicurezza J Vasc Surg 2008;47: 330-336 CILOSTAZOLO – Effetti indesiderati Drop out <3% J Vasc Surg 2008;47: 330-336 PENTOSSIFILLINA Approvato dalla F.D.A. nel 1984 Meccanismo d’azione: riduce la viscosità ematica, migliora la flessibilità eritrocitaria e riduce l’aggregazione piastrinica Migliora il trasporto ossigeno ai tessuti di Ma… EFFETTI Risultati degli studi clinici contrastanti. In definitiva: Pentossifillina causa un aumento solo marginale dell’autonomia di marcia rispetto al placebo TASC II J Vasc Surg 2007 ALTRI FARMACI PER LA CLAUDICATIO Farmaci antiaggreganti: studi datati ne hanno documentato lieve beneficio anche nell’autonomia di marcia. Vengono però utilizzati per la loro capacità di contrastare la progressione di malattia, perché per l’efficacia come farmaci sintomatici sono stati superati. Buflomedil (Loftyl) ha azione vasodilatatrice → buoni risultati in trials terapeutici, ma mancano studi a lungo termine, randomizzati, controllati con placebo, doppio cieco Naftidrofuryl (Praxilene) antagonista serotonina → riduce aggregazione piastrinica, azione vasodilatatrice e miglioramento del metabolismo aerobico. buoni risultati in trials terapeutici, ma mancano studi a lungo termine, randomizzati, controllati con placebo, doppio cieco Proprionil-carnitina (Dromos) aumenta il metabolismo ossidativo muscolare, buoni risultati in trials terapeutici, ma mancano studi a lungo termine, randomizzati, controllati con placebo, doppio cieco Fattori di crescita angiogenetici: buone premesse fisiopatologiche per la stimolazione di sviluppo di nuovi vasi, ma per ora scarsi risultati Arginina, prostaglandine, vitamina E e terapia chelante con EDTA non si sono dimostrati efficaci nel ridurre la claudicatio intermittens Sostanze naturali (es. Ginkgo biloba) in fase di studio TERAPIA DELLA CLAUDICATIO FARMACI PER LA CLAUDICATIO CHEST 2008 TRATTAMENTO DELL’ISCHEMIA CRITICA CRONICA Trattamento dell’ischemia critica Cura delle lesioni ischemiche locali Indagini strumentali per identificare le lesioni aterosclerotiche responsabili del quadro emodinamico Valutazione cardiovascolare pre-intervento Farmaci: anti-aggreganti, anticoagulanti, prostanoidi e.v., agenti reologici Rivascolarizzazione (chirurgica o endovascolare) Trattamento dell’ischemia critica Principali prostanoidi impiegati • PGI1 (Prostaciclina naturale): Epoprostenolo • PGE2 (Prostaglandina): Alprostadil • Analogo stabile della PGI1 : Iloprost Trattamento dell’ischemia critica ILOPROST Profili farmacologici • • • • • • emivita più lunga maggiore biodisponibilità assenza di effetti metabolici nel passaggio polmonare maggiore costanza di risposta non controindicazione negli epatopatici e nei nefropatici equivalenza di efficacia per la somministrazione e.v. o i.a. Meccanismi d’azione • • • • • • • • inibizione dell’aggregazione, dell’adesione e della reazione di rilascio piastrinico dilatazione delle arteriole e delle venule aumento della densità capillare e diminuzione della permeabilità del microcircolo attivazione della fibrinolisi inibizione dell’adesione e della migrazione dei globuli bianchi mononucleati dopo lesione endoteliale riduzione del rilascio dei radicali liberi dell’ossigeno Effetto citoprotettivo per riduzione della lipoperossidazione e riduzione dei livelli ematici di catepsina D Effetto reologico con riduzione della viscosità ematica Trattamento dell’ischemia critica Prostanoidi: dosaggi • ILOPROST (PGI2): 0.5-2 ng/kg/min per infusione di 6 ore, per 4 settimane, 1 ciclo all’anno – Schemi alternativi: • 0.5-1.5 ng/kg/min in infusione e.v con pompa peristaltica 2 volte al giorno per 6 ore, per 2 settimane • 0.5 -1.5 ng/kg/min in infusione e.v, con pompa peristaltica, per 16 ore al giorno, per 1 settimana (0.05 mg in 6 ore) • 0.05-0.1 mg/24 ore in siringa elastomerica per 1 settimana, più cicli all’anno • ALPROSTADIL (PGE1): 40-60 mg per infusione di 2 ore, due volte al giorno, per 3 settimane, 4 cicli all’anno • Vie di somministrazione in fase di studio: – orale – inalatoria Trattamento dell’ischemia critica Prostanoidi: effetti collaterali • • • • Flushing, cefalea, nausea, vomito arrossamento e dolore lungo il decorso della vena sede di infusione ipotensione arteriosa, tachicardia sensibilizzazione allergica Prostanoidi: interazioni farmacologiche • Interazioni con altri farmaci a livello di legame con le proteine plasmatiche assenti • possibile effetto additivo su farmaci antiipertensivi (beta-bloccanti, calcio-antagonisti, ACE-inibitori) • possibile effetto additivo con farmaci vasodilatatori Trattamento dell’ischemia critica Prostanoidi: risultati Dati clinici • • • • • • Guarigione o significativo miglioramento delle lesioni trofiche scomparsa o netta riduzione del dolore ischemico a riposo regressione allo stadio IIb aumento dell’autonomia di marcia in pazienti in stadio IIb miglioramento della qualità della vita riduzione della mortalità e delle amputazioni maggiori nei 6 mesi successivi al trattamento Dati strumentali Miglioramento dei seguenti parametri: • Indice pressorio caviglia-braccio • parametri ecografici • parametri pletismografici • treadmil test CHEST 2008 Indicazioni alla rivascolarizzazione (endovascolare o chirurgica) Severità dei sintomi → dolore a riposo incoercibile Severa limitazione funzionale Inefficacia della terapia medica Mancata guarigione di ulcera ischemica Lesioni ulcerative complicate da sepsi Assenza di severe comorbidità Favorevole rapporto rischio/beneficio Localizzazione e lesioni eleggibili rivascolarizzazione tipologia per la Indagini strumentali addizionali TRATTAMENTO DELL’ISCHEMIA ACUTA Trattamento dell’ischemia acuta Indagini strumentali urgenti per identificare livello e causa dell’occlusione Valutazione cardiovascolare pre-intervento urgente Rivascolarizzazione urgente (chirurgica o endovascolare) Trombolisi intraarteriosa è indicata nelle categorie Rutherford I e IIa con durata inferiore a 14 giorni (Livello di evidenza A) Trombectomia meccanica può essere utlizzata come terapia aggiuntiva (Livello di evidenza B) Trombolisi intraarteriosa o trombectomia possono essere considerati nella categoria Rutherford IIb con durata maggiore di 14 giorni (Livello di evidenza B) Grazie per l’attenzione!
Scarica