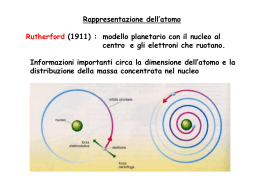
La “crisi” della Fisica Classica Alcune situazioni sperimentali in cui la Fisica “Classica" fallisce: Effetto fotoelettrico Linee spettrali atomiche Radiazione di corpo nero Proprietà ondulatorie degli elettroni Le risposte della meccanica quantistica: Energia del fotone Impulso del fotone Lunghezza d’onda di una particella Principio di indeterminazione Funzione d’onda Equazione di Schrödinger 1 – LA RADIAZIONE DI CORPO NERO “Radiazione di Corpo Nero” o di "cavità” si riferisce ad un oggetto che assorbe tutta la radiazione incidente su di esso e ri-irraggia energia che è caratteristica del suo solo sistema irraggiante, e non dipende dal tipo di radiazione incidente. L’energia irradiata può essere considerata come prodotta da onde stazionarie, o modi risonanti,della cavità che irraggia fuori. Esempio di corpo nero emittente è la fornace in cui l’ energia entra da un piccolo foro e viene assorbita dalle pareti della fornace che si riscaldano ed emettono radiazione La radiazione di Corpo Nero La teoria dell’elettromagnetismo di Maxwell consente di calcolare la quantità di radiazione emessa al variare della frequenza considerando I diversi modi in cui è possibile ubicare un’onda elettromagnetica entro la cavità . Nella seconda figura da sinistra si vedono 4 modi diversi: 2 λ , 3/2 λ , λ , λ /2 … Corpo nero modi di radiazione La quantità di radiazione emessa in una certa banda di frequenze dovrebbe essere proporzionale al numero di modi in quella banda. Secondo la Fisica Classica tutti i modi hanno la stessa probabilità di essere prodotti, ed il numero di modi possibili nella cavità cresce con il quadrato della frequenza. Tuttavia, la continua crescita di energia emessa con la frequenza (denominata "ultraviolet catastrophe") non avviene. La Natura è più saggia ! La nascita della Meccanica Quantistica L’espressione quantistica della energia media per modo si ottiene partendo dalla ipotesi di Planck: tutta la radiazione elettromagnetica è quantizzata e l’emissione avviene per “quanti di energia”, che chiamiamo fotoni. Il quanto di energia di un fotone è dato dal prodotto della costante di Planck h per la sua frequenza. Questa quantizzazione implica che un fotone di luce, di data frequenza e lunghezza d’onda, ha una energia quantistica fissata. Per esempio, un fotone di luce blu, che ha una lunghezza d’onda di 450 nm, avrà sempre una energia di 2.76 eV. Tutta la luce blu è formata da fotoni di questa energia, e trasporta energia in multipli di 2.76 eV. Non si può avere un mezzo fotone blu. Energia massima e minima, Meccanica Quantistica e Meccanica Classica La frequenza disponibile è continua, senza limiti superiori o inferiori; quindi non vi alcuna restrizione circa la possibile energia di un fotone. Per quanto riguarda le energie alte, un limite pratico è semplicemente dovuto alla difficoltà di trovare meccanismi per la creazione di fotoni ad altissima energia. I fotoni di bassa energia invece abbondano; tuttavia, quando si scende sotto il limite delle frequenze radio, le energie dei fotoni sono così piccole, confrontate con le energie termiche a temperatura ambiente, che non si potranno mai isolare come singole entità quantizzate. Si perdono semplicemente nella energia di fondo presente. In altre parole, nel limite di basse frequenze la trattazione della radiazione elettromagnetica si fonde con la descrizione classica ed una trattazione quantistica non è più necessaria. 2000 K 1750 K 1500 K 1250 K l (mm) 2 – L’EFFETTO FOTOELETTRICO Gli aspetti incomprensibili dell’effetto fotoelettrico quando si incominciò ad osservarlo erano: 1. La luce rossa non provoca emissione di elettroni, qualunque sia la sua intensità! 2. Una debole luce violetta causa l’emissione di pochi elettroni, ma la loro energia cinetica è maggiore di quella ottenuta con luce più intensa di frequenza minore! Le caratteristiche dell’effetto fotoelttrico erano in netta contraddizione con le predizioni della Fisica Classica. La spiegazione dell’effetto segnò uno dei passi fondamentali verso la Teoria dei Quanti. 3. Gli elettroni vengono emessi immediatamente - nessun ritardo! 4. Un aumento della intensità della luce causa un aumento del numero di fotoelettroni, ma non della loro energia cinetica! L’effetto fotoelettrico L’analisi dei dati dell’effetto fotoelettrico mostrò che l’energia degli elettroni emessi era proporzionale alla frequenza della luce incidente. Ciò mostrava che qualunque “cosa” estraesse gli elettroni dal metallo aveva un’energia proporzionale alla frequenza della luce. Il fatto sorprendente che l’energia dei singoli elettroni fosse indipendente dalla energia totale della luce incidente (cioè l’intensità), mostrava che l’interazione della luce con il metallo deve essere come quella di una singola particella che cede la sua energia all’elettrone. Ciò è consistente con l’ipotesi di Planck, da lui applicata al problema della radiazione del Corpo Nero, secondo cui la luce è formata da quanti discreti (fotoni), ciascuno con energia: hν Sul collettore appariranno fotoelettroni se l’energia dei fotoni è maggiore del lavoro di estrazione qVo , e cioè se i fotoni hanno una frequenza ν > νo frequenza di soglia. Lestrazione qVo E hν hvo Se i fotoni hanno una frequenza maggiore di quella di soglia, l’energia cinetica massima degli elettroni che colpiscono il collettore, in base al principio di conservazione dell’energia, sarà data dalla relazione : Ec h h I fenomeni luminosi più comuni possono essere spiegati e descritti mediante la natura ondulatoria della luce. Invece, l’effetto fotoelettrico suggerisce una natura corpuscolare della luce. 3- IL PROBLEMA DEGLI SPETTRI ATOMICI Negli anni alla fine del 1800, si osservò che la luce emessa da gas luminosi non mostrava una distribuzione continua di lunghezze d’onda, ma formava un insieme discreto di colori, diversi per i vari gas. Helium spectrum Queste "linee spettrali" si disponevano in una serie regolare e si giungerà ad interpretarle come transizioni tra livelli atomici di energia. Allora, rappresentavano un grosso problema per la Fisica Classica. Si sapeva che particelle cariche accelerate emettono onde elettromagnetiche, e ci si aspettava che orbite di elettroni intorno ai nuclei fossero instabili, in quanto, a causa della perdita di energia elettromagnetica emessa, sarebbero stati attratti dal nucleo. Non si poteva trovare alcun modello classico che portasse ad orbite stabili degli elettroni. Il modello atomico di Bohr segnò il passo fondamentale verso una moderna teoria atomica. Il punto fondamentale fu il postulato che il momento angolare è quantizzato, permettendo di ottenere solo specifici livelli di energia. Hydrogen spectrum 1 1 n , n interi RH 2 2 1 2 l n1 n2 (n1 n2 ) 1 RH, costante di Rydberg = 1.097 10–7 m–1 Atomo di idrogeno La spiegazione dello spettro dell’atomo di H è riposta nel modello atomico di Bohr con le orbite elettroniche quantizzate: emissione/n= assorbimento n=4 assorbimento n=3 13.6 eV n=2 Balmer (V) instabile elettrone 12.8 eV 12.1 eV 10.2 eV Lyman (UV) n=1 nucleo stabile Spettro emissione dell’idrogeno Linee spettrali nel visibile dell’Elio Linee spettrali nel visibile del Neon Linee spettrali nel visibile del mercurio l = 435.835 nm (blu), 546.074 nm (verde), 576.959 nm e 579.065 nm (giallo-arancio). 4 - L’ esperienza di Rutherford • • • • • • Nel 1907 non c’era ancora la tecnologia necessaria a creare proiettili dell’energia necessaria, ma Rutherford usa ciò di cui dispone: i decadimenti di sostanze radioattive. Nel famoso esperimento da lui diretto, le particelle alfa (nuclei di atomi di elio, emessi da una sorgente radioattiva) vengono dirette contro una sottile lamina d’oro. Con un cristallo scintillante è possibile osservare le particelle alfa deviate dal fascio, a diversi angoli da esso. Se gli atomi sono formati da un “panettone” carico positivamente in cui alloggiano gli elettroni, le pesanti particelle alfa dovrebbero attraversare la lamina quasi indeflessi . Invece, i suoi assistenti Geiger e Marsden scoprono che in rari casi le particelle alfa subiscono deflessioni a grande angolo, alcune addirittura rimbalzando indietro! Nasce il modello atomico planetario di Rutherford! 5 - IL MODELLO ATOMICO DI BOHR Nel modello di Bohr, la conservazione dell’energia viene combinata con la quantizzazione del momento angolare, per ottenere un’espressione dei livelli quantizzati di energia. F=ma=v²/r = Felettrica T = mv²/2 La quantizzazione del momento angolare Secondo il modello di Bohr le orbite degli elettroni atttorno al nucleo sono stazionarie, contrariamente a quanto affermato dalla teoria elettromagnetica, secondo quest’ultima l’elettrone in moto accelerato attorno al nucleo (moto circolare), perde energia per irraggiamento. La condizione di stazionarietà delle orbite elttroniche Bohr la ricava dal seguente ragionamento:la lunghezza d’onda associata all’elettrone è data dalla relazione: l h h p mv (Relazione di De Broglie) a cui si unisce la condizione di stazionarietà: lunghezza della circonferenza = numero intero di lunghezze d’onda : 2 r nl Queste due condizioni si combinano per dare l’espressione quantizzata del momento angolare per l’elettrone in orbita: L mvr hr l hr nh n 2 r n 2 Quindi L non solo è conservato (non dipende dal tempo), ma è costretto ad assumere valori discreti, multipli di h/2π secondo il numero quantico n. Questa quantizzazione del momento angolare è un risultato fondamentale e può essere usato per determinare I raggi e le energie delle orbite di Bohr. Combinando l’espressione dell’energia totale con la quantizzazione del momento angolare, Bohr fornisce le espressioni per i raggi e le energie delle orbite degli elettroni: energia cinetica dell’elettrone espressa in funzione del momento angolare uso della condizione di quantizzazione energia cinetica orbitale Dove r è il raggio dell’orbita elettronica attorno al nucleo e Z il numero dei protoni da queste espressioni si ricava: 13.6 eV 2 Z 2 n a0 = 0.529 10–10 m = raggio di Bohr Con n = 1,2,3,… l’espressione di E ci da i diversi livelli energetici Livelli di energia dell’atomo di idrogeno I livelli di energia dell’atomo di idrogeno sono in accordo con quelli del modello di Bohr. La descrizione usuale è quella di una struttura ad orbite (o gusci), con ogni orbita associata ad uno dei valori del numero quantico principale n. La descrizione dell’atomo tramite le orbite del modello di Bohr è una utile visualizzazione; non bisogna tuttavia dimenticare che, come risulterà dalla Meccanica Quantistica, i concetti di orbita e raggio orbitale saranno sostituiti da concetti quali la distribuzione di probabilità di posizione. Il modello di Bohr prevede che gli elettroni occupino una delle possibili orbite quantizzate, senza emissione di onde elettromagnetiche. L’emissione avviene quando l’elettrone passa da un’orbita all’altra; in questa transizione avviene l’emissione di un fotone di energia pari alla differenza di energia tra le due orbite. h E2 E1 Dall’espressione dei livelli quantizzati di energia si ha 1 me4 1 1 1 h 2 13.6 2 2 eV 2 2 2 8 0 h n1 n2 n1 n2 Questa relazione può essere scritta come h con hc l me4 RH 2 8 0 ch3 RH 1.097 107 m1 Spiegazione dello spettro dell’atomo di H col modello atomico di Bohr: Spettro di H: I limiti del modello di Bohr Anche se il modello di Bohr rappresentò un passo avanti fondamentale verso la costruzione della teoria quantistica degli atomi, non rappresenta in realtà la corretta descrizione teorica della natura delle orbite elettroniche. Le sue principali lacune sono: 1. Non permette di capire perché certe linee spettrali sono più luminose di altre. Non vi è alcun meccanismo che permetta di calcolare la probabilità di transizione tra livelli atomici. 2. Il modello di Bohr considera gli elettroni come pianeti in miniatura, in rotazione intorno al nucleo con un ben preciso raggio ed impulso. Questo viola il principio di indeterminazione, secondo cui posizione ed impulso non possono essere esattamente determinati contemporaneamente. 3. Il modello di Bohr non fornisce previsioni corrette per gli atomi con molti elettroni. Il modello di Bohr ci fornisce un modello concettualmente semplice e fondamentale delle orbite e delle energie degli elettroni atomici. I dettagli dello spettro e della distribuzione di cariche sono ottenibili solo dai calcoli della Meccanica Quantistica e dell’equazione di Schrödinger.. 6 LA NATURA ONDULATORIA DELL’ELETTRONE Giovane studente a Parigi, Louis DeBroglie aveva appreso la relatività e l’effetto fotoelettrico. Quest’ultimo evidenziava la natura corpuscolare della luce, da sempre considerata un fenomeno ondulatorio. Egli si chiese se gli elettroni ed altre "particelle" potessero a loro volta esibire proprietà ondulatorie. Questo condurrà ad una nuova teoria. La conferma dell’ipotesi di DeBroglie arrivò grazie all’esperimento di Davisson- Germer. Esso mostrò figure di interferenza – in accordo con la lunghezza d’onda di DeBroglie – per l’urto di elettroni su cristalli di nickel. LA DIFFRAZIONE CON ELETTRONI Quando i raggi X sono deflessi dal reticolo cristallino, si osservano picchi di intensità finale corrispondenti alla condizione di Bragg, secondo cui si hanno massimi quando la differenza di cammino di due raggi è uguale ad un multiplo intero della lunghezza d’onda. Da tale formula, conoscendo d e misurando theta, si ricava lambda. Davisson e Germer utilizzando un fascio di elettroni su cristalli di nichel, ottennero queste figure di interferenza. Variando il potenziale di accelerazione si modificava la quantità di moto degli elettroni. La misura della lunghezza d’onda degli elettroni era in accordo con l’ipotesi di D.Broglie. L’esperimento di DavissonGermer dimostrò che anche gli elettroni presentano fenomeni ondulatori, in accordo con la lunghezza d’onda di DeBroglie: lunghezza d’onda di un elettrone di quantità di moto p La lunghezza d’onda di DeBroglie 7 . DUALISMO ONDA PARTICELLA La luce consiste di particelle o di onde? La risposta dipende dai tipi di fenomeni che si osservano: Fenomeno Può essere spiegato in termini di onde Può essere spiegato in termini di particelle Riflessione Rifrazione Interferenza Diffrazione Polarizzazione Effetto fotoelettrico Compton scattering I più comuni fenomeni luminosi osservati possono essere spiegati come fenomeni ondulatori; l’effetto fotoelettrico e lo scattering Compton suggerirono una natura particellare per la luce. Lo stesso dualismo onda-particella fu osservato anche per gli elettroni ! 8 – IL PRINCIPIO DI INDETERMINAZIONE La dualità onda-particella e la relazione di De Broglie aiutano a comprendere tale principio. Man mano che si scende verso dimensioni atomiche, non è più valido considerare una particella come una sfera rigida, perché più piccole sono le dimensioni e più “ondosa” essa diviene. Non ha più senso dire che si conoscono precisamente la posizione e l’impulso di tale particella, infatti nel momento che andiamo a misurare la quantità di moto della particella, interagendo con un fotone, la sua traiettoria è cambiata... L’incertezza della quantità di moto dell’elettrone lungo l’asse x sarà: q x qsen ' h l sen ' Per effetto della diffrazione sarà impossibile ubicare esattamente l’elettrone entro la larghezza dell’oculare, l’incertezza della sua posizione x sarà data dalla larghezza della frangia centrale dell’immagine di diffrazione attraverso una fenditura : x Quindi il prodotto dell’incertezza sulla quantità di moto per l’incertezza sulla posizione sarà allora: q x x h l sen ' l sen ' h l sen ' Il principio di indeterminazione In generale : la posizione e l’impulso p (quantità di moto) di una particella non possono essere misurati simultaneamente con precisione arbitraria. Il prodotto delle incertezze delle due misure ha un minimo. Lo stesso principio vale per la misura contemporanea di energia e tempo. Questo principio non riguarda il limite proprio degli strumenti di misura, o limiti derivanti dalla accuratezza dei metodi sperimentali. Deriva dalle proprietà ondulatorie intrinseche alla descrizione quantistica della natura. Anche con strumenti e tecniche perfetti, questa incertezza rimane, intrinseca alla natura delle cose. In base al principio di indeterminazione un singolo elettrone può essere rivisto come pacchetto d’onda localizzato in un Δx: Le incertezze di Δx e Δp sono date dalla relazione : x p 2 Calcolo della energia di particelle confinate in un atomo o in un nucleo E’ l’energia tipica degli elettroni nelle orbite atomiche E’ l’energia tipica dei protoni o neutroni nel nucleo, ed anche l’energia trasportata dalle particelle alfa quando sono emesse da un nucleo radioattivo. 9 - La funzione d’onda Le proprietà della funzione d’onda : contiene tutte le informazioni fisiche |Ψ(x)|2=Ψ(x)Ψ(x)* sempre positiva se la particella esiste, la probabilità totale di trovarla è 1 : * dV 1 è continua (insieme alla sua derivata) permette il calcolo del valore medio di qualunque grandezza fisica misurabile. Ψ(x) è sia positiva che negativa Ogni particella è rappresentata da una funzione d’onda Ψ (x,t) tale che Ψ Ψ* è la densità di probabilità di trovare la particella nel punto x al tempo t. La funzione d’onda è soluzione dell’equazione di Schrödinger. Questa equazione gioca lo stesso ruolo della legge di Newton e della conservazione dell’energia nella Meccanica Classica, cioè predice il comportamento futuro di un sistema dinamico. 10 - I POSTULATI DELLA MECCANICA QUANTISTICA A - Il postulato della Funzione d’Onda: Associata ad ogni particella che si muove in un campo di forze conservative vi è una funzione d’onda, la quale determina tutte le informazioni ottenibili sul sistema. •Ad ogni sistema fisico formato da una particella è associata una funzione d’onda. • Questa funzione d’onda permette di ottenere tutte le informazioni possibili sul sistema. La funzione d’onda è descritta da variabili complesse. • Un numero complesso può essere scritto nella forma a+ib oppure a-ib con a,b reali e i=√-1, a+ib e a-ib sono numeri complessi coniugati ed il loro prodotto fa a²+b². •Il prodotto della funzione ψ con la sua funzione complessa coniugata ψ*specifica la vera probabilità fisica di trovare la particella in un certo stato. ( x, t ) È solo una funzione matematica priva di un immediato significato fisico ( x, t ) ( x, t ) * E’ la densità di probabilità di trovare la particella nel punto di coordinata x , all’istante t Probabilità in Meccanica Quantistica La vera probabilità di trovare la particella è data dal prodotto della funzione d’onda (che può essere un numero complesso) con il suo complesso coniugato; il risultato è sempre un numero reale . Poiché la probabilità totale di trovare la particella da qualche parte deve essere = 1, la funzione d’onda deve essere normalizzata. Cioè la somma delle probabilità, estesa a tutto lo spazio, deve essere 1. Ciò si esprime tramite l’integrale: dV 1 dV dx dy dz Volume infinitesimo * La richiesta di avere funzioni d’onda normalizzabili svolge un ruolo molto importante nella ricerca delle soluzioni dell’equazione di Schrödinger. Ad esempio, si può trovare che solo certi valori dell’energia permettono di ottenere soluzioni normalizzabili. Una particella libera e l’equazione di Schrödinger L’equazione di Schrödinger non può essere dedotta; la sua validità viene dal confronto con i dati sperimentali. La naura ondulatoria di un elettrone è chiaramente confermata da esperimenti come quello di Davisson-Germer. Ciò fa sorgere la domanda: “Cosa è questa natura ondulatoria?". La risposta, a posteriori, è che questa natura ondulatoria si manifesta attraverso la funzione d’onda dell’elettrone. La soluzione dell’equazione di Schrödinger per una particella libera è un’onda piana, la quale contiene la relazione di deBroglie per l’impulso e di Planck per l’energia. h 2 Le funzioni d’onda •Il principio di indeterminazione dice: λ = h / mv •l’energia cinetica: E = ½ m v² ed mv=√ 2mE λ = h / √ 2mE • quanti modi per sistemare un’onda nella scatola? Risposta : nλ/2 = L • sostiutendo nell’ultima eq. rossa λ si ha: ½ n h √ 2mE = L ed elevando al quadrato si ricava l’energia E : E L n=4 2λ n=3 3λ/ 2 En = n² ( h² / 8 m L² ) cioè: 1. E n 2 E n 1 2. 1/ 2 2 L n ( x) sin n x L 2 ( x) n=2 λ n=1 λ/ 2 Probabilità di trovare la particella ai diversi valori di x: Calcolo dei livelli energetici degli elettroni confinati in una buca di potenziale ∞ U(x) 0 x0 0x L x L ∞ x 0 x L U 0 En L x eV eV L=1 Å 800 8 600 6 400 4 E 2 E1 112eV 200 l(1.12eV ) 12398 1.12 c hc E l(112eV ) E 8mL2 n2 E 2 E1 1.12eV 2 6.62 1034 3 108 h2 L=10 Å Å 11000Å 1.1 mm l (x) 0 12398 E (eV ) Å 12398 112 Å 110Å B - Operatori in Meccanica Quantistica : Principio di corrispondenza Associato ad ogni grandezza misurabile di un sistema fisico vi è un operatore quantistico. In Meccanica Quantistica si descrivono i sistemi fisici mediante onde (la funzione d’onda), piuttosto che tramite particelle il cui moto e la cui dinamica possono essere descritti con precisione dalle equazioni deterministiche della Fisica di Newton. Questi operatori possono essere rappresentati in vari modi. Alcuni sono elencati qui di sotto:. In questa rappresentazione (detta di Schrödinger) degli operatori, le posizioni e le loro funzioni non cambiano, mentre gli impulsi diventano derivate rispetto alla posizione. L’operatore dell’energia (Hamiltoniano) contiene derivate rispetto allo spazio ed al tempo. C - L’ EQUAZIONE DI SCHRODINGER L’energia cinetica e potenziale sono trasformate nell’operatore Hamiltoniano, che agisce sulla funzione d’onda per generarne l’evoluzione nello spazio e nel tempo. L’equazione di Schrödinger dà l’energia quantizzata del sistema (i possibili valori di E) e la forma della funzione d’onda, a partire dalla quale altre proprietà fisiche possono essere calcolate. Equazione di Schrödinger Per una particella che si muove lungo la dimensione x, con energia E e con potenziale V(x) l’equazione di Schrodinger sarà: h d (x) 2 V (x) (x) E (x) 2 8 m dx 2 Erwin Rudolf Josef Alexander Schrödinger Vienna 12 Agosto 1887 – Vienna 4 Gennaio 1961 Nobel per la Fisica 1933 2 (x) è la funzione d’onda che descrive la particella ed è la soluzione di questa equazione differenziale. 11. Il Principio di Complementarità Vediamo ora come la meccanica quantistica ha superato il dualismo onda particella nato dalla relazione di De Broglie … quindi entriamo nella discussione sul principio di COMPLEMENTARITA’ Riflessione Rifrazione Interferenza Diffrazione Polarizzazione Effetto fotoelettrico Compton scattering ESPERIMENTO DELLA DOPPIA FENDITURA : PROIETTILI I proiettili arrivano sempre a blocchi, identici e distinti – COMPORTAMENTO CORPUSCOLARE N12 = N1 + N2 Non si ha interferenza ESPERIMENTO DELLA DOPPIA FENDITURA: ONDE D’ACQUA L’ intensità può assumere qualsiasi valore; non possiede una struttura a “blocchi” – COMPORTAMENTO ONDULATORIO I12 I1 + I2 Si ha interferenza MATEMATICA DELL’ INTERFERENZA Interferenza costruttiva I1 = |ψ1|2 I12 = |ψ1 + , ψ2|2 Interferenza distruttiva I2 = |ψ2|2 = |ψ1|2 + |ψ2|2 + 2 |ψ1| |ψ2| cos q ESPERIMENTO della DOPPIA FENDITURA con ELETTRONI Gli elettroni arrivano sempre in granuli, tutti identici tra loro P12 P1 + P2 P1 1 2 Si ha interferenza P2 P12 OSSERVAZIONE degli elettroni attraverso una SINGOLA FENDITURA 1 2 Gli elettroni osservati risultano essere passati o dal foro 1 oppure dal foro 2 P12 = P1 + P2 Non si ha interferenza P12 E’ possibile stabilire con esattezza da quale fenditura siano passati? “E’ impossibile ideare un esperimento in grado di determinare da quale foro sia passato l’elettrone che allo stesso tempo non perturbi l’elettrone sufficientemente da distruggere l’interferenza” PRINCIPIO DI INDETERMINAZIONE di HEISENBERG x p 2 SIMULAZIONE della DIFFUSIONE di ELETTRONI attraverso DUE FENDITURE La figura di interferenza si forma lentamente, man mano che, uno per volta, gli elettroni si accumulano sullo schermo. 500 elettroni (simul.) 1500 elettroni (simul.) 2500 elettroni (simul.) Non si può affermare che ciascun elettrone passa o nella fenditura in alto o in quella in basso. Quando anche l’altra fenditura è aperta, essa influenza in modo complicato la distribuzione risultante sullo schermo: alcuni punti (ad esempio al centro) ricevono molti più elettroni a causa dell’interferenza costruttiva; altri punti, per interferenza distruttiva, ne ricevono meno. PRINCIPIO DI COMPLEMENTARITÀ: In ogni esperimento una particella manifesta o proprietà corpuscolari oppure ondulatorie, e ciascun comportamento esclude l’altro. L’interferenza (natura ondulatoria) si manifesta ogni volta che i due eventi sono possibili e indistinguibili. Essa scompare (si manifesta la natura corpuscolare) non appena diventa possibile, anche solo in principio, distinguere i due eventi. Il principio di complementarità è compatibile chiaramente col PRINCIPIO DI INDETERMINAZIONE: Non si può misurare nello stesso momento con arbitraria precisione la posizione e la quantità di moto di una particella : xp 2 Infatti la luce “misura” la posizione dell’elettrone con una incertezza ∆x ≈ l lunghezza d’onda della radiazione usata. Tale localizzazione produce una incertezza nel momento ∆px = h/l. l grande: non si distingue dove passa l’elettrone, ma ∆px è piccola e non distrugge la figura d’interferenza (predomina il comportamento ondulatorio); l piccola: la posizione dell’elettrone è determinata con alta precisione, ma esso acquista una grande quantità di moto trasversale e di conseguenza la figura di interferenza è distrutta (predomina il comportamento corpuscolare). 12 - L’atomo di idrogeno La soluzione dell’equazione di Schrödinger per l’atomo di idrogeno si ottiene più facilmente usando coordinate polari sferiche e separando le variabili, così che la funzione d’onda è rappresentata dal prodotto: La separazione conduce a tre equazioni separate per le tre variabili spaziali, e le loro soluzioni portano ai tre numeri quantici associati con i livelli di energia dell’atomo di idrogeno. I numeri quantici per l’atomo di idrogeno La soluzione dell’equazione di Schrödinger per l’atomo di idrogeno richiede di imporre la condizione che le funzioni d’onda siano normalizzabili. Queste soluzioni, per le tre funzioni separate delle tre variabili, possono esistere soltanto se certe costanti che appaiono nelle equazioni assumono valori interi. Ciò porta ai numeri quantici dell’atomo di idrogeno: H nlm En nlm En 13.6 eV 2 n n = principal quantum number L2 nlm l (l 1) 2 nlm l = orbital quantum number Lz nlm ml nlm ml = magnetic quantum number Il modello vettoriale per il momento angolare orbitale Il momento angolare orbitale per un elettrone atomico può essere visualizzato mediante un modello vettoriale, nel quale il vettore momento angolare effettua un moto di precessione intorno ad una direzione fissa nello spazio. Mentre la lunghezza del vettore ha il valore indicato, solamente un massimo di l unità of ħ può essere misurato lungo una certa direzione, dove l è il numero quantico orbitale. Anche se lo si definisce "vettore", il momento angolare orbitale in Meccanica Quantistica è un tipo speciale di vettore; infatti la sua proiezione lungo una direzione nello spazio è quantizzata, con valori che differiscono di una unità ħ. Il diagramma mostra che i possibili valori del “numero quantico magnetico" ml (for l =2), sono ml 2, 1, 0, 1, 2 Lo spin dell’elettrone Lo spin di un elettrone, s = 1/2, è una proprietà intrinseca degli elettroni. In aggiunta al momento angolare orbitale gli elettroni posseggono un momento angolare intrinseco, caratterizzato dal numero quantico 1/2. In analogia al momento angolare orbitale, si ha: s = ½ “spin su” s = – ½ “spin giù” I due stati di spin, “su" e “giù“, permettono di avere due elettroni per ogni insieme degli altri numeri quantici Pertanto i numeri quantici divengono 4 : n, l , ml , s 13 - Il Principio di Esclusione di Pauli Due elettroni in un atomo non possono avere gli stessi numeri quantici. Questo è un esempio di un principio generale che si applica non solo agli elettroni, ma anche a tutte le altre particelle di spin semi-intero (fermioni). Non si applica alle particelle di spin intero (bosoni). Quindi 2 elettroni possono avere stessi numeri quantici n,l,ml, ma diverso spin! L’ esperimento di Stern-Gerlach ha verificato il principio di Pauli: fascio di particelle con “spin” 1/2 sorgente “calda” Fn Per ciascuna particella del fascio la componente del momento angolare lungo una qualsiasi direzione assume solo due valori : s / 2 s / 2 Funzione d’onda di Scroedinger La probabilita’ di trovare una particella in una piccola porzione di volume e’ proporzionale al quadrato del modulo della funzione d’onda Orbitali Atomici Orbitale 2s dell’ idrogeno Lez. 7 51 Orbitali Rappresentazione tridimensionale delle distribuzioni di probabilità per gli orbitali s p d Riempimento degli orbitali • • • • • • H He Li Be B C 1s 1s2 1s2 1s2 1s2 1s2 2s 2s2 2s2 2s2 2px 2px2 14 - La Tabella Periodica degli Elementi I numeri quantici associati agli elettroni atomici, insieme al principio di esclusione di Pauli, forniscono le proprietà fondamentali per la costruzione delle strutture atomiche e la comprensione della Tabella Periodica degli Elementi. Per un dato numero quantico principale n, vi sono 2n2 diversi stati possibili (con la stessa energia). L’ordine di occupazione dei livelli di energia atomici da parte degli elettroni avviene a partire da quelli di energia pù bassa, e prosegue consistentemente con il principio di Pauli. L’indicazione dei livelli segue lo schema della notazione spettroscopica. Tavola periodica degli elementi Proprietà degli Atomi Energia di ionizzazione Lez. 7 56 Proprietà degli Atomi Elettronegativita' degli elementi : I II III IV V VI VII Be B C N O F H 2,20 Li 0,97 1,47 2,01 2,50 3,07 3,50 4,10 0.94 1,46 2,01 2,63 2,33 3,17 3,91 Na Al Mg Si P S Cl 1.01 1,23 1,47 1,74 2,06 2,44 2,83 0,93 1,32 1,81 2,44 181 2,41 3,00 Dai livelli discreti alle bande Metalli isolanti Semiconduttori
Scarica