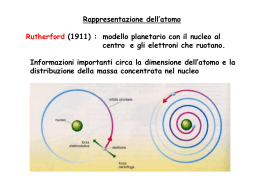
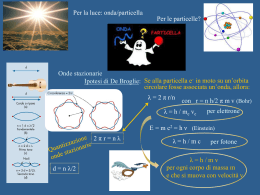
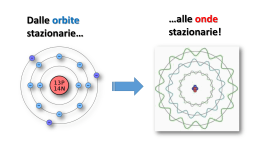
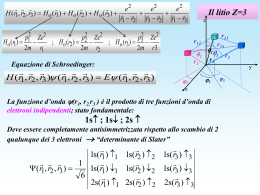
La teoria quantistica 1. Fisica quantistica 2.2 Proprietà ondulatorie della materia Nella natura della luce esiste una dualità: si presenta come onda (interferenza) o come particella (fotoni) a seconda delle condizioni sperimentali. Dualità onda particella della materia (De Broglie, 1923-24): A ogni particella materiale con quantità di moto p deve essere associata un’onda di lunghezza d’onda (detta di De Broglie) tale che h p Effetto microscopico, trascurabile per oggetti macroscopici Ingloba la relazione di Planck E = hf e giustifica la quantizzazione delle orbite atomiche: all’elettrone deve essere associata un’onda stazionaria, ossia la lunghezza dell’orbita deve essere multipla della dell’elettrone Verifica sperimentale: diffrazione degli elettroni (esperimento di Davisson e Germer). 2.3 Principio di indeterminazione L’osservazione e la misurazione del moto di un oggetto microscopico (elettrone), perturba il moto stesso. Il concetto di traiettoria di un elettrone non ha più senso. Principio di indeterminazione: Se un corpo si muove lungo una retta, non è possibile misurare contemporaneamente con precisione grande quanto si vuole sia la sua posizione x che la sua quantità di moto p x p h 2 Quanto più piccolo è x (più accurata la misura di x), tanto più grande è p (più imprecisa è la misura di p) e viceversa. 2.3 Principio di indeterminazione Vale per tutti i corpi, sia macroscopici sia microscopici: nel primo caso è irrilevante, nel secondo é rilevante, a causa della piccolezza del valore della costante di Planck h. I limiti nella misura sono insiti nella struttura stessa della materia e non sono eliminabili con miglioramenti degli apparati e delle tecniche di misura. Seconda forma del principio di indeterminazione: la precisione intrinseca E con la quale è possibile conoscere l’energia di un sistema ha un limite inferiore determinato dalla durata t della misurazione E t h 2 2.4 Le onde di probabilità Fisica quantistica: ciò che vibra in un’onda di materia è l’ampiezza di probabilità, : funzione delle coordinate x, y, z e del tempo t, che serve per calcolare la probabilità che la particella considerata si trovi nel volume V di spazio nell’intervallo di tempo t. La probabilità è proporzionale al quadrato di . Nei punti in cui oscilla (pacchetto d’onda), la probabilità di trovarvi la particella è diversa da zero. L’ampiezza di probabilità (non più la traiettoria) delle particelle di un sistema si ottiene risolvendo l’equazione di Schrödinger In realtà, si tratta di onde o di corpuscoli? Non è possibile rispondere: dipende dal tipo di misura che su di esse si esegue. 2.5-6 Orbitali atomici La stabilità degli atomi è dovuta a una situazione di equilibrio: la forza di Coulomb tende ad attirare gli elettroni atomici che irraggiando cadrebbero sul nucleo, ma il principio di indeterminazione impedisce loro di andare troppo vicino al nucleo. Non vi sono elettroni che “girano” intorno al nucleo (orbite), ma “nuvole” di probabilità (orbitali) stazionarie, cioè la probabilità di trovare un elettrone a una certa distanza dal nucleo non cambia nel tempo. Gli elettroni atomici emettono (e assorbono) fotoni solo quando l’ampiezza di probabilità di trovare l’elettrone muta improvvisamente Quando un sistema quantizzato passa da un livello energetico più alto a uno più basso, emette anche un fotone che ha energia E fissata (pari alla differenza di energia tra i due stati) e, quindi, frequenza f = E/h fissata.
Scarica