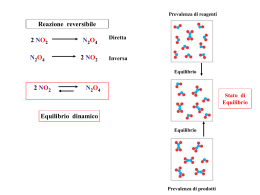
Cinetica chimica Aspetto cinetico e termodinamico di una reazione DG° e Keq ci dicono se una reazione avviene spontaneamente. È indispensabile però sapere anche quanto impiega una reazione a raggiungere il proprio stato di equilibrio. Spontaneità e velocità non hanno nessuna correlazione tra loro. es N2 + 3H2 2NH3 Kc= 5·108 dice che i reagenti si sono completamente trasformati in prodotti, ma nella realtà non è così e questa reazione non è sfruttabile per produrre ammoniaca es C + O2 CO2 Keq=2·1069 la costante di equilibrio dice che la reazione è spostata a dx, ma….. per sapere se una reazione avviene o no si deve conoscere sia la posizione dell’equilibrio che il tempo necessario a raggiungerlo una reazione può avere Keq elevata ed essere lentissima oppure Keq piccola ed essere veloce Velocità media e velocità istantanea durante una reazione chimica la concentrazione di tutte le specie varia in funzione del tempo il concetto di velocità sarà tradotto in termini di variazione di concentrazione in un intervallo di tempo di una qualunque specie che compone il sistema chimico v = s/t ds v = ____ dt velocità media velocità istantanea supponendo quindi di seguire l’andamento della concentrazione di un prodotto di reazione vedremo che la sua concentrazione nel tempo aumenterà, tuttavia questo incremento non è lo stesso in tempi successivi, ma varia durante tutto il tempo in cui avviene la trasformazione cioè la velocità della reazione (definita come variazione della concentrazione in un intervallo di t) varia mentre procede la reazione Velocità di reazione A aA + bB cC + dD C vreazione = 1 ______ d[A] - ___ = 1 ______ d[C] ___ a c dt dt = 1 ______ d[B] - ___ b = dt 1 ______ d[D] ___ d dt = Cinetica chimica. Andamento nel tempo (a sinistra) delle concentrazioni del reagente e dei prodotti, per il processo di dissociazione di N2O4 . Andamento (a destra) delle velocità di trasformazione delle due specie La velocità delle reazioni varia entro limiti estremamente ampi. Sono in genere veloci le reazioni di combustione, una volta innescate, come anche le reazioni di precipitazione di composti insolubili e quelle acido-base. Altre, come le reazioni con reagenti solidi, possono essere molto lente (lo è ad esempio il processo di arrugginimento). Vi è inoltre una forte dipendenza della velocità dallo stato di suddivisione dei solidi. Infine, la velocità dipende dalla concentrazione dei reagenti, come già detto, ed è fortemente influenzata dalla temperatura e dall’eventuale presenza di catalizzatori. Il ferro si arrugginisce lentamente, ma se è molto finemente suddiviso può combinarsi velocemente con O2, se la reazione è innescata. Carbonato di calcio finemente suddiviso (a sin.) reagisce rapidamente con HCl diluito. Un pezzo di marmo (sempre CaCO3, a destra) reagisce anch’esso, ma più lentamente. Legge cinetica della reazione data una reazione aA + bB cC La velocità di una reazione dipende dalla concentrazione dei reagenti secondo: vreazione = k [A]x[B]y k costante cinetica della reazione: è la velocità iniziale della reazione a 25°C con i reagenti con conc.1 M x ordine della reazione rispetto al componente A y ordine della reazione rispetto al componente B x+y ordine complessivo della reazione x e y sono costanti che vanno determinate sperimentalmente per ogni reazione Ordine di reazione • ordine 0 • 1° ordine v=k v = k[A] • 2° ordine v = k[A]2 v = k[A][B] v = k[A]3 v = k[A]2[B] v = k[A][B]2 v = k[A][B][C] • 3° ordine oppure oppure oppure oppure Ordine di reazione In generale le costanti x e y non coincidono con i coefficienti stechiometrici. H2 + Br2 2HBr vreazione = k [H2][Br2]1/2 ordine complessivo di reazione è 3/2 Relazione di Arrhenius Esprime la dipendenza di k dalla temperatura: k = A e-E/RT R costante dei gas T temperatura assoluta E energia di attivazione A fattore di frequenza sono parametri costanti caratteristici di ogni reazione dato che la velocità di una reazione dipende dalla concentrazione dei reagenti e dalla T per confrontare velocità di reazioni diverse si fa riferimento a K: è caratteristica di ogni reazione ed è legate al meccanismo di reazione Meccanismo delle reazioni È il modo dettagliato a livello molecolare con cui i reagenti si combinano per dare i prodotti e determina la velocità di reazione. In generale una reazione avviene attraverso uno o più passaggi intermedi detti processi elementari, che ne descrivono il meccanismo. il meccanismo con cui una reazione avviene determina la velocità della reazione I processi elementari H2 + Br2 2HBr Questa reazione avviene attraverso una serie di processi elementari: Br2 2Br 2Br Br2 Br + H2 HBr + H stadio lento H+ Br2 HBr + Br La velocità di reazione complessiva non può essere maggiore di quella dello stadio più lento. L’ordine di un processo elementare può essere dedotto dalla stechiometria. vreazione = k’ [H2][Br] La concentrazione di Br non può però essere dedotta sperimentalmente, quindi va espressa in funzione di quella di Br2. Keq = [Br]2/[Br2] [Br] = Keq1/2 [Br2]1/2 vreazione = k’Keq1/2 [H2][Br2]1/2 = k [H2][Br2]1/2 Corrisponde all’espressione ottenuta sperimentalmente. Velocità della reazione diretta e inversa e Keq Se una reazione avviene in un singolo processo elementare, l’equilibrio è raggiunto quando la velocità della reazione diretta è uguale a quella della reazione inversa. NO2 + CO NO + CO2 k1 [NO2][CO] = k-1[NO][CO2] k1/ k-1 = [NO][CO2]/ [NO2][CO]= Keq In generale, per reazioni che avvengono attraverso più processi elementari, i singoli processi devono essere all’equilibrio e quindi: Keq = (k1 k2 k3 …)/ (k-1k-2 k-3 …) L’energia di attivazione Modello teorico: teoria delle collisioni Per poter reagire due particelle devono collidere tra loro. Condizione necessaria ma non sufficiente. Si avrà reazione solo se le particelle collidenti possiedono una energia maggiore di un valore minimo detto energia di attivazione. In questo caso si parla di urto efficace. energia di attivazione supponiamo di avere NO2 + CO NO + CO2 e di calcolare la variazione di Epot in funzione delle particelle interagenti. Quando le due molecole si avvicinano ho inizialmente una lieve diminuzione di Epot a causa di deboli legami di Van der Waals: avvicinando ancora le molecole l’Epot subisce un drastico aumento in corrispondenza dello stadio intermedio di reazione in cui il legame N-O dell’NO2 inizia ad indebolirsi e si forma un debole legame dell’ossigeno con il CO. in questa situazione ho il max di energia potenziale e la disposizione degli atomi è definita complesso attivato. Dato che sia R che P hanno Epot < del complesso attivato la reazione può andare avanti o tornare indietro orientazione favorevole orientazione sfavorevole Dipendenza dell’energia potenziale dalla coordinata di reazione Epot L’energia di attivazione si riferisce al percorso più favorevole della reazione, indicato dalla coordinata di reazione. Coordinata di reazione Rappresenta il percorso che va dai reagenti ai prodotti, lungo il quale l’energia di attivazione è minima. Il percorso comprende rottura e formazione di legami chimici determinando il meccanismo di reazione in termini di processi elementari. Coordinata di reazione Il percorso indicato in rosso collega il minimo energetico corrispondente ai reagenti con quello dei prodotti attraverso il punto di sella rappresentato dallo stato di transizione. Stato di transizione Punto di sella = massimo di energia lungo la coordinata di reazione, ma minimo di energia lungo le altre direzioni. Intermedi Intermedio = specie chimica capace di esistenza reale ed autonoma. Ea>, per cui stadio lento La forma della curva di Ep è quella tratteggiata, in cui i due massimi corrispondono alla formazione di due complessi attivati (o stati di transizione TS), mentre il minimo tra essi corrisponde alla formazione dell’intermedio, che ha E< dei complessi attivati ma > dei reagenti e prodotti. Se determinati reagenti possono dar luogo a più tipi di prodotti, sono favoriti quei prodotti (C anzichè D) la cui formazione è accompagnata da una energia di attivazione più bassa. Come si può aumentare la velocità di una reazione termodinamicamente permessa ma che procede lentamente? abbiamo visto che la velocità di una reazione dipende dal suo stadio più lento e quindi dalla particolare Eattivazione associata a quel processo Un aumento di T fa sempre aumentare la velocità di reazione. Ma esistono limitazioni pratiche. Inoltre, se la reazione è esotermica l’aumento di T fa spostare l’equilibrio a sinistra. quindi devo far seguire alla reazione un percorso diverso e che implichi una Eattivazione< Catalizzatore = sostanza che fa aumentare la velocità di raggiungimento dell’equilibrio facendo percorrere alla reazione un percorso diverso da quello che sarebbe spontaneo e che implichi una energia di attivazione minore. L’uso di catalizzatori non comporta variazioni termodinamiche allo stato di equilibrio. Catalisi Il catalizzatore si ritrova inalterato alla fine della reazione. Catalisi omogenea, eterogenea, ed enzimatica • Catalisi eterogenea quando il catalizzatore è in una fase diversa da reagenti e prodotti (es. solido per reazioni gassose). • Catalisi omogenea quando il catalizzatore è nella stessa fase di reagenti e prodotti. • Catalisi enzimatica quando il catalizzatore è una proteina, che in questo caso viene detta enzima. Reazioni di ordine 0 v=k -d[A]/dt = k [A] = [A]0 – kt t1/2 = [A]0/(2k) Equazione di una retta con pendenza –k e intercetta [A]0 Reazioni di ordine 1 A prodotti v = k [A] cioè -d[A]/dt = k [A] e quindi -d[A]/ [A] = k dt Equazione di una retta con pendenza –k e intercetta ln[A]0 [A] = [A]0 e– kt ln[A] = ln[A]0 – kt t1/2 = 0,693/k caratteristica delle reazioni i primo ordine è che il tempo in cui la concentrazione iniziale si dimezza è una costante per ogni reazione, indipendentemente dal valore iniziale Reazioni di ordine 2 A+B prodotti v = k [A]2 -d[A]/dt = k [A] 2 1/[A] = 1/[A]0 + kt t1/2 = 1/(k [A]0) Equazione di una retta con pendenza +k e intercetta 1/[A]0 tempo di dimezzamento un applicazione importante del tempo di dimezzamento è la datazione di reperti archeologici analizzando [146C] il decadimento di questo isotopo è una reazione del primo ordine, quindi il tempo di dimezzamento è costante quando l’organismo è vivente scambia continuamente O2 e CO2 con l’ambiente e il suo livello di 14C rimane costante. Al momento della morte questa attività cessa e il livello di 14C diminuisce progressivamente; misurando questa quantità possiamo risalire a quanto tempo fa morto. Se ad esempio si trova che la [14C] è metà di quella presente negli organismi viventi, allora è morto 5570 anni fa
Scarica