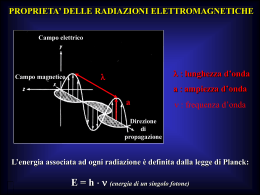
BIOTECNOLOGIE utilizzo di organismi viventi o loro derivati allo scopo di produrre quantità commerciali di prodotti utili migliorare le caratteristiche di piante ed animali Tecniche biochimiche TECNICHE OTTICHE o SPETTROSCOPICHE Il passaggio della luce o di radiazioni elettromagnetiche attraverso Una sostanza Informazioni qualitative Informazioni quantitative INTERAZIONE tra una radiazione elettromagnetica e la MATERIA FENOMENO QUANTICO Le radiazioni sono onde elettromagnetiche che viaggiano alla velocità di 3x108 m/sec. Sono caratterizzate da una componente elettrica ed una magnetica perpendicolari fra loro e che vibrano in una infinità di piani PARAMETRI CHE LE CARATTERIZZANO l = lunghezza d’onda: distanza tra due stessi punti dell’onda elettromagnetica (si misura in METRI) T = periodo d’onda: intervallo di tempo in cui avviene una oscillazione completa (si misura in SECONDI) n = frequenza: numero di oscillazioni compiute nell’unità di tempo (si misura in Hertz; 1 Hz = 1 ciclo/sec) RAPPRESENTAZIONE DI UNA RADIAZIONE ELETTROMAGNETICA E = energia o intensità di una radiazione elettromagnetica detta: l FOTONE o QUANTO DI LUCE T La lunghezza d’onda ( l ) di una radiazione elettromagnetica e la sua frequenza ( n ) sono grandezze tra loro inversamente proporzionali: ln=C C = rappresenta la velocità di propagazione nel vuoto Il suo valore è di circa 3 x 108 m/sec. Per una qualsiasi radiazione è necessario conoscere solo uno dei due parametri per poter ricavare anche l’altro. E=n l Radiazioni a bassa lunghezza d’onda e ad elevata frequenza: elevata Elevata lunghezza d’onda ed bassa frequenza: bassa energia energia Spettro delle radiazioni elettromagnetiche Lunghezza d’onda Nome radiazione Å (10 -8cm) Raggi gamma 10-3 – 10-1 Raggi X 10-1 – 10 Ultravioletto (UV) 10 – 350 Visibile 350 - 800 Infrarosso 800 -10- 4 Onde hertziane 10- 4 – 1010 Lunghezza d’onda Lunghezza d’onda SPETTRO DELLE RADIAZIONI ELETTROMAGNETICHE Nella regione del VISIBILE: radiazioni che possono essere percepite dall’occhio umano Radiazioni a bassa lunghezza d’onda e ad elevata frequenza: elevata energia Elevata lunghezza d’onda ed bassa frequenza: bassa energia Come avviene l’interazione tra le radiazioni elettromagnetiche e la materia ? Il fenomeno può essere spiegato sulla base della teoria quantistica della materia Gli elettroni presenti in un orbitale atomico o molecolare si distribuiscono secondo unità discrete di energia o quanti L’energia associata al passaggio dallo stato fondamentale Eo a quello eccitato avviene solo se è di una particolare frequenza o lunghezza d’onda E eccitato DE = frequenza Eo fondamentale SI VERIFICANO TRANSIZIONI ELETTRONICHE associabili ALLE DIVERSE RADIAZIONI ELETTROMAGNETICHE La spettroscopia atomica o molecolare in seguito a transizioni che si verificano a livello atomico e molecolare Considera l’energia delle radiazioni elettromagnetiche che viene assorbita: SPETTROSCOPIA DI ASSORBIMENTO Oppure quella parte dell’energia delle radiazioni elettromagnetiche che viene emessa: SPETTROSCOPIA DI EMISSIONE Sulla base delle diverse radiazioni elettromagnetiche avremo: · spettroscopia rotazionale (onde radio) · spettroscopia vibrazionale (infrarosso) spettroscopia molecolare elettronica (visibile e ultravioletto) · spettroscopia atomica (raggi X) LA TECNICA SPETTROSCOPICA CONSENTE AI CHIMICI DI OTTENERE INFORMAZIONI QUALI-QUANTITATIVE Le tecniche spettroscopiche sono basate sullo scambio di energia che si verifica fra l’energia radiante e la materia SPETTROFOTOMETRIA DI ASSORBIMENTO assorbimento delle radiazioni luminose della regione dello spettro elettromagnetico appartenenti al campo del visibile (350 – 700 nm) e del vicino ultravioletto (200 – 350 nm) L’assorbimento di questi tipi di radiazioni da parte delle molecole è in grado di produrre delle transizioni energetiche degli elettroni esterni della molecole Quando una radiazione elettromagnetica attraversa una sostanza, provocherà una transizione elettronica e la radiazione emergente dalla sostanza avrà una intensità Inferiore (SPETTROSCOPIA DI ASSORBIMENTO ) I0 = Intensità radiazione incidente IR = “ “ riflessa IA = “ “ assorbita IT = “ “ trasmessa I0 = IR + IA + IT LA LEGGE DI LAMBERT-BEER It / I0 = 10 -ecl Nelle soluzioni: I0 = IA + It IL SOLUTO è responsabile dell’assorbimento l = il cammino ottico (cm) c = concentrazione molare del soluto e = coefficiente di estinsione molare, costante caratteristica di ogni soluto ma il log I0 / It = E = e c l E=ecl E = Densità ottica o ASSORBANZA è direttamente proporzionale alla concentrazione del soluto che sta assorbendo la luce e = coefficiente di estinsione molare Rappresenta quella densità ottica di una soluzione in cui la concentrazione = 1 (C = 1) ed il cammino ottico è unitario (l = 1) It / I0 = 10 -ecl E=ecl La legge di Lambert-Beer consente di calcolare facilmente la concentrazione di una soluzione dalla misura dell’intensità della radiazione trasmessa It quando è nota l’intensità della luce incidente I0 , e ed il cammino ottico T = TRASMISSIONE PERCENTUALE T = 100 It I0 T=1 T=0 sostanza trasparente E = 0 sostanza opaca E = 8 Log T = 2 - log I0 / It Log T = 2 - E E = 2 - Log T T varia da 0 a 100 E varia da + a 0 E = 2 – log T 8 Componenti schematici di una apparecchiatura per analisi spettroscopica S = Sorgente di radiazioni (lampada) M = Monocromatore LP = Radiazione policromatica LMI = Rad. Monocromatica incidente LME = Rad. Monocromatica emergente C = Contenitore campione (cuvetta) SP = Specchio R = Rivelatore Spettrofotometri UV-VISIBILE, i tipi più comuni sono il “monoraggio” e il “doppio raggio”: 1) SORGENTE DI RADIAZIONE 2) SELEZIONATORE DI LUNGHEZZE D’ONDA O MONOCROMATORE 3) CELLA 4) RIVELATORE 5) LETTORE Sorgenti di radiazioni per spettroscopia nel visibile ed ultravioletto (spettroscopia molecolare elettronica) · Ad incandescenza ( compresa tra 350 800 nm) adatte solo per il visibile · Ad idrogeno ( compresa tra 200 400 nm) adatte solo per ultravioletto Lampada al Tungsteno + deuterio Il monocromatore è il sistema ottico usato per disperdere la luce policromatica in bande monocromatiche, che vengono inviate in successione sul campione. Essi sono basati su un ELEMENTO DISPERDENTE (prisma o reticolo), che separano le varie componenti della radiazione e ne permettono la successiva selezione della banda desiderata. Consistono nel far incidere il fascio policromatico su un oggetto (un prisma o un reticolo) in grado di deviare le diverse radiazioni con diversi angoli: la radiazione uscente sarà quella che passa attraverso la fenditura di uscita. MONOCROMATORI separa la luce policromatica in bande monocromatiche, che vengono inviate in successione sul campione. A prisma A reticolo CUVETTE Sono i contenitori dei campioni da analizzare Cammino ottico calibrato (1 cm) Volume diverso Materiale diverso in dipendenza della lunghezza d’onda Quarzo per UV e visibile Vetro solo per il visibile Durante questi esperimenti vengono utilizzate cuvette in quarzo,in quanto questo materiale permette alla luce bianca di oltrepassare senza alcun cambiamento. PORTACUVETTE dove inserire il campione Sono dispositivi capaci di produrre un segnale elettrico che dipende dall'energia delle radiazioni ricevuta. Tale segnale elettrico (proporzionale all'intensità luminosa) viene poi trasferito a un indicatore RILEVATORI Sistemi capaci di determinare l’intensità di una radiazione trasformando un segnale luminoso in energia elettrica Fotocella (o fototubo) Effetto fotoelettrico Fotomoltiplicatori Effetto fotoelettrico amplificato Rivelatori a serie di diodi Elettronici, fanno anche lo spettro delle radiazioni di cui determinano l’intensità. Tramite un convertitore analogico digitale è possibile così ottenere i risultati dell’analisi direttamente su un personal computer che ne elabora i dati. Il segnale proveniente dal rivelatore viene opportunamente amplificato e un amperometro ne rileva l’intensità. Il lettore converte quindi il segnale elettrico in un valore numerico proporzionale all’intensità del segnale, e questo valore va da 0 a 100. Ponendo pari a 100 il valore del segnale in assenza del campione, otteniamo la trasmittanza e da questa l’assorbanza. ASSORBANZA L’assorbanza è il logaritmo negativo della trasmittanza A = 2 - log(T) A = ecl Secondo la legge di Lambert – Beer l’assorbanza A è proporzionale alla concentrazione della sostanza assorbente, per cui più elevata è la concentrazione delle molecole che passano dallo stato fondamentale a quello eccitato, maggiore sarà l’assorbanza Esistono diversi tipi di spettrofotometro, a seconda di come sono organizzate le varie componenti: ♥ SPETTROFOTOMETRI MONORAGGIO ♥ SPETTROFOTOMETRI A DOPPIO RAGGIO Gli SPETTROFOTOMETRI MONORAGGIO, sono usati prevalentemente in analisi quantitativa e non sono comodi per ottenere spettri di assorbimento La difficoltà sta nel fatto che per ogni misura, si deve ripetere l'azzeramento contro il bianco, oppure registrare prima lo spettro del bianco, poi lo spettro del campione ed infine sottrarre al secondo il primo. Negli SPETTROFOTOMETRI A DOPPIO RAGGIO si ha invece un sistema che invia due raggi, identici per frequenza e intensità, uno attraverso il campione e l'altro attraverso il bianco, per cui si ha un confronto continuo tra l'assorbanza del campione e quella del bianco. Grazie a queste caratteristiche è possibile effettuare misure direttamente senza ripetere azzeramenti, e soprattutto registrare continuativamente lo spettro di assorbimento. SCHEMA DI UNO STRUMENTO A SINGOLO RAGGIO IL MONOCROMATORE è un PRISMA o un RETICOLO DI DIFFRAZIONE 1) Si mette nella cuvetta il solvente e si misura l’Intensità. 2) Si lava la cuvetta. 3) Si mette la soluzione e si misura l’intensità. 4) Si fa il rapporto fra le due Intensità Converte l’Intensità della radiazione in Intensità di corrente SCHEMA DI UNO STRUMENTO A DOPPIO RAGGIO Il bianco (o riferimento) è costituito dal solvente ad eccezione della sostanza di cui si vuol esaminare l’assorbimento La radiazione proveniente dal MONOCROMATORE si divide in due raggi che sono inviati contemporaneamente al campione ed al solvente. Il secondo raggio passa attraverso il campione e fuoriesce con l’Intensità trasmessa Icampione Il computer registra entrambe in modo alterno e calcola il rapporto. FOTOMETRIA I valori di T sono convertiti in E o assorbanza (A) Per risalire dai valori di E alla concentrazione della soluzione in esame : Noto il coefficiente di estinsione molare Noto il cammino ottico Si allestisce una CURVA STANDARD di una soluzione a concentrazione nota Assorbanza 280nm Conoscendo il valore dell’assorbanza del campione si può Interpolare graficamente il valore della sua concentrazione 1,25 1,00 . 0,75 0,50 0,25 0’5 1,0 1,5 2,0 2,5 Concentrazione albumina mg Lo studio delle radiazioni assorbite da una sostanza (SPETTRO DI ASSORBIMENTO) può essere utilizza A SCOPO ANALITICO Il colore delle sostanze è dovuto al fatto che esse assorbono specifiche radiazioni e ne lasciano passare o riflettono altre SOSTANZA COLORATA: assorbe solo alcune radiazioni che costituiscono la luce bianca e lascia passare tutte le altre SOSTANZA INCOLORE: non assorbe nessuna radiazione che costituisce la luce bianca ma assorbe radiazioni a lunghezza d’onda comprese nell’ultravioletto o nell’infrarosso Il massimo dell’assorbimento dipende dai gruppi funzionali presenti nelle molecole ed identifica LO SPETTRO DI ASSORBIMENTO ASSORBIMENTO DELLA LUCE ULTRAVIOLETTA DA PARTE DEGLI Aa AROMATICI Il triptofano e la tirosina Assorbono la luce ultravioletta, ciò spiega perché la maggior parte delle proteine hanno un caratteristico assorbimento della luce ad una lunghezza d’onda di 280nm Spettri di di assorbimento della luce da parte dei comuni nucleotidi, gli spettri sono quasi identici, per effettuare misure di assorbimento viene usata la luce a 260 nm I citocromi possono essere distinti in base agli spettri diassorbimento della luce LUNGHEZZA D’ONDA Applicazioni METODI DIRETTI Sfruttano le proprietà ottiche delle molecole analizzate PROTEINE = 280 nm ACIDI NUCLEICI = 260 nm METODI INDIRETTI Amminoacidi = ninidrina (570nm) Proteine = biureto (540) Zuccheri = proprietà riducenti Enzimi = substrati o prodotti Metodi enzimatici indiretti Reazioni enzimatiche accoppiate in cui il prodotto viene utilizzato come substrato in un’altra reazione nella quale è coinvolta una sostanza cromofora Glucosio ossidasi Glucosio + O2 + H2 O = ac. Gluconico + H2 O2 perossidasi H2 O2 + sost. Ridotta (incolore) Glucosio + ATP = = sost. colorata Glucosio-6-fosfato + ADP Glucosio-6-fosfato + NADP = 6-fosfogluconato + NADPH La riduzione dell’anello nicotinamidico produce una nuova banda di assorbimento della luce con un massimo a 340 nm FLUORIMETRIA Tecnica ottica quantitativa e qualitativa Una molecola assorbe una radiazione elettromagnetica Si produce uno stato eccitato instabile nel ritornare allo stato basale EMETTE ENERGIA A LUNGHEZZA D’ONDA MAGGIORE L’energia della radiazione emessa è sempre inferiore a quella assorbita, pertanto avrà una frequenza inferiore e lunghezza d’onda superiore SPETTROFLUORIMETRIA Tecnica ottica di analisi qualitativa e quantitativa basata sul fenomeno della fluorescenza. La fluorescenza è un fenomeno di emissione di una radiazione elettro-magnetica che si verifica in seguito ad una transizione elettronica da uno stato energetico superiore ad uno inferiore. Affinché possa avvenire è necessario che una molecola si trovi in uno stato eccitato. L’energia della radiazione emessa è sempre inferiore a quella assorbita, pertanto avrà una frequenza inferiore e lunghezza d’onda superiore. RAPPRESENTAZIONE SCHEMATICA DI UNO SPETTROFLUORIMETRO APPLICAZIONI · Metodi diretti Sfruttano la fluorescenza intrinseca delle molecole da analizzare Proteine 300-350 nm Gruppi prostetici (400 600 nm) · Metodi indiretti Sfruttano le proprietà di sostanze che diventano fluorescenti in seguito alla loro interazione con le sostanze da analizzare. Cloruro di dansile (DNS) · Acido 1-anilinonaftalen-8-solfonico (ANS) · Etidio bromuro (EB) Slide 40 BIOTECNOLOGIE utilizzo di organismi viventi o loro derivati allo scopo di produrre quantità commerciali di prodotti utili migliorare le caratteristiche di piante ed animali Ingegneria genetica: tecniche che consentono di modificare il patrimonio genetico di organismi in modo da trasferire da un essere vivente ad un altro caratteristiche utili
Scarica