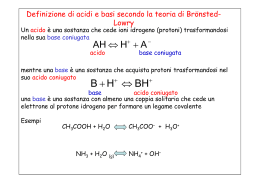
Lezione 11 La funzione pH Si definisce p un operatore matematico tale per cui pX = -log10X (X è solitamente una concentrazione molare). Si definiscono di conseguenza pH e pOH come: pH = -log10[H+] o più correttamente pH = -log10[H3O+] pOH = -log10 [OH‾] Il pH (dal latino pondus hydrogenii, peso dell'idrogeno) è una scala di misura dell'acidità di una soluzione acquosa. Fu ideato dal chimico danese Søren Sørensen nel 1909. Come già visto, a 25°C nel caso di acqua pura o di una qualsiasi soluzione ideale neutra: Kw = 1,0·10-14 [H3O+] = [OH‾] = 1,0·10-7 pH = pOH =7. Si definisce quanto segue per una soluzione acquosa a 25°C: pH < 7 soluzione acida pH = 7 soluzione neutra pH > 7 soluzione basica In ogni caso è sempre pH + pOH = 14 2H2O(aq) H3O+(aq) + OH‾(aq) A qualunque temperatura e per ogni tipo di soluzione acquosa Kw = [H3O+] ·[OH‾] [H3O+] = [OH‾] A 25°C: pH + pOH = pKw Kw = 1,0·10-14 [H3O+] = [OH‾] = 1,0·10-7 pH = pOH = 7 pH + pOH = pKw = 14 La reazione di dissociazione dell’acqua è endotermica per cui: se T aumenta dissociazione aumenta Kw aumenta pH di soluzione neutra < 7! Nota: in alcuni casi pH < 0 o pH > 14 La concentrazione di [H3O+] in un campione di vino è 2,0·10-4 M. Calcolare il pH e [OH‾] del vino. Il pH di una urina umana normale si trova tra 5,5 e 6,5. Calcolare l’intervallo di concentrazione di H3O+ e OH‾. L’aceto commerciale è una soluzione acquosa al 6% in peso di acido acetico. Se la densità dell’aceto è 1,1 g/cm3, calcolare il volume di una soluzione 2 M di idrossido di sodio necessario per neutralizzare 100 ml di aceto. Determinare il pH di una soluzione acquosa ottenuta unendo 200 ml di KOH 0,15 M con 500 cm3 di HCl 0,4 M in 1,3 litri di acqua. 3,70; 5,0·10-11 M 3·10-7 M < [H3O+] < 3·10-6 M; 3·10-9 M < [OH‾] < 3·10-8 M 55 ml 1,1 Forza degli acidi monoprotici e Ka Gli acidi sono classificati come forti o deboli a seconda che siano totalmente o parzialmente ionizzati in soluzione. La ionizzazione di un generico acido (“HA”) in soluzione acquosa può essere scritta come: HA(aq) + H2O(l) H3O+(aq) + A‾(aq) Ovvero, (più concisamente): HA(aq) H+(aq) + A‾(aq) Ove A‾ è la base coniugata di HA. La costante di equilibrio in questo caso non viene indicata con Kc ma con Ka e viene chiamata costante di ionizzazione acida. [ H 3O ] [ A ] Ka [ HA] Ovvero: Nel caso ad esempio di HCN [ H ] [ A ] Ka [ HA] [ H 3O ] [CN ] Ka [ HCN ] Nota: si definisce un acido forte se Ka > 1, debole se Ka < 1 Forza degli acidi poliprotici Gli acidi poliprotici possiedono una Ka specifica per ogni grado di dissociazione. Ad esempio nel caso di H3PO4: H3PO4 + H2O H2PO4‾ + H3O+ Ka1 = 7,5·10-3 H2PO4‾ + H2O HPO42‾ + H3O+ Ka2 = 6,0·10-8 HPO42‾ + H2O PO43‾ + H3O+ Ka3 = 4,4·10-13 Ove Ka1 = costante di dissociazione primaria Ka2 = costante di dissociazione secondaria… In genere è Ka1 >> Ka2 >> Ka3 Nei nostri esercizi qualunque acido poliprotico sarà considerato monoprotico, ovvero sarà considerato Ka2 = Ka3 =…= Kan = 0. È più forte l’acido fluoridrico o il cloridrico? Come lo posso stabilire? HCl Forza delle basi e Kb La forza di una base è inversamente correlata alla forza del suo acido coniugato: più forte è l’acido, più debole è la sua base coniugata e viceversa. Consideriamo ad esempio: H2O(l) + NH3(aq) NH4+(aq) + OH‾(aq) Che fornisce la seguente espressione di equilibrio: [OH ] [ NH 4 ] Kb [ NH 3 ] Kb = costante di ionizzazione basica Poiché vale comunque sempre la relazione: Kw = [H3O+] ·[OH‾] Kb può essere scritta come: K w [ NH 4 ] Kw Kb [ H 3O ] [ NH 3 ] K a Kw = Uguaglianza Ka·Kb sempre valida Ove Ka è la costante di ionizzazione acida dell’acido coniugato: NH4+(aq) + H2O(l) H3O+(aq) + NH3(aq) [ H 3O ] [ NH 3 ] Ka [ NH 4 ] Nota: si definisce una base forte se Kb > 1, debole se Kb < 1 Idrolisi di elettroliti L’idrolisi (dal greco hydro, acqua, e lysis sciogliere) è la scissione di una molecola in due o più parti per effetto di una molecola di acqua. Gli elettroliti subiscono idrolisi originando ioni. Elettrolita forte dissociazione forte (spesso completa) Elettrolita debole dissociazione parziale (nasce equilibrio) All’interno di una soluzione acquosa contenente elettroliti variamente dissociati in ioni, oltre al bilancio di massa e alla neutralità elettrica, devono essere contemporaneamente rispettati tutti gli equilibri di dissociazione che possono venire a formarsi: prodotti di solubilità di possibili sali, prodotto ionico dell’acqua, costanti di ionizzazione acida e basica. Nota: nelle soluzione acquose gli ioni [H3O+] e [OH‾] sono sempre presenti! Se ad esempio considero una soluzione acquosa di acetato di sodio CH3COONa di concentrazione Ms, gli ioni presenti sono: H3O+, OH‾ (dalla dissociazione di H2O), Na+, CH3COO‾. Se le concentrazioni degli ioni sono sufficientemente alte, allora si possono generare le seguenti molecole con la conseguente formazioni dei rispettivi equilibri: H2O, CH3COONa, NaOH, CH3COOH. Gli equilibri che potrebbero formarsi sono pertanto: K w [ H 3O ] [OH ] [ H 3O ] [CH 3COO ] Ka [CH 3COOH ] K ps [ Na ] [CH3COO ] [OH ] [ Na ] Kb [ NaOH ] Essendo in questo caso molto elevati sia Kb (NaOH è una base forte) sia Kps (CH3COONa è un elettrolita forte) occorrerebbero concentrazioni molto elevate degli ioni corrispondenti per far precipitare il sale o la base corrispondente: cosa che non accade per bassi valori di Ms (quali solitamente sono). In questo caso dunque [Na+] = Ms e la formazione di CH3COOH sottrarrà ioni [H+] alla soluzione che diverrà basica. pH di soluzioni saline Le soluzioni di sali possono avere pH neutro, acido o basico a seconda dalla forza degli acidi e delle basi che possono essere considerati i reagenti che hanno generato quel sale. SALE ACIDO FORTE + BASE FORTE soluzione NEUTRA ACIDO FORTE + base debole soluzione ACIDA acido debole + BASE FORTE soluzione BASICA acido debole + base debole non può essere Sono tipici acidi forti HI, HBr, HClO4, HCl, HClO3, H2SO4, HNO3. Sono basi forti tutti gli idrossidi solubili: NaOH, Ca(OH)2, KOH… Prevedere il carattere acido, basico o neutro delle soluzioni acquose dei seguenti sali CaCl2 LiF NH4Cl NaCl NH4NO3 (CH3COO)2Mg KNO2 Relazione tra grado di dissociazione α e costante di ionizzazione acida Ka Sia HA un generico acido debole monoprotico e sia Ca (moli di HA per litro di acqua) la sua concentrazione in acqua. Solitamente si confonde Ca con Ma (moli di HA per litro di soluzione) e questo è tanto più vero quanto minore è Ca. È possibile stabilire una relazione tra Ka, α e Ma, relazione variamente semplificabile in funzione dei valori di Ma e α. Si ricorda che: nd n0 n0 = moli di acido introdotte nd = moli di acido che si dissociano in soluzione E che: HA(aq) + H2O(l) H3O+(aq) + A‾(aq) Ka [ H 3O ]eq [ A ] [ HA]eq Se T = 25°C e n0 è il numero di moli di HA presenti in 1 L di soluzione: HA H+ + A‾ Kw = [H+] ·[OH‾] = 10-14 H+ 10-7 10-7 + nd HA n0 n0 – nd A‾ 0 nd ( [H+] = [H3O+] ) OH‾ 10-7 Kw/[H+]eq 1 1 n0 – α·n0 n0·(1– α) M·(1– α) 10-7 + α·n0 α·n0 α·M α·n0 2 α·n0 3 α·M t=0 equilibrio Kw/[H+]eq Kw/[H+]eq Kw/[α·M ] 2 Se α·n0 >> 10-7 3 n0 = M [ H ]eq [ A ] 4 M M M Ka M (1 ) 1 4 Ka 5 Ka 2 M 5 Se α << 1 2 nd n0 [ HA]eq La costante di prima ionizzazione acida dell’acido solforoso vale 1,54·10-2 mol/L a 25°C. Calcolare la concentrazione molare degli ioni ossidrile in una soluzione 0,4 M di detto acido alla stessa temperatura. Calcolare il grado di dissociazione. Supponendo che 1500 ml di ammoniaca gassosa, misurati in condizioni normali, sciolti in acqua reagiscano completamente con essa, a temperatura e pressione ambiente, e che il volume della fase liquida resti invariato, calcolare il pH della soluzione finale ottenuta sapendo che la Kb della base debole NH4OH vale, a 25°C, 1,8·10-5 mol/L Una soluzione acquosa 0,15 M di un acido debole biprotico è dissociata per il 15%. Qual’è la variazione di pH di tale soluzione, qualora si aggiunga ad essa tanta acqua da aumentarne il volume totale del 20%? Due soluzioni acquose alla stessa temperatura hanno la stessa pressione osmotica. La prima è una soluzione 0,20 M di CuCl2, la seconda una 1,4·10-13 ; soluzione 0,55 M di un acido debole monoprotico. 0,178 Calcolare il grado di dissociazione dell’acido. 12,5 0,08
Scarica