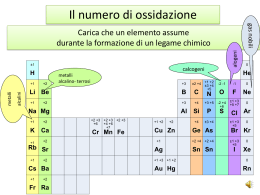
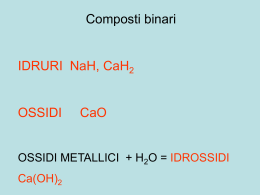
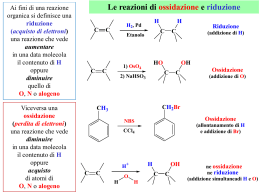
Valenza: Termine obsoleto per indicare il numero di altri elementi che un elemento può legare. Valenza ionica: Termine usato per identificare la carica che uno ione può assumere. Numero di ossidazione Oggi si preferisce parlare di numero o grado di ossidazione. Il numero o grado di ossidazione si può definire come: "La carica che assumerebbe un elemento in un composto, se si attribuissero gli elettroni di legame all'elemento più elettronegativo". La carica che l'elemento "assume", si determina dal confronto con la configurazione elettronica esterna dell'elemento nel suo stato fondamentale Regole per assegnare i numeri di ossidazione Oltre che attraverso la definizione data, i numeri di ossidazione si possono determinare applicando le regole seguenti: 1. Gli elementi allo stato fondamentale hanno numero di ossidazione zero. 2. L'ossigeno nei composti ha sempre numero di ossidazione -2, tranne che nei perossidi (-1), nei superossidi (-1/2) e nell'ossido di fluoro (+2). 3. L'idrogeno nei composti ha sempre numero di ossidazione +1, tranne che negli idruri metallici (-1) 4. Negli ioni monoatomici il numero di ossidazione coincide con la carica (valenza ionica) dello ione. 5. La somma algebrica dei numeri di ossidazione degli elementi di un composto deve risultare pari alla carica del composto. Zero se il composto è una specie neutra. Negli ossidi, l'Ossigeno ha sempre no. di ossidazione -2. Ossidi acidi o anidridi Acidi meta, orto e piro Talvolta può essere necessario distinguere il diverso "grado di idratazione" di un ossiacido, ovvero il diverso contenuto di molecole d'acqua. Tale distinzione si fa mediante i prefissi meta-, orto- e piroSi definisce orto l'acido che contiene il maggior numero possibile di molecole d'acqua. L'acido meta contiene una molecola d'acqua in meno rispetto all'orto. Il termine di (o piro) si usa invece per indicare gli ossiacidi che derivano dalla condensazione di due molecole di un ortoacido. Es. ortoborico (H3BO3), ortosilicico (H4SiO4), ortofosforico (H3PO4), ortoperiodico (H5IO6); metaborico (HBO2), metasilicico (H2SiO3), metafosforico (HPO3)n, acido pirofosforico (H4P2O7); . sali acidi = sali che derivano dalla reazione incompleta di acidi poliprotici con basi forti e che quindi mantengono idrogeni acidi nell'anione Si indica, prima dell'anione, il numero di idrogeni presenti, usando le particelle mono-, di-, tri- etc. Esempi: NaHCO3, idrogenocarbonato di sodio (in alternativa a idrogenocarbonato, si usava una volta il termine bicarbonato); KH2PO4, diidrogenofosfato di potassio; Ca(HSO3)2, idrogenosolfito di calcio. Molti cibi comuni e prodotti per la casa sono acidi. Sali basici = sali contenenti gli ioni OH- o O2Si usano rispettivamente i termini idrossi e ossi. PbOCl2, ossidicloruro di piombo (IV) Soluzioni acquose di alcuni composti che contengono cromo. Sali multipli: I cationi si scrivono in ordine alfabetico e con lo stesso criterio si scrivono gli anioni. Nella nomenclatura, al nome dell'anione si fa seguire l'aggettivo doppio o il numero di anioni presenti
Scarica