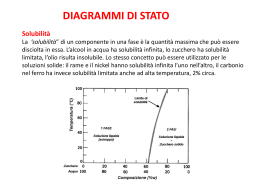
Equilibri di solubilità Solubilità Solubilità = concentrazione della soluzione satura (g/L, g/100 mL, mol/L) s(g / L) = s(mol/L) * PM(g/mole) CaSO4 (s) Ca2+(aq) + SO42-(aq) Elettrolita forte e poco solubile Si ha equilibrio quando è in presenza di sale indisciolto Keq= [Ca2+][SO42-] / [CaSO4] Kps Ξ prodotto di solubilità = [Ca2+][SO42-] Relazione tra Kps ed s funzione del tipo di sale o composto poco solubile Per il solfato di calcio s(mol/l)=√Kps Per il solfato di argento s=3√ Kps/4 Fattori che influenzano la solubilità 1-Temperatura 2- Effetto dello ione a comune: è provocato su un equilibrio da una sostanza che fornisce ioni che partecipano all’equilibrio Alcuni organismi producono solidi che si trovano in natura anche come minerali. Piccin Nuova Libraria S.p.A. Immagine ai raggi X del tratto gastrointestinale. Piccin Nuova Libraria S.p.A. Un processo di dissoluzione di ioni. Il solfato di bario, si trova nel minerale barite. Il fluoruro di calcio, si trova nel minerale fluorite. L’effetto dello ione comune. L’effetto dello ione comune Solfuro di cadmio. Ioduro di piombo. Il cloruro di argento precipita quando vengono aggiunti ioni cloruro a una soluzione contenente ioni argento. Conversione di uno ione in altra specie per mezzo di reazioni redox Conversione di uno ione in altra specie per mezzo di reazioni redox Formazione di ioni complessi Formazione di ioni complessi A una soluzione di CuSO4, solfato di rame (II), è stata aggiunta A una soluzione di CuSO , solfato di rame (II), è stata aggiunta lentamente NH acquosa concentrata. lentamente NH3 acquosa concentrata 4 3
Scarica







![K ps = [Ca 2+ ]](http://s2.diazilla.com/store/data/000128004_1-8ae544435108dbec861deb5fa2c69e2d-260x520.png)