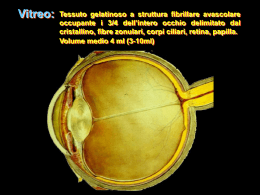
Si ringrazia, per il contributo alla realizzazione del presente fascicolo, l’Azienda: INDICE Videorefrattiva 2004-2005 Vitreo, degenerazione vitreale e distacco di retina 3 Guido Lesnoni – Livio Colecchia Vitreo e patologie traumatiche 14 Cesare Forlini – Paolo Rossini – William Gualtieri Vitreo e cataratta 23 Vittorio Picardo – Rosalia Sorce – Salvatore Migliore Rottura capsulare 29 Paolo Vinciguerra – Alessandro Randazzo – Alessandro Castellani Vitreo e chirurgia refrattiva Massimo Filippello – Edoardo Stagni 36 © Copyright 2005 - Centro Ambrosiano di Microchirurgia Oculare SpA Edito da Fabiano Editore Reg. S. Giovanni 40 - 14053 Canelli (AT) Tel. 0141 822557 - Fax 0141 822669 E-mail: [email protected] http://www.fabianoeditore.it Gli Autori e l’Editore declinano ogni responsabilità per eventuali errori contenuti nel testo. Tutti i diritti sono riservati. È vietata ogni riproduzione totale o parziale. Stampa: Litografia Fabiano snc Reg. S. Giovanni 40 - 14053 Canelli (AT) Tel. 0141 822589 - Fax 0141 822669 Finito di stampare: Marzo 2005 FABIANO EDITORE Reg. S. Giovanni, 40 – 14053 Canelli (AT) – Tel 0141 822557 – Fax 0141 822669 e-mail: [email protected] - www.fabianoeditore.it Vitreo, degenerazione vitreale e distacco di retina Guido Lesnoni – Livio Colecchia Anatomia ed istologia II corpo vitreo, struttura gelatinosa occupante circa quattro quinti del volume dell’occhio, ha un volume di circa 4 ml. e pesa circa 4 g. Inizia a svilupparsi allo stadio embrionale di 13 mm. e deriva dalla retina e dal mesoderma del sistema ialoide. Ha aspetto sferoidale, anteriormente presenta una lieve depressione, la “fossa patellare”, ed è leggermente appiattito in basso. Il vitreo aderisce a tutte le strutture con cui è in contatto, ma il grado di adesione è diverso nei vari punti1: maggiore a livello della base del vitreo, a livello del cristallino, nell’area foveale-parafoveale, al margine della testa del nervo ottico2 e lungo i vasi retinici maggiori. La base vitreale occupa un’area larga circa 6 mm, 2 mm della pars plana posteriore e 4 mm della retina periferica, in cui le fibre collagene aderiscono perpendicolarmente alla retina e presentano la massima densità, mentre l’adesione è più tangenziale in altre aree. Il vitreo aderisce al cristallino attraverso il legamento ialoideo-capsulare (legamento di Wiegert); questo fa parte di una struttura anatomica complessa che attraverso il canale di Cloquet si apre nello spazio di Martegiani, al di sopra della testa del nervo ottico, il cui margine rappresenta un’altra area di forte adesione vitreoretinica. A livello maculare l’adesione si sviluppa nelle aree foveale e parafoveale. Sebag e Balasz3 hanno accuratamente documentata l’organizzazione vitreale, descrivendo una struttura membranosa continua dall’ora serrata al polo posteriore, la corteccia vitreale, che presenta due aperture rotonde nelle aree prepapillare e premaculare, di diametro di circa 1,25 mm 3 e 5 mm, rispettivamente. Le fibre vitreali, nell’adulto, hanno un orientamento anteroposteriore e si inseriscono anteriormente alla base del vitreo e posteriormente nella cortex premaculare; nella regione medioperiferica ed equatoriale si raccolgono in fasci e si inseriscono nella cortex; tra i fasci sono presenti aree regolari prive di struttura. Con l’invecchiamento, la struttura vitreale va incontro a profonde modificazioni: le fibre vitreali perdono l’orientamento anteroposteriore e appaiono “spezzate” ed arricciate a formare una rete intrecciata, con ampi spazi nel vitreo centrale; fra i fasci di fibre equatoriali e medio-periferici si evidenziano tasche e lacune di forma e grandezza variabili4; la base vitreale si allarga posteriormente verso l’equatore, maggiormente nell’uomo e dal lato nasale (massima nel quadrante inferonasale); la sintesi intraretinica di fibrille collagene, che penetrano attraverso difetti della membrana limitante interna e si connettono alle fibrille della corticale del vitreo, genera una più forte adesione retinovitreale che può essere causa di trazioni vitreoretiniche periferiche5. Nel vitreo, dal punto di vista istologico, sono presenti tre componenti principali: il collagene6, concentrato nell’area corticale, che costituisce la componente fibrillare, l’acido ialuronico e rare cellule, gli ialociti, con aspetto ovale o affusolato, di cui non si conosce con esattezza la funzione, anche se è stata dimostrata la produzione dell’acido ialuronico7. Biochimica del vitreo Il vitreo è costituito per circa il 99% da acqua e il restante 1% da sali inorganici, lipidi organici di basso peso molecolare, collagene, fondamentale proteina strutturale, e glicosaminoglicani, condroitinsolfato e acido ialuronico, che rappresentano meno dello 0,1%. Le fibrille collagene sono costituite da tipi diversi di collagene: in particolare un ibrido di collagene di tipo V/XI costituisce il core della fibrilla, il tipo II circonda il core e il tipo IX si trova sulla superficie della fibrilla8. Le fibrille collagene sono organizzate da ponti di glicosaminoglicani in fasci a decorso parallelo e questa organizzazione strutturale garantisce la trasparenza del vitreo. L’acido ialuronico, altra fondamentale macromolecola vitreale, a elevato potenziale elettrostatico negativo, condiziona il volume idratato del vitreo in quanto l’acqua non è legata all’acido ialuronico ma è adesa alle spire delle unità del polimero9 (figura 1). L’introduzione di molecole con carica positiva elimina il polimero dell’acido ialuronico, determinando una dissociazione fra le molecole di 4 acido ialuronico, che si organizzano in pool (liquefazione), e i filamenti di collagene, che si organizzano in fasci di fibre. I pool di acido ialuronico esclusi si allargano a formare tasche che, nel tempo confluiscono in lacune clinicamente visibili. Questo processo è alla base della degenerazione Figura 1 che avviene nella parte centrale del vitreo con l’età, in quasi tutti gli adulti: dopo la terza decade il contenuto totale di collagene vitreale non si modifica, mentre la concentrazione di collagene nel gel vitreale a 70-90 anni è maggiore che a 20 anni, per cui aumenta la concentrazione del collagene in gel, organizzato in fasci di fibrille legate probabilmente da interfilamenti; la concentrazione totale di acido ialuronico rimane la stessa nel liquido e nel gel vitreale da 20 a 70 anni; ciò suggerisce uno spostamento di molecole di acido ialuronico dal gel al liquido vitreale. Fisiopatologia dell’adesione vitreoretinica In alcuni punti il vitreo presenta zone di adesione fisiologicamente più forte alle strutture adiacenti, quali la testa del nervo ottico, la macula, la base del vitreo, i vasi retinici maggiori. Possono, invece, crearsi zone patologiche di maggiore adesione vitreoretinica, in particolare in corrispondenza di aree di degenerazione retinica, di lesioni infiammatorie, di lesioni della base vitreale. Testa del nervo ottico La papilla rappresenta un punto di forte adesione che può persistere anche in caso di distacchi parziali del vitreo; in alcuni casi di distacco posteriore di vitreo, se preceduti da proliferazione fibrocellulare, si genera un anello di tessuto (anello di Weiss) (figura 2) evidente all’interno della Figura 2 5 cavità vitreale, che può generare la visione di un corpo mobile estremamente fastidiosa. Macula Il vitreo aderisce alla macula in un’area di circa 4 mm di diametro, anche se tale zona di adesione non è quasi mai visibile se non in alcune condizioni patologiche. Base del vitreo La base è l’area di massima adesione del vitreo alle strutture limitrofe e in questa zona le fibrille collagene si inseriscono quasi ad angolo retto sulla superficie interna dell’epitelio ciliare e della retina periferica. Aree di disembriogenesi Le baie incluse o parzialmente incluse sono aree di indentazione posteriore della retina che possono essere associate a rotture retiniche soprattutto in caso di distacchi posteriori del vitreo. Le pieghe meridionali sono aree di sollevamento della retina periferica orientate in senso radiale che, raramente possono essere associate a trazione vitreale e rotture retiniche; quando associate nello stesso meridiano ad un processo ciliare, prendono il nome di complesso meridionale. I ciuffi retinici, proiezioni di tessuto retinico dentro la base del vitreo, possono essere cistici, non cistici e con trazione zonulare10. Le forme cistiche e con trazione zonulare possono essere associate a fori retinici e, raramente, a distacco retinico, specie dopo distacco posteriore di vitreo. Vasi retinici maggiori Alcuni Autori11 ritengono che una incostante assenza della membrana limitante interna al di sopra dei vasi retinici maggiori possa determinare un incarceramento del vitreo nella retina che viene ad essere a diretto contatto con il tessuto perivascolare. Ciò sarebbe confermato dalla frequenza con cui, nelle alterazioni trazionali, si verifica una avulsione dei vasi retinici. La presenza di forti adesioni vitreoretiniche in vicinanza di vasi retinici rappresenta un importante fattore di trazione e può causare l’avulsione di un vaso retinico, che costituisce una causa importante di emorragia vitreale. Degenerazione a palizzata della retina La degenerazione a palizzata è il più importante processo degenerativo vitreoretinico a carattere regmatogeno, ossia predisponente alle rot6 ture ed al distacco retinico, in quanto si associa in una percentuale variabile fra il 20 e il 30 % dei casi di distacco di retina. I margini della degenerazione a palizzata costituiscono un punto di forte adesione del vitreo alla retina; le lesioni a palizzata, di aspetto estremamente variabile, si localizzano solitamente anteriormente all’equatore, parallele all’ora serrata. L’aspetto più tipico è costituito da un assottigliamento retinico associato a strie biancastre a livello dei vasi sclerotici e alterazioni pigmentarie, anche se può presentarsi con caratteristiche variabili. A livello istopatologico è caratterizzata dalla presenza di una tasca di vitreo fluidificato soprastante la lesione e dalla condensazione ed adesione del vitreo ai suoi margini. Nel tempo può associarsi alla comparsa di diverse lesioni: fori atrofici, ritenuti a basso rischio per distacco retinico, ipertrofia ed iperplasia dell’epitelio pigmentato retinico, ma soprattutto rotture retiniche trazionali in concomitanza con un distacco posteriore del vitreo sovrapposto alla trazione. Bianco con o senza pressione Classificandole fra le lesioni potenzialmente regmatogene, Schepens12 ha descritto delle aree di colorito biancastro nella retina periferica, medio-periferica ed equatoriale la cui natura è tuttora controversa. Si definisce bianco senza pressione quando queste aree sono evidenti, all’oftalmoscopia indiretta, senza indentazione; se si evidenziano solo dopo indentazione sclerale, sono definite bianco con pressione. Altri Autori13, invece escludono qualsiasi significato diagnostico o prognostico per questi riflessi. Degenerazione vitreale Sineresi Con il termine sineresi si definisce la degenerazione e liquefazione della parte centrale del vitreo gelatinoso che si verifica con l’età. La liquefazione (sinchisi) del vitreo centrale inizia già nella prima decade di vita con formazione di lacune e aggregati di fibre; dopo la quarta decade si ha una significativa riduzione del volume del gel vitreale con aumento del volume del liquido, determinando l’estensione e la coalescenza delle lacune che formano una grande lacuna centrale al polo posteriore cui si associa la contrazione delle fibre vitreali anteroposteriori degenerate, adiacenti alla cavità vitreale, che tirano in avanti il vitreo posteriore. 7 L’alterazione dell’adesione fra cortex vitreale posteriore e membrana limitante interna retinica, dovuta ad alterazioni biochimiche (è stato identificato un componente della matrice extracellulare dell’interfaccia vitreoretinica presente nel giovane, ma assente nell’adulto14, causa il passaggio del vitreo liquefatto attraverso i fori prepapillare e premaculare della cortex ed il conseguente spostamento di Figura 3 volume dal vitreo centrale allo spazio preretinico determina il collasso del vitreo (figura 3). La sineresi si sviluppa prima ed in maniera più estesa in occhi miopi, nei quali è stata dimostrata una precorrenza di circa 10 anni15 di tutti i fenomeni degenerativi vitreoretinici, ed è accelerata da malattie oculari infiammatorie, traumi e retinopatie ialoidee. La sineresi vitreale predispone al distacco posteriore del vitreo16. Distacco posteriore di vitreo (DPV) Il vitreo liquefatto, attraverso i fori della cortex posteriore, si porta nello spazio retroialoideo e, favorito alla gravità e dai movimenti saccadici dell’occhio, scolla progressivamente la ialoide posteriore dalla retina. Può essere17: completo con collasso: si osserva un ampio spazio retrocorticale, la cortex ha un tipico aspetto sigmoidale quando il paziente è seduto ed è caratterizzato quasi sempre dall’anello di Weiss; completo senza collasso: il gel vitreale è scarsamente liquefatto, lo spazio retrocorticale è evidente, quasi sempre è presente l’anello di Weiss; parziale, con o senza ispessimento della cortex posteriore. L’incidenza è significativamente correlata con l’età, la miopia, l’afachia ed è maggiore nelle donne per cause sconosciute18; è un processo lento che può, tuttavia verificarsi in modo acuto ed essere sintomatico. Segni clinici caratteristici e tipici sono l’inizio delle fluttuazioni nel vitreo oppure modificazioni del quadro abituale delle miodesopsie. L’esame clinico del vitreo presenta diverse difficoltà e non sempre è possibile evidenziare e quantificare la presenza e l’estensione del DPV. Si ritiene comunemente che la lente a contatto di Goldmann sia miglio8 re per l’esame del vitreo periferico mentre la lente di El Bayadi-Kajiura consenta una più precisa visualizzazione dei rapporti fra vitreo e retina. Quando il DPV raggiunge un punto di maggior adesione vitreale crea una trazione sulla retina che può indurre stiramenti, pieghe, retinoschisi, rotture retiniche che, se associate ad avulsione di vasi, possono generare emovitreo (figura 4). Figura 4 In Letteratura il DPV sintomatico acuto è associato ad una incidenza di rotture retiniche variabile fra il 7% ed il 46%19,20. La sintomatologia ha un ruolo fondamentale nella prevenzione del distacco di retina associato a DPV e la comparsa di corpi mobili (figura 5) e fotopsie deve sempre condurre ad un attento esame del vitreo e della retina alla ricerca di eventuali rotture. Le rotture retiniche hanno il tipico aspetto a ferro di cavallo con l’apertura posta sul davanti e avvengono in punti di forte adesione vitreoretinica. Il lembo retinico (opercolo), cui il vitreo rimane adeso, può staccarsi per successive trazioni generando un foro. Tuttavia solo una percentuale relativamente bassa di rotture retiniche trazionali genera un distacco di retina21. Esistono forme di DPV anomalo che Sebag ha recentemente ridefinito come il risultato di una estensione della liquefazione vitreale eccessiva rispetto al grado di alterazione dell’adesione vitreoretinica, che può essere dovuta ad errori congeniti del metabolismo del collagene 9 Figura 5 (S. di Marfan, Elhers-Danlos e Stickler), ad alterazioni sistemiche quali il diabete ed è molto frequente nella miopia elevata. L’anomala trazione che si sviluppa a livello dell’interfaccia vitreoretinica può determinare effetti dannosi sia sulla retina (emorragie, rotture e distacco di retina, sindromi trattive vitreomaculari) che sul vitreo, ove lo spostamento in avanti del corpo vitreo lascia lo strato esterno della cortex vitreale adeso alla retina (vitreoschisi posteriore). Questo processo può essere la base per lo sviluppo di pucker e fori maculari e di vitreoretinopatia diabetica proliferante. L’aspetto e la posizione delle alterazioni vitreali e, in particolare, del DPV e della vitreoschisi posteriore del miope elevato, condizionano il tipo di distacco retinico e le strategie chirurgiche da adottare, oltre a condizionare la prognosi visiva: un recente studio22 ha messo in evidenza, nel miope elevato, un miglior recupero visivo postoperatorio nei distacchi di retina associati a DPV rispetto a quelli con vitreoschisi posteriore, probabilmente dovuto ad una migliore conservazione delle connessioni fra gli strati della neuroretina, come dimostrato all’OCT. DPV e distacco di retina regmatogeno Tra le varianti di distacco di retina, la forma regmatogena, così definita perché determinata da una rottura a tutto spessore della retina, rappresenta la causa più frequente. Ha una incidenza variabile tra 9 e 24.4 per 100.000 per anno. In condizioni normali, diversi fattori agiscono per mantenere il neuroepitelio adeso all’epitelio pigmentato: il più importante è certamente l’azione di pompa esercitata dall’epitelio pigmentato stesso; altri fattori determinanti per l’adesione retinica sono il gradiente di pressione oncotica, forze idrauliche e molecole mucopolisaccaridiche che legano i fotorecettori alle cellule dell’epitelio pigmentato. Quando le 10 forze esercitate da tutti questi fattori vengono superate da un volume di fluido intravitreale che penetra attraverso una o più rotture retiniche e raggiunge lo spazio sottoretinico, l’azione di dissezione generata determina il distacco. Perché si verifichi, devono associarsi tre fattori fondamentali: la presenza di una rottura o di un foro retinico, forze trazionali vitreoretiniche in prossimità della rottura ed una certa quantità di vitreo liquefatto che raggiunge lo spazio sottoretinico attraverso la soluzione di continuo della retina (figura 6). La sola presenza di una rottura non è in grado di generare un distacco di retina, in assenza degli altri fattori. Il DPV può avere un ruolo fondamentale nella dinamica del distacco retinico regmatogeno in quanto ove il vitreo rimane aderente si sviluppano forze trazionali che possono generare rotture retiniche: la trazione vitreoretinica rappresenta il punto d’innesco della cascata di eventi che portano al distacco di retina. Infatti, una rottura retinica a lembo sintomatica, con trazione vitreoretinica persistente, genera frequentemente un distacco di retina, mentre non è mai stata descritta l’associazione fra una rottura ad opercolo senza trazione, anche se generata da un DPV acuto, ed il distacco retinico. Il punto d’origine del distacco di retina regmatogeno dipende strettamente dalla localizzazione della rottura: la localizzazione più comune è quella equatoriale, associata a rotture a ferro di cavallo che si generano in corrispondenza di aree di degenerazione retinica, mentre meno frequenti sono le forme dovute a rotture giganti o alla dialisi temporale inferiore che originano a livello della base del vitreo quando questa si retrae5. Più rare e tipiche dell’occhio miope elevato sono le forme di distacco retinico posteriore, spesso secondarie a fori Figura 6 maculari22. La prevenzione della degenerazione vitreale: quali possibilità? La retina ed il vitreo vanno incontro, con il passare degli anni, a diverse modificazioni strutturali e funzionali dovuti prevalentemente a stress ossidativi causato da meccanismi indotti dalla luce. 11 La cornea ed il cristallino sono in grado di assorbire solo parzialmente la radiazione luminosa ed è, quindi, il vitreo il principale responsabile della protezione della retina dalle radiazioni luminose23. La radiazione luminosa attiva diverse sostanze presenti nel vitreo che agiscono da fotosensibilizzatori (riboflavina, ematoporfirina ed altre) che generano le specie reattive dell’ossigeno, fra cui i radicali liberi, che sono in grado di depolimerizzare le catene di acido ialuronico. L’aumento di alcuni ioni metallici, fra cui ferro e rame, e la diminuzione di altri, come lo zinco, catalizza la reazione di formazione di tali molecole, accelerando la degradazione vitreale24. Anche i prodotti derivanti dalla reazione di Maillard (glicosilazione non enzimatica) determina la depolimerizzazione dell’acido ialuronico. Oltre all’acido ascorbico, presente in grandi quantità25, sono state individuate recentemente altre sostanze antiossidanti presenti nel vitreo e, fra queste, le più importanti sono gli enzimi antiossidanti (SOD, catalasi), i chelanti del ferro (desferrioxamina, transferrina) e gli scavengers di radicali liberi (acido urico, carnosina)26. Il potenziale antiossidante vitreale decresce significativamente con l’età23, mentre alcuni Autori, misurando la perossidazione lipidica e l’attività antiossidante plasmatica e lacrimale in soggetti affetti da distacco di retina hanno evidenziato una diminuzione dell’attività antiossidante lacrimale a fronte di una stabilità di quella plasmatica. La somministrazione di flavonoidi antiossidanti (dikvertina e gingko biloba) era in grado di ridurre la per ossidazione lipidica e di aumentare l’attività antiossidante a livello lacrimale27. Questi interessanti dati, pur necessitando di ulteriori riscontri, suggeriscono l’importanza del ruolo degli antiossidanti nella protezione del vitreo e della retina dal danno ossidativo e offrono il razionale per una approfondita valutazione degli effetti della supplementazione alla dieta con specifici integratori alimentari di queste molecole nelle varie fasce d’età, a scopo preventivo nei più giovani e prettamente terapeutico nei soggetti anziani, peraltro più facilmente soggetti a disordini alimentari e metabolici. Bibliografia 01. HOGAN MJ, ALVARADO JA, AND WEDDELL JE: Histology of the human eye: an atlas and textbook, Philadelphia, 1971, WB Saunders Co. 02. GRIGNOLO A: Fibrous components of the vitreous body, Arch Ophthalmol 47:760-774, 1952. 03. SEBAG J, AND BALAZS EA: Human vitreous fibres and vitreoretinal disease, Trans Ophthalmol Soc UK 104:123-128, 1984. 04. SEBAG J.: The vitreous 1989. 05. WANG J, MC LEOD D, HENSON DB, BISHOP PN: Age-dependent changes in the basal retinovitreous adhesion, Invest Ophthalmol Vis Sci 44(5):1793-800, 2003. 12 06. SNOWDEN JM, AND SWANN DA: Vitreous structure. V. The morphology and thermal stability of vitreous collagen fibers and comparison to articular cartilage (type II) collagen, Invest Ophthalmol Vis Sci 19:610-618, 1980. 07. STERN WH, LEWIS GP, ERICKSON PA, GUERIN CJ, ANDERSON DH, FISHER SK, AND O’DONNELL JJ: Fluorouracil therapy for proliferative vitreoretinopathy after vitrectomy, Am J Ophthalmol 96:33-42, 1983. 08. SEBAG J: Anomalous posterior vitreous detachment: a unifying concept in vitreo-retinal disease, Graefes Arch Clin Exp Ophthalmol 242 (8):690-8, 2004. 09. BISHOP PN: Structural macromolecoles and supramolecular organisation of the vitreous gel Prog retin Eye Res 19:323-44 2000. 10. RYAN SJ: Retina, Vol. 3:24-30, 1992. 11. GREEN WR: Retina. In Spencer, WH, ed: Ophthalmic pathology: an atlas and text, Philadelphia, 1985, WB Saunders Co. 12. SCHEPENS CL: Diagnostic and prognostic factors as found in preoperative examination, Trans Am Acad Ophthalmol Otolaryngol 56:398-418, 1952. 13. BYER NE: The peripheral retina in profile. A stereoscopic atlas, Torrence, Calif, 1982, Criterion Press. 14. RUSSEL SR, SHEPERD JD, HAGEMAN GS: Distribution of glycoconjugates in the human internal limiting membrane, Invest Ophthalmol Vis Sci 32:1986-95, 1991. 15. AKIBA J.: Prevalence of posterior vitreous detachment in high myopia, Ophthalmology 1993; 100: 1384-1388. 16. MORITA H ET AL: A clinical study of the development of posterior vitreous detachment in high myopia, Retina 1995; 15: 117-124. 17. KAKEHASHI A ET AL: Variations of posterior vitreous detachment, Br J Ophthalmol 1997; 81:527-532. 18. HAYREH SS, JONAS JB: Posterior vitreous detachment: clinical correlations, Ophthalmologica 218:333-43. 19. BYER NE: Natural history of posterior vitreous detachment with early management as the premier line of defense against retnal detachment, Ophthalmology 101:1503-13, 1994. 20. SARRAFIZADEH R, HASSAN TS, RUBY AJ, WILLIAMS GA, GARRETSON BR, CAPONE A, TRESE MT, MARGHERIO RR: Incidence of retinal detachment and visual outcome in eyes presenting with posterior vitreous separation and dense fundus-obscuring vitreous hemorrage, Ophthalmology 108:2273-8, 2001. 21. BYER NE: What happens to untreated asymptomatic retinal breaks, and are they affected by posterior vitreous detachment? Ophthalmology 105:1045-9, 1998. 22. RIPANDELLI G, PARISI V, FRIBERG TR, COPPÈ AM, SCASSA C, STIRPE M: Retinal detachment associated with macular hole in high myopia (21) Ophthalmology 111:726-31, 2004. 23. BERRA A., FERREIRA S, STANGA P, LLESUY S: Age-related antioxidant capacity of the vitreous and its possible relationship with simultaneous changes in photoreceptors, retinal pigment epithelium and Bruchs’ membrane in Human donors’ eyes, Arch Gerontol geriatr 34:371-7. 24. UENO N: Changes in vitreous structure caused by oxygen free radicals, Nippon Ganka Gakkai Zasshi Dec 1995; 99(12) :1342-60. 25. ROSE RC, RICHER SP, BODE AM: Ocular oxidants and antioxidant protection, Proc Soc Exp Biol Med 217:397-407 1998. 26. DEGUINE V, MENASCHE M, FERRARI P, FRAISSE L, POULIQUEN Y, ROBERT L: Free radical depolymerization of hyaluronan by Maillard reaction products: role in liquefaction of aging vitreous, Int J Biol Macromol Feb 1998; 22(1) :17-22. 27. KARAZHAEVA MI, SAKSONOVA EO, KLEBANOV GI, LIUBITSKII OB, GUR’EVA NV: The use of flavonoid antioxidants in the complex treatment of patients with periferal vitreo-chorioretinal dystrophies and distrophic retinal detachment. Vestn Oftalmol 120(4): 14-18. 13 Vitreo e patologie traumatiche Cesare Forlini – Paolo Rossini – William Gualtieri Negli ultimi decenni, i progressi tecnologici hanno migliorato le possibilità di studio, diagnostiche e di trattamento del trauma oculare. In questo senso le tecniche di vitrectomia hanno reso possibile la comprensione della fisiopatologia degli effetti del trauma oculare nei minimi dettagli, migliorando le capacità diagnostiche dell’oftalmologo e, ovviamente, le possibilità del trattamento stesso. Senza dubbio, i risultati del trattamento dell’occhio traumatizzato sono enormemente migliorati nell’ultimo quarto di secolo scorso e durante l’inizio di quello corrente. La vitrectomia ha dato il maggior contributo e la nostra conoscenza della materia si è arricchita di un tale enorme ammontare di dati e concetti che la comunità scientifica oftalmologica internazionale ha sentito l’esigenza di adottare un linguaggio comune per una migliore e rapida reciproca comprensione. In un campo dove la varietà delle situazioni patologiche impone un rigoroso rispetto dei termini per una precisa comprensione dell’evento patologico, l’idea e la messa a punto di un nuovo sistema classificativo detto “The Birmingham Eye Trauma Terminology” (BETT). Trauma chiuso In accordo con la classificazione del BETT del trauma oculare (figura 1), il trauma chiuso è caratterizzato dalla contusione e/o dalla lacerazione lamellare (non a tutto spessore) del globo oculare. Patogenesi Tipicamente, il trauma chiuso è causato dall’impatto di un agente smusso sulla superficie oculare. L’effetto dell’impatto dipende da diverse 14 Figura 1. Classificazione del BETT variabili fra cui: la velocità dell’agente che colpisce, la direzione e l’angolo d’incidenza fra esso e la superficie oculare, la sede della superficie oculare colpita. Le conseguenze dell’impatto sostanzialmente si dividono in dirette (colpo) ed indirette (contraccolpo): le prime si producono sulle strutture anatomiche oculari direttamente colpite, le seconde si realizzano a distanza dalla sede d’impatto, in diverse zone anatomiche a seconda del meccanismo patogenetico che le sottende. I meccanismi patofisiologici che connettono il momento del trauma ed il contraccolpo sono essenzialmente di duplice natura: a) vascolare e b) meccanico. Meccanismo vascolare Quando il globo oculare è colpito da un agente smusso, la forza distorce il globo oculare ed il suo intero sistema circolatorio. I vasi in generale, ma quelli retinici e coroideali in particolare, subiscono in rapida successione una marcata, estesa vasocostrizione seguita da una imponente vasodilatazione che dà come risultato una Figura 2. Rottura della barriera ematoretinica in seguito a trauma contusivo 15 gamma di sequele che vanno dall’edema (edema di Berlin, commotio retinae) sino alla franca rottura con emorragia (emorragia retinica, emovitreo, emorragia coroideale) (figura 2). Meccanismo meccanico Negli anni ’60, Delori condusse degli studi di miliare importanza per la comprensione del meccanismo attraverso il quale si producono le lesioni vitreoretiniche a seguito di un trauma chiuso. Utilizzando la registrazione fotografica o la cinematografia accelerata e l’analisi del “fermo immagine”, egli studiò nei minimi dettagli che cosa accadeva durante il trauma contusivo dal momento dell’impatto sino al momento in cui termina il contatto fra l’agente che colpisce e l’occhio, e il periodo immediatamente successivo quando l’agente contundente si allontana. La sequenza degli eventi fu così stabilita e divisa in quattro periodi: la compressione, la decompressione, il superamento e le oscillazioni di lunga durata. Quest’ultima fase potè essere misurata mediante l’esame, fotogramma per fotogramma, dal film ad alta velocità. Compressione: (da 0 a 0.25 msec, figura 3/a) spostamento d’aria prima ed impatto poi provocano deformazione ed indentazione corneale. In questo istante, il diametro antero-posteriore dell’occhio risulta ridotto al 59% della sua lunghezza originale, il che corrisponde ad una indentazione corneale di 8.5 mm. Decompressione: ( da 0.25 a 1.00 msec, figura 3/b) durante questo periodo l’occhio, agendo come una molla in tensione, respinge il proiettile dell’esperimento di Delori. Il diametro equatoriale continua la sua espansione allorquando raggiunge il suo valore maggiore 111% della sua originale lunghezza. L’occhio assume un aspetto piriforme. Superamento: (da 1.00 a 2.50 msec, figura 3/c) il diametro anteroposteriore supera il 112% della sua lunghezza originale, mentre il diametro equatoriale decresce, dando al globo una forma ellissoidale. Oscillazioni: (da 2.50 a 100 msec, figura 3/d) le oscillazioni riguardano sia il polo posteriore che l’intero globo. Anche il fluido intraoculare oscilla contestualmente con il globo. Tenendo in debito conto che l’occhio è composto da strutture anatomiche di diversa densità, dobbiamo ritenere che le deformazioni studiate da Delori si realizzano in momenti diversi sulle varie strutture oculare e in particolar modo fra il vitreo e la retina. Di conseguenza è proprio 16 a b c d Figura 2. Esperimento di Delori: a. compressione b. decompressione c. superamento d. oscillazioni durante quei momenti differenti di inerzia vitreale in cui la retina segue più velocemente le deformazioni oculari dal trauma indotte che si producono le lesioni retiniche. Nei primi 0.40 msec, quando il globo è massimamente compresso e l’asse equatoriale è aumentato, si verificano le rotture retiniche periferiche, le dialisi e le rotture giganti. Nei periodi successivi, quando l’asse antero-posteriore del globo si è allungato oltremisura, il foro maculare e le rotture retiniche posteriori possono realizzarsi. A parte queste più comuni presentazioni delle lesioni retiniche posttraumatiche contusive, siti più comuni delle lesioni da contraccolpo si verificano lungo un arco circonferenziale parallelo al limbus corneale all’inserzione del muscolo retto opposto alla sede dell’impatto, o all’equatore del globo. Statisticamente, il sito più comune ad essere interessato è il quadrante superonasale vicino al limbus. Clinica Un trauma contusivo, può interessare una o più strutture anatomiche oculari. Come abbiamo visto dagli studi di Delori il vitreo rappresenta la struttura più coinvolta nelle lesioni contusive da contraccolpo. Poiché i segmenti di popolazione interessata dalla traumatologia sono i giovani maschi, di solito il vitreo è ben conformato. Il trauma di per sé non provoca alterazioni intravitreali importanti, ma può provocare un acuto distacco posteriore di vitreo. Se il distacco vitreale causa un’emorragia intravitreale, questa può determinare alterazioni tali da condurre ad una 17 Figura 4. Rotture retiniche associate al trauma contusivo: a. rottura gigante; b. rottura posteriore; c. foro maculare; d-e. rotture periferiche con lembo; f. rottura equatoriale con lembo; g. foro rotondo percolato; h. dialisi con avulsione del vitreo della base liquefazione vitreale molto simile a quella legata all’età. Senza dubbio, è il distacco posteriore acuto del vitreo che è foriero della patologia regmatogena retinica che solitamente rimane asintomatica proprio perché il resto del corpo vitreo mantiene la sua compattezza almeno inizialmente e nei soggetti giovani. La patologia retinica regmatogena si caratterizza per una serie di rotture retiniche di cui la dialisi e la rottura extrafoveale posteriore irregolare sono le lesioni paradigmatiche. Le rotture giganti ed il foro maculare sono le altre lesioni più frequenti (figura 4). Trauma aperto In accordo con il sistema classificativo BETT, il trauma perforante o aperto deve essere distinto in: rottura o lacerazione; quest’ultima è distinta in: lesione penetrante, lesione con ritenzione di corpo estraneo, lesione perforante. In realtà, un trauma aperto spesso implica anche una più o meno importante componente contusiva. Pertanto il risultato finale è dato dalla combinazione degli esiti delle due componenti. Poiché la compartecipazione contusive e “aperte” sono varie e molteplici, si può affermare che ogni singolo caso è una storia a sé, individuale, unica. Tuttavia, per chiarezza espositiva, in questa sede sarà trattato il trauma aperto puro, senza componente contusiva. Clinica Così come per il trauma chiuso, nel corso degli anni ’70 e ’80 sono stati condotti numerosi studi sperimentali sugli effetti del trauma aperto che hanno notevolmente contribuito alla comprensione degli eventi istopatologici che si producono in seguito ad una ferita penetrante/perforante con o senza ritenzione di corpo estraneo, alla loro sequenza e cronologia. Nel trauma aperto, al contrario di quanto accade in quello chiuso, il coinvolgimento del corpo vitreo è immediato e diretto. Una volta che l’integrità del vitreo è stata violata, l’occhio reagisce con 18 un processo riparativo molto efficace ma involutivo che conduce alla distruzione delle strutture adiacenti. Questa risposta riparativa è in realtà del tutto identica a quella che avviene in qualsiasi altra parte dell’organismo quando si produce una lesione traumatica. Gli effetti nel trauma oculare risultano spesso devastanti se si prende in considerazione l’estrema delicatezza dell’occhio come struttura anatomica. I segni anatomopatologici patognomonici del trauma aperto sono: bande e veli transvitreali e crescita interna fibrocellulare con formazione di membrane localizzate o diffuse. Le bande e le formazioni membranose transvitreali possono essere considerate le vere stigmate del trauma vitreale aperto, caratterizzanti le lesioni penetranti/perforanti. La trazione transvitreale caratteristicamente causa trazione sulla base vitreale e sulla retina periferica nel lato dell’occhio opposto al sito d’entrata della ferita (figure 5 e 6). Infatti la penetrazione oculare è seguita dalla proliferazione cellulare tipicamente lungo la traccia della ferita penetrante. La formazione di membrane epiretiniche localizzate o diffuse non apparentemente direttamente connesse al sito d’entrata e d’uscita della ferita sono espressioni della invasione cellulare fuori la traccia della ferita penetrante con conseguente contrattura della regione della base vitreale che causa una trazione centripeta sulla retina periferica, lungo la superficie posteriore del gel vitreale e sulla superficie della retina posteriore che causano trazioni antero-posteriori della retina posteriore. Le membrane sono in gran parte simili a quelle che costituiscono il processo proliferativo vitreoretinico (PVR) e pertanto il fenomeno che determina la sua produzione è usualmente definito PVR postraumatico. Figura 5. Membrane localizzate sul punto d’entrata e di uscita della ferita. Le trazioni anteroposteriori esitano in un distacco trazionale Figura 6. Fibrosi nella regione della base vitreale 19 La formazione delle bande e delle membrane avviene nel giro di 10-14 giorni, come si evince dagli studi sperimentali e dalle osservazioni cliniche. Il distacco di retina trazionale puro, con eventuale componente regmatogena successiva (la componente regmatogena che precede quella trazionale è possibile nelle forme miste), avviene generalmente dopo il 14° giorno dal trauma (figura 7). Da qui si desume Figura 7. PVR postraumatica: distacco che il momento più conveniente per il trazionale-regmatogeno con estese membrane epiretiniche trattamento tramite vitrectomia cade fra il 10° ed il 14° giorno dal trauma, quando il processo di formazione delle bande e delle membrane ha verosimilmente terminato il suo corso biologico, ma prima che il distacco di retina trazionale insorga. La corteccia vitreale posteriore si comporta in modo incostante. Talvolta le alterazioni intravitreali, liquefazione e collasso, comportano un distacco del vitreo posteriore spontaneo nel periodo postraumatico, prima della formazione delle membrane. Talvolta, questo non accade e il distacco di retina posteriore è altamente probabile. La bioistopatologia delle bande e delle membrane è piuttosto complessa. La loro formazione è espressione del processo di riparazione. Il processo di riparazione è sostanzialmente distinto in due fasi cronologicamente in successione: la prima, caratterizzata dalla infiammazione la seconda dalla contrazione (schema 1). Il processo infiammatorio implica la liberazione di sostanze chimiche che stimolano la proliferazione cellulare allo scopo di sostituire il tessuto danneggiato. La fase successiva di contrazione, caratterizzata dalla contrazione tissutale che costituisce il tentativo da parte dell’organo leso di avvicinare i margini della ferita come parte del processo riparativo. Il processo infiammatorio è indotto da fattori esterni ed interni. Tra i primi vanno ricordati un corpo estraneo reattivo nel caso di trauma aperto tipo lacerazione con ritenzione di corpo estraneo, un possibile agente infettivo, e lo stesso trauma vitreale. I fattori flogogeni interni sono rappresentati dai prodotti ematici, materiale lenticolare e detriti tissutali penetrati dal foro d’entrata. La risposta infiammatoria si realizza in una fase acuta ed una cronica. La prima è caratterizzata da un’abbondante migrazione di polimorfonucleati nel vitreo che si verifica 24-48 ore dopo il trauma. La fase cronica, 20 Schema 1. Trauma penetrante aperto (penetrante, perforante, con corpo estraneo intraoculare) che inzia dopo 72 ore, è dominata da macrofagi e monoliti che presumibilmente sintetizzano e liberano nel vitreo sostanze chimiche in grado di stimolare la metaplasia e la migrazione di cellule sclerali, coroideali e dell’epitelio pigmentato retinico, le quali tutte proliferano sull’impalcatura rappresentata dalle fibrille vitreali condensate. Nello stadio della contrazione tissutale, i miofibroblasti contenuti nelle dense membrane vitreali si contraggono, allontanando la corteccia vitreale dalla retina. Quando la corteccia vitreale non riesce a distaccarsi completamente si può determinare un distacco di retina trazionale oppure una retinoschisi trazionale o una vitreoschisi. La contrazione di una membrana ciclitica può distaccare il corpo ciliare provocando ipotonia e talvolta tisi bulbare. Rottura del globo Questa è, ovviamente, una devastante lesione che causa esteso danno a tutti i tessuti oculari e frequentemente implica nella perdita della vista. 21 La rottura risulta da una estrema ed improvvisa pressione sul globo oculare, di solito dal davanti, cosicché l’occhio si rompe in molteplici punti caratterizzati da anatomica minore resistenza (figura 8). Il limbus è la sede più frequentemente interessata, e il contenuto oculare fuoriuscendo si dispone nello spazio sottocongiuntivale. Uvea, vitreo e retina sono letteralmente “spremuti” fuori dal globo oculare (figura 9). In alcuni casi è possibile salvare qualcosa da questa terribile situazione ma queste opportunità sono rare. Figura 8. Lacerazione sclerale con prolasso di vitreo Figura 9. Prolasso retinico in ferita sclerale Conclusioni Pertanto molto è stato fatto, ma ancora tanto lavoro da affrontare negli anni a venire. Benché non sia giusto porre limiti nel campo della scienza e della medicina, la chirurgia da sola forse ha limitati margini di miglioramento. Come nel caso della PVR, anche la traumatologia ha riposto molte speranze per ulteriori avanzamenti nella farmacologia. Per prevenire o stabilizzare o per invertire il decorso dei processi biocellulari che spesso fanno fallire un intervento chirurgico, deve essere scoperta una o più sostanze appropriate. Bibliografia 1. D.V. ALFARO III, P.E. LIGGETT. Vitreoretinal surgery of the injured eye. Ed. 1998. 2. J. SEBAG, G.S. HAGEMAN. Interfaces. Ed. 2000. 22 Vitreo e cataratta Vittorio Picardo – Rosalia Sorce – Salvatore Migliore Il riscontro contemporaneo di cataratta e patologia vitreale (sineresi, sinchisi, corpi mobili, distacco posteriore) è frequente nella pratica clinica (figure 1, 2, 3). I fattori che condizionano il timing dell’intervento di cataratta sono diversi e la decisione su quando operare non segue solitamente rigidi schematismi; tuttavia, bisogna attenersi a principi generali avendo sempre come obiettivo il recupero funzionale del paziente. Le aberrazioni vitreali, che spesso spingono il paziente a rivolgersi all’oculista, condizionano la qualità della visione e, di conseguenza, interferiscono con la qualità della vita. L’aumento dell’età media, la miopia, le diete squilibrate, l’aumentata diffusione delle terapie antipertensive, gli agenti inquinanti, sia atmosferici che luminosi, la maggiore frequenza degli interventi chirurgici contribuiscono ad accentuare tali problematiche. Bisogna tener presente che il vitreo, organo trasparente a struttura semiliquida, a forma di sfera depressa nella sua parte anteriore, rappresenta i due terzi del contenuto dell’occhio e, pertanto, le sue alterazioni hanno un’entità forte sulla qualità della visione. La patologia vitreale è prevalentemente di natura degenerativa ma essendo anche un eccellente mezzo di coltura, risente passivamente delle patologie infiammatorie delle strutture limitrofe. Inoltre, la sua vicinanza alla retina amplifica le dimensioni di qualunque alterazione della sua struttura. Le miodesopsie sono percepite meglio in condizioni di forte luminosità o guardando una superficie bianca; si manifestano in modo lento e progressivo e la loro percezione è dovuta all’ombra che proiettano sulla retina. Lo studio clinico del corpo vitreo può essere effettuato con diverse metodiche: oftalmoscopia convenzionale, oftalmoscopia stereoscopica, 23 biomicroscopia convenzionale a luce fessurata, biomicroscopia a contatto con lente di Goldman, metodiche ecografiche A e B-scan, fotofluorometria (figure 4, 5, 6). Nell’esame del vitreo devono essere considerati: la trasparenza, la compattezza, la mobilità, la forma e la sede, i rapporti con le strutture contigue. Figura 1. Ialinosi vitreale e cataratta Le forme più diffuse di affezioni vitreali nell’età senile sono quelle degenerative che si estrinsecano nella fluidificazione (sinchisi o sineresi, vitreopatia asteroide, sinchisi scintillante), negli opacamenti parcellari o corpi mobili vitreali o miodesopsie o mosche volanti, nella coartazione e quindi nel distacco (solitamente posteriore) del vitreo. In quest’ultimo caso la sintomatoloFigura 2. Sineresi vitreale con lacune gia soggettiva è rappresentata dalla brusca comparsa di mosche volanti accompagnata talvolta da fotopsie e quindi da una velatura dovuta all’accartocciarsi delle fibrille vitreali. Ed ecco che il paziente non riesce ad identificare la causa del disturbo visivo quando coesiste la cataratta. Pertanto, si rivolge all’oculista pensando di risolvere con l’intervento di Figura 3. Distacco posteriore di cataratta anche il problema vitreale vitreo completo che ahimè continuerà a persistere. Così ci si dovrà confrontare con il problema della qualità della visione. Il termine “visione” sottintende due differenti significati: uno oggettivo, ovvero percezione-osservazione-chiarificazione-oggettivazione, e uno soggettivo, a cui fanno riferimento i termini sensazione-inganno-meraviglia. Questo significa che il termine visione è vocabolo complesso, ricco di ambiguità, di differenti significati che possono ascriversi non soltanto a speculazioni filosofiche ma anche al complesso processo fisiologico e funzionale dell’atto di vedere. 24 La visione può essere quindi definita come: “il processo fisiologico e psicologico attraverso il quale il soggetto forma una rappresentazione del mondo reale che si presenta davanti ai suoi occhi”. Quindi, la funzione visiva è una funzione adattativa finalizzata ad un obiettivo; il compimento di questa funzione dipende dall’aFigura 4. Lacuna vitreale in bulbo bilità degli occhi a guardare, indivipseudofachico duare, e inseguire un oggetto nello spazio per identificarlo, focalizzarlo, riconoscerlo e simbolizzarlo. Le frasi popolari come “non ci vedo più dalla rabbia”, oppure “ho una fame che non ci vedo” o “accecato dall’ira” o “oggi vedo tutto nero” o “vedo rosso” sono esempi (certamente non scientifici ma sicuramente significativi) di come deterFigura 5. Ialinosi asteroide minate situazioni di equilibrio-dis(forte ingrandimento) equilibrio emotivo possano influire più o meno soggettivamente sulla qualità della visione. Mentre frasi come “non leggo più senza occhiali” o “non mi muovo più senza qualcuno che mi accompagni” o “non vedo più chiaramente il tuo viso” sottintendono alterazioni nella percezione visiva che influenzano pesantemente i comFigura 6. Ialinosi asteroide in portamenti abituali e provocano di paziente con cataratta conseguenza problemi all’omeostasi psicologica dell’individuo. Ne deriva che la misurazione dell’acuità visiva, pur essendo il test più utilizzato per valutare la perdita funzionale causata dalla cataratta o da altre patologie oculari, non sempre appare in grado di evidenziare la reale disabilità visiva. Infatti pazienti con uguale perdita di acutezza visiva misurata, spesso, presentano un diverso livello di discomfort soggettivo che si traduce 25 in un differente grado di handicap che la disabilità visiva causa nella vita quotidiana. Le miodesopsie, pur non rappresentando causa di ipovisione, possono inficiare in modo significativo la qualità della vista e della vita. Il grosso limite dell’oculista è il non avere dei mezzi terapeutici efficaci per risolvere il problema. Solitamente si fa riferimento ai metodi farmacologici che, in genere, non risolvono completamente la sintomatologia. Spesso il paziente, “rassicurato” dalle parole dell’oculista, cerca in un qualche medicinale una soluzione al proprio problema di mosche volanti: colliri, compresse, cocktail di farmaci ed integratori ma anche terapie alternative basate sull’omeopatia o sull’erboristeria. Se coesiste la cataratta il paziente si illude di trovare la soluzione nell’intervento chirurgico. Molto presto però si accorge che il risultato è molto modesto, tale da confondersi con il normale processo di adattamento o, per i più fortunati, di schiarimento della massa di “floaters”: difficile e alquanto improbabile dire in questo caso se il risultato sia da attribuire al movimento meccanico delle miodesopsie o all’effetto curativo del farmaco. È chiaro che in mancanza di studi scientifici in doppio cieco, non è possibile emettere un verdetto definitivo. Alcune linee di riferimento disponibili nel campo dei farmaci per le miodesopsie possono così essere elencate (figure 7, 8): COLLIRI: sono da annoverarsi nella tipologia dei colliri “anti catarattosi” tenendo conto che le mosche volanti abbiano un’origine simile alla cataratta. Sono a base di iodio che dovrebbe accelerare il processo metabolico e quindi favorire una “riparazione” della zona malata; INTEGRATORI BASATI SU ANTIOSSIDANTI: il razionale dell’uso di questa classe di medicinali-integratori sotto forma di capsule è che le Figura 7. Addensamenti vitreali fibrillari 26 Figura 8. Distacco posteriore di vitreo completo miodesopsie sono spesso associate all’invecchiamento dell’intero organismo e quindi possono essere “ritardate” dall’assunzione di preparati anti-ossidanti, basati su assunzione di vitamine del gruppo C e del gruppo E, nonché di β-carotene, in unione ad altre sostanze in grado di limitare l’effetto dannoso dei radicali liberi, spesso responsabili della degenerazione del collagene. L’unico processo possibile è quello osmotico ovvero mediante scambi molto lenti con le zone circostanti; INTEGRATORI BASATI SULL’IDRATAZIONE: hanno come obiettivo l’idratazione del vitreo e quindi svolgono un’azione coadiuvante all’acqua. Infatti il vitreo, a causa di condizioni di disidratazione, va incontro alla sineresi o anche al distacco posteriore, entrambi causa di sviluppo di opacità vitreali; in questo caso è assolutamente corretto favorire l’idratazione del vitreo, soprattutto nei mesi estivi e nei climi secchi; INTEGRATORI A BASE DI LISINA, ARGININA, CARNITINA, POTASSIO, MAGNESIO E VITAMINE: recentemente sono stati trovati nel vitreo dei sistemi enzimatici chiamati metalloproteinasi (MMPs); questi enzimi, che si trovano in tutte le matrici extracellulari del corpo umano, hanno un ruolo fondamentale nel mantenimento e nell’invecchiamento, o chimicamente nella degradazione dei tessuti connettivali e delle strutture contenenti fibre collagene in particolare. Con l’aumentare degli anni o in presenza di patologie che determinano una sofferenza dell’epitelio pigmentato, come ad esempio la miopia, si ha una lenta ma inesorabile diminuzione degli enzimi protettivi e, di conseguenza, un incremento delle MMPs che attaccano le componenti fibrillari del vitreo. Pertanto, risulta giustificata l’integrazione dietetica di alimenti particolarmente ricchi di queste sostanze che inibiscono l’azione delle MMPs, ma anche dei principali costituenti la matrice vitreale: dalla semplice acqua ai sali di potassio, all’acido ascorbico. Gli aminoacidi, come lisina, arginina e carnitina, contribuiscono alla formazione di collagene di tipo II, che è proprio quello presente nel corpo vitreo, e hanno una spiccata azione sulla produzione di energia da parte delle cellule. La bromelina consente la protezione delle fibre di collagene che compongono il corpo vitreo dall’attacco enzimatico delle metalloproteinasi e collagenasi che hanno un ruolo nei processi degenerativi vitreali, con degradazione della matrice extracellulare. Il magnesio e il potassio permettono il mantenimento dello stato dei tessuti connettivali a cui appartiene il corpo vitreo, la conservazione dei liquidi nelle cellule e un ottimale bilancio idrosalino. 27 L’integrità strutturale del corpo vitreo è inoltre assicurata anche dalle vitamine del gruppo B (B1, B2, B6, B12), importanti cofattori in tutte le reazioni metaboliche specifiche. La presenza del ginseng permette di elevare la soglia di resistenza dei tessuti all’azione di agenti nocivi esterni regolando e ripristinando gli equilibri fisiologici alterati; l’associazione con il guaranà ha ottime proprietà di ricostituente psicofisico. ALTRE SOLUZIONI: la medicina cinese consiglia l’assunzione di medicinali con funzione depurativa tipo il “cardo mariano” e il “tarassaco” che ripristinando la corretta funzionalità epatica migliorano a loro dire la funzione visiva. Bisogna riconoscere lo stato di disabilità a cui possono portare le miodesopsie nei casi più gravi e l’assoluta necessità di una cura non invasiva. Ci si potrebbe orientare sull’uso di enzimi e sulle vitrectomia farmacologica se non talora chirurgica. Lettura consigliate KAKEHASHI A, INODA S, SHIMUZU Y, MAKINO S, SHIMIZU H. Predictive value of floaters in the diagnosis of posterior vitreous detachment. Am. J. Ophthalmol 1998 Jan; 125(1): 113-115. PLANTNER JM, ET AL. Matrix metalloproteinases and metalloproteinase inhibitors in human interphotoreceptor matrix and vitreous. Current Eye Research 1998; 17:132-140. SETHI C, BAYLEY T, LUTHERT P, ET AL. Matrix metalloproteinase biology applied to vitreoretinal disorders. Br. J. Ophthalmol 2000; 84: 654-666. WEBER KRAUSE B, ECKARDT C. Incidence of posterior vitreous detachment in the elderly. Ophthlamologie 1996 Dec; 93(6):660-665. ZINGIRIAN M, CALABRIA G, CIURLO G. Oftalmologia e qualità della visione, Relazione SOI, Fabiano Editore. 28 Rottura capsulare Paolo Vinciguerra – Alessandro Randazzo – Alessandro Castellani Nell’ambito della chirurgia della cataratta, la rottura della capsula posteriore è probabilmente una delle complicanze intraoperatorie più frequenti che espone il chirurgo del segmento anteriore alla gestione di un evento al quale spesso non è preparato. La percentuale riportata in Letteratura è circa il 2% del totale degli interventi effettuati1-3. Bisogna però sottolineare che la Letteratura riporta generalmente casistiche di chirurghi esperti e che le aziende fornitrici di strumenti chirurgici riferiscono una percentuale di vendita di vitrectomi anteriori superiori al 5%. Da una rottura capsulare con perdita di vitreo si ha in genere un severo aumento dell’incidenza di edema maculare cistoide e di distacco di retina4. Un buon management del prolasso del vitreo quindi è importante per ridurre al minimo i danni generati dalla rottura capsulare, consentire un facile impianto secondario ed evitare di esporsi ad eventuali critiche sulla gestione della complicanza. Management della rottura capsulare Da ogni step chirurgico durante la chirurgia della cataratta può generarsi una rottura della capsula con perdita di vitreo ed esistono, quindi, delle manovre che a nostro avviso debbono essere messe in atto per limitare i danni e procedere correttamente nell’intervento. Qualora si verifichi una fuga della ressi fino all’equatore della lente, conviene convertire la manovra di capsuloressi in una “can opener” o “apertura a scatola di birra” che prevede l’esecuzione di molteplici tagli radiali della capsula anteriore (20-30) e l’asportazione pressoché in toto della capsula residua. Tale manovra ha lo scopo di interrompere lo stress delle forze centrifu29 ghe su un unico punto e di distribuirlo su 360° frammentandone così la forza complessiva Infatti durante gli interventi di estrazione del cristallino con tecnica extracapsulare l’apertura della capsula anteriore con tecnica “can opener” consentiva comunque una idrodissezione senza fuga posteriore della ressi. Una volta interrotta questa linea di forza si potrà procedere con la facoemulsificazione, previa delicata idrodissezione, portando il nulceo in camera anteriore. Qualora invece la fuga oltrepassi l’equatore lentale interessando la capsula posteriore, ci troveremo di fronte al rischio di lussazione del cristallino in camera vitrea. In questo caso può essere consigliabile convertire l’intervento allargando il tunnel ed estraendo in cristallino in toto con l’ansa di Henle. Il più delle volte con questa manovra si riesce ad evitare l’affondamento del nucleo in camera vitrea. Ci sentiamo di consigliare una tecnica analoga anche quando, rimossi i primi quadranti, si dovesse apprezzare la rottura della capsula posteriore ancora in assenza di prolasso del gel vitreale. Un chirurgo esperto in questo caso può terminare l’aspirazione dei quadranti residui utilizzando ancora il manipolo del facoemulsificatore avvicinandosi al quadrante residuo, ingaggiarlo in aspirazione e senza “mollare la presa” completarne l’aspirazione. Purtroppo l’esperienza insegna che in caso di rottura capsulare posteriore è difficile non avere anche una perdita di vitreo. Questo deriva anche dalla presenza del legamento di Wegener che stabilisce un rapporto anatomico stretto tra la capsula posteriore e la ialoide anteriore. Alcuni chirurghi, in caso di rottura capsulare, suggeriscono l’utilizzo di sostanze viscoelastiche per controbilanciare la spinta del vitreo. A nostro parere tale tecnica è assolutamente da proscrivere per i seguenti motivi: la sostanza viscoelastica aumenta la pressione esercitata sui residui capsulari aumentandone la trazione ed ampliando la rottura; l’onda di iniezione della viscoelastica genera comunque una controspinta vitreale che ne promuove l’avanzamento nel volume non ancora occupato dalla sostanza viscoelastica; il materiale viscoelastico aderisce alle fibre vitreali e le immobilizza inoltre, avendo lo stesso indice di rifrazione del vitreo, ne rende difficile la visualizzazione. In acqua invece, nonostante l’indice di rifrazione sia uguale, l’aspirazione del vitreo è evidenziata dalla comparsa dell’effetto schlierent (una sorta di “tremore” del materiale aspirato appena davanti alla bocca del vitrectomo); per aspirare con il vitrectomo una sostanza viscoelastica si devono utilizzare aspirazioni molto elevate quindi, non appena il viscoelastico 30 sarà completamente rimosso il vitrectomo ingaggerà il vitreo con un surge generato dall’accumulo di vuoto nei tubi con una aspirazione superiore a quella necessaria generando trazioni violente sulla gelatina vitreale e quindi sulla retina. In caso di prolasso di vitreo si dovrà quindi eseguire una vitrectomia con infusione separata dall’ingresso di servizio con un ago di Charleux. È consigliato preparare tale infusione con 2 linee collegate ad un rubinetto a 3 vie. A una di queste si aggancerà l’ago di Charleaux, alle rimanenti la linea d’infusione con BSS e l’altra aria a pressione controllata (vedi vitrectomia anteriore). Qualora invece si sia determinata una lussazione dell’intero nucleo o di frammenti dello stesso in camera vitrea sarà necessario effettuare una vitrectomia via pars plana, liberare il nucleo dalle trazioni vitreali circostanti, anteriorizzarlo con l’iniezione di perfluorocarbonato liquido, utile anche per proteggere il polo posteriore ed emulsificarlo con il facoemulsificatore via pars plana. La vitrectomia anteriore In caso di prolasso di vitreo in camera anteriore bisognerà sospendere la facoemulsificazione, preparare il vitrectomo anteriore e creare un secondo accesso di servizio alla destra del tunnel. PARAMETRI DEL VITRECTOMO ANTERIORE Pompa peristaltica 90 vuoto - 10 flusso - boccia d’infusione 20-30 cm sopra la testa del paziente Pompa Venturi 60-70 vuoto - boccia d’infusione 20-30 cm sopra la testa del paziente in entrambi i casi frequenza di taglio elevata > 750 tagli/min. Nei vitrectomi che consentano la regolazione della IOP è bene settarla a 20 mmHg. A questo punto introduciamo l’ago di Charleux in infusione di acqua (la linea d’infusione dovrà avere un rubinetto a doppia via acqua-aria collegato da una parte alla boccia di soluzione salina e dall’altra all’unità di vitrectomia per l’immissione di aria) dall’accesso laterale sinistro e lo posizioniamo tra piano irideo e cornea rivolgendo il flusso verso l’endotelio. Il vitrectomo invece verrà introdotto attraverso il tunnel in camera vitrea (tra piano irideo e macula). Qualora fosse preferibile avere un sistema 31 “chiuso” si può inserire il vitrectomo attraverso la paracentesi di destra eseguita però con lancia calibrata 20 G oppure attraverso il tunnel in cornea chiara dopo averlo ridotto con un punto di sutura. La vitrectomia deve essere fatta in camera vitrea in modo da creare spazio posteriormente e richiamare “da dietro” la gelatina vitreale presente in camera anteriore. Dopo aver eseguito una vitrectomia centrale si passa ad infusione di aria dallo Charleux. Questa manovra ha un duplice scopo: il vitreo ancora presente in camera anteriore per differenza di peso (aria/vitreo) tenderà a retrarsi in camera vitrea, infatti l’aria andrà in alto e permetterà al vitreo di dislocarsi dietro l’iride; evidenziare il vitreo residuo grazie al diverso l’indice di rifrazione ariavitreo. Per verificare, sempre sotto aria, la presenza di fibre vitreali, introduciamo attraverso la paracentesi di sinistra la spatola di Castroviejo e la facciamo scorrere tangenzialmente ad un piano ipotetico immediatamente anteriore al piano irideo. Tale manovra consente di identificare e sganciare le fibre vitreali aderenti all’iride o al tunnel e di farle “cadere” dietro l’iride. Ripetiamo questo passaggio 2 o 3 volte sia dall’accesso di servizio di sinistra che da quello di destra. Tale manovra ha il vantaggio di rendere visibili quelle fibre vitreali che diversamente ci appaiono evidenti alla lampada a fessura il giorno dopo e che sono spesso causa nel tempo di atrofie iridee localizzate e di trazioni retiniche. Dopo aver compiuto tale manovra si ripasserà in infusione di acqua per poter vitrectomizzare le fibre residue sganciate che si troveranno quindi posteriormente al piano irideo. In questa fase il vitrectomo può essere posto appena dietro il piano irideo poiché le fibre residue in questa fase hanno spesso origine dalla base del vitreo. È sempre consigliabile mantenere la bocca del vitrectomo orientata verso il chirurgo per non generale un flusso che richiami il vitreo posteriore. Un ennesimo passaggio in aria ci permetterà di controllare se finalmente tutta la gelatina vitreale sarà libera ed assente dal segmento anteriore. Alla fine della vitrectomia iniettiamo triamcinolone acetonide in camera anteriore con lo scopo di evidenziare l’eventuale vitreo residuo aderente alla capsula, all’iride o affacciato in campo pupillare e di generare un potente effetto antiflogistico. Le molecole di triamcinolone infatti si aggregano alle fibre vitreali migliorandone la visibilità. Questo permette quindi di verificare se la camera anteriore è completamente libera dal vitreo ed eventualmente completarne l’asportazione, è sorprendente 32 vedere come dopo l’iniezione di triamcinolone si evidenzino in quantità insospettata fibre vitreali prima invisibili. Ricordiamo inoltre che una rottura capsulare con perdita di vitreo aumenta la percentuale di edema maculare cistoide post- chirurgico quindi, l’effetto antiflogistico del triamcinolone, può ridurre questa incidenza. Nel caso in cui la rottura della capsula fosse avvenuta, come spesso accade, in presenza di masse catarattose o di segmenti nucleari, alla fine della vitrectomia dobbiamo aspirare i residui con il manipolo di irrigazione aspirazione oppure con l’ago di Simcoe. È fondamentale eseguire tale manovra solo se si è sicuri di aver liberato completamente la camera anteriore dal vitreo. Qualora infatti fossero presenti ancora delle fibrille vitreali queste potrebbero tappare il manipolo di aspirazione generando trazioni sulla retina periferica con il rischio di rotture retiniche o distacco del neuroepitelio. Come trattare la capsula residua Una volta liberata completamente la camera anteriore dal vitreo e dalle masse residue verifichiamo la condizione della capsula anteriore e posteriore in previsione di un impianto di lente intraoculare. Indipendentemente dalla localizzazione anteriore o posteriore della rottura capsulare, l’obiettivo è quello di preservare quanto più possibile la capsula periferica eliminando le masse intracapsulari ed eventuali brandelli rimasti della capsula posteriore/anteriore centrale, in modo da favorire la formazione di un anello fibrotico sufficiente per un impianto nel solco. Conviene sempre eliminare con il vitrectomo i brandelli di capsula per evitare che vadano a contatto con l’endotelio (perdita di cellule endoteliali), con il tunnel (fibrosi retraente e seidel positivo) o con l’iride (atrofia iridea). Non è necessaria l’integrità sui 360° di questo cercine fibroso, riteniamo infatti che circa 200° di estensione possano essere sufficienti per un impianto secondario, eventualmente con l’aiuto nella regione mancante di una fissazione sclerale di una sola loop. Noi preferiamo rimandare l’impianto della IOL di 2-3 mesi in modo da attendere la adesione della capsula anteriore a quella posteriore e avere una fibrosi che renda il supporto capsulare più robusto. La chiusura del tunnel e delle cheratotomie di servizio deve essere stagna poichè un’eventuale ipotonia da seidel nel post-operatorio potrebbe causare il prolasso di nuova gelatina vitreale in camera anteriore. 33 Impianto immediato di IOL: perché evitarlo Riteniamo che la scelta di impiantare il cristallino artificiale alla fine della vitrectomia sia intimamente legata al desiderio di risolvere tutte le complicazioni in un solo intervento, riducendo al minimo i disagi per il paziente (ed il chirurgo). È comune a tutti i chirurghi “l’imbarazzo” nel comunicare al paziente ed ai suoi familiari che l’intervento si è concluso senza impianto della IOL. La speranza infatti di tutti è che il nostro malato, risolta la reazione infiammatoria postchirurgica, possa avere un visus ottimale senza dover intervenire nuovamente. Purtroppo però questa strategia chirurgica non sempre è la migliore per il nostro paziente. Ad un impianto della IOL alla fine di un unico intervento infatti possono seguire altre complicazioni molto gravi quale la lussazione totale o parziale della IOL in camera vitrea, l’incarceramento di eventuali vibrille vitreali residue nella loop della IOL con successiva fibrosi del vitreo e decentramento del piatto ottico che genera aberrazioni ottiche cui consegue ipovisus, astigmatismo da obliqua incidenza nonché trazione retinica secondaria con rischio di generare rotture retiniche/distacco di retina. Per prima cosa quindi bisogna essere assolutamente certi della totale assenza di vitreo in camera anteriore e sul piano capsulare. Se si opta per un impianto nel solco che sfrutti il supporto capsulare residuo bisogna essere certi dell’integrità su 360° dell’anello periferico anteriore, cosa plausibile solo in caso di ressi anteriore integra, e della totale assenza di lussazioni parziali della zonula (non sempre evidenziabili con sicurezza). Se si opta per un impianto in camera anteriore, cosa che noi sconsigliamo, è mandatario effettuarlo dopo aver ristretto farmacologicamente la pupilla cosa che comunque non preserva dai rischi di sanguinamento e dispersione del pigmento irideo con aumentata probabilità di scompenso endoteliale ed edema maculare cistoide. Se, come riteniamo più corretto, si ha “il coraggio” di non impiantare immediatamente il cristallino artificiale saranno essenzialmente due i problemi da affrontare. Innanzitutto informare adeguatamente il paziente su quando accaduto, spiegargli i benefici a lungo termine di questa atteggiamento più prudente e tranquillizzarlo con un accurato esame del visus corretto appena possibile. In secondo luogo attendere un tempo sufficiente (circa 2 mesi) affinché i residui capsulari anteriori e posteriori si saldino, fibrotizzino e costituiscano un diaframma sufficiente per un impianto secondario. In questo lasso di tempo sarà fondamentale seguire periodicamente il paziente con continui esami del visus, tono ed accurato esame della retina periferica. Ricordiamo che, data l’aumentata pro34 babilità di sviluppare EMC, sarà mandatario mantenere una terapia locale cortisonica e successivamente con FANS più a lungo del normale. Impianto secondario: solco o fissazione sclerale La scelta se utilizzare un impianto secondario nel solco o fissazione sclerale in una afachia postchirurgica è strettamente legata alla presenza di un appoggio capsulare residuo sufficiente. Questo dipende ovviamente dal tipo di rottura capsulare intraoperatoria e da quanta capsula si sia riusciti a conservare alla fine della vitrectomia. Riteniamo che l’impianto nel solco sia possibile con un appoggio capsulare residuo fibrotico di 200-250°. Qualora nella programmazione dell’impianto secondario non si riesca ad identificare con certezza durante la biomicroscopia la presenza del supporto capsulare, si può ricorrere all’ecografia ad alta frequenza del segmento anteriore nella quale, la capsula residua apparirà come una banda ad alta reflettività in posizione posteriore e grossolanamente parallela all’iride. Qualora non sia possibile l’impianto nel solco, la scelta sarà tra impianto in camera anteriore ed impianto a fissazione sclerale. Noi abbiamo abbandonato da tempo la prima soluzione per i noti problemi di questa tecnica (emorragie iridee, blocchi pupillari, dispersione di pigmento con atrofia iridea ed edema maculare, scompensi endoteliali, ecc.) preferendo l’impianto a fissazione sclerale pur consapevoli della maggior difficoltà di tale procedura chirurgica. Utilizziamo quindi la tecnica classica creando due sportelli sclerali per il fissaggio della sutura ed introducendo la IOL attraverso una apertura corneale limbare di dimensioni variabili a seconda del tipo di lentina utilizzata (rigida vs pieghevole). Crediamo che questa tecnica, pur consapevoli della maggior invasività, sia da preferire all’impianto della IOL in camera anteriore per il miglior risultato a lungo termine. Bibliografia 1. ANGRA SK, VAJPAYEE RB, TITIYAL JS, SHARMA YR, SANDRAMOULI S, KISHORE K. Types of posterior capsular breaks and their surgical implications. Ophthalmic Surg. 1991 Jul;22(7):388-91. 2. GUZEK JP, HOLM M, COTTER JB, CAMERON JA, RADEMAKER WJ, WISSINGER DH, TONJUM AM, SLEEPER LA. Risk factors for intraoperative complications in 1000 extracapsular cataract cases. Ophthalmology. 1987 May;94(5):461-6. 3. SCOROLLI L, CAMPOS EC, BASSEIN L, MEDURI RA. Pseudoexfoliation syndrome: a cohort study on intraoperative complications in cataract surgery. Ophthalmologica.1998;212(4):278-80. 4. Jaffe N. Cataract Surgery and its Complications, 3rd ed. St. Louis, CV Mosby, 1981, pp 368, 576–579. 35 Vitreo e chirurgia refrattiva Massimo Filippello – Edoardo Stagni Il ruolo nel vitreo nell’esame pre-operatorio Il visus La valutazione pre operatoria del visus è l’esame di maggior rilevanza in chirurgia refrattiva. L’esattezza della rilevazione è il cardine di una corretta valutazione delle aspettative post operatorie del paziente. In questi anni, si è avuta una notevole richiesta di interventi chirurgici refrattivi in pazienti in grado di correggere adeguatamente il proprio difetto di vista sia con occhiali che lenti a contatto. In questi casi, la chirurgia refrattiva diventa indubbiamente un intervento con pure finalità estetiche, piuttosto che mediche. Attualmente la giurisprudenza tende a separare nettamente le aspettative del paziente e le eventuali complicanze di un intervento chirurgico estetico da quelle di intervento chirurgico tradizionale. In effetti, le prestazioni professionali del chirurgo, soprattutto di quello estetico, sono state “riconsiderate” nel senso che può essere superato il tradizionale collocamento delle obbligazioni professionali tra quelle di “mezzi” e non di “risultato”. In mancanza di un adeguato consenso, il chirurgo può essere chiamato a rispondere del mancato raggiungimento del risultato che il paziente si attende piuttosto che del risultato chirurgico realmente possibile. È del tutto evidente che la responsabilità professionale del medico si ricollega alla obbligazione che egli assume, nei confronti del paziente, di eseguire un determinato trattamento medico-chirurgico, in 36 grado di soddisfare le aspettative del paziente sia in termini di correzione ottica residua che, soprattutto, in termini di visus naturale e corretto. Per tali ragioni, la presenza di patologie oculari in grado di modificare, sia pure transitoriamente, il visus naturale e corretto va attentamente studiata e analizzata ed infine spiegata Figura 1. Lacuna vitreale al paziente. Sappiamo che una patologia vitreale anche minima è presente nella quasi totalità dei miopi oltre 3 diottrie e oltre 35 anni di età15. Generalmente, un paziente desideroso di eliminare la propria dipendenza da una correzione ottica tradizionale tende a sottostimare le variazioni del visus legate al vitreo (figura 1). È comprensibile che un Figura 2. Sinchisi vitreale paziente che ha un visus naturale di 1/10 o meno, equivalente ad un difetto refrattivo miopico di almeno circa 1.5 diottrie, non si renda perfettamente conto che il suo visus si modifica ulteriormente e saltuariamente durante i movimenti del capo o in presenza di forti contrasti luminosi od, infine, con condizioni di scarsa luminosità. Viceversa dopo un intervento in cui le aspettative sono “adesso vedrò benissimo senza occhiali e per sempre” una modificazione transitoria del visus può essere collegata erroneamente a complicanze da chirurgia refrattiva. Pertanto nella stesura del consenso informato la fluttuazione del visus legata al vitreo va diligentemente rilevata dal Chirurgo e approvata dal paziente (figura 2). La ricerca di una patologia vitreale in grado di modificare il visus va fatta chiedendo al paziente di leggere l’ottotipo dopo aver fatto muovere gli occhi in tutte le posizioni di sguardo, come per un esame della motilità oculare. Se al termine dei movimenti oculari il paziente riferisce anche un semplice annebbiamento del visus si deve ritenere che esiste una patologia vitreale in grado di modificarlo (figura 3). È ovvio che in questi casi l’acutezza visiva registrata nel consenso informato deve essere la più bassa delle misurazioni registrate e non va considerata come letta una riga in cui è stato rilevato anche un solo errore. 37 Dato che la presenza di alterazioni vitreali determina una netta diminuzione del contrasto è sempre consigliabile eseguire anche un esame del visus con un ottotipo a contrasto e valutare la eventuale diminuzione del visus dopo la riduzione del contrasto dello schermo di almeno il 25%. Infatti, questa riduFigura 3. Ialinosi vitreale zione è approssimativamente quella che si determina in presenza di un ampia sineresi vitreale o di un corpo mobile filamentoso. Nel caso più eclatante di distacco posteriore di vitreo (figura 4) si può avere una fluttuazione visiva che riduce il visus anche a 1/10 o meno 5. I sistemi fin qui descritti per rilevare le modificazioni del visus vanno sempre abbiFigura 4. Distacco posteriore di vitreo nati ad un approfondito esame alla lampada a fessura. Anche in questo caso i corpi mobili vitreali tendono a depositarsi nella retina inferiore e solo dopo aver fatto muovere rapidamente l’occhio in alto e in basso e possibile vedere i filamenti vitreali muoversi in campo pupillare. Nel caso di un distacco posteriore di vitreo in genere le patologie vitreali tendono a rimanere confinate nel vitreo posteriore. In questi vasi una lente da 78 diottrie per l’esame del fundus e una focalizzazione della lampada proprio al davanti della retina consente di vedere senza difficoltà le patologie vitreali. Infine va ricordato che con una buon ecografo B scan è possibile vedere e dimostrare al paziente i corpi mobili vitreali. Pertanto l’esecuzione di una ecografia dovrebbe sempre completare la visita pre operatoria. Aberrazioni oculari e vitreo Nel calcolo complessivo delle aberrazioni correggibili con il laser ad eccimeri, sottratte quelle corneali certamente stabili e che incidono per circa il 80-90% sul totale delle aberrazioni oculari, il 10-20% rimanente va distribuito fra cristallino e vitreo. Le modificazioni del visus correlate ad un patologia vitreale si pos38 sono valutare in modo esaustivo anche attraverso l’esame delle aberrazioni oculari. Ricordo in estrema sintesi che, secondo la classificazione di Zernike, queste aberrazioni di distinguono in 7 ordini. Le aberrazioni di primo e secondo ordine sono sostanzialmente quelle che correggiamo con gli occhiali (difetti sferici e cilindrici), le aberrazioni di terzo ordine sono quelle che correggiamo con lenti a contatto su calco. Gli attuali link aberrometrici teoricamente riescono a correggere anche le aberrazioni di terzo e una buona parte di quelle di quarto ordine. Quasi sempre le aberrazioni oculari indotte dal vitreo sono estremamente complesse e, generalmente, dal quarto ordine in poi. È intuitivo che i movimenti della matrice vitreale generano quadri aberrometrici in continua variazione e proprio per questo motivo non correggibili con le attuali tecnologie. Pertanto, nel caso di chirurgia refrattiva con link aberrometrico bisogna cercare di sottrarre le aberrazioni vitreali dal programma operatorio. Come fare a riconoscere una aberrazione vitreale dalle altre aberrazioni oculari? Il modo più semplice e forse il migliore è quello di fare diverse mappe aberrometriche dopo aver fatto muovere gli occhi in tutte le posizioni di sguardo ed esaminare le differenze di ciascuna mappa. Se si notano differenze significative oltre il terzo ordine si tratta con grande probabilità di aberrazioni indotte da patologie vitreali che andranno attentamente studiate anche alla lampada a fessura e con una ecografia bscan. Un intervento laser con link aberrometrico che comprende erroneamente anche aberrazioni vitreali puo’ creare dei pattern fotoablativi con nuove aberrazioni oculari che, per la loro complessità, dovranno essere eliminate successivamente con un reintervento. Per queste ragioni, e considerato che le aberrazioni non corneali sono comunque sono un 10-20% del totale e forse prudente limitarsi alla semplice correzione aberrometria corneale nei casi un cui si è al corrente di una patologia vitreale. Il ruolo del vitreo nella scelta della tecnica refrattiva Sappiamo che le patologie vitreali sono più frequenti nelle miopie medio alte piuttosto che in quelle basse2. Lo studio del paziente refrattivo deve determinare la tecnica migliore e che dà le migliori aspettative al paziente ma anche deve, nei limiti del possibile, cercare di prevedere eventuali complicanze. Nella scelta della tecnica chirurgica adeguata va considerato sempre lo stato della matrice vitreale e l’eventuale possibilità di un suo deterio39 ramento a seguito dell’intervento refrattivo, o di un aggravamento della patologia vitreale già presente prima dell’intervento. Attualmente, non sono stati segnalate interferenze fra la tecniche di superficie e l’insorgenza di patologi vitreali. Viceversa, sono segnalate sia pur sporadicamente, la visione di corpi mobili vitreali e di distacco di vitreo a seguito di LASIK6-8 (figure 5 e 6). In particolare è possibile l’aggravamento di una patologia vitreale in pazienti con miopia elevata e con un vitreo già alterato quando si utilizza il microcheratomo. Infatti, la suzione necessaria per far aderire la lama alla cornea determina un aumento molto rapido (2-3 secondi) della pressione oculare che sale ad almeno 50 millimetri di mercurio o più. Al massimo della suzione è spesso evidente una midriasi e un temporaneo annebbiamento del visus. In quei pochi secondi la struttura vitreale viene fortemente compressa e la stessa arteria centrale della retina diminuisce rapidamente la perfusione. Al termine della sezione del flap la cessazione della suzione avviene nel giro di pochi secondi con una decompressione rapida della struttura vitreale. È indubbio che questa fase dell’intervento può costituire un trauma, sia pur lieve, per il vitreo. In questi casi la struttura fibrillare subisce una rapida compressione e decompressione che può spezzare alcune maglie di fibre collagene favorendo al formazione di lacune vitreali e di sineresi. Un paziente con una matrice vitreale ben rappresentata e senza corpi mobili è sicuramente in grado di superare il breve trauma da microcheratomo, tuttavia sarà opFigura 5. LASIK a 12 ore portuno nei giorni successivi all’intervento un esame accurato del vitreo e della periferia retinica allo scopo di valutare eventuali trazioni vitreo retiniche. Viceversa, in un occhio con una coroidosi miopica avanzata, dove lo stafiloma miopico è ampio e i legami del vitreo posteriore con la papilla sono estremamente deboli, si può avere un increFigura 6. LASIK a 24 ore mento dei corpi mobili vitreali e, in 40 casi predisposti, un distacco posteriore di vitreo (figura 7). Secondo uno studio di Luna e coll.9 condotto su 50 occhi con miopia moderata (fino a 3 diottrie) in pazienti senza patologie vitreali post operatorie, dopo lasik si è avuto un incidenza dell’8% di corpi mobili vitreali percepiti dal paziente. In un secondo gruppo di 50 occhi con miopia oltre 7 diottrie l’incidenza delle Figura 7. LASIK: quadro patologie vitreali è stata del 32% e di queoperatorio sti il 10% ha avuto un distacco di vitreo posteriore. Per tali considerazioni forse la scelta della tecnica va considerata in relazione alla situazione vitreo retinica del paziente. In presenza di alterazioni retiniche regmatogene può essere indicato anche un trattamento argon laser preventivo allo scopo di limitare eventuali trazioni vitreo retiniche. In conclusione, in un paziente da sottoporre a chirurgia refrattiva è bene valutare il tipo di tecnica in relazione oltre che alla entità del difetto di vista e alla presenza di patologie vitreali. Nel caso di tecniche intrastromali può essere utile eseguire un approfondito esame del fundus e del vitreo nell’immediato post operatorio. Bibliografia 1. VAN OVERDAM KA, BETTINK – REMEIJER MV, MULDER PG, VAN MEURS JC. Symptoms predictive for the later development of retinal break. Arch. Ophthalmol 2001 ;119 (10): 1483-1486. 2. WEBER KRAUSE B., ECKARDT C. Incidence of posterior vitreous detachment in the eldery. Ophthalmologie 1996; 93 (6) : 660-665. 3. TOLENTINO F. SCHEEPENS CL, FREEMAN H, Alterazioni vitreo retiniche 1975; 133-148. 4. SEBAG J. Age-related changes in human vitreous structure. Graefe’s Arch Clin Exp Ophthalmol 1987 225 (2) : 89-93. 5. HAYREH SS, JONAS JB. Posterior vitreous detachment: clinical correlations. Ophthalmologica. 2004 Sep-Oct;218(5):333-43. 6. AREVALO JF. Retinal complications after laser-assisted in situ keratomileusis (LASIK). Curr Opin Ophthalmol. 2004 Jun;15(3):184-91. 7. Kaohsiung J Med Sci. 2001 Nov;17(11):586-9. Giant tear retinal detachment after laser in situ keratomileusis--a case report. Kaohsiung J Med Sci. 2001 Nov;17(11):586-9. 8. AREVALO JF, RAMIREZ E, SUAREZ E, MORALES-STOPELLO J, CORTEZ R, RAMIREZ G, ANTZOULATOS G, TUGUES J, RODRIGUEZ J, FUENMAYOR-RIVERA D. Incidence of vitreoretinal pathologic conditions within 24 months after laser in situ keratomileusis. Ophthalmology. 2000 Feb;107(2):258-62. 9. LUNA JD, ARTAL MN, REVIGLIO VE, PELIZZARI M, DIAZ H, JUAREZ CP. Vitreoretinal alterations following laser in situ keratomileusis: clinical and experimental studies. Graefes Arch Clin Exp Ophthalmol. 2001 Jul;239(6):416-23. 41 Miodesopsie: un discomfort che richiede attenzione Il corpo vitreo, ritenuto un tempo come un organo residuale, è oggi considerato come un’importante struttura dell’occhio, soprattutto in considerazione degli stretti legami che esso assume con la patologia del segmento anteriore. Non vi è dubbio che le migliorate tecniche diagnostiche, le maggiori conoscenze fisiopatologiche e la maggiore attenzione data alle alterazioni vitreali hanno portato a considerare la patologia del corpo vitreo come un problema clinico di ampia portata ed una situazione in progressiva diffusione. Molti possono essere i fattori che determinano, a livello del corpo vitreo, alterazioni della sua struttura, omogeneità, aspetto e funzionalità. Con l’età avanzata la struttura vitreale può divenire più disomogenea, le fibre di collagene vanno incontro a rarefazione e contrazione (sineresi), la consistenza stessa può variare fino ad una perdita della sua tipica caratteristica (sinchisi). Accanto ai fattori già noti che sono in grado di determinare variazioni delle proprietà del corpo vitreo, come l’età, la miopia, alcuni farmaci, certi interventi chirurgici sul bulbo ecc., altri sono stati individuati e studiati più recentemente. Il corpo vitreo è un gel ed è straordinario che la piccola quantità di sostanze solide che lo compongono (il 99% circa è costituito da acqua) possano essere in grado di conferirgli una struttura semisolida. Il materiale solido costituisce meno dell’1% ed è formato da fibre di collagene (principalmente tipo II e IX), proteine, mucopolisaccaridi (acido ialuronico) e cellule vitree. I mucopolisaccaridi s’intersecano, insieme con gli altri costituenti, negli spazi compresi tra le fibre di collagene ma in maniera tale da consentire una perfetta trasmissione della luce. Le cellule (ialociti) che si distribuiscono verso la periferia del corpo vitreo, ma sono assenti in vicinanza del disco ottico, sono in grado di sintetizzare acido ascorbico e di produrre acido ialuronico. Nel corpo vitreo sono presenti altri componenti: albumina, globulina, zuccheri (circa la metà della concentrazione ematica), glucosamina. Nel corpo vitreo sono presenti anche numerosi elettroliti: sodio, potassio, calcio, cloruri, bicarbonato, fosfati ecc. Le principali funzioni del vitreo sono quelle di costituire un mezzo diottrico importante, di mantenere la sfericità del bulbo oculare, di proteggerlo da eventuali traumi da impatto e di favorire, attraverso la sua elasticità, le variazioni di curvatura del cristallino. Nella tarda età il volume del vitreo si riduce, il corpo vitreo tende a collassare (sineresi) mentre le fibre si ispessiscono, diventano tortuose e risultano circondate da vitreo liquefatto. Tutto ciò è stato ritenuto essere dovuto ad una riorganizzazione progressiva dell’acido ialuronico e delle fibre di collagene. Le patologie del corpo vitreo, escluse quelle congenite, sono legate alla degenerazione della sua microstruttura e vanno dalle opacità più o meno diffuse ai corpi mobili vitreali (miodesopsie), dal distacco posteriore del vitreo alla vitreopatia asteroide. E’ stato dimostrato che nei processi biochimici di invecchiamento del vitreo un ruolo importante è ascritto alle metalloproteinasi. Questi enzimi agiscono degradando le fibre connettivali, e pertanto anche quelle del collagene vitreali. Questo effetto diventa più aggressivo in seguito a progressiva carenza di enzimi protettivi.Tali situazioni si verificherebbero non solo nella miopia ma anche in tutte quelle situazioni dove i processi patologici determinano sofferenza dell’epitelio pigmentato. Tra tutti i sintomi delle alterazioni vitreali le miodesopsie, o floaters in inglese, (moscae volitan- tes o mosche volanti) rappresentano raramente un segno di seri problemi oculari. Più del 50% dei soggetti con più di 70 anni di età riferisce di vedere mosche volanti quando guardano il cielo sereno o sfondi chiari, come neve o una pagina di un libro, e ciò è dovuto al fatto che le fibre alterate e mobili si inseriscono nel cono di luce della visione e vengono cosi proiettate sulla retina. La loro forma è la più varia: filamentosa a, tela di ragno, macchie, punti scuri ecc. I corpi mobili vitreali si possono riscontrare nei miopi ma anche in pazienti con allergie alimentari o in pazienti affetti da candidiasi oculari. Quando il numero dei corpi mobili è piccolo non sta quasi mai a significare seri problemi, anche se il paziente può accusare un certo discomfort, ma un numero elevato di essi, soprattutto se dovessero apparire improvvisamente, o il rapido peggioramento di situazioni preesistenti richiede certamente un attento esame da parte dell’oculista. Questo è tanto più vero quando vengono contemporaneamente riferiti fosfeni o alterazioni del visus poiché ciò può preludere a trazioni retiniche, distacco posteriore di vitreo, emmorragie ecc. Molti corpi mobili si dissolvono nel tempo (ma possono anche ripresentarsi), altre volte sono avvertiti come poco fastidiosi. Il paziente viene informato e rassicurato sul fatto che se anche le mosche volanti dovessero rimanere costanti nel tempo ciò non costituisce pericolo o segno di malattia alcuna ma va posto tuttavia l'accento sul fatto che è importante ricorrere all’oculista in presenza di variazioni di forma e soprattutto del numero delle stesse. Le recenti conoscenze sembrano accreditare l’uso di sostanze in grado di inibire le metalloproteinasi preservando cosi le strutture vitreali da possibili aggressioni da parte di questi enzimi. Un’altra prospettiva di sicuro interesse è quella di contrastare il danno ossidativo da radicali liberi, ritardando cosi il progressivo invecchiamento del corpo vitreale. Nella prevenzione delle alterazioni del corpo vitreo o nel trattamento di situazioni che non richiedono terapie specifiche o interventi chirurgici (vitrectomia, interventi laser ecc.) la integrazione con sostanze che hanno proprietà tali da avere un ruolo nella fisiopatologia di diversi organi, e in quella del corpo vitreo in particolare, costituisce certamente una prospettiva di indubbio interesse. Questo fatto è tanto più vero quanto più incongruo è l’apporto dietetico o quanto più squilibrata è la dieta. L’utilizzo di VITREOXIGEN, un preparato a base di Lisina, Arginina, Carnitina, Potassio, Magnesio e Vitamine con estratti vegetali, ha trovato in questo settore larghi consensi, poiché risponde alla necessità di disporre di interventi terapeutici sempre più tempestivi e multifattoriali. Le diverse sostanze che sono alla base di VITREOXIGEN hanno tutte un ruolo nella fisiopatologia oculare e un’azione particolarmente importante a livello del corpo vitreo. Infatti gli aminoacidi presenti nel VITREOXIGEN,Arginina Carnitina e Lisina consentono la formazione di collagene di tipo II altamente presente a livello vitreale ; i sali minerali, quali Magnesio e Potassio, permettono il mantenimento del bilancio idrosalino della matrice vitreale; gli estratti vegetali, quali la Bromelina, consentono la protezione delle fibre di collagene dall’attacco di enzimi nocivi (collagenasi e metalloproteinasi); Ginseng e Guaranà elevano la soglia di resistenza dei tessuti vitreali all’azione di agenti nocivi esterni ed hanno ottimali proprietà di ricostituenti psicofisici; infine le Vitamine del guppo B sono importanti cofattori in tutte le reazioni metaboliche specifiche anche a livello vitreale. Grazie alle proprietà dei suoi costituenti il VITREOXIGEN contribuisce a migliorare il metabolismo cellulare, a mantenere la fisiologica composizione dei tessuti e ad aumentare le difese delle strutture del corpo vitreo. L’apporto di tali micronutrienti trova un razionale impiego, anche dopo l’intervento chirurgico della cataratta . La finalità è duplice, ridurre i corpi mobili vitreali che si rendono visibili al paziente dopo la sostituzione del cristallino, garantire un apporto energetico, utile dopo un intervento chirurgico. La formulazione in compresse effervescenti agevola l’assunzione del preparato contribuendo al processo di idratazione del vitreo. In definitiva il VITREOXIGEN grazie alla sua razionale e completa formulazione, permette il trattamento delle miodesopsie in maniera mirata e multifattoriale. La posologia consigliata è di una cpr effervescente al di sciolta in un bicchiere d’acqua (200ml.) al mattino o nella mattinata prima dei pasti.
Scarica