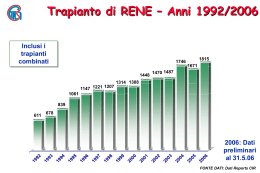
Trapianto Renale Trattamento di scelta per pazienti affetti da insufficicienza renale terminale (riduzione irreversibile filtrazione glomerulare <10 ml/min; creatininemia > 8 mg/dl) •60% pz uremici effettua emodialisi •10% “ “ effettua dialisi peritoneale •30% “ “ è trapiantato •Può essere eseguito anche in pazienti che non hanno effettuato ancora trattamenti dialitici cosiddetto “preemptive”. •Garantisce una migliore qualità di vita ed una maggiore sopravvivenza. •In Italia il tempo di attesa medio in lista per un trapianto renale è di circa 2.8 anni con mortalità annua ben superiore a quella dei pazienti sottoposti a trapianto renale. L’attività di trapianto di organi prevede: Il rispetto di Riferimenti normativi e delle procedure nelle varie fasi di prelievo e trapianto Accurati e scrupolosi criteri di selezione del donatore E del ricevente Una stretta collaborazione fra le figure professionali impegnate nelle fasi di prelievo e trapianto Una buona rete trapiantologica IL SISTEMA TRAPIANTI IN ITALIA COORDINAMENTO NAZIONALE (CNT) COORDINAMENTO LOCALE Il sistema trapianti in Italia COORDINAMENTO REGIONALE COORDINAMENTO INTERREGIONALE (AIRT-NITp-OCST) RETI TRAPIANTOLOGICHE IN ITALIA NITp (Nord Italia Transplant program ) Lombardia, Liguria,Provincia di Trento, Friuli Venezia Giulia Marche AIRT(Associazione interregionale trapianti) Piemonte,Val d’Aosta,Provincia Bolzano Emilia Romagna Toscana,Puglia OCST (Organizzazione Centro Sud Trapianti) Umbria,Lazio,Abruzzo Molise,Campania,Sardegna,Calabria,Sicilia LA LEGISLAZIONE IN ITALIA Il prelievo di organi o tessuti da vivente o da cadavere può essere effettuato ESCLUSIVAMENTE a scopo di TRAPIANTO TERAPEUTICO (art. 6 L. 91/99) Chi è il potenziale donatore? • Ogni soggetto in cui sia stata fatta diagnosi di morte in seguito a lesioni cerebrali esclusi i soggetti in cui esistano cause di inidoneità assoluta alla donazione legate al rischio di trasmissione di gravi patologie al ricevente. ” Accertamento della morte nei soggetti affetti da lesioni encefaliche e sottoposti a misure rianimatorie”. Art.3 del DM n° 582/94 La morte è accertata quando sia riscontrata la simultanea presenza delle seguenti condizioni: -Stato di incoscienza. Assenza di riflesso corneale, fotomotore, oculo-encefalico, oculovestibolare, reazioni a stimoli dolorifici portati nel territorio di innervazione del trigemino, riflesso carenale e respirazione spontanea Dopo sospensione della ventilazione artificiale fino a raggiungimento di ipercapnia accertata da 60 mmHg con pH ematico minore di 7,40. -Silenzio elettrico documentato da EEG. -Assenza respiro spontaneo La simultaneità di tali condizioni va rilevata almeno 3 volte: -inizio -metà -fine dell’osservazione. ” Accertamento della morte nei soggetti affetti da lesioni encefaliche e sottoposti a misure rianimatorie”. Periodo di osservazione 6 ore per gli adulti e i bambini in età superiore ai 5 anni, 12 ore per i bambini di età compresa tra 1 e 5 anni, 24 ore nei bambini di età inferiore ad 1 anno. Non si può procedere all’accertamento di morte Prima di 24 h da un insulto anossico Nel neonato con meno di una settimana di vita extra uterina Nel nato prima della 38^ settimana gestazionale ACCERTAMENTO MORTE CEREBRALE Collegio medico Anestesista rianimatore Neurofisiopatologologo Medico legale Condizioni di liceità del prelievo Accertamento della morte secondo il disposto della L. 29.12.1993, n. 578 Consenso reale o presumibile del soggetto che subisce il prelievo. OPPOSIZIONE ALLA DONAZIONE DI ORGANI In caso di morte possono verificarsi tre casi: il cittadino ha espresso in vita la volontà positiva alla donazione, in questo caso i familiari non possono opporsi: donazione si. il cittadino ha espresso volontà negativa alla donazione, in questo caso non c'è prelievo di organi: donazione no. il cittadino non si è espresso, in questo caso il prelievo è consentito se i familiari non si oppongono: donazione si/no. QUALI ORGANI NON SI POSSONO PRELEVARE? E’ VIETATO IL PRELIEVO DI GONADI CERVELLO IL PRELIEVO DI ORGANI PUO’ ESSERE EFFETTUATO SU Donatore deceduto a cuore battente (Hearth beating donor HBD è la situazione più frequente) Donatore deceduto a cuore fermo (Non Heart beating donor NHBD) Donatore vivente PRELIEVO DI ORGANI DA CADAVERE IN MORTE CEREBRALE Sicurezza del donatore e Valutazione del rischio di trasmissibilità Malattie infettive o neoplastiche INACCETTABILE AUMENTATO MA ACCETTABILE STANDARD RISCHIO NON VALUTABILE CALCOLATO Definizione dei livelli di rischio Rischio calcolato (criteri relativi a protocolli per trapianti elettivi) Rientrano in questo livello i casi in cui la presenza di uno specifico agente patogeno o stato sierologico del donatore è compatibile con il trapianto in riceventi che presentino lo stesso agente o stato sierologico, a prescindere dalle condizioni del ricevente. Vengono compresi in questo ambito anche i donatori con meningite in trattamento antibiotico mirato da almeno 24 ore e quelli con batteriemia documentate in trattamento antibiotico mirato. Sicurezza del donatore Valutazione del rischio di trasmissibilità Malattie infettive o neoplastiche Con il termine “Second Opinion” si intende il parere richiesto ad esperti del Centro Nazionale Trapianti che possono essere interpellati non solo per la verifica del rischio standard ma per ogni livello di rischio di trasmissibilità di malattie infettive e/o neoplastiche. . Definizione dei livelli di rischio Rischio standard Casi in cui dal processo di valutazione non emergono fattori di rischio per malattie trasmissibili. Qualora ci fossero dubbi vanno interpellati gli esperti del Centro Nazionale trapianti (Second Opinion). Definizione dei livelli di rischio Rischio aumentato ma accettabile. Rientrano in questo ambito i casi in cui, sebbene il processo di valutazione evidenzi la presenza di agenti patogeni o patologie trasmissibili, l'utilizzo degli organi è giustificato dalla particolare condizione clinica del/i ricevente/i, O dall’urgenza clinica del ricevente. Più specificatamente rientrano nel rischio aumentato ma accettabile quei casi in cui il rischio del non trapianto per il ricevente viene valutato sensibilmente superiore rispetto al rischio del trapianto Al momento in cui un paziente diventa candidabile per il trapianto con un organo a rischio aumentato, occorre ottenere il suo consenso informato In questi casi l’utilizzo del donatore non è precluso a priori. L’utilizzo degli organi deve essere valutato caso per caso, in funzione delle informazioni disponibili e/o delle particolari condizioni dei riceventi.Tali condizioni sono: Condizioni salvavita - a soggetti candidati al trapianto che si trovino in condizioni di urgenza clinica comprovata e peri quali, a giudizio del clinico trapiantatore, il beneficio atteso risulti superiore al rischio di contrarre l’infezione da HIV o altre patologie infettive non documentabili al momento della donazione; - a candidati che abbiano già una infezione da HIV. Condizioni elettive - a soggetti con documentata infezione da HIV al momento dell’inserimento in lista o a soggetti che non presentino l’infezione da HIV ma per i quali, a giudizio del clinico trapiantatore, il beneficio atteso risulti superiore al rischio di contrarre l’infezione da HIV o altre patologie infettive non documentabili al momento della donazione. Per il trapianto di rene tale condizione si identifica nella presenza di almeno uno tra i seguenti requisiti: -completa assenza di accessi vascolari e impossibilità di praticare terapia sostitutiva; -presenza in lista superiore a 10 anni; -condizione di iperimmunizzazione superiore all'80% per un periodo superiore a 5 anni;- altri casi particolari concordati con il Centro Nazionale Trapianti (CNT). In ogni caso è raccomandato avvalersi del parere degli esperti della Second Opinion del CNT Definizione dei livelli di rischio Rischio non valutabile. -mancanza di uno o più elementi di valutazione -documentati comportamenti ad elevato rischio di acquisizione di patologie infettive nelle 2 settimane non rilevabili anche con metodiche di biologia molecolare. Tali comportamenti sono: a) Uso di droghe per via parenterale; b) Rapporti sessuali mercenari o promiscui (omo o eterosessuali); c) Rapporti sessuali (omo o eterosessuali) con soggetti con documentata infezione da HIV; d) Esposizione a sangue di soggetto con sospetta infezione da HIV sia mediante inoculo che per contaminazione di ferite cutanee o mucose e) Detenzione in ambiente carcerario Definizione dei livelli di rischio Rischio inaccettabile Le seguenti condizioni rappresentano, se in atto, criteri di esclusione di idoneità assoluti. − Sieropositività da HIV1 o 2 (protocollo specifico) − sieropositività contemporanea per HBsAg ed HDV (protocollo specifico) − neoplasia maligna in atto ad alto potenziale metastatico; − infezioni sistemiche sostenute da microrganismi per i quali non esistono opzioni terapeutiche praticabili; − malattie da prioni accertate; VALUTAZIONE DELL’IDONEITA’DEL DONATORE MULTIORGANO CONDIZIONI DI ESCLUSIONE Diabete mellito di lunga durata Ipertensione arteriosa severa Vasculopatia retinica. Pregresso infarto del miocardio By-pass coronarico ,angina Vasculopatie severe sistemiche Episodi di ipotensione di lunga durata Oliguria Lunga permanenza in terapia intensiva. VALUTAZIONE DELL’IDONEITA’DEL DONATORE MULTIORGANO PATOLOGIE NEOPLASTICHE IN ATTO Se al momento del decesso il potenziale donatore è portatore di un tumore maligno, può essere donatore di organi, e viene considerato a rischio standard, nel caso si tratti di uno dei tumori seguenti: - Carcinoma in situ di qualsiasi organo; - Basalioma; - Carcinoma spinocellulare cutaneo senza metastasi; - Carcinoma papillifero dell’epitelio uroteliale (T1a secondo la classificazione TNM); - Carcinomi con potenziale metastatico particolarmente basso tanto da essere considerato trascurabile (carcinoma prostatico confinato alla ghiandola prostatica con score di Gleason totale combinato ≤ a 6 o parzialmente prevalente ≤ a 3 [ vedi “donatore positivo per PSA”]; - Carcinoma follicolare minimamente invasivo della tiroide e carcinoma papillifero capsulato della tiroide. DONATORE MULTIORGANO CON > DEL PSA valori di PSA totale < 4ng/ml SI TRAPIANTO valori di PSA totale inferiori a 10 ng/ml associati ad un valore del rapporto PSA libero/PSA >25% SI TRAPIANTO Qualora pur in presenza di un adenocarcinoma confinato all’interno della ghiandola prostatica ed esteso ad uno o ad entrambi i lobi, lo score di Gleason non presenti nessun campione esaminato con prevalente grado 4, il donatore può essere considerato a rischio standard. DONATORE MULTIORGANO CON > DEL PSA È necessario invece il consenso informato quando uno o più campioni presentano un prevalente grado 4 di Gleason e/o segni clinici, strumentali o istopatologici di estensione locale della neoplasia fuori della ghiandola prostatica. In questo caso si applicano le procedure del “rischio aumentato ma accettabile”. Rientrano nel “rischio inaccettabile” solo i casi di accertate metastasi linfonodali o a distanza. Nell’impossibilità di controlli istopatologici può essere utilizzata la metodica del PSA density Se il PSA density è ≤ a 0,01 ng/ml/g il donatore può essere considerato a rischio standard VALUTAZIONE DELL’IDONEITA’ DEL DONATORE MULTIORGANO PATOLOGIE NEOPLASTICHE PREGRESSE Se nell’anamnesi del potenziale donatore figura in passato una neoplasia potenzialmente trasmissibile con il trapianto, definita guarita, gli organi non sono in nessun caso utilizzabili per trapianto (donatore a rischio inaccettabile) nei seguenti casi: 1. siano trascorsi meno di 10 anni dalla diagnosi di guarigione a meno che non si tratti di neoplasie che anche quando in atto permettono di considerare il donatore a rischio aumentato ma accettabile. L’utilizzo degli organi segue le norme proprie della categoria “rischio aumentato ma accettabile”. 2. Carcinoma mammario; Melanoma; Leucemie; Linfomi VALUTAZIONE DELL’IDONEITA’ DEL DONATORE MULTIORGANO NEOPLASIE DEL SISTEMA NERVOSO CENTRALE 1. Rischio standard (portatori di neoplasia cerebrale giudicati idonei per la donazione di organi) neoplasie cerebrali benigne neoplasie cerebrali a basso grado di malignità (grado I WHO) 2. Rischio aumentato ma accettabile previo consenso informato (in assenza di fattori di rischio clinici*) neoplasie cerebrali maligne grado 2, 3 e 4 WHO ad eccezione dei tumori maligni a più elevato rischio metastatico (tumori embrionari, glioblastoma e gliosarcoma). VALUTAZIONE DELL’IDONEITA’ DEL DONATORE MULTIORGANO NEOPLASIE DEL SISTEMA NERVOSO CENTRALE 3. Rischio aumentato ma accettabile previo consenso informato solo in emergenza (in assenza di fattori di rischio clinici*) tumori embrionari glioblastoma gliosarcoma 4. Rischio inaccettabile neoplasie cerebrali maligne grado 4 WHO a maggior rischio di trasmissibilità tumorale in presenza di almeno uno dei fattori di rischio clinici* tumori embrionari glioblastoma gliosarcoma VALUTAZIONE DELL’IDONEITA’ DEL DONATORE MULTIORGANO NEOPLASIE DEL SISTEMA NERVOSO CENTRALE *Fattori di rischio clinici: lunga durata della malattia, precedenti interventi chirurgici, craniotomia, (shunt ventricolari) e/o i trattamenti radioterapici intensivi. Fanno eccezione gli interventi chirurgici cerebrali e le craniotomie eseguite a fini diagnostici contestualmente al prelievo o in un momento immediatamente precedente. NB: i melanomi ed i linfomi maligni del SNC rappresentano una condizione assoluta di rischio inaccettabile anche in assenza di fattori di rischio clinici. VALUTAZIONE INFETTIVOLOGICA DELPOTENZIALE DONATORE MULTIORGANO • (HIV-1, HIV-2) • Eepatite C • (HBsAg), anti-HBc; Epatite acuta • Cytomegalovirus (CMV) • Epstein-Barr virus (EBV), (in riceventiPediatrici ) • Sifilide attiva • Infezioni virali,sepsi, tubercolosi, infezioni ad eziologia sconosciuta • Storia familiare di malattia di Creutzfeldt-Jacob VALUTAZIONE INFETTIVOLOGICA DELPOTENZIALE DONATORE MULTIORGANO ECCEZIONI RICEVENTI GIA’ INFETTI Donatore HCV-positivo • In un ricevente HCV-positivo il trapianto è possibile dopo consenso informato. • In un ricevente HCV¬negativo esiste alto rischio di trasmissione.Trapianto solo in emergenza e dopo consenso informato. Informare CNT VALUTAZIONE INFETTIVOLOGICA DELPOTENZIALE DONATORE MULTIORGANO ECCEZIONI RICEVENTI GIA’INFETTI Donatore HBsAg-positivo • In un ricevente HBsAg-positivo (se HDV antigene è negativo) il trapianto è possibile previo consenso informato • In un ricevente HBsAg-negativo con elevato titolo anticorpale anti-HBs e HBc positività, il trapianto è possibile previo consenso informato • In un ricevente HBsAg-negativo con titoli anticorpali intermedio alti anti-HBs (Anticorpi Hbcnegativi), Il trapianto presenta un elevato rischio ma può essere eseguito previo consenso informato • In un ricevente HBsAg-negativo con anticorpi anti -Hbs non determinabili ,il trapianto è possibile solo in situazioni salvavita quando l’antigene HDV è negativo e previo consenso informato. VALUTAZIONE INFETTIVOLOGICA DELPOTENZIALE DONATORE MULTIORGANO Donatore positivo anticorpi anti HBc In un ricevente HBsAg-positivo o HBsAg-negativo con titolo anti-HBs _> 10mlU/mL il trapianto è possibile previo consenso informato. • In un ricevente HBsAg-negativo senza anticorpi anti-HBsAg il trapianto può essere effettuato solo se salvavita previo consenso informato. VALUTAZIONE INFETTIVOLOGICA DELPOTENZIALE DONATORE MULTIORGANO Rischio trasmissione HIV 1-2 In caso di evidenziazione, all'anamnesi, di situazioni a particolare rischio per infezione da HIV, sarà necessario dimostrare l'idoneità del donatore attraverso indagini biomolecolari mirate a restringere il più possibile il “periodo finestra”. In questi casi vale comunque quanto previsto per i donatori a rischio potenzialmente elevato per patologie infettive. Se non è possibile eseguire tali indagini, il donatore può essere utilizzato solo in casi di urgenza, oppure di particolari condizioni del ricevente, previo consenso informato e sentito il parere della Second Opinion nazionale. VALUTAZIONE DEL RISCHIO AL TAVOLO OPERATORIO Accertamento di tutti i sospetti, o elevati rischi, di malattie trasmissibili rilevati nelle fasi precedenti. − Ispezione e palpazione degli organi toracici (compresa l’esplorazione e la palpazione delle principali stazioni linfonodali profonde). − Ispezione e palpazione degli organi addominali (compresa quella dei reni, previa apertura e rimozione della capsula del Gerota e del grasso pararenale, ed ispezione della superficie convessa del rene sino al grasso ilare). Se dubbi prelevare esami bioptici ed eventuale parere second opinion POLITICHE PER INCREMENTARE IL NUMERO DI TRAPIANTI AUMENTO DEL POOL DEI DONATORI DECEDUTI -Espressione e registrazione in vita presso medico curante ,ASL della volontà di donare (riduzione opposizioni) -Utilizzo di Donatori subottimali(marginali) -Utilizzo di Donatori deceduti a cuore fermo (Non heart beating donors NHBD) VIVENTI -Maggiori informazioni all’atto dell’immissione in lista d’attesa su : -Migliori risultati del trapianto da vivente. -Possibilità del prelievo laparoscopico Trapianto “cross-over” quando una coppia consanguinea o emozionalmente relata si riveli biologicamente incompatibile, in presenza di almeno un’altra, o più coppie, che presentino un problema analogo, i donatori ed i riceventi delle singole coppie si incrociano in base a criteri di compatibilità biologica (problemi etici) DONATORI MARGINALI (subottimali) -Età >70 anni senza altri fattori di rischio. -Età compresa tra 60 e 70 anni con storia di diabete mellito,ipertensione,proteinuria >1 g/24h,danni vascolari retinici. -Clearance della creatinina clearance di 50 mL/min (I reni possono ancora essere idonei per trapianto singolo) -Clearance della creatinina < 50 mL/min(Gli organi dovrebbero essere usati per doppio trapianto o rifiutati se istologicamente anormali). -Se alla biopsia di entrambi I reni con almeno 25 glomeruli è presente approssimativamente il 5-20% di glomerulosclerosi gli organi possono essere valutati per trapianto singolo o doppio. -Se la glomerulosclerosi è>20% la decisione di idoneità al trapianto va presa caso per caso considerando la funzionalità renale. PRELIEVO DI RENI DA DONATORE A CUORE FERMO (Non Heart Beating Donor NHBD) VANTAGGI: AUMENTO DEL POOL DEI DONATORI PREVEDE: -ACCURATA SELEZIONE DEI POTENZIALI DONATORI (CRITERI DI MAASTRICHT) -ELEVATI LIVELLI ORGANIZZATIVI -POSSIBILITA’ DI MANTENIMENTO DEL POTENZIALE DONATORE IN CIRCOLAZIONE EXRACORPOREA PER LA MICROOSSIGENAZIONE (ECMO) -UTILIZZO DI DISPOSITIVI MECCANICI PER LA CONSERVAZIONE – PERFUSIONE CONTINUA DEI RENI PRELEVATI E MISURAZIONE DELLE RESISTENZE INTRAPARENCHIMALI Valuatazione del potenziale donatore Funzionalità renale (Creatinina clearance con formula di Cockroft-Gault) In alcuni centri livelli di 50 mL/min sono ai limiti inferiori per utilizzare I reniper 2 riceventi indipendentemente dalla biopsia. In altri centri viene valutata la glomerulosclerosi e la sclerosi arteriolare alla biopsia. Proteinuria 24 H Ecografia addome completo Biopsia renale (donatori subottimali). L’insufficienza renale acuta non rappresenta di per se una controindicazione.Il rene può essere utilizzato dopo una accurata valutazione Prelievo Multiorgano • L’attività di prelievo mette alla prova sia l’efficienza tecnica che quella organizzativa delle strutture impegnate. • Il prelievo multiorgano rende indispensabile la collaborazione tra le varie èquipes chirurgiche preposte al prelievo (Cardiochirurghi, Chirurghi generali, Urologi). • Una buona tecnica di prelievo rappresenta il presupposto fondamentale per la buona riuscita del trapianto. Prelievo Multiorgano Tecnica La tecnica del prelievo multiorgano è stata descritta da Thomas E. Starzl nel 1987. Fu ideata per i “donatori instabili” con alto rischio di arresto cardiaco. La razionalità di tale procedura risiede nella possibilità di perfondere “in situ” tutti gli organi effettuando, come primo atto chirurgico, l’incannulamento dell’aorta. Prelievo Multiorgano La tecnica ideale per il prelievo d’organi dovrebbe essere: rapida semplice flessibile sicura standardizzata efficace Prelievo Multiorgano Standardizzazione Maggiore collaborazione e Maggiore collaborazione e scambio scambio did’organi organi Flessibilità Organi che abitualmente Organi che abitualmente non vengononon trapiantati vengono trapiantati, ad es. l’intestino Efficacia Organi buona qualità Organi didibuona qualità con alti con alti tassi ripresa tassi di ripresadi funzionale funzionale immediata Prelievo Multiorgano Rapidità Minore possibilità che il donatore si destabilizzi Semplicità e Sicurezza Affidabilità indipendentemente dall’esperienza dell’operatore Prelievo Multiorgano Tecnica • Ribaltamento della matassa intestinale e isolamento dell’aorta sottorenale e la cava inferiore in prossimità della biforcazione • Legatura e sezione dell’arteria mesenterica inferiore Prelievo Multiorgano Tecnica • Dopo eparinizzazione del donatore (300 U/Kg di eparina sodica) si procede alla legatura dell’aorta al di sopra della biforcazione • Incannulamento dell’aorta con una cannula (12-18F) che viene connessa con un sistema di perfusione per gravità (circa 1 m di altezza) con soluzione Belzer,Celsior etc a 4°C • Prelievo Multiorgano Tecnica Contemporaneamente all’induzione dell’arresto cardiaco, provocato dall’infusione di soluzione cardioplegica nell’aorta, e all’incisione della vena cava inferiore in prossimità dell’atrio destro da parte del cardiochirurgo, l’équipe addominale clampa l’aorta sopraceliaca e da inizio alla perfusione degli organi addominali riempiendo l’addome con ghiaccio sterile Prelievo Multiorgano Tecnica Prelievo dei reni • Si isolano gli ureteri al di sotto dei vasi iliaci e si sezionano più distalmente possibile • Si seziona l’aorta e la cava alla biforcazione • Occorre identificare eventuali arterie renali polari che possono nascere anche dall’arteria iliaca comune • Si scolla bilateralmente in senso latero-mediale i reni con la capsula di Gerota dalla parete addominale posteriore fino alla colonna vertebrale Prelievo Multiorgano Tecnica Prelievo dei reni “en bloc” • Procedendo dall’alto verso il basso si prelevano i reni “en bloc” con aorta e cava distaccandoli lungo il piano del legamento vertebrale longitudinale Prelievo Multiorgano Tecnica Ultimato il prelievo dei reni prelevare e dividere -milza (se donatore non splenectomizzato in precedenza) -linfonodi iliaci e mesenterici -inviare insieme a ciascun rene al centro che eseguirà il trapianto per l’esecuzione dei test di istocompatibilità “cross-match” necessari in caso di difficile allocazione dell’organo. Preparazione su banco Separazione dei reni • Si comincia la separazione dei reni incidendo la parete aortica posteriore longitudinalmente tra gli osti delle arterie lombari • Si seziona la vena renale sinistra alla confluenza nella cava. La vena cava viene, quindi, lasciata con il rene destro per dare modo a chi eseguirà il trapianto di poter allungare la vena renale Preparazione su banco Separazione dei reni • Si incide longitudinalmente la parete anteriore dell’aorta in modo da lasciare un patch aortico per le arterie di entrambi i lati e si separano i reni • I reni vengono completamente liberati della capsula adiposa ed ispezionati. • Biopsia a cuneo (ove richiesto) polare inf per valutazione idoneità trapianto singolo doppio o non idoneità al trapianto. Preparazione su banco Separazione dei reni • • Per ottenere una uniforme ipotermia dell’organo si procede alla perfusione su banco con soluzione a 4 °C per ciascun rene fino alla fuoriuscita di liquido limpido Ciascun rene viene conservato in 3 involucri sterili, immerso nello stesso liquido di perfusione, circondato dal ghiaccio (nel 2° sacchetto) per mantenerlo a temperatura di 4 °C e riposto in un contenitore termico Perfusione • Un’efficace protezione dell’organo da trapiantare è un presupposto fondamentale per la sua ripresa funzionale • Il principale problema legato alla conservazione degli organi è l’ipossia per l’interruzione del flusso ematico Ipossia Esaurimento delle riserve energetiche intracellulari Cessazione dei processi metabolici Aumento dell’attività catabolica Danno progressivo e irreversibile Conservazione del rene Esistono due metodi per la conservazione del rene Perfusione iniziale a “caduta” e successiva conservazione in contenitore frigo con ghiaccio Conservazione e contemporanea Perfusione pulsatile meccanica continua in appositi dispositivi (molto utile per I donatori subottimali e per i donatori a cuore fermo NHBD. Soluzioni utilizzate per la perfusione Celsior UW- (University of Wisconsin) HTK-(istidina-triptofano-chetoglutarato) Sono attualmemte quelle utilizzate sia in corso di prelievo multiorgano che per il prelievo dei reni Ipossia Prelievo Multiorgano Tempo di Ischemia Calda Intervallo tra l’interruzione del flusso ematico e l’inizio della perfusione fredda Tempo di Ischemia Fredda Intervallo tra l’inizio della perfusione durante il prelievo e la rivascolarizzazione dell’organo al momento del trapianto Prelievo Multiorgano Ischemia fredda Conservazione in ischemia fredda degli organi: – Reni 36-48 hr – Cuore 6 hr – Fegato 6-8 hr – Polmone 3-4 hr Il donatore vivente Vantaggi della donazione da vivente -Risultati migliori a breve e lungo termine -Ripresa precoce della funzione renale -Riduzione dei tempi di attesa del trapianto -Programmazione intervento -Immunosoppressione meno aggressiva -Aumento numero di trapianti -Il prelievo con tecnica laparoscopica o Robot assistita può incoraggiare la donazione ed aumentare ulteriormente il numero di trapianti. DONATORE VIVENTE Chi può donare? Genitori ; Fratelli/Sorelle; Figli (maggiorenni); Parenti prossimi (zii, cugini); Coniugi o conviventi (con un rapporto di familiarità stabile da almeno 3 anni); • Soggetti "affettivamente vicini” (“emotionally related") al paziente. • • • • • DONATORE VIVENTE Controindicazioni alla donazione da vivente • • • • • • • • • • • • • • • • • Età < 18 aa. Incapacità di esprimere il proprio consenso Evidenza di coercizione Abuso di droghe Evidenza di neoplasia maligna Gravidanza Malattie cardiovascolari e respiratorie maggiori Diabete mellito Nefropatie Malattie sistemiche con interessamento renale Aumentato rischio di tromboembolia Obesità (BMI >35) Infezioni in atto Epatite B,C Infezioni da HIV Ipertensione in trattamento con danno d’organo Aumentato rischio chirurgico e/o anestesiologico DONATORE VIVENTE CONTROINDICAZIONI RELATIVE ALLA DONAZIONE DA VIVENTE •INFEZIONI CRONICHE ATTIVE (TBC,EPATITE B/C PARASSITOSI • OBESITA’ • DISORDINI PSICHIATRICI DONATORE VIVENTE VALUTAZIONE DEL POTENZIALE DONATORE VIVENTE -ANAMNESI -ESAME OBIETTIVO -ESAMI EMATOCHIMICI DI ROUTINE -ESAMI SIEROLOGICI (EBV-CMV-HBV-HCV-HIV) -ESAME STANDARD DELLE URINE -URINOCOLTURA -CREATININA CLEARANCE E PROTEINURIA 24h -CONTROLLO DI IPERTENSIONE ARTERIOSA BORDERLINE -ANGIO-TC (IN CASI PARTICOLARI ANGIOGRAFIA) DONATORE VIVENTE Approccio chirurgico per il prelievo da vivente • Transperitoneale (incisione mediana o sottocostale) • Extraperitoneale (sopra o sottocostale) • Incisione dorso-lombare (extraperitoneale, extrapleurica) • Laparoscopica (Transperitoneale o retroperitoneale). Laparoscopico Robot assistito Donatore vivente Prelievo di rene con tecnica laparoscopica o robot assistita Vantaggi • Minor dolore post operatorio • Minima cicatrice chirurgica Rapido ritorno alle proprie attività lavorativa Ridotta degenza ospedaliera Miglior visione dei vasi renali Incoraggia la donazione Svantaggi • Lo Pneumoperitoneo può compromettere il flusso renale • Tempi oeratori più lunghi Danni o Perdita del graft durante la curva di apprendimento . DONATORE VIVENTE Scelta del rene da prelevare In genere a causa della maggior lunghezza della vena è preferibile prelevare il rene sinistro. Se esistono anomalie o un rene è di piccole dimensioni,al donatore va lasciato il rene “migliore” Trapianto Classificazione Nuova definizione Vecchia definizione Relazione fra donatore e ricevente Singenico Isogenico Autograft Isograft Stesso individuo Stessa specie individui geneticamente identici Allogenico Omograft Stessa specie ma non geneticamente identici Xenogenico Eterograft Specie differente •Controindicazioni relative al trapianto renale Età (?) • Co-morbidità ( cardiovascolari, malattie complesse, gastroenteriche) • Malattie renali ad elevata recidiva etc etc) • Obesità ( BMI > 30) • Neoplasie in anamnesi • Malformazioni maggiori delle vie urinarie OBESITA’ BMI (peso/sup. corp.) >= 30 Aumentato Rischio di complicanze post trapianto: cardiovascolari infettive polmonari rischio anestesiologico ferita chirurgica diabete Riduzione della sopravvivenza del graft e del paziente Controindicazioni assolute al trapianto renale • • • • Neoplasie in atto o non adeguatamente risolte Insufficienza di organi salvavita non sostituibili Gravi vasculopatie generalizzate Psicopatie non compatibili con adeguata compliance Valutazione del candidato al trapianto renale Valutazione cardiologica Ecocardiografia (malattie valvolari,cardiomiopatie, disfunzioni ventricolari) • ECG sotto sforzo,Scintigrafia o Ecocardiografia sotto sforzo in pazienti con ridotta capacità sotto stress • Coronarografia nei casi sospetti soprattutto nei pazienti in dialisi,anziani,diabetici TRATTAMENTO IN PRESENZA DI MALATTIA CORONARICA acuta (C.A.D) C.A.D. NON CRITICA TER. MEDICA IDONEITA’ TRAPIANTO C.A.D. CRITICA RIVASCOLARIZZABILE PTCA o BY-PASS TEST C.A.D. CRITICA NON RIVASCOLARIZZABILE NON IDONEITA’ TRAPIANTO Valutazione del candidato al trapianto renale VALUTAZIONE VASCOLARE -Ecodoppler arterioso aorto iliaco femorale e tronchi sovraaortici -Ecodoppler venoso cavo-iliaco femorale -Rx diretta addome (calcificazioni) -Angio TC Valutazione del candidato al trapianto renale Diabete mellito Il diabete mellito non è una controindicazione al trapianto se non sono presenti altre severe controindicazioni. Nei pazienti con Diabete mellito di tipo I è preferibile il trapianto combinato rene-pancreas (miglior controllo della glicemia e lenta progressione delle malattie vardiovascolari) Valutazione del candidato al trapianto renale Coagulopatie Dosaggio di: Antitromnina III Proteina C Proteina S Anticorpi anti fosfolipidi Fattore V (soprattutto nei pazienti con trombosi ricorrente della fistola per emodialisi o altri eventi trombosi) Valutazione del candidato al trapianto Malattie che potrebbero richiedere un trattamento prima del trapianto Diverticolosi Diverticolite Colelitiasi Iperparatiroidismo Valutazione del candidato al trapianto renale SCREENING GASTROENTEROLOGICO GASTROSCOPIA sostituisce Rx Digerente poiché evidenzia piccole ulcere,gastriti erosive,micosi,permette biopsia di lesioni dubbie,asportare polipi,ricerca H.P. RICERCA H.P. consigliato Urea Breath Test, i test sierologici si negativizzano più tardi ECO ADDOME controllo fegato, colecisti, milza, (reni nativi, aorta addominale) TAC ADDOME se , anamnesi pos. per più di 3 peritoniti o peritoniti fungine o da pseudomonas RX CLISMA OPACO in alcuni casi pancolonscopia se età > 50 anni, anamnesi dubbia per diverticolite, familiarità per K colon Valutazione del candidato al trapianto renale SCREENING APPARATO RESPIRATORIO RX TORACE PROVE DI FUNZIONALITA’ RESPIRATORIA VISITA PNEUMOLOGICA PPD o MANTOUX CAUSE DI ESCLUSIONE BRONCHIECTASIE NON BONIFICABILI BPCO SEVERA Valutazione candidata al trapianto renale SCREENING GINECOLOGICO PAP TEST VISITA GINECOLOGICA Se >=40 anni (<30 aa se anamnesi familiare positiva per neoplasia mammaria) MAMMOGRAFIA A discrezione del ginecologo ECOTOMOGRAFIA PELVICA ECOTOMOGRAFIA TRANSVAGINALE Valutazione candidato altrapianto renale SCREENING APPARATO URINARIO ECOTOMOGRAFIA RENALE URETROCISTOGRAFIA RETROGRADA E MINZIONALE PSA ESAME URINE STANDARD URINOCOLTURA CON ANTIBIOGRAMMA ESAME URODINAMICO (Disfunzione vescico uretrale vescica neurologica) Se nefropatia policistica o reperti ecografici di cisti sospette TAC ADDOME Valutazione candidato al trapianto renale SCREENING ODONTOSTOMATOLOGICO RX PANORAMICA DENTARIA VISITA ODONTOIATRICA BONIFICHE DENTARIE GRANULOMI INFEZIONI CARIE CONSIGLIATA DETARTRASI PERIODICA Valutazione candidato al trapianto renale ASPETTI PSICOSOCIALI NON COMPLIANCE PATOLOGIE PSICHIATRICHE ALCOOL O DROGHE Programma di riabilitazione Documentazione di astinenza e sobrietà Supporto familiare e psichiatrico ASPETTI SOCIALI Pazienti anziani soli Valutazione candidato al trapianto renale Pazienti con rene trapiantato in sede,e non funzionante In genere non è necessario procedere all’espianto Se il graft diventa sintomatico o se sono presenti rischi correlati alla immunosoppressione procedere all’espianto O in alternativa all’embolizzazione Valutazione candidato al trapianto renale Screening Infettivologico Tests sierologici per HBV, HCV, HIV, TBC (CMV),Treponema pallidum . La valutazione sierologica di HBV e HCV è particolarmente importante poichè l’epatite virale è la maggior causa di malattia epatica dopo trapianto e contribuisce ad un considerevole aumento di morbidità e mortalità post trapianto CMV: la terapia immunosoppressiva può far sviluppare infezioni da CMV HIV L’infezione da HIV è una controindicazione per il trapianto.Alcuni studi dimostrano che iltrapianto può avere successo nei casi ben controllati (carica batterica non determinabile e nei pazienti HIV pos. trattati) TBC Una anamnesi positiva per TBC è importante poichè adeguate misure preventive (profilassi con isoniazide) possono evitare la riattivazione in coso di immunosoppressione.. Test per il T. pallidum in casi selezionati (comportamenti a rischio) Valutazione candidato al trapianto renale NEOPLASIE : periodo di attesa consigliato prima dell’immissione in Lista Attesa Trapianto (LAT) TIPO ADENOK RENALE K VESCICALE focale (TaG1) infiltrante K PROSTATA nodo isolato (T1-2 PSA<10) diffuso K MAMMELLA K UTERO in situ diffuso K COLON-RETTO K CUTE non melanoma melanoma ATTESA PRE LAT 5 aa 5 aa no tx 5 aa no tx 5 aa 2 aa 5 aa 5 aa 2 aa ( >5 aa) no tx Valutazione candidato al trapianto renale PREVENZIONE NEOPLASIE periodicità dei controlli Tipo esame Età pz. Periodicità Sigmoidoscopia aa PAP test Eco pelvico Mammografia PSA > 50 aa > 20 aa > 20 aa >=35 <=50 aa > 50 aa > 40 aa 3-5 aa (2 annuale annuale 2 aa annuale 2 aa Candidato al trapianto renale BONIFICHE UROLOGICHE NEFRECTOMIA per - RENI POLICISTICI DI GROSSE DIMENSIONI (creare lo spazio per il trapianto) E/O SINTOMATICI (ematuria,cisti infette,dislocazione organi addominali) - CALCOLOSI INFETTA - REFLUSSO VESCICO URETERALE IV GRADO con Infezioni urinarie non rispondenti all’antibioticoterapia -IPERTENSIONE NEFROVASCOLARE AMPLIAMENTO VESCICALE per VESCICA A BASSA COMPLIANCE Derivazioni sovrapubiche o tasche continenti per deficit sfinterico TRAPIANTO E GRAVIDANZA Pianificare la gravidanza almeno 1 – 2 anni dopo il trapianto. In caso di gravidanza dopo alcuni anni dal trapianto potrebbe svilupparsi rigetto cronico o deterioramento della funzionalità renale. Il riconoscimento precoce della gravidanza è importante per monitorare modificare la terapia immunosoppressiva appena possibile. Fattori che possono alterare il graft in gravidanza • variazioni emodinamiche •ipertensione • rigetto •infezioni urinarie (controllare mensilmente urinocoltura ) Precauzioni per il feto Se batteriuria trattare con penicillina o cefalosporine. Infezioni virali (CMV) possono provocare ritardo mentale L’idronefrosi può rendere la gravidanza a maggior rischio per l’aumentata incidenza di infezioni urinarie e litiasi che possono peggiorare nell’ultimo trimestre. TRAPIANTO E GRAVIDANZA Il numero di aborti spontanei o terapeutici nelle trapiantate è simile a quello della popolazione generale. IL PARTO PER VIA VAGINALE NON È ostacolato dalla presenza del graft TAGLIO CESAREO PER: -alta incidenza di prematurità -Ipertensione incontrollata -Rottura delle membrane (indebolite dai coticosteroidi) -Sofferenza fetale I neonati possono presentare basso peso alla nascita (20%) Le malformazioni congenite sono a quelle sovrapponibili alla popolazione generale IMMUNOSOPPRESSIONE IN GRAVIDANZA Ciclosporina con o senza azatioprina e prednisone (passano la barriera placentare ed apparentemente non teratogeni). La concentrazione plasmatica di ciclosporina varia soprattutto nel 3 trimestre per aumento del volume di distribuzione e va spesso aumentato il dosaggio) Tacrolimus altrettanto sicuro e ben tollerato Mycofenolato Mofetil (MMF) e Sirolimus Controindicati per effetti teratogeni. EVITARE ALLATTAMENTO AL SENO PER POSSIBILE INGESTIONE DI IMMUNOSOPPRESSORI Fattori che possono alterare il graft in gravidanza • variazioni emodinamiche •ipertensione • rigetto •infezioni urinarie TRAPIANTO RENALE TECNICA CHIRURGICA PREPARAZIONE DEL RENE DA TRAPIANTARE •Posizionare il rene in una bacinella contenente ghiaccio sterile •Controllare eventuale presenza di tumori Arteria • Preservare il patch aortico controllare’l’intima • Accurata linfostasi dell’ostio renale Ancoraggio di placcche con punti in prolene 6/0 Vena con doppio passaggio interno esterno per •Su banco eventuale plastica di evitare la mobilizzazione (flap) o migrazione. allungamento della vena renale • In caso di marcata ateromasia dell’ostio utilizzando il patch cavale in caso di rimuovere il patch aortico. rene destro. • In caso di arterie multiple eseguire ricostruzioni su banco Preservare le arterie polari soprattutto polari inf. ( vascolarizzazione dell’uretere ) Uretere • Preservare il grasso peripielico prossimale e periureterale (vascolarizzazione ureterale) •Controllare duplicità ureterale Eseguite le eventuali ricostruzioni vascolari Perfondere il rene (Celsior-Wisconsin fredda) fino alla fuoriuscta dalla vena di liquido chiaro. TRAPIANTO RENALE TECNICA CHIRURGICA PREPARAZIONE DEL RENE DA TRAPIANTARE -Sutura di eventuali biopsie renali con interposizione di agenti emostatici. -Perfondere il rene attraverso il tronco pincipale e rami accessori con soluzione Celsior o Wisconsin fredda 4° fino alla fuoriuscita dalla vena di liquido chiaro. -Maneggiare con estrema delicatezza l’ostio arterioso evitando lesioni dell’intima con la cannula di perfusione. Controllare fuoriuscite di liquido di perfusione dall’ilo renale, dal sito della biopsia dalle pareti vascolari mantenendo la perfusione e chiudendo distalmente la vena renale Sutura dei punti di fuoriuscita del liquido di perfusione. TRAPIANTO RENALE TECNICA CHIRURGICA Tx extraperitoneale Fossa iliaca destra o sinistra • • • • • • • • • • semplice preparazione della “tasca” per accogliere il rene semplice preparazione dei vasi iliaci esterni buona portata ematica rispetto della circolazione pelvica del ricevente scarso rischio di infezioni poca distanza fra rene e vescica (uretere corto) facile controllo clinico e strumentale del rene agevole esecuzione di manovre strumentali Esecuzione più semplice di eventuali reinterventi decorso dei vasi iliaci esterni superficiale TRAPIANTO RENALE TECNICA CHIRURGICA Tx intraperitoneale (anastomosi vascolari termino-laterali con aorta e cava inf) Si esegue: • pazienti già trapiantati • Tx di rene adulto in bambino • Tx di reni “en bloc” TRAPIANTO RENALE TECNICA CHIRURGICA VIA D’ACCESSO Laterale pararettale a “J” rovesciata sec. Gibson ottima luce vasi iliaci Monolaterale Poco anatomica Possibili lesioni vasi epigastrici, nervo femorocutaneo Ricostruzione parete indaginosa Accesso controlaterale impossibile Alto rischio di laparocele Cicatrice antiestetica Mediana ombelico-pubica buona luce vasi iliaci Possibile accesso bilaterale Vasi e nervi indenni Ricostruzione parete semplice Basso rischio laparocele Cicatrice anatomica Non interferisce nell’approccio percutaneo al rene TRAPIANTO RENALE TECNICA CHIRURGICA Tx Renale Ortotopico Rene da donatore vivente o cadavere collocato in sede ortotopica (loggia renale) Nefrectomia sin nel ricevente ed utilizzo dei vasi renali o splenici Da valutare per Problemi vascolari vasi iliaci ricevente Retrapianto TRAPIANTO RENALE TECNICA CHIRURGICA ANASTOMOSI VASCOLARI Termino-laterale: Vena renale con vena iliaca est o comune arteria renale con arteria iliaca est o comune Termino-terminale: Arteria renale con arteria iliaca int (aumenta rischio stenosi, deficit erettile). Da utilizzare in particolari occasioni: brevità arteria renale,assenza di patch (trapianto da donatore vivente) TRAPIANTO RENALE TECNICA CHIRURGICA ANASTOMOSI VASCOLARI -Minima dissezione dell’asse vascolare per ridurre il vasospasmo -Accurata linfostasi per ridurre l’insorgenza di linfocele -Ispezione e palpazione dell’arteria iliaca per eseguire clampaggio ed anastomosi in zone libere da placche calcifiche -Valutare accuratamente la lunghezza dei vasi per evitare trazioni o kinkig -suture vascolari in monofilamento non riassorbibile 5/0 o 6/0 -Controllare la perfusione del rene al declampaggio e dopo il suo posizionamento nella tasca precedentemente preparata. -Se dubbi sulla perfusione rimuovere le suture vascolari e riperfondere il rene fino alla fuoriuscita dalla vena di liquido chiaro e rieseguire le anastomosi. TRAPIANTO RENALE TECNICA CHIRURGICA ANASTOMOSI VASCOLARI Problemi vascolari nel ricevente • Se le arterie iliache non consentono un adeguato clampaggio,può essre eseguita una endoarteriectomia o l’utilizzo simultaneo di una protesi vascolare. • Se è stata precedentemente adoperata una protesi vascolare,per l’anastomosi con la protesi è opportuno adoperare un perforatore arterioso (aortic punch) TRAPIANTO RENALE TECNICA CHIRURGICA Anastomosi ureterale • Il reimpianto ureterale Extravescicale sulla parete anterolaterale della vescica con tecnica antireflusso è da preferire . (migliori risultati rispetto alla tecnica intravescicale. •Va posizionato uno stent ureterale doppio J a protezione dell’anastomosi che va rimosso 3- 4 settimane dopo il trapianto. • L’anastomosi dell’uretere del graft con l’uretere nativo va utilizzata in caso di uretere molto corto, scarsamente vascolarizzato,in caso di terzo trapianto o nei pazienti pediatrici. COMPLICANZE MEDICHE DEL TRAPIANTO RENALE Infettive (CMV,VZV,EBV,Epatite,infezioni ospedaliere,parassitosi) Tumori ( più frequenti cutanei,ematologici,) Cardiovascolari(ipertensione,coronaropatie) Ematologiche (anemia,eritrocitosi,neutropenia) Gastrointestinali (iperplasia gengivale,esofagiti da candida,diarrea) Metaboliche Diabete iperlipidemia ipercalcemia,iperparatiroidismo) • Ossee (osteoporosi,necrosi ossee) • Oculari (cataratta,retiniti,lesioni erpetiche) • • • • • • COMPLICANZE MEDICHE DEL TRAPIANTO RENALE • Necrosi tubulare acuta • Rigetto Iperacuto (min poche ore dovuto ad anticorpi citotossici preesistenti nel ricevente) • Rigetto Accelerato (7-10gg Linfociti T e B capaci di produrre una risposta anti graft) • Rigetto Vascolare (primi 2 mesi può essere reversibile switch terapia immunosoppressiva) • Rigetto cronico (24 mesi) • Farmaco tossicità (nefropatia tubulo interstiziale,Ialinosi arteriolare • Sindrome emolitico-uremica • Recidiva nefropatia originaria • Nefropatia “de novo” COMPLICANZE CHIRURGICHE DEL TRAPIANTO RENALE Ascesso parete addominale Fattori di rischio :obesità diabete,ematoma,immunosoppressione Trattamento: Se superficiale :piccola apertura della parete. Se profondo :revisione chirurgica. Escludere fistola urinosa. Emorragia Fattori di rischio : -Terapia anticoagulante antiaggregante. -Inadeguata preparazione dell’ilo renale -Arterie renali multiple -Biopsie renali -Rigetto iperacuto Trattamento: Ematoma voluminoso o sanguinamento eseguire revisione chirurgica Ematuria Dopo biopsia del graft considerare fistola artero venosa Trattamento regressione spontanea, eventuale embolizzazione percutanea selettiva. COMPLICANZE UROLOGICHE DEL TRAPIANTO RENALE • • Precoci Tardive Fattori favorenti • Tecnica chirurgica (mancato rispetto vascolarizzazione ureterale) Prelievo Chirurgia su banco Trapianto • Terapia immunosoppressiva • Stato uremico ricevente COMPLICANZE UROLOGICHE Precoci • UTI • Fistola vescicale • Cause: deiscenza cistotomia, vescica defunzionalizzata, pregressa chirurgia vescicale • Diagnosi: Riduzione diuresi, iperpiressia, ileo paralitico • Diagnosi strumentale: Cistografia • Trattamento: Cateterismo protratto, reintervento • Fistola ureterale • Cause: eccessiva scheletrizzazione uretere, sezione di art. polare inf.Non utilizzo stent ureterale • Trattamento: nefrostomia, stenting, UCNS COMPLICANZE UROLOGICHE Precoci • Fistola pielica • Cause: incerta, ischemia parcellare renale? • Trattamento: nefrostomia a permanenza, pieloplastica, espianto • Reflusso vescico-ureterale • Cause: correlate alla tecnica di UCNS • Diagnosi: iperpiressia, decremento funz. Renale • Diagnosi strumentale: Cistografia tradizionale o con radionuclidi • Trattamento: antibiosi, bulking, UCNS • Linfocele • Cause: Interruzione vasi linfatici iliaci perivascolari o linfatici del graft,obesità,immunosoppressione m-TOR • Diagnosi: dolore, tensione, iperpiressia, idronefrosi, edema arti inf • Diagnosi strumentale: ecografia, TC • Trattamento: drenaggio ecoguidato, sclerotizzazione, marsupializzazione VLP • Trattamento chirurgico dopo fallimento altri trattamenti COMPLICANZE UROLOGICHE Tardive • Stenosi uretere – Cause: patologia intrinseca dell’uretere (S. Giunto Pielo-ureterale), infezioni, ascessi, linfocele, fibrosi peri anastomotica, ischemia ureterale – Diagnosi: decremento funz. renale, oliguria, iperpiressia, ipertensione – Diagnosi strumentale: ecografia, ureteropielografia – Trattamento: nefrostomia, stenting ureterale anterogrado o retrogrado, UCNS • LAPAROCELE • Fattori di rischio : • Obesità,diabete,ematoma,rigetto,utilizzo mTOR inibitori. • Trattamento :riparazione chirurgica con o senza mesh . COMPLICANZE VASCOLARI Trombosi arteria renale • Cause:aterosclerosi.rottura dell’intima,anastomosi non correttamente eseguita ,kinking arteria,arteria più lunga della vena,arterie multiple • Sintomi: primary non function,anuria. • DiagnosiEcocolor doppler,Angioscintigrafia (%) • Trattamento: trombectomia radiologica entro le prime 12 h. 0.9-3.5 • Revisione chirurgica. • Spesso a causa della sofferenza ischemica è necessario rimuovre il graft 0.9-7.6 • Trombosi della vena renale • • • • • 1.6-12 Cause :Anastomosi non correttamente eseguita,eccessiva lunghezza vena ? Sintomi primary non function , ematuria , anuria Diagnosi EcocolorDoppler . Trattamento :la trombectomia di salvataggio spesso non èefficace e quindi è necessario espiantarei l rene. Complicanze vascolari Stenosi arteria renale Sintomi Ipertensione,aumento della creatinina in assenza di idronefrosi. Diagnosi:Ecocolor Doppler Angio-Tc Angiografia Trattamento:trattamento medico e attento follow-up Dilatazione transluminale percutanea con o senza stent se la stenosi è > 70% Intervento chirurgico per stenosi anastomotiche o dopo fallimento di dilatazione percutanea. Fistola artero-venosa Sintomi :ematuria Diagnosi:Ecocolor doppler Angiografia Trattamento: regressione spontanea Se ematuria persistente o diametro >15mm embolizzazione selettiva Aneurisma Cause:infezione micotica Trattamento :Espianto renale FARMACI IMMUNOSOPPRESSORI Corticosteroidi: immunosoppressione aspecifica Effetti indesiderati:sindrome metabolica,dislipidemia,aumento ponderale,osteoporosi,osteonecrosi,cataratta,ipertensione,alterazioni comportamentali CNIs Ciclosporina Tacrolimus :inibiscono l’attivazione e proliferazione dei T linfociti Effetti indesiderati:Nefrotossicità,tremori,parestesie,irsutismo,ipertrofia gengivale,ipertensione,iperlipidemia,iperpotassiemia,ipomagnesiemia.colelitiasi Micofenolato mofetile o sodico:blocca la sintesi “de novo” delle purine nei linfociti Effetti indesiderati:depressione midollare,diarrea Inibitori m-TOR Sirolimus,Everolimus:macrolidi che inibiscono il ciclo cellulare Effetti indesiderati;anemia,piastrinopenia,leucopenia,infezioni da CMV Aggravano gli effetti neurotossici e iperlipemizzanti delle CNIs Possono essere utilizzati in protocolli di mantenimento che non prevedono utilizzo di CNIs Azatioprina:Blocca la proliferazione delle cellule immunitarie impedendo di sintetizzare DNA Effetti indesiderati:leucopenia,piastrinopenia,anemia megaloblastica,danno epatocellulare,ittero colestatico,alopecia Attualmente poco usata - FARMACI IMMUNOSOPPRESSORI Anticorpi per la deplezione linfocitaria: Monoclonali Rituximabimpediscono ai linfocitiT maturi il riconoscimento di allo antigeni Effetti indesiderati: maggior suscettibilità infezioni CMV,EBV, Malattie linfoproliferative. Policlonali Timogloguline (sieroantilinfocitario) Utilizzo: Induzione trapianto ,rigetto cellulare steroido resistente. TERAPIA IMMUNOSOPPRESSIVA Sempre necessaria per prevenire il rigetto tranne che nei gemelli omozigoti. L’attuale terapia iniziale prevede l’utilizzo di: -Inibitori della Calcineurina CNIs Ciclosporina,Tacrolimus -Micofenolato Mofetile o Sodico, -Corticosteroidi Eccellente efficacia Buona tollerabilità TERAPIA IMMUNOSOPPRESSIVA La terapia iniziale con corticosteroidi rimane il miglior approccio nel trattamento perioperatorio e nell’immediato post operatorio. La scelta fra Ciclosporina e Tacrolimus dipende da: -rischi immunologici -caratteristiche del ricevente -concomitante immunosoppressione Per entrambi è necessario il monitoraggio dei livelli ematici per evitare rigetto o effetti collaterali Micofenolato :molto efficace nel rigetto precoce FOLLOW- UP -Controlli regolari eseguiti da medici qualificati ed esperti in trapianti almeno ogni 6-12 mesi Controlli ogni 4-8-settimane -valutazione della funzionalità renale Controllo immunosoppressione ed effetti collaterali •FOLLOW-UP Controllo annuale -valutazione dermatologica -palpazione stazioni linfonodali, -ricerca del sangue occulto nellle feci, -Visita cardiologica -Visita urologica e ginecologica -Rx torace, -Ecografia addominale completa -Esami ematochimici :Glicemia,assetto lipidico -Profilassi ed eventuale trattamento di malattie concomitanti (anemia,malattie ossee,infezioni).
Scarica