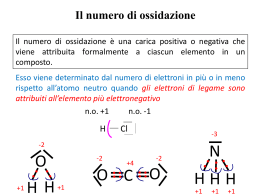
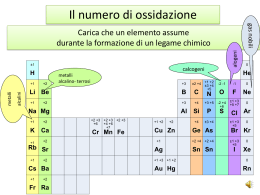
NOMENCLATURA CHIMICA Gli elementi sono caratterizzati da simboli internazionali. Attorno al simbolo di un elemento possono essere disposti 4 indici che rappresentano: Indice superiore a sinistra …..il numero di massa Indice inferiore a sinistra…… il numero atomico Indice inferiore a destra…….. il numero di atomi Indice superiore a destra……..la carica ionica 32 16 2+ S2 Tutti gli isotopi di un elemento, eccetto l’idrogeno, hanno lo stesso nome. Un isotopo viene indicato utilizzando solo il numero di massa: per esempio “ossigeno-18” è indicato con 18O. Per l’idrogeno vengono usati rispettivamente i nome di Prozio, Deuterio e Trizio con i simboli 1H, 2H o D, 3H o T. I nuovi elementi (caratterizzati da alti numeri atomici) hanno nomi provvisori, fino al momento della loro completa caratterizzazione ed accettazione da parte della comunità scientifica. Il nome provvisorio si ottiene a partire dal numero atomico, le cui cifre vengono descritte con opportune radici seguite dal suffisso “ium”: 0 1 2 3 4 5 6 7 8 9 nil un bi tri quad pent hex sept oct enn Esempio: il nome dell’elemento 106 risulta unnilhexium con simbolo provvisorio Unh La tavola periodica viene ottenuta ordinando gli elementi in funzione della loro struttura elettronica (quindi in funzione del loro numero atomico). La tavola periodica viene suddivisa in periodi (orizzontali) e gruppi (verticali). Gli elementi di alcuni gruppi hanno un nome collettivo: metalli alcalini (I gruppo) metalli alcalino-terrosi (II gruppo) calcogeni (VI gruppo) alogeni (VII gruppo) gas nobili (VIII gruppo) elementi di transizione (per gli elementi i cui atomi presentano un livello d incompleto o che danno origine a cationi con un livello d incompleto) metalli delle terre rare (per gli elementi scandio e ittrio e per gli elementi lantanio e lutezio e per quelli tra essi compresi) lantanoidi o lantanidi (per gli elementi dal cerio al lutezio) attinoidi o attinidi (per gli elementi dal torio al laurenzio) La TAVOLA PERIODICA Le regole della nomenclatura in chimica sono redatte dalla International Union of Pure and Applied Chemistry (IUPAC) Scopo: razionalizzare i nomi dei composti in modo che vi sia una correlazione univoca fra la formula e il nome del composto stesso. La nomenclatura IUPAC utilizza la definizione di numero di ossidazione e il concetto di elettronegatività. Elettronegatività : misura della tendenza di un atomo ad attrarre su di sé gli elettroni di legame. Numero di ossidazione : rappresenta la carica che formalmente un atomo acquisterebbe se gli elettroni di legame venissero attribuiti all’atomo più elettronegativo nei composti covalenti. Nei composti ionici (monoatomici) il numero di ossidazione dell’atomo coincide in valore e in carica con la sua carica ionica. Composti covalenti H-H H •• H HF H: n.o. +1 F: n.o. -1 H2O H: n.o. +1 O: n.o. -2 δ+ • • H: n.o. 0 H •• F δ- H-F • • δ+ • • H2 δ- δ+ H-O-H • • Composti ionici Na: n.o. +1 Cl: n.o. -1 MgCl2 Mg: n.o. +2 Cl: n.o. -1 H •• O •• H • Cl • • • Mg (2+) • • (-) • Cl • • • • • • • (-) • • • Cl • • • • • Na (+) • • • • NaCl (-) Ioni monoatomici Ioni positivi (cationi) Nomenclatura IUPAC: Ione+ nome del metallo + numero di ossidazione, se necessario, indicato come numero romano fra parentesi (notazione di Stock) Nomenclatura tradizionale: suffisso oso (n.o. più basso) o ico (n.o. più alto) Cu2+ Cu+ Fe3+ Fe2+ Na+ Ca2+ Zn2+ Ione rame (II) Ione rame (I) Ione ferro (III) Ione ferro (II) Ione sodio Ione calcio Ione zinco Ione rameico Ione rameoso Ione ferrico Ione ferroso Ione sodio Ione calcio Ione zinco Ioni negativi (anioni) Ione+ nome dell’elemento + desinenza uro BrIone bromuro F Ione fluoruro S2Ione solfuro P3Ione fosfuro Eccezioni: O2HN3C4- Ione ossido Ione idruro Ione nitruro Ione carburo (non ossigenuro) (non idrogenuro) (non azoturo) (non carboniuro) COMPOSTI Sono sostanze chimiche, a composizione costante, formate da 2 o più specie elementari e vengono dette composti binari, ternari, ecc. Composti binari tra un metallo e un non metallo Nome dell’elemento più elettronegativo + desinenza uro + nome dell’elemento meno elettronegativo invariato Nelle formule, il costituente meno elettronegativo deve essere posto per primo NaCl NaF AlN Cloruro di sodio Fluoruro di sodio Nitruro di alluminio KI LiH CdSe Ioduro di potassio Idruro di litio Seleniuro di cadmio In presenza di composti diversi, costituiti dagli stessi elementi, ma con uno di essi in un diverso stato di ossidazione: •la nomenclatura IUPAC precisa il numero di atomi di ciascuna specie utilizzando i prefissi: (mono), di, tri, tetra, penta, esa, epta, ecc.; • la nomenclatura tradizionale ricorre ai suffissi oso (per il più basso stato di ossidazione) e ico (per il più alto stato di ossidazione). Esempi: SnCl2 Dicloruro di stagno Cloruro stannoso SnCl4 Tetracloruro di stagno Cloruro stannico FeCl2 FeCl3 Dicloruro di ferro Tricloruro di ferro Cloruro ferroso Cloruro ferrico Composti binari tra non metalli Nel caso di composti binari tra non metalli la desinenza uro viene assunta dall’elemento che compare dopo nel seguente elenco: B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl, O, F. H H H BB N N O Si Si PP SS Cl Cl As As Se Se Br Br Sb Sb Te Te II Nella formula chimica il costituente a cui spetta la desinenza uro deve essere posto per secondo: perciò FF CC O SiC GaAs Si3N4 AsH3 OF2 Carburo di silicio Arseniuro di gallio Tetranitruro di trisilicio Triidruro di arsenico Difluoruro di ossigeno At At NH3 e non H3N Per alcuni composti il nome tradizionale è radicato nell’uso corrente e tuttora mantenuto : NH3 ammoniaca B2H6 diborano PH3 fosfina SiH4 silano AsH3 arsina I composti binari con l’ossigeno vengono chiamati ossidi CaO Ossido di calcio CO Ossido di carbonio CO2 Diossido di carbonio SO2 Diossido di zolfo SO3 Triossido di zolfo NO Ossido di azoto NO2 Diossido di azoto Nomenclatura tradizionale I composti fra metallo e ossigeno sono detti ossidi basici. I composti fra non metallo e ossigeno sono detti anidridi. Negli ossidi basici i diversi stati di ossidazione, e quindi le diverse sostanze, sono differenziati usando i suffissi OSO e ICO. Nelle anidridi vengono utilizzati i suffissi OSA e ICA e i prefissi IPO e PER nel caso di più di 2 stati di ossidazione. FeO Ossido ferroso Fe2O3 Ossido ferrico Cl2O Anidride ipoclorosa CO2 Anidride carbonica Cl2O3 Anidride clorosa SO2 Anidride solforosa Cl2O5 Anidride clorica SO3 Anidride solforica Cl2O7 Anidride perclorica Per il composto H2O è di uso corrente il nome tradizionale acqua; poco usato è il nome IUPAC ossido di diidrogeno. Ioni poliatomici Ioni positivi Tra i cationi poliatomici sono importanti quelli formati da elementi non metallici con idrogeno. Ione+ nome dell’elemento legato all’idrogeno + desinenza onio Eccezione: H3O+ PH4+ NH4+ Ione ossonio Ione fosfonio Ione ammonio (non azotonio) Ioni negativi Per alcuni anioni si usa la desinenza uro tipica dei monoatomici: Ione+ nome dell’elemento + desinenza uro S22CNN3O3- Ione disolfuro Ione cianuro Ione azoturo Ione ozonuro OHO22- Ione idrossido Ione perossido Eccezioni rilevanti: Composti importanti: NaOH H2O2 (non ossidrile) idrossido di sodio perossido di idrogeno acqua ossigenata Di regola, gli anioni poliatomici si considerano formati da un elemento centrale il cui nome assume la desinenza ato; si precisa il numero degli altri atomi legati all’elemento centrale con i prefissi di, tri, tetra, ecc., eventualmente indicando con la notazione di Stock il numero di ossidazione dell’elemento centrale. Esempi: - BF4 2SiF6 ione tetrafluoroborato (III) ione esafluorosilicato (IV) Tra gli anioni poliatomici costituiscono una classe molto importante gli OSSOANIONI, cioè gli anioni in cui l’ossigeno è legato all’atomo centrale. Il numero di atomi di ossigeno viene precisato con i prefissi: (mono)osso, diosso, triosso, tetraosso, ecc. Esempi: - NO3 2SO4 MnO4 2MnO4 ione triossonitrato (V) ione tetraossosolfato (VI) ione tetraossomanganato (VII) ione tetraossomanganato (VI) Nomenclatura tradizionale: se l’elemento centrale può avere 2 diversi stati di ossidazione, si adottano i suffissi ato per il numero di ossidazione più alto e ito per il numero di ossidazione più basso. Esempi: - NO2 - NO3 2- SO3 2- SO4 ione nitrito ione diossonitrato (III) ione nitrato ione triossonitrato (V) ione solfito ione triossosolfato (IV) ione solfato ione tetraossosolfato (VI) Se l’elemento centrale ha più di 2 stati di ossidazione, si usano i prefissi ipo con desinenza ito per indicare l’ossoanione che ha un numero di ossidazione più basso rispetto all’ossoanione indicato con la desinenza ito; per con desinenza ato per indicare l’ossoanione che ha un numero di ossidazione più alto rispetto all’ossoanione indicato con la desinenza ato. Esempi: - ClO - ClO2 - ClO3 - ClO4 ione ipoclorito ione (mono)ossoclorato (I) ione clorito ione diossoclorato (III) ione clorato ione triossoclorato (V) ione perclorato ione tetraossoclorato (VII) Acidi Gli acidi possono essere suddivisi in: -acidi binari o pseudo-binari (idracidi) -acidi derivanti dagli anioni poliatomici Acidi binari o pseudo-binari Sono composti formati dall’idrogeno con elementi non metallici del VI e VII gruppo. La nomenclatura IUPAC usa le regole descritte per i composti binari. La nomenclatura tradizionale usa acido + nome dell’elemento non metallico + suffisso idrico. Esempi: HCl HBr HF H2S HCN Cloruro di idrogeno Bromuro di idrogeno Fluoruro di idrogeno Solfuro di diidrogeno Cianuro di idrogeno Acido cloridrico Acido bromidrico Acido fluoridrico Acido solfidrico Acido cianidrico Acidi derivanti dagli anioni poliatomici Gli acidi più comuni sono quelli che derivano dagli ossoanioni e sono chiamati OSSOACIDI. La nomenclatura IUPAC utilizza il nome del corrispondente ossoanione variando la desinanza ato in ico e premettendo la parola acido. Alternativamente può essere mantenuto il suffisso ato specificando il numero di ossidazione dell’elemento centrale e precisando il numero di atomi di idrogeno. Esempi: HNO2 HNO3 Acido diossonitrico (III) Acido triossonitrico (V) Diossonitrato (III) di idrogeno Triossonitrato (V) di idrogeno La nomenclatura tradizionale utilizza il nome del corrispondente ossoanione variando la desinenza ato in ico e ito in oso e mantenendo i prefissi per e ipo se presenti. Esempi: H2SO3 Acido triossosolforico (IV) Acido solforoso Triossosolfato (IV) di diidrogeno H2SO4 Acido tetraossosolforico (VI) Acido solforico Tetraossosolfato (VI) di diidrogeno Esempi: HClO HClO2 HClO3 HClO4 H2CO3 HIO4 H2CrO4 H3AsO3 H3AsO4 Acido (mono)ossoclorico (I) (Mono)ossoclorato (I) di idrogeno Acido diossoclorico (III) Diossoclorato (III) di idrogeno Acido triossoclorico (V) Triossoclorato (V) di idrogeno Acido tetraossoclorico (VII) Tetraossoclorato (VII) di idrogeno Acido triossocarbonico (IV) Triossocarbonato (IV) di diidrogeno Acido tetraossoiodico (VII) Tetraossoiodato (VII) di idrogeno Acido tetraossocromico (VI) Tetraossocromato (VI) di diidrogeno Acido triossoarsenico (III) Triossoarseniato (III) di triidrogeno Acido tetraossoarsenico (V) Tetraossoarseniato (V) di triidrogeno Acido ipocloroso Acido cloroso Acido clorico Acido perclorico Acido carbonico Acido periodico Acido cromico Acido arsenioso Acido arsenico In alcuni casi l’elemento centrale può formare più di un ossoacido, pur mantenendo lo stesso numero di ossidazione, a causa di un diverso grado di idratazione dell’anidride. Questo è il caso, ad esempio, del fosforo, che può dar luogo a 3 ossoacidi corrispondenti al numero di ossidazione (V). P2O5 + 3 H2O → 2 H3PO4 P2O5 + H2O → 2 HPO3 P2O5 + 2 H2O → H4P2O7 La nomenclatura IUPAC rimane invariata. La nomenclatura tradizionale utilizza i prefissi: orto per il maggior grado di idratazione, meta per il minor grado di idratazione, piro per il grado di idratazione intermedio. H3PO4 HPO3 H4P2O7 Acido tetraossofosforico (V) Tetraossofosfato (V) di triidrogeno Acido triossofosforico (V) Triossofosfato (V) di idrogeno Acido eptaossodifosforico (V) Eptadiossofosfato (V) di tetraidrogeno Acido ortofosforico Acido metafosforico Acido pirofosforico Sali Sono composti formati da uno ione negativo e uno ione positivo. Sia la nomenclatura IUPAC sia quella tradizionale utilizzano il nome dell’anione seguito dalla preposizione di e dal nome dello ione positivo. Nella nomenclatura IUPAC si precisa il numero degli atomi con i prefissi (mono), di, tri, ecc. Nella nomenclatura tradizionale sono mantenuti tutti i prefissi ed i suffissi visti in precedenza. Esempi: CaCl2 FeCl3 NaClO Fe(OH)2 Fe(OH)3 KCN Na2O2 CaSO4 CaSO3 Na3PO4 dicloruro di calcio tricloruro di ferro (mono)ossoclorato (I) di sodio diidrossido di ferro triidrossido di ferro cianuro di potassio perossido di sodio tetraossosolfato (VI) di calcio triossosolfato (IV) di calcio tetraossofosfato (V) di trisodio cloruro di calcio cloruro ferrico ipoclorito di sodio idrossido ferroso idrossido ferrico solfato di calcio solfito di calcio ortofosfato di sodio Sali che contengono atomi di idrogeno acidi (Sali acidi) La nomenclatura IUPAC fa precedere al nome dell’anione il termine idrogeno, indicando il numero di atomi di idrogeno attraverso opportuni prefissi, seguito dalla preposizione di e dal nome dell’elemento che costituisce il catione . La nomenclatura tradizionale fa precedere al nome dell’anione il prefisso bi. Esempi: NaHCO3 idrogeno triossocarbonato (IV) di sodio KHSO4 idrogeno tetraossosolfato (VI) di potassio Bicarbonato di sodio Bisolfato di potassio
Scarica