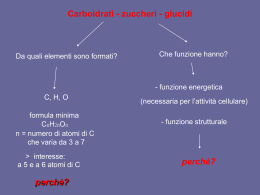
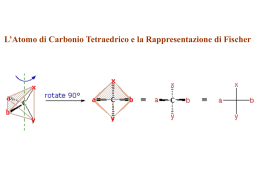
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 15 Monosaccaridi Concetti chiave: • Gli zuccheri sono aldosi o chetosi aventi la formula (C·H2O)n. • I monosaccaridi ciclizzano per formare anomeri α o β. • I derivati dei monosaccaridi comprendono gli acidi aldonici, gli acidi uronici, gli alditoli, i deossi-zuccheri e gli amminozuccheri. • I monosaccaridi possono essere legati l'uno all'altro o ad altre molecole non saccaridiche con legami glicosidici. • I monosaccaridi, o zuccheri semplici, sono sintetizzati tramite la fotosintesi a partire da precursori più semplici che a loro volta derivano da CO2 e H2O. Carboidrati I carboidrati o saccaridi (dal greco sàkcharon, zucchero) sono le molecole biologiche più abbondanti. Chimicamente sono costituiti da C, H e O combinati secondo la formula ≥3. generale (C·H2O)n con n≥ Le unità di base dei carboidrati sono i monosaccaridi che si uniscono poi a dare i polisaccaridi. Funzioni dei carboidrati • I carboidrati svolgono una funzione strutturale ed energetica sia come sostanze nutrienti che come intermedi metabolici. • Il ribosio e il deossiribosio (due monosaccaridi) fanno parte della struttura del DNA e dell’RNA. • I carboidrati come polisaccaridi sono elementi strutturali della parete dei batteri e delle piante. • I carboidrati possono essere legati a proteine e lipidi. Carboidrati I monosaccaridi sono aldeidi o chetoni con catene laterali poliossidriliche contenenti almeno tre atomi di carbonio. Sono classificati in base alla natura chimica del loro gruppo carbonilico e al numero dei loro atomi di C. Se il gruppo carbonilico è aldeidico, lo zucchero è un aldosio, se è chetonico lo zucchero è un chetosio. I monosaccaridi più piccoli (n=3) sono i triosi. Tautomeri Molte aldeidi e chetoni esistono come miscela in equilibrio tra due forme, dette forma chetonica e forma enolica. Le due forme differiscono per la posizione di un protone e di un doppio legame. La tautomeria cheto-enolica è caratteristica di specie carboniliche che hanno almeno un atomo di idrogeno legato al carbonio in posizione α rispetto al gruppo funzionale (-CHO o -C=O). Il doppio legame del carbonile si rompe e si forma un ossidrile, trasformando così l'aldeide o il chetone di partenza in un enolo (alcool con un doppio legame fra gli atomi di carbonio e il gruppo ossidrile direttamente legato ad uno di essi). Carboidrati I monosaccaridi con 4, 5, 6, 7 atomi di carbonio sono chiamati tetrosi, pentosi, esosi, eptosi ecc., rispettivamente. L’aldoesosio D-glucosio e il chetoesosio D-fruttosio sono i monosaccaridi più comuni in natura. Carboidrati Gli aldopentosi D-ribosio e 2-deossi deossi-D-ribosio sono componenti dei nucleotidi e degli acidi nucleici. Enantiomeri La gliceraldeide ha un atomo di carbonio asimmetrico (centro chirale). La D- e la Lgliceraldeide sono enantiomeri. Il diidrossiacetone non ha atomi di carbonio asimmetrici. Stereoisomeri Una molecola con n centri chiralici può avere 2n stereoisomeri. La gliceraldeide ha 21 = 2 stereoisomeri; gli aldoesosi con 4 centri chirali, hanno 24 = 16 stereoisomeri. Gli stereoisomeri dei monosaccaridi, qualunque sia la lunghezza della loro catena, possono essere divisi in due gruppi che differiscono per la configurazione intorno al centro chirale più lontano dal gruppo carbonilico. Quelli che hanno una configurazione a livello di questo atomo di carbonio di riferimento identica a quella della D-gliceraldeide vengono detti isomeri D. Quelli con configurazione identica alla L-gliceraldeide sono gli isomeri L. La maggior parte degli zuccheri presenti negli organismi viventi sono isomeri D D-Glucosio L-Glucosio Enantiomeri Stereoisomeri degli aldosi della serie D che contengono da 3 a 6 atomi di C I D-aldosi a 3-4 atomi di carbonio I D-aldosi a 4-5 atomi di carbonio I D-aldosi a 5-6 atomi di carbonio Il D-glucosio (C•H2O)6 Stereoisomeri dei chetosi della serie D che contengono da 3 a 6 atomi di C I D-chetosi a 3-4 atomi di carbonio I D-chetosi a 4-5 atomi di carbonio I D-chetosi a 5-6 atomi di carbonio Epimeri Gli zuccheri che si differenziano esclusivamente per la configurazione intorno a un atomo di C sono detti epimeri. Aldeidi e chetoni formano emiacetali ed emichetali Gli alcoli reagiscono con i gruppi carbonilici delle aldeidi o dei chetoni formando, rispettivamente emiacetali o emichetali. Ciclizzazione del glucosio Le funzioni ossidriliche e quelle aldeidiche o chetoniche dei monosaccaridi possono reagire tra loro per dare emiacetali o emichetali ciclici. Ciclizzazione del fruttosio Le funzioni ossidriliche e quelle aldeidiche o chetoniche dei monosaccaridi possono reagire tra loro per dare emiacetali o emichetali ciclici. Il nome degli zuccheri deriva dall'analogo strutturale eterociclico Uno zucchero che genera un anello a sei atomi è detto piranosio, in analogia con il pirano. Gli zuccheri con anelli a cinque atomi sono definiti furanosi per le analogie con il furano. Le forme predominanti del glucosio e del fruttosio in soluzione non sono catene aperte. Le forme cicliche del glucosio e del fruttosio con anelli a sei e cinque membri sono note come glucopiranosio e fruttofuranosio. Gli anomeri α e β possono interconvertirsi Quando un monosaccaride va incontro a ciclizzazione, il gruppo carbonilico si trasforma in un centro chirale, chiamato carbonio anomerico. I due stereoisomeri che differiscono per configurazione a livello del carbonio anomerico sono detti anomeri. 36.4% 63.6% Nell’anomero α, il sostituente OH del carbonio anomerico giace dal lato opposto dell’anello dello zucchero rispetto al gruppo CH2OH situato in corrispondenza del centro chirale che indica le configurazioni D ed L (C5 negli esosi). L’altra forma è l’anomero β. Gli anomeri si interconvertono liberamente in soluzione acquosa. Conformazioni a sedia del β-D-glucosio Gli anelli delle forme furanosiche o piranosiche degli zuccheri non sono planari perché tutti gli orbitali atomici degli atomi di carbonio dell’anello presentano un’ibridazione sp3. L’anello piranosico come quello del cicloesano può assumere una conformazione a sedia in cui i sostituenti assumono disposizioni tetraedriche. Delle due conformazioni possibili la disposizione predominante è quella in cui i sostituenti occupano posizioni equatoriali piuttosto che le più addensate conformazioni assiali. Le modificazioni degli zuccheri Gli zuccheri possono andare incontro a processi di interconversione mediante le reazioni tipiche delle aldeidi e dei chetoni. L'ossidazione del gruppo aldeidico lo converte in gruppo carbossilico portando alla formazione degli acidi aldonici. Le modificazioni degli zuccheri L'ossidazione del gruppo alcolico primario porta alla formazione degli acidi uronici. Le modificazioni degli zuccheri La riduzione del gruppo aldeidico porta alla formazione degli alditoli. Dolcificante Componenti dei lipidi Le modificazioni degli zuccheri La riduzione di un gruppo alcolico porta alla formazione dei deossi-zuccheri. Le modificazioni degli zuccheri La sostituzione di un gruppo alcolico con un gruppo amminico porta alla formazione degli amminozuccheri. Le modificazioni degli zuccheri Gli amminozuccheri possono essere acetilati sul gruppo amminico. Altre modificazioni degli zuccheri: gli acidi sialici L’acido N-acetilneuramminico e i suoi derivati (acidi sialici) sono importanti costituenti di glicoproteine e glicolipidi. Nella forma ciclica questo monosaccaride a nove atomi di C l’anello piranosico incorpora il residuo di acido piruvico. Formazione degli O-glicosidi Il gruppo anomerico di uno zucchero può condensarsi con un alcol per formare α- e βglicosidi (dal greco glykys, dolce) con legame glicosidico. I saccaridi con atomi di carbonio anomerici che non hanno dato origine a glucosidi sono definiti zuccheri riducenti dal momento chi il gruppo aldeidico libero in equilibrio con la forma ciclica dello zucchero riduce blandi agenti ossidanti. La mancanza di attività riducente in uno zucchero indica che si tratta di un glucoside. Legame α-1,4-glicosidico Legame α-1,4-glicosidico e α-1,6-glicosidico Formazione degli N-glicosidi I legami N-glicosidici si instaurano tra il C anomerico di uno zucchero e un’ammina. I polisaccaridi Concetti chiave: • I disaccaridi come il lattosio e il saccarosio sono formati da due zuccheri legati da specifici legami glicosidici. • La cellulosa e la chitina sono polimeri di residui di glucosio legati da legami β (1→4). • Nell'amido e nel glicogeno i residui di glucosio sono legati tra loro principalmente da legami α (1→4). • I glicosamminoglicani e gli altri grandi eteropolisaccaridi hanno generalmente una struttura tipo gel. Polisaccaridi I polisaccaridi (glicani) sono formati da monosaccaridi uniti insieme da legami glicosidici. Sono classificati in omopolisaccaridi ed eteropolisaccaridi a seconda che siano costituiti da uno stesso monosaccaride o da più monosaccaridi diversi. Contrariamente alle proteine e agli acidi nucleici, i polisaccaridi formano polimeri sia lineari sia ramificati grazie alla presenza di più gruppi ossidrilici su un singolo monosaccaride. Il lattosio: un disaccaride riducente I disaccaridi, i polisaccaridi più semplici, sono ottenuti dall’idrolisi di molecole di dimensioni maggiori. Il lattosio è formato dal legame glicosidico (1→4) tra l’atomo C1 dell’anomero β del galattosio con l’atomo O4 del glucosio. Il saccarosio: un disaccaride non riducente Il saccarosio è formato dal legame glicosidico (1→2) tra l’atomo C1 dell’anomero α del glucosio con l’atomo C2 dell’anomero β del fruttosio. I dolcificanti artificiali In alcuni alimenti e bevande sono presenti molecole dolcificanti di origine non saccaridica che hanno un sapore simile al saccarosio. I dolcificanti artificiali Le fibre di cellulosa La cellulosa è la componente strutturale primaria delle pareti delle cellule vegetali. Metà del C della biosfera è presente nella cellulosa. Cellulosa: un polimero di D-glucosio con legami β(1→4) La cellulosa è un polimero lineare formato da fino a 15000 residui di D-glucosio uniti da legami β(1→4) glicosidici. Conformazione strettamente condensata della cellulosa Le catene di cellulosa hanno una forma a nastro piatto in cui gli anelli di glucosio sono ruotati di 180° l’uno rispetto all’altro. Il gruppo C3-OH di ogni residuo di glucosio forma un legame H con l’O in posizione 5 dell’anello del residuo successivo. In aggiunta ci sono legami H intercatena e interazioni di van der Waals che creano una struttura stabile e compatta che conferisce alla fibra una straordinaria resistenza. Cellulasi Sebbene i vertebrati non possiedono gli enzimi che idrolizzano la cellulosa, il tratto digestivo degli erbivori contiene microrganismi simbiontici che secernono cellulasi. La degradazione della cellulosa è un processo lento pertanto i bovini devono ruminare a lungo. Chitina La chitina, principale componente strutturale dell’esoscheletro di crostacei, insetti e ragni e componente delle pareti fungine, è un omopolimero di N-acetil-D-glucosammina con legami β(1→4). Presenta analogie strutturali con la cellulosa. Amido L’ amido, principale riserva energetica delle piante, è depositato nei cloroplasti delle cellule vegetali sottoforma di granuli insolubili costituiti da α-amilosio e amilopectina. L'α-amilosio: un polimero di D-glucosio con legami α(1→4) L'α-amilosio è un polimero lineare con molte migliaia di residui di D-glucosio con legami α(1→4). L'α-amilosio: un polimero di D-glucosio con legami α(1→4) L'α-amilosio assume una conformazione ad avvolgimento avvolto irregolarmente aggregato a causa dei legami α glicosidici. Ramificazioni α(1→6) dell'amilopectina L‘amilopectina consiste prevalentemente di residui di residui di D-glucosio uniti da legami α(1→4) ma è una molecola ramificata con ramificazioni α(1→6) ogni 24-30 residui di glucosio. L’amilopectina contiene fino a 106 residui di glucosio e sono tra le molecole di maggiori dimensioni in natura. Amilosio e amilopectina Digestione dell’amido La digestione dell’amido costituisce la fonte prevalente di carboidrati nella dieta umana. L’amilasi salivare idrolizza in modo casuale i residui α(1→4) dell’amido. Tale processo digestivo prosegue poi nell’intestino tenue ad opera dell’amilasi pancreatica che degrada l’amido in una miscela di piccoli oligosccaridi. Una α-glucosidasi rimuove un glucosio per volta ed un enzima deramificante idrolizzano i legami α(1→4) e α(1→6) producendo monosaccaridi liberi assorbiti dall’intestino che sono poi trasportati nel sangue. Glicogeno Il glicogeno è il polisaccaride di riserva degli animali. E’ contenuto in tutte le cellule soprattutto nel fegato come granuli citoplasmatici. Il contenuto di glicogeno nel fegato può arrivare al 10% del suo peso netto. Glicogeno La struttura è simile a quella dell’amilopectina ma è più fittamente ramificata con ramificazioni ogni 8-14 residui di glucosio. Il glicogeno è degradato dalla glicogeno fosforilasi che scinde i legami α(1→4) a partire dalle estremità non riducenti della molecola. La struttura altamente ramificata consente di mobilizzare in modo rapido il glucosio nei momenti di necessità metabolica. Le ramificazioni α(1→6) sono poi idrolizzate dall’enzima deramificante del glicogeno. I glicosamminoglicani: unità disaccaridiche ripetute Gli spazi extracellulari, in particolare quelli dei tessuti connettivi (i.e. cartilagine, tendini, pelle e pareti dei vasi sanguigni) contengono collageno ed altre proteine incluse in una matrice gelatinosa composta di glicosamminoglicani, polisaccaridi non ramificati formati da acido uronico ed esosammina. L’acido ialuronico è un componente del tessuto connettivo, del fluido sinoviale e dell’umor vitreo dell’occhio. Le molecole sono costituite da 250-25000 unità disaccaridiche costituite da β(1→3) acido D-glucoronico/N-Acetil-D-glucosammina unite da ponti β(1→4). Le glicoproteine Concetti chiave: • I proteoglicani sono proteine di grandi dimensioni contenenti glicosamminoglicani. • La parete cellulare batterica è costituita da catene di glicani unite con legami trasversali da peptidi. • Le catene oligosaccaridiche legate covalentemente alle glicoproteine eucariotiche possono determinare la struttura e il riconoscimento delle proteine. Peptidoglicano Le pareti cellulari dei batteri sono formate da catene polisaccaridiche e polipeptidiche legate covalentemente. Tale struttura, nota come peptidogliocano, è costituita da unità ripetute di N-Acetilglucosammina e acido N-acetilmuramico la cui catena laterale lattilica forma un legame ammidico con un tetrapeptide. Gli antibiotici specifici per i peptidoglicani La pennicillina si lega specificamente a enzimi che formano legami trasversali tra i filamenti di peptidoglicano delle pareti delle cellule batteriche e li inattivano. Le glicoproteine Quasi tutte le proteine secrete ed associate alle membrane delle cellule eucariotiche sono glicosilate. Gli oligosaccaridi sono uniti covalentemente alle proteine per mezzo di legami N-glicosidici oppure O-glicosidici. N-glicosilazione Alcuni oligosaccaridi sono uniti all’asparagina mediante legami N-glicosidici. In questo tipo di glicosilazione un residuo di N-acetilglucosammina dell’oligosaccaride è sempre unito tramite legame β-glicosidico all’azoto ammidico di un residuo di asparagina appartenente alla sequenza Asn-X-Ser oppure Asn-X-Thr dove X è un qualsiasi amminoacido ad eccezione di Pro e raramente di Asp, Glu, Leu o Trp. Sintesi di oligosaccaridi uniti con legami N-glicosidici durante la traduzione Struttura pentasaccaridica di un oligosaccaride con legame N-glicosidico Le tappe del processo di maturazione dell’oligosaccaride possono variare con l’identità della glicoproteina e con la serie di endoglicosidasi contenuta nella cellula ma tutti gli oligosaccaridi prodotti in questo modo presentano lo stesso nucleo pentasaccaridico con la struttura seguente: O-glicosilazione Alcuni oligosaccaridi sono uniti alla serina o alla treonina con legami O-glicosidici. Il legame O-glicosidico più comune coinvolge il nucleo β-Galattosil-(1→3)-α-N-acetilgalattosammina legato al gruppo OH della catena laterale dei residui di Ser o Thr non inserite in una specifica sequenza segnale. N- ed O-glicosilazione a confronto Gli oligosaccaridi sono determinanti antigenici I carboidrati sulla superficie delle cellule sono noti marcatori immunochimici. Gli antigeni dei gruppi sanguigni A, B, 0 sono componenti oligosaccaridiche delle glicoproteine e dei glicolipidi superficiali delle cellule di un individuo, non solo dei globuli rossi. Gli oligosaccaridi sono determinanti antigenici La trasfusione di sangue di tipo A in una persona di tipo B conduce una reazione tra anticorpo anti-A e antigene A che determina agglutinazione ossia aggregazione degli eritrociti trasfusi, il cui esito è un blocco spesso fatale dei vasi sanguigni. Antigene sulla superficie cellulare Anticorpi nel sangue Antigene A Anticorpi anti-B Antigene B Anticorpi anti-A Antigene AB - Antigene 0 Anticorpi anti-A e anti-B
Scarica