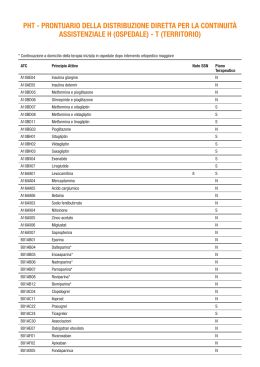
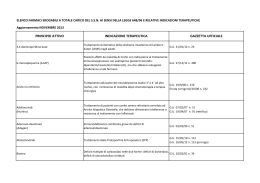
Scheda di monitoraggio - Follow-up Data della visita di follow-up (da effettuare entri due mesi)_______________________ Segni, sintomi o patologie insorte durante il trattamento (data insorgenza, descrizione, esito). Nuovi trattamenti in corso: Antiipertensivi Antidiabetici Anti Parkinson Statine Si conferma la terapia in corso Motivo sospensione: Sostituzione antipsicotico: Antiaggreganti Anticoagulanti altro (specificare) Si No Inefficacia ADRs extrapiramidali (allegare copia scheda di segnalazione ADR) ADRs cerebrovascolari (allegare copia scheda di segnalazione ADR) Altre ADRs (allegare copia scheda di segnalazione ADR) Decesso Si No Prescrizione Antipsicotico_________________________ Posologia____________________________ Data___________________ Timbro e firma del medico prescrittore ______________________________________________________ Scheda di monitoraggio dei pazienti con disturbi psicotici e comportamentali associati a demenza in trattamento con antipsicotici Durata della prima visita__________________________ Nome e cognome del paziente______________________________________________________ Codice fiscale dell’assistito_________________________________________________________ Indirizzo__________________________________Recapito telefonico______________________ Sesso___Data di nascita_______________________ Regione_______________Azienda sanitaria___________________________________________ Altri trattamenti in corso: Antiipertensivi Antidiabetici Antiaggreganti Anti Parkinson Statine altro Anticoagulanti Malattia di base Alzheimer Demenza (indicare tipo di demenza) Disturbi e sintomi: Delirio Allucinazioni Aggressività Altro Prescrizione Antipsicotico__________________________________________________________________ Posologia_____________________________________________________________________ Acquisito consenso informato (copia allegata) Data_________________ Timbro e firma del medico prescrittore ___________________________________ Via Vida, 10 – 12051 ALBA (CN) Tel +39 0173.316111 Fax +39 0173.316480 e-mail: [email protected] – www.aslcn2.it P.I./Cod. Fisc. 02419170044 Piano terapeutico per off-label aziendali Nome e cognome del paziente______________________________________________________ Codice fiscale dell’assistito_________________________________________________________ Indirizzo__________________________________Recapito telefonico______________________ Sesso___Data di nascita_______________________ Diagnosi_________________________________________________________________________ Farmaco_________________________________________________________________________ Posologia_________________________________________________________________________ Durata della terapia________________________________________________________________ Off-label rimborsabile come da accordi aziendali Alba, li______________ Firma e timbro del medico prescrittore _________________________________________ I farmaci vengono distribuiti direttamente dal Servizio farmaceutico Territoriale, senza oneri a carico dell’assistito, presentando questo Piano Terapeutico: ALBA – Servizio Farmaceutico Territoriale - corso Nino Bixio 22 (tel:0173316225-246) BRA – Ospedale S.Spirito – via Ospedale 4 (tel: 0172420121) Piano terapeutico per medicinali prescrivibili a carico del Servizio Sanitario da parte del medico di medicina generale o del pediatra di libera scelta solo su diagnosi e piano terapeutico di centri specializzati, universitari o delle aziende sanitarie, individuati dalla regione (da inviare al medico curante, al Servizio Farmaceutico Territoriale della ASS di residenza del paziente e conservare in copia) Generalità dell’Assistito Nome e Cognome:……………...…………………………………………………………………… Età:……………..Sesso M F CRA:………………………………………….. Indirizzo:…………………………………………………………………………………………….. ASS di residenza:………………………(………) Regione………………….………………. Medico curante………………………………………………………………………………………. Diagnosi ………………………………………………………………………………………………………. ……………………………………………………………………………………………………….. ………………………………………………………………………………………………………... conforme alle disposizioni CUF per prescrizione a carico del SSN, specificare: Nota CUF n……………., ovvero (*): indicazione terapeutica regolarmente autorizzata altre limitazioni prescrittive:………………………………………….…………………. Formulata in data:……………Presso:………………………………………………….…………… ……………………………………………………………………………………………………….. Piano Terapeutico: Farmaco/i prescritto/i:………………………………………………………………………………... Posologia:…………………………………………………………………………………………….. Durata prevista del trattamento:……………………………………………………………………… Prima prescrizione Prosecuzione della cura Cambio posologia/trattamento Timbro e Firma del Medico Prescrittore ……………………………………… Data………………………………. (*): indicare il numero della Nota CUF di pertinenza, ovvero solo nel caso in cui non sia prevista una nota CUF specifica indicare se l’indicazione è compresa tra quelle regolarmente autorizzate ovvero se rientra in particolari protocolli di ricerca che ne definiscono le condizioni di rimborsabilità. 20-3-2009 GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA Serie generale - n. 66 ALLEGATO 1 PIANO TERAPEUTICO AIFA PER PRESCRIZIONE DI CLOPIDOGREL Centro prescrittore __________________________________________________________ Nome cognome del clinico prescrittore __________________________________________ recapito telefonico _____________ Paziente (nome,cognome) ___________________________________________ età ______ sesso M F codice fiscale ____________________ Indirizzo _______________________________________________ Tel. ________________ ASL di residenza___________________________________________________________ La prescrizione di clopidogrel è a carico del SSN solo se rispondente a una delle seguenti condizioni: Sindrome coronarica acuta senza innalzamento del tratto ST (angina instabile o infarto miocardio senza onda Q) in associazione con ASA (trattamento di 6 mesi rinnovabile per 1-2 volte)1 Angioplastica percutanea (PTCA) con applicazione di stent2,3: non medicato (trattamento di 1 mese in associazione con ASA) medicato (trattamento di 12 mesi in associazione con ASA) Terapia antiaggregante a breve termine per la prevenzione secondaria dell’infarto in associazione con ASA4,5 Terapia antiaggregante a lungo termine per la prevenzione secondaria dell’infarto e dell’ictus, in pazienti per i quali esiste controindicazione a ASA o ticlopidina6,7 Dose e durata del trattamento Dose/die: ________________ Durata prevista del trattamento: __________________ Indicare se: Prima prescrizione Prosecuzione della cura (motivo: ……………………………………………..) Data ___/____/____ Timbro e firma del clinico prescrittore — 47 — 10-8-2010 GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA 10A09662 — 67 — Serie generale - n. 185 PIANO TERAPEUTICO AIFA P E R P RE S CR IZ IO NE S S N D I E R IT R O P O IE T I NE ( e x N o t a 1 2) Centro prescrittore________________________________________________________________________ Medico prescrittore (nome e cognome)________________________________________________________ Tel___________________________________email______________________________________________ Paziente (nome e cognome) ________________________________________________________________ Data di nascita______________ Sesso M F Codice Fiscale ____________________________________________________________________________ Residente a ________________________________________________Tel. __________________________ Regione _________________________________________________________________________________ ASL di residenza___________________________________ Prov.___________________________________ Medico di Medicina Generale_________________________________________________________________ La prescrizione di eritropoietine è a carico del SSN per le seguenti condizioni cliniche: Trattamento dell’anemia (Hb 11 g/dL e suo mantenimento tra 11 e 12 g/dL) associata ad IRC in pazienti adulti e in soggetti pediatrici* sia in trattamento dialitico che in trattamento conservativo Trattamento dell’anemia (Hb 10 g/dL) in pazienti adulti oncologici che ricevono chemioterapia antiblastica; in caso di Hb 8 mg/dL è indicato il ricorso all’emotrasfusione Principi attivi: eritropoietina alfa, eritropoietina beta, darbepoetina alfa, eritropoietina zeta (*per darboepoetina sono disponibili dati in età pediatrica solo su pazienti con età > 11 anni) Trattamento dell'anemia (Hb <11 g/dL e suo mantenimento tra 11 e 12 g/dL) associata ad IRC in pazienti adulti Principi attivi: Metossipolietilenglicole-eritropoietina beta Trattamento per incrementare la quantità di sangue autologo nell’ambito di programmi di predonazione con le limitazioni previste in scheda tecnica Principi attivi: eritropoietina alfa, eritropoietina beta, eritropoietina zeta Farmaco prescritto eritropoietina alfa eritropoietina beta darbepoetina alfa eritropoietina zeta Metossipolietilenglicole-eritropoietina beta Dosaggio_______________ Durata prevista del trattamento ____________________________ Prima prescrizione Data ___/__/_____ Prosecuzione della cura Timbro e firma del clinico prescrittore PIANO TERAPEUTICO AIFA PER PRES CRIZIONE DI FATTORI DI CRESCITA GRANULOCITARI (ex Nota 30 e 30 bis) Centro prescrittore________________________________________________________________________ Medico prescrittore (nome e cognome)________________________________________________________ Tel___________________________________email______________________________________________ Paziente (nome e cognome) ________________________________________________________________ Data di nascita______________ Sesso M F Codice Fiscale ____________________________________________________________________________ Residente a ________________________________________________Tel. __________________________ Regione _________________________________________________________________________________ ASL di residenza___________________________________ Prov.___________________________________ Medico di Medicina Generale_________________________________________________________________ La prescrizione di fattori di crescita granulocitari è a carico del SSN per le seguenti condizioni cliniche (barrare la casella corrispondente alla condizione clinica del paziente) Trattamento della neutropenia febbrile da chemioterapia (filgrastim, lenograstim, pegfilgrastim) Neutropenia congenita (filgrastim) Trapianto di midollo osseo (filgrastim, lenograstim) Mobilizzazione di cellule staminali periferiche (filgrastim, lenograstim) Neutropenia HIV correlata o correlata ai farmaci antiretrovirali in pazienti pluritrattati che necessitino di farmaci ad azione neutropenizzante (filgrastim) Farmaco prescritto: Filgrastim Lenograstim Pegfilgrastim Dosaggio ___________________ Durata prevista del trattamento _______________________ Prima prescrizione Data______________________ Prosecuzione cura Timbro e firma del clinico prescrittore PIANO TERAPEUTICO AIFA PER PRESCRIZIONE SSN DI INTERFERONI (ex Nota 32) Centro prescrittore________________________________________________________________________ Medico prescrittore (nome e cognome)________________________________________________________ Tel___________________________________email______________________________________________ Paziente (nome e cognome) ________________________________________________________________ Data di nascita______________ Sesso M F Codice Fiscale _____________________________________________________ Residente a ________________________________________________Tel. __________________________ Regione _________________________________________________________________________________ ASL di residenza___________________________________ Prov.___________________________________ Medico di Medicina Generale_________________________________________________________________ La prescrizione di interferoni è a carico del SSN per le seguenti condizioni cliniche: Epatite cronica B: Epatite cronica B HBV-DNA-positiva con ipertransaminemia Principi attivi: interferone alfa-2a ricombinante; interferone alfa-2b ricombinante; interferone alfa-2a peghilato; interferone alfa naturale leucocitario* Epatite cronica B-delta (monoterapia) Principi attivi: interferone alfa-2a ricombinante; interferone alfa-2b ricombinante; interferone alfa naturale leucocitario* Epatite C: in combinazione con ribavirina o in monoterapia, se esistono controindicazioni alla ribavirina, trattamento dell’epatite cronica C in pazienti adulti con ipertransaminasemia e positività per HCVRNA, inclusi pazienti con malattia epatica avanzata (cirrosi epatica compensata – Child A) e/o con coinfezione da HIV, mai trattati in precedenza con interferoni o in recidiva dopo precedente trattamento con interferoni Principi attivi: interferone alfa-2a peghilato; interferone alfa 2-b peghilato; interferone alfa-2a ricombinante; interferone alfa-2b ricombinante Nota: vi sono evidenze in letteratura di maggiore efficacia degli interferoni peghilati rispetto agli interferoni ricombinanti. in combinazione con ribavirina (o in monoterapia se esistono controindicazioni alla ribavirina, trattamento dell’epatite cronica C, senza ipertransaminasemia, in soggetti senza scompenso epatico, positivi per HCVRNA sierico, mai trattati in precedenza con interferoni o in recidiva dopo precedente trattamento con interferoni. Principio attivo: interferone alfa-2a peghilato in combinazione con ribavirina o in monoterapia, se esistono controindicazioni alla ribavirina, trattamento dell’epatite cronica C in pazienti adulti con ipertransaminasemia e positività per HCVRNA: da riservare a pazienti con problemi di intolleranza agli interferoni (presenza di documentata intolleranza soggettiva o neutropenia o piastrinopenia con conta dei neutrofili persistentemente inferiori a 750/mmc e/o piastrine persistentemente inferiori a 50.000/mmc, che compaiano in corso di terapia con altri interferoni, e che ne impediscano la prosecuzione in presenza di risposta terapeutica). Non utilizzare nei pazienti non responders a precedenti cicli di trattamento con interferoni Principio attivo: interferone alfa naturale leucocitario leucemia a cellule capellute Altre patologie: Principi attivi: interferone alfa-2a ricombinante; interferone alfa-2b ricombinante; interferone alfa naturale leucocitario* leucemia mieloide cronica * Interferone alfa naturale leucocitario è previsto solo in caso di intolleranza agli interferoni ricombinati (presenza di documentata intolleranza soggettiva o neutropenia o piastrinopenia con conta dei neutrofili persistentemente inferiori a 750/mmc e/o piastrine persistentemente inferiori a 50.000/mmc, che compaiano in corso di terapia con altri interferoni e che ne impediscano la prosecuzione in presenza di risposta terapeutica). * Da impiegare in caso di intolleranza agli interferoni ricombinati (in presenza di documentata intolleranza soggettiva o neutropenia o piastrinopenia con conta dei neutrofili persistentemente inferiori a 750/mmc e/o piastrine persistentemente inferiori a 50.000/mmc, che compaiano in corso di terapia con altri interfero ni, e che ne impediscano la prosecuzione in presenza di risposta terapeutica Principi attivi: interferone alfa-2a ricombinante; interferone alfa-2b ricombinante; interferone alfa naturale leucocitario* sarcoma di Kaposi correlato all’AIDS o ad altre condizioni cliniche di immunodepressione Principi attivi: interferone alfa-2a ricombinante; interferone alfa-2b ricombinante; interferone alfa naturale leucocitario* linfoma non Hodgkin follicolare Principi attivi: interferone alfa-2a ricombinante; interferone alfa-2b ricombinante; interferone alfa naturale leucocitario* melanoma maligno Principi attivi: interferone alfa-2a ricombinante; interferone alfa-2b ricombinante; interferone alfa naturale leucocitario* carcinoma renale avanzato Principio attivo: interferone alfa-2a ricombinante; interferone alfa naturale leucocitario* linfoma cutaneo a cellule T Principio attivo: interferone alfa-2a ricombinante mieloma multiplo Principio attivo: interferone alfa-2b ricombinante; interferone alfa naturale leucocitario* tumore carcinoide Principio attivo: interferone alfa-2b ricombinante micosi fungoide Principio attivo: interferone alfa naturale leucocitario Farmaco prescritto: interferone alfa 2a ricombinante interferone alfa 2a peghilato interferone alfa 2b ricombinante interferone alfa 2b peghilato interferone alfa naturale leucocitario Dose/die________________________ Prima prescrizione Data______________________ Durata prevista del trattamento _________________________________ Prosecuzione cura Timbro e firma del clinico prescritto 6-10-2009 Supplemento ordinario n. 181 alla GAZZETTA UFFICIALE 09A11415 — 19 — Serie generale - n. 232 26-7-2010 Supplemento ordinario n. 164 alla GAZZETTA UFFICIALE 10A08747 — 47 — Serie generale - n. 172 7-6-2010 GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA Serie generale - n. 130 ALLEGATO 1 10A07148 — 49 — 3-2-2010 Supplemento ordinario n. 22 alla GAZZETTA UFFICIALE Serie generale - n. 27 ALLEGATO 10A00387 — 13 — PIANO TERAPEUTICO AIFA PER PRES CRIZIONE SSN DI LAMIVUDINA (ex Nota 32 bis) Centro prescrittore________________________________________________________________________ Medico prescrittore (nome e cognome)________________________________________________________ Tel___________________________________email______________________________________________ Paziente (nome e cognome) ________________________________________________________________ Data di nascita______________ Sesso M F Codice Fiscale _____________________________________________________ Residente a ________________________________________________Tel. __________________________ Regione _________________________________________________________________________________ ASL di residenza___________________________________ Prov.___________________________________ Medico di Medicina Generale_________________________________________________________________ La prescrizione di lamivudina è a carico del SSN per le seguenti condizioni cliniche: Epatite cronica B HBV-DNA-positiva, con malattia avanzata (con riscontro istologico di ponti porto-centrali e/o diagnosi clinica di cirrosi) in cui l’interferone sia controindicato, o non tollerato o inefficace, come terapia soppressiva senza limiti temporali né di associazione Epatite cronica B HBVDNA positiva senza malattia avanzata, come terapia di durata definita e senza limiti di associazione Riesacerbazioni dell’epatite B conseguenti a terapie con chemioterapici antitumorali o farmaci immunosoppressivi o a trapianto di midollo o di organo solido, senza limiti temporali né di associazione Farmaco prescritto lamivudina cp 100 mg lamivudina sospensione 5 mg/mL Dose/die_____________________ Durata prevista del trattamento _______________________________ Prima prescrizione Data_____________ Prosecuzione cura Timbro e firma del clinico prescrittore PIANO TERAPEUTICO AIFA PER PRES CRIZIONE SSN DI LAMIVUDINA (ex Nota 32 bis) Centro prescrittore________________________________________________________________________ Medico prescrittore (nome e cognome)________________________________________________________ Tel___________________________________email______________________________________________ Paziente (nome e cognome) ________________________________________________________________ Data di nascita______________ Sesso M F Codice Fiscale _____________________________________________________ Residente a ________________________________________________Tel. __________________________ Regione _________________________________________________________________________________ ASL di residenza___________________________________ Prov.___________________________________ Medico di Medicina Generale_________________________________________________________________ La prescrizione di lamivudina è a carico del SSN per le seguenti condizioni cliniche: Epatite cronica B HBV-DNA-positiva, con malattia avanzata (con riscontro istologico di ponti porto-centrali e/o diagnosi clinica di cirrosi) in cui l’interferone sia controindicato, o non tollerato o inefficace, come terapia soppressiva senza limiti temporali né di associazione Epatite cronica B HBVDNA positiva senza malattia avanzata, come terapia di durata definita e senza limiti di associazione Riesacerbazioni dell’epatite B conseguenti a terapie con chemioterapici antitumorali o farmaci immunosoppressivi o a trapianto di midollo o di organo solido, senza limiti temporali né di associazione Farmaco prescritto lamivudina cp 100 mg lamivudina sospensione 5 mg/mL Dose/die_____________________ Durata prevista del trattamento _______________________________ Prima prescrizione Data_____________ Prosecuzione cura Timbro e firma del clinico prescrittore 3-2-2010 Supplemento ordinario n. 22 alla GAZZETTA UFFICIALE Serie generale - n. 27 ALLEGATO 10A00387 — 13 —
Scarica