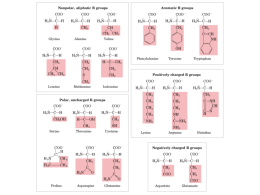
Emoglobina La biochimica comparata della mioglobina e dell’emoglobina mioglobina: singola catena polipeptidica di 153 amminoacidi emoglobina: 4 catene polipeptidiche, di cui due di 141 amminoacidi (a) e due di 146 amminoacidi (b) propanoile metile vinile Mioglobina: la porzione polipeptidica della Mb racchiude il gruppo eme inclinazione di 60° il legame dell’ossigeno alla mioglobina ossimioglobina: sesto ligando ossigeno deossimioglobina: sesta posizione vuota metamioglobina: sesto ligando una molecola d’acqua catena laterale di istidina La funzione principale della mioglobina è quella di facilitare il trasporto dell’ossigeno nel muscolo Curva di legame dell’ossigeno alla mioglobina Curve di dissociazione dell’ossigeno dell’emoglobina e della mioglobina Deossiemoglobina movimento molecolare elica F contatti di scivolamento a1b2 e a2b1 Ossiemoglobina l’ossigenazione avvicina le due subunità b I cambiamenti nella posizione dell’atomo di ferro del gruppo eme dopo l’ossigenazione determinano modificazioni conformazionali nella molecola di emoglobina Movimenti dell’eme e dell’elica F durante la transizione T dell’emoglobina R Forma T Forma R Legame dell’ossigeno all’emoglobina: curva sigmoide In ogni sistema di legame una curva di tipo sigmoide è indicativa della presenza di interazioni cooperative tra i siti di legame. Il legame dell’ emoglobina all’ossigeno è influenzato da: -protoni -biossido di carbonio -2,3-bisfosfoglicerato effettori allosterici Curve di dissociazione dell’ossigeno della mioglobina e dell’emoglobina a cinque diversi valori di pH HbO2 + H+ Hb H+ + O2 Effetto Bohr biossido di carbonio CO2 + H2O anidrasi carbonica H2CO3 H+ + HCO3 molti degli ioni H+ sono catturati dall’Hb quando l’O2 si dissocia . Quando l’Hb viene di nuovo ossigenata nei polmoni, l’ H+ viene rilasciato per formare di nuovo H2CO3 Ruolo dell’emoglobina nel trasporto dell’O2 dai polmoni ai tessuti che respirano e della CO2 (sotto forma di HCO3-) dai tessuti ai polmoni. l’ossigeno entra nei polmoni con un’elevata pressione Protoni e ossigeno non si legano allo stesso sito. L’ossigeno si lega agli ioni ferrosi dei gruppi eme mentre lo ione H+ può legarsi alle catene laterali di diversi residui amminoacidici della proteina. Quando la concentrazione di ioni idrogeno aumenta la conseguente protonazione dell’emoglobina favorisce il rilascio dell’ossigeno e la transizione allo stato T. L’anidride carbonica si lega all’estremità amminoterminale di ciascuna globina formando carbamminoemoglobina. Quando la concentrazione di anidride carbonica è alta, come nei tessuti periferici, alcune molecole di anidride carbonica si legano all’emoglobina diminuendone l’affinità per l’ossigeno. Viceversa quando l’emoglobina raggiunge i polmoni, l’elevata concentrazione di ossigeno determina il distacco della CO2 e la saturazione dell’HB. Tutto ciò rende l’Hb particolarmente adatta al trasporto integrato di ossigeno, anidride carbonica e ioni idrogeno da parte degli eritrociti. Effetto del BPG e della CO2 sulla curva di dissociazione dell’O2 dell’emoglobina Struttura del 2,3-bisfosfoglicerato (BPG) L’interazione dell’Hb con il 2,3-bifosfoglicerato è un esempio di regolazione alloasterica eterotropica. Legame del BPG alla deossiemoglobina avviene tramite le catene b BPG e O2 sono effettori allosterici mutualmente esclusivi per l’Hb anche se i loro siti di legame sono fisicamente distinti Il BPG è una molecola fortemente negativa e si lega all’ Hb mediante interazioni elettrostatiche con gruppi funzionali carichi positivamente di residui di entrambe le catene b. Nell’ossiemoglobina il BPG non può entrare e con la sua presenza induce l’ Hb a rilasciare ossigeno. Il BPG svolge una funzione importante nell’adattamento fisiologico alla bassa pressione di ossigeno che si ha per esempio a quote elevate. Per un uomo sano il legame di O2 all’Hb è regolato in modo che il gas trasferito ai tessuti sia circa il 40% della quantità totale di gas che il sangue può trasportare. A 4500 metri di altezza, dove la pressione di ossigeno è più bassa, il trasferimento di ossigeno ai tessuti si riduce. Alcune ore più tardi la concentrazione di BPG nel sangue comincia ad aumentare generando una diminuzione dell’affinità dell’Hb per l’O2 e favorendo il rilascio di ossigeno a livello dei tessuti. L’emoglobina fetale ha una struttura del tipo a2g2 L’emoglobina fetale ha una maggiore affinità per l’ossigeno perché ha una minore affinità per il BPG (mancano le catene b) Anemia a cellule falciformi HbS o emoglobina delle cellule falciformi clinicamente: -episodi intermittenti di crisi emolitiche e vaso-occlusive -dolore alle ossa, al torace e all’addome -ritardo della crescita -maggiore suscettibilità alle infezioni -danni a diversi organi Struttura della fibra di deossiemoglobina S - presenza di valina al posto di acido glutammico nelle catene b dell’Hb -le catene laterali dei residui di valina creano delle sporgenze idrofobiche (zone appiccicose) sulla superficie della molecola, alle quali si vanno a legare molecole vicine di HbS lunghi polimeri a catena insolubili Formazione dei filamenti di Hb S mediante interazioni tra le catene laterali idrofobiche dei residui di valina delle catene b e le tasche idrofobiche presenti nelle catene b delle molecole di Hb adiacenti. residuo di valina Fotografia al microscopio elettronico di fibre di deossiemoglobina S che stanno uscendo da un eritrocita rotto l’ossigeno entra nei polmoni con un’elevata pressione TRASPORTO DELL’ANIDRIDE CARBONICA L’ anidride carbonica è presente nel sangue in tre forme principali: 1) come CO2 disciolta 2) come HCO3- formata dalla ionizzazione dell’ H2CO3 (prodotto quando la la CO2 reagisce con l’acqua) 3) come carbamino gruppi, formati quando la CO2 reagisce con gli amminogruppi dell’emoglobina. FORMAZIONE DEL BICARBONATO L’anidride carbonica diffonde all’interno degli eritrociti dove viene trasformata in acido carbonico che, in maniera rapida e spontaneamente ionizza: CO2 + H2O anidrasi carbonica H2CO3 H+ + HCO3- Formazione della carbaminoemoglobina (trasporto della CO2) L’anidride carbonica reagisce con gli amminogruppi della desossiemoglobina, formando carbaminoemoglobina: R-N H H + CO2 R-N Questo processo libera ioni H+ H C O- + H+ O Poiché gli amminogruppi N-terminali delle catene della globina formano parte del sito di legame del BPG, si verifica una competizione tra CO2 e BPG: il BPG diminuisce la capacità dell’Hb di formare carbamino Hb L’ Hb, oltre ad essere il principale trasportatore dell’ossigeno è un importante trasportatore dell’anidride carbonica sotto forma di gruppi carbamino legati covalentemente e gioca il ruolo principale nel controllo degli idrogenioni prodotti dal trasporto della CO2 Il potere tampone dell’emoglobina è dovuto a: -4 a-amminogruppi degli amminoacidi N-terminali - catene laterali imidazoliche dei residui di istidina L’emoglobina possiede 38 istidine per tetramero che sono responsabili della maggior parte del potere tampone di questa proteina. L’emoglobina rappresenta il principale sistema tampone del sangue dopo quello del bicarbonato. Nel sangue intero, l’azione tampone assorbe circa il 60% dell’acido prodotto nel normale trasporto dell’anidride carbonica. TRASPORTO ISOIDRICO DELLA CO2 La parte rimanente dell’acido che proviene dall’anidride carbonica viene assorbita dall’Hb tramite questo meccanismo. 1 All’atmosfera Il sistema isoidrico può assorbire gli ioni H+ derivanti dall’anidride carbonica impedendo così variazioni del pH. Eventi che si verificano sul gruppo NH2 terminale delle catene a e b dell’Hb Evento NH2 terminali catene a catene b Formazione di gruppi carbamino si si Legame del DPG no si Legame di H+ nell’effetto Bohr si no Il controllo del pH del sangue è importante perché eventuali variazioni determinano modificazioni del pH intracellulare che, a loro volta, possono alterare profondamente il metabolismo. Il pH normale del sangue arterioso è 7,40 + 0,05 L’intervallo compatibile con la vita è circa 7,8 – 6,8 Il pH dell’eritrocita è prossimo a 7,2 (nelle altre cellule è 7,0) Il sistema tampone del bicarbonato è il tampone principale del plasma e del liquido interstiziale CO2 + H2O anidrasi carbonica H2CO3 H+ + HCO3- CO2 + H2O anidrasi carbonica H2CO3 H+ + HCO3- Il tampone biossido di carbonio-bicarbonato è un sistema aperto Come funziona? Quando il pH del sangue scende per la produzione metabolica di H+, l’equilibrio si sposta verso sn con accumulo di acido carbonico. Allo stesso tempo l’acido carbonico si scinde e l’anidride carbonica viene eliminata dai polmoni con l’espirazione. Quando il pH del sangue aumenta si forma più HCO3- . La respirazione viene adattata in modo che la quantità di CO2 aumentata nei polmoni possa essere reintrodotta nel sangue e, per conversione ad acido carbonico, fornisce gli ioni H+ necessari a controbilanciare l’aumento di HCO3- Acidosi: il pH del sangue si abbassa a valori di 7,1 -patologie ostruttive del polmone che impediscono una normale eliminazione della CO2 determinano una acidosi respiratoria -l’improvviso aumento dei livelli di acido lattico durante uno sforzo fisico possono provocare un’acidosi metabolica Alcalosi: il pH del sangue tende a salire oltre 7,6 -l’iperventilazione accelera la perdita di CO2 e porta ad un’alcalosi respiratoria Trattamento dell’acidosi: somministrazione intravenosa di NaHCO3 Trattamento dell’alcalosi: quella respiratoria viene migliorata dalla respirazione di un’atmosfera ricca di CO2
Scarica