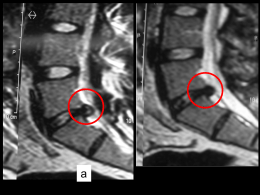
- Addome Acuto - Patologia del canale inguinale - Varicocele - Ipospadia e Fimosi - Anomalie congenite del tratto urinario - Patologie malformative di interesse chirurgico - Stenosi ipertrofica del piloro - Malattia di Hirschsprung o Megacolon Congenito Agangliare Addome Acuto Pietro Antonuccio, Pietro Impellizzeri, Emanuela Santacaterina, Tizaiana Russo, Giorgio Lamberti, Maria Rosaria Chirico, Carmelo Romeo Cattedra di Chirurgia Pediatrica Dipartimento di Scienze Pediatriche Mediche e Chirurgiche Università di Messina Definizione Per Addome Acuto s’intende un quadro clinico a localizzazione addominale caratterizzato dalla acuzie, a prognosi grave se non addirittura fatale se non trattata d’urgenza con intervento chirurgico. La diagnosi di addome acuto è spesso tutt’altro che agevole nei pazienti pediatrici, soprattutto in neonati e lattanti che non sono capaci di esprimersi se non con il pianto. Fisiopatologia Ogni organo contenuto nella cavità addominale può dare DOLORE per DISTENSIONE o COMPRESSIONE, poiché la sofferenza anossica che questi due meccanismi provocano a livello dei nocicettori intraparietali ne abbassa la soglia di sensibilità. Il dolore addominale può essere classicamente diviso in: - Vero Dolore Viscerale - Dolore Riferito (o visceroparietale) - Dolore Peritoneale (o peritoneo-parietale) Classificazione Considerate le molteplici possibili eziologie del dolore addominale acuto, fondamentale importanza riveste l’esame anamnestico-clinico, che dovrà prendere in considerazione: 1) CARATTERISTICHE DEL DOLORE: tempo, modalità e sede di insorgenza intensità ed evoluzione andamento (continuo, remittente o intermittente) 2) VALUTAZIONE DEI DISTURBI RIFLESSI e di in eventuale stato di shock 3) COMPORTAMENTO DELLA PARETE ADDOMINALE: disegno di anse, contrattura di difesa Considerando inoltre gli eventuali segni associati e le loro caratteristiche: - vomito - caratteri dell’alvo - diuresi - temperatura corporea I dati così ottenuti indirizzeranno la richiesta di indagini laboratoristiche e/o strumentali al fine di inquadrare la patologia di base in uno dei seguenti gruppi: A) Sindromi Addominali Acute (SAA) che richiedono un intervento chirurgico immediato: Peritoniti Torsione di visceri peduncolati Rottura su base traumatica di visceri addominali Occlusioni intestinali con distensione mal tollerata e sofferenza ischemica. B) SAA che permettono un intervento differito: Ascesso epatico Enterocolite necrotizzante Occlusioni intestinali da mucoviscidosi Occlusioni intestinali con distensione ben tollerata C) SAA di pertinenza medica Malattie infettive Malattie autoimmuni Malattie del ricambio Emolinfopatie Gastroenteriti Epatiti virali Infezioni delle vie urinarie Stipsi ostinata Coliche gassose Neonati Ostruzione Intestinale • Atresia, Stenosi Intestinale, Duplicazioni • Ileo da Meconio • Malattia diHirschsprung • Malrotazione e Volvolo • Occlusione postoperatoria • Gastroschisi/Onfalocele Peritonite • Spontanea perforazione dello Stomaco o dell’Intestino • Enterocolite Necrotizzante Neonatale (NEC) Altre • Ernia incarcerata con necrosi intestinale o torsione ovarica • Trauma Bambini < 2 anni • Invaginazione • Malrotazione e Volvolo • Ernia incarcerata con necrosi intestinale o torsione ovarica • Trauma Addominale • Malattia di Hirschsprung Pazienti pediatrici (2-16 anni) • Appendicite – Diverticolo di Meckel • Ostruzione Intestinale • Trauma Addominale • Torsione Ovarica o Testicolare o Omentale • Pancreatite • Colecistite acuta - Cisti del coledoco • Morbo di Crohn o Colite Ulcerativa • Fibrosi Cistica • Gravidanza Ectopica La diagnosi di quadro addominale acuto deve essere sempre prima clinica e quindi strumentale. Diagnostica Esami di laboratorio L’esame emocromocitometrico è importante per la valutazione della componente emorragica e infiammatoria della patologia in atto. Ripetuto a breve distanza può indicare l’evoluzione della malattia. Una Leucocitosi è quasi sempre presente. Un aumento dei valori sierici di Azotemia e Creatinina da informazioni sulla disidratazione del compartimento extracellulare, poiché riducendosi il filtrato glomerulare, diminuisce l’escrezione urinaria di questi cataboliti. Può rappresentare un indice della gravità della flogosi in atto, poiché la disidratazione è spesso proporzionale all’entità del processo infiammatorio. Importante il dosaggio della Proteina C reattiva. Va sempre effettuato anche un dosaggio di elettroliti (Na, K, Cl, Ca), per poter correggere eventuali squilibri. Altre utili informazioni ci possono venire da valori elevati di Bilirubina Diretta, Fosfatasi Alcalina e Gamma Gt, che indicano un ostacolo al transito biliare e dall' aumento di Amilasemia e di Lipasemia, che supporta l' ipotesi di una pancreatite. Un' emogasanalisi può dimostrare un' eventuale acidosi metabolica che accompagna lo stato settico o un’ alcalosi metabolica in caso di vomito protratto nel tempo; vanno poi determinati gruppo sanguigno e prove di coagulazione, in previsione dell' intervento chirurgico. Nelle adolescenti in età fertile e storia clinica dubbia sul ciclo mestruale é indispensabile l' esecuzione di un Test di Gravidanza. Diagnostica strumentale Le immagini radiologiche non devono essere lette ma interpretate alla luce della reale situazione clinica. I maggiori supporti strumentali per il chirurgo in urgenza sono rappresentati da esami semplici e di rapida esecuzione come la radiologia tradizionale e l' ultrasonografia. Una radiografia dell' addome senza mezzo di contrasto o un' ecografia sono nella maggior parte dei casi sufficienti a confermare l' ipotesi diagnostica. Esami più complessi come la TC, la RMN, l' angiografia o la scintigrafia, trovano indicazione nella diagnostica dell' addome acuto solo in casi selezionati. Radiologia tradizionale • L' esecuzione di una radiologia addominale deve essere accompagnata da un radiogramma toracico in proiezione antero-posteriore e latero-laterale per escludere la presenza di cause extra addominali di addome acuto. • La radiografia dell' addome senza mezzo di contrasto rappresenta l' esame più' semplice ed importante nelle diagnosi del quadro occlusivo: permette di differenziare se l' occlusione è colica o ileale e di differenziare tra loro ileo meccanico o adinamico. I segni radiologici sono la distensione gassosa e la presenza di livelli idroaerei, evidenziabili in ortostatismo (ansa sentinella) e ascite. Nell' ipotesi di un evento perforativo la radiografia dell' addome senza mezzo di contrasto è finalizzato alla dimostrazione di aria libera in peritoneo, che in posizione eretta si presenta come una falce d' aria sottodiaframmatica. • Altro segno importante è la presenza di calcificazioni endoaddominali, che in relazione alla sede può suggerire l’esistenza di alcune patologie: litiasi biliare, pancreatite cronica, che si associa a calcificazioni diffuse della ghiandola, litiasi renale ed ureterale, patologia vascolare, diverticolo di Meckel, nella pelvi delle pazienti femmine potrebbero indicare un tumore dermoide. • Andranno anche valutati i profili renali e degli psoas: la scomparsa di queste linee è generalmente indice di patologie infiammatorie retroperitoneali. • In alcune occasioni sono usati mezzi di contrasto: se si sospetta evento perforativo delle alte o basse vie digestive si può utilizzare mdc idrosolubile; mentre per valutare la sede precisa di un' occlusione il mezzo di contrasto baritato è più indicato. • In ogni caso, quando vi è il sospetto che all' occlusione sia associata una perforazione va sempre utilizzato il mezzo di contrasto idrosolubile per i dannosissimi effetti del bario nella cavità peritoneale. • Clisma Opaco, ha lo scopo di evidenziare le alterazioni, morfologiche e funzionali, dei diversi segmenti del grosso intestino e del retto. Questo esame fornisce una diagnosi, sovente precoce, delle lesioni organiche di tipo ulcerativo o tumorale, delle malformazioni digestive (atresie e stenosi intestinali, ileo meconio). In caso di invaginazione intestinale tale esame può essere oltre che diagnostico terapeutico. Ecografia • È particolarmente utile nella valutazione delle sindromi addominali acute ed è rapida, innocua, e relativamente economica. • Nel sospetto di patologie epato-biliari, pancreatiche, reno-uretero-vescicali, retroperitoneali, ginecologiche, traumatiche e ascessuali l'ecografia può confermare o escludere la diagnosi o monitorare la patologia. • Per la patologia epato-biliare ci permette di valutare il contenuto della colecisti, l' ispessimento delle sue pareti in presenza di colecistite, e il calibro delle vie biliari in relazione ad un eventuale ostruzione. • In caso di pancreatite l' ecografia può dimostrare le alterazione dimensionali e le irregolarità parenchimali della ghiandola e può contemporaneamente valutare l'esistenza di una patologia biliare come causa scatenante. • L' ecografia ha anche un ruolo rilevante nel trattamento delle raccolte ascessuali addominali: oltre ad individuarne la presenza, può permetterne la diagnosi di natura mediante agoaspirato, che consente di valutare macroscopicamente e colturalmente il materiale aspirato. • In anestesia locale è anche possibile procedere al posizionamento di drenaggio percutaneo della raccolta sempre sotto il controllo ecografico. TC Occupa un posto limitato nello studio del paziente con dolore addominale acuto, per la esposizione alle radiazioni e per l' elevato costo. La causa di addome acuto in cui la TC mantiene una certa superiorità nei confronti dell' ecografia è la pancreatite acuta, poiché consente una migliore definizione delle alterazioni parenchimali e dell' estensione retroperitoneale del processo. E’ inoltre la metodica di scelta per diagnosticare e monitorare le patologie nei traumi addominali. Addome acuto neonatale Enterocolite necrotizzante (NEC) Grave malattia del neonato ad eziologia multifattoriale caratterizzata dalla presenza di lesioni a carattere necrotico ed infiammatorio a livello intestinale. E’la forma più comune ed insidiosa di addome acuto nel neonato. Rappresenta probabilmente la tappa terminale di fenomeni ipossici, ipotermici ed ipovolemici a cui consegue una ischemia intestinale per ridistrubuzione di sangue dal distretto splancnico ad altri distretti. In genere è più frequente nei prematuri. Sintomatologia :vomito, distensione addominale, alvo diarroico più o meno francamente ematico. Nella stadio più avanzato quando la NEC diventa una patologia di interesse chirurgico è possibile osservare letargia, distensione addominale, disegno di anse e radiologicamente versamento ascitico intraperitoneale. La diretta addome è caratterizzata da pneumatosi intestinale. Segno prognostico infausto è la pneumatosi portale (gas nella vena porta). Atresie intestinali Per Atresia Duodenale (AD) si intende un’ostruzione completa del lume intestinale, mentre la stenosi duodenale è una condizione di ostruzione incompleta che può essere sostenuta da cause estrinseche (pancreas anulare, briglia di Ladd, vena porta pre-duodenale) più raramente intrinseche (diaframma mucoso incompleto, diverticolo endoluminale). È dovuta alla mancata ricanalizzazione al termine della fase solida. Si distinguono tre tipi di AD: tipo I diaframma completo, tipo II cordone fibroso che unisce le due tasche intestinali a monte e a valle, tipo III discontinuità tra i segmenti atresici. Spesso associata ad altre anomalie congenite in altri organi o a quadri sindromici. Diagnostica L’ecografia prenatale alla 24 esima settimana mostra il segno della doppia bolla addominale (costituita da stomaco e porzione duodenale atresica) e il polidramnios dovuto al mancato riassorbimento intestinale del liquido amniotico. Alla nascita la radiografia dell’addome in clino e ortostatismo documenta il “segno della doppia bolla”. Il clisma opaco risulta utile nei casi dubbi e può documentare un quadro di malrotazione intestinale incompleta tipo briglia di Ladd. Sintomatologia Il primo segno dell’ostruzione è dato da vomito biliare a poche ore dalla nascita. Obiettivamente l’addome presenta il caratteristico aspetto scafoide. Trattamento La terapia è esclusivamente chirurgica. L’atresia digiuno-ileale (AD-I) è una condizione caratterizzata dalla completa ostruzione del lume del piccolo intestino. Alla base dell’AD-I vi è un evento meccanico che si verifica accidentalmente durante la vita intrauterina con ripercussioni sul circolo mesenteriale. Distinguiamo 5 diversi tipi: tipo I diaframma mucoso completo (parete intestinale e meso intatti) tipo II presenza di un sottile cordone fibroso che unisce i due segmenti intestinali (meso integro) tipo IIIa difetto a V del meso con soluzione di continuità tra i due segmenti duodenali tipo IIIb atresia digiunale alta vicino al Treiz (l’intestino distale ha forma elicoidale) tipo IV atresie multiple. Sintomatologia Vomito biliare la cui comparsa è tanto più precoce quanto più alta è l’atresia .Obiettivamente a causa dell’occlusione intestinale si riscontra una distensione addominale. L’ emissione del meconio avviene nelle prime 24 ore ma esso risulta frammisto a materiale necrotico. Nelle atresie digiunali un sintomo caratteristico è l’ ittero che insorge a 72 ore dalla nascita. Diagnostica L’RX diretta addome in clino e ortostatismo mostra anse dilatate con livelli idroaerei . Trattamento Esclusivamente chirurgico. Ileo da meconio Quadro ostruttivo neonatale a livello dell’ ileo terminale. Viene classificato in due forme: semplice (con semplice ostruzione del tenue) complicato (associato a stenosi, atresia, o volvolo). Tipico nei pazienti affetti da fibrosi cistica o nei neonati SGA o VLBW . In presenza di ileo da meconio semplice è possibile disostruire l’ ileo terminale con il clisma con Gastrografin, anche due o tre volte prima di considerare fallito il trattamento conservativo. Per favorire l’evacuazione del meconio è possibile somministrare N-acetilcisteina da proseguire anche dopo la ripresa della canalizzazione e l’inizio della alimentazione. Se si ha peggioramento delle condizioni cliniche del neonato si può ricorrere a enterotomia realizzata dal moncone appendicolare per eseguire irrigazione. Quando la toilette intestinale non è completa o la parete è danneggiata allora si rende necessaria resezione intestinale seguita da anastomosi primaria o da ileostomia. Invaginazione Definizione L’invaginazione intestinale è una delle cause più frequenti di addome acuto nell’ età pediatrica. È dovuta alla penetrazione “a cannocchiale” di un segmento di intestino (detto invaginato) in quello sottostante (detto invaginante). L’invaginazione può verificarsi in qualunque tratto dell’ intestino mesenteriale, anche se i tratti più coinvolti sono l’ileo terminale ed il cieco. In rapporto alla causa che determina l’invaginazione possiamo distinguere due tipi: l’invaginazione idiopatica che si verifica senza una causa apparente ( alterazioni della motilità legate allo svezzamento, infezioni gastroenteriche) e l’invaginazione sintomatica legata alla presenza di formazioni endoluminali che stimolano la peristalsi (polipi, diverticolo di Meckel, masse). Rapporto tra maschi e femmine 3:1. Sintomatologia La sintomatologia d’esordio è rappresentata da crisi dolorose (85%), emissioni di materiale mucoematico misto a feci (“gelatina di lampone”) e pianto inconsolabile. Se la diagnosi non è precoce si può assistere ad un rapido deterioramento delle condizioni generali del bambino (disidratazione, ipotermia, shock) e talvolta all’ esame obiettivo è possibile palpare il budino dell’ invaginazione (insieme di invaginato e invaginante). Diagnostica e Terapia L’ecografia addome evidenzia la presenza di immagine a bersaglio caratterizzata da un area centrale iperecogena con al centro una piccola zona ipoecogena. Il clisma opaco, che può essere sia diagnostico che terapeutico, mostra: l’arresto del mdc a livello dell’invaginazione dando origine alle immagini definite “ a coccarda”, “chela di aragosta”, “molla di materasso”. Se si ha la successiva progressione del mdc oltre l’ostacolo fino a visualizzazione dell’ ultima ansa ileale, l’invaginazione può considerarsi risolta. In caso contrario si procede ad esplorazione chirurgica con spremitura manuale dell’ invaginato dall’ invaginante. Nei casi in cui l’intestino presenti segni di sofferenza vascolare o di perforazione è necessario effettuare resezione intestinale con anastomosi primaria. Appendicite acuta È la causa più frequente di addome acuto in età pediatrica. Si manifesta come conseguenza di un’ostruzione del lume appendicolare (iperplasia tessuto linfatico, ristagno fecale, corpi estranei, infezioni sistemiche). Sintomatologia I sintomi classici sono rappresentati da dolore ad insorgenza periombelicale che successivamente migra in fossa iliaca destra, continuo, febbre, nausea e/o vomito. Sono talvolta presenti sintomi urinari se l’ appendice è in posizione retrocecale e decubita sull’ uretere. All’ esame obiettivo importante è ricercare i segni tipici : Segno di Mc Burney: dolenzia alla palpazione di un punto situato tra il terzo esterno e il terzo medio della linea obliqua che congiunge la spina iliaca anterosuperiore destra all’ombelico. Manovra di Blumberg: con la mano a piatto si esercita una pressione in corrispondenza della fossa iliaca destra e si rilascia rapidamente provocando dolore, legato allo stiramento del peritoneo parietale che stimola le terminazioni nervose. Manovra di Rovsing: palpando la fossa iliaca sinistra si suscita dolore in fossa iliaca destra. Diagnostica La diagnosi di appendicite acuta è essenzialmente clinica può essere coadiuvata dalle indagini di laboratorio o di immagini. L’emocromo mostra leucocitosi neutrofila ed innalzamento della PCR. L’ecografia addome ha una sensibilità del 30% nella diagnosi delle forme catarrali e nel 100% di quelle gangrenose. Evidenzia una diversa ecogenicità del lume appendicolare, presenza di eventuale coprolita, di ascesso pelvico o di raccolte fluide o corpuscolate nel Douglas. Utilissima per la diagnosi differenziale dell’addome acuto da patologie urinarie o annessiali. Nel 1986 fu proposto un sistema a punteggio clinico (conosciuto come Alvarado clinical score) che agevolasse la diagnosi di appendicite; esso è basato sul riscontro di alcuni sintomi (dolore in fossa iliaca destra, anoressia, nausea e vomito), segni e reperti di laboratorio (dolore alla palpazione in fossa iliaca destra, manovra di Blumberg positiva, febbre, leucocitosi, neutrofilia) ai quali viene attribuito un punteggio. Se la somma è superiore a 7 la diagnosi viene confermata. Se inferiore a 5 è forte la probabilità che non si tratti di appendicite. I punteggi intermedi tra 5 e 7 richiedono accertamenti ulteriori. Trattamento La terapia medica non ha ruolo nel trattamento dell’ appendicite acuta, si può instaurare una terapia con antibiotici a largo spettro in preparazione all’ intervento chirurgico. È possibile effettuare l’intervento in open (appendicectomia sec. Mc Burney nelle forme non complicate,o in pararettale destra, per le forme complicate da peritonite) oppure per via interamente laparoscopica o per via transombelicale videoassistita (TULAA) Bibliografia 1. GB Parigi Chirurgia Pediatrica Cap. 5,4,19 Ed. Masson 2. Sivit CJ.:”Contemporary immaging in abdominal emergencies” Pediatr Radiol. 2008 Nov; 38 Suppl 4:S675-8. E pub 2008 Sep 23. Review 3. Waseem M, Rosenberg HK.:” Intussusception.” Pediatr Emerg Care. 2008 Nov;24(11):793800. Review 4. Shreef KS, Waly AH, Abd-Elrahman S, Abd Elhafez MA : Alvarado score as an dmission criterion in children with pain in right iliac fossa .Afr J Paediatr Surg. 2010 Sep-Dec;7(3):163-5 5. Stanfill AB, Matilsky DK, Kalvakuri K, Pearl RH, Wallace LJ, Vegunta RK “Transumbilical Laparoscopically Assisted Appendectomy: An Alternative Minimally Invasive Technique in Pediatric Patients” J Laparoendosc Adv Surg Tech A. 2010 Sep 27. Patologia del canale inguinale Pietro Impellizzeri, Pietro Antonuccio, Giorgio Lamberti, Angela Simona Montalto, Roberta Gentile, Antonino Costa, Carmelo Romeo Cattedra di Chirurgia Pediatrica Dipartimento di Scienze Pediatriche Mediche e Chirurgiche Università di Messina Questo capitolo comprende: patologie malformative dovute a persistenza del dotto peritone-vaginale (dpv) come l’ernia inguinale, l’idrocele comunicante, la cisti del funicolo, la ritenzione testicolare da anomala migrazione della gonade. patologie acquisite quale la torsione del funicolo. Embriologia ed anatomia del canale inguinale Nell’embrione maschile il dpv è un’estroflessione della cavità peritoneale determinata, intorno al III-IV mese di gestazione, dalla migrazione del testicolo in senso cranio-caudale verso lo scroto. La discesa della gonade si completa al VII-IX mese di gestazione con l’obliterazione del dpv. Nella porzione finale il residuo del dpv avvolge il testicolo formandone la vaginale propria. Il dpv si Fig 1 oblitera spontaneamente tra l’anello inguinale interno e i testicoli dopo la completa discesa testicolare (Fig.1). Il meccanismo di controllo non è ancora chiaro, ma sembra possano essere coinvolti fattori ormonali. Hutson et al. (1) hanno prospettato un possibile ruolo del peptide correlato al gene della calcitonina, CGRP, nella fusione del dotto peritoneo vaginale. Nell’embrione femminile: l’ovaio discende nello scavo pelvico ma non esce dalla cavità addominale. La parte superiore del gubernaculum diviene il legamento ovarico, quella inferiore il legamento rotondo, che attraverso l’orifizio inguinale esterno si porta nel grande labbro attraverso il dotto di Nuck, l’equivalente femminile del dpv (2). Il canale inguinale attraversa a tutto spessore la parete addominale con decorso obliquo, dall’alto verso il basso, dall’ esterno all’interno, dal dietro in avanti. Presenta quattro pareti: a) anteriore: costituita dall’aponeurosi dell’obliquo esterno e dalle fibre arcuate; b) posteriore: costituita dalla fascia trasversalis, dal tendine congiunto e legamento di Henle; c) superiore: costituita dal margine superiore del muscolo obliquo interno e trasverso; d) inferiore: costituita dal legamento inguinale di Poupart. Presenta un orifizio di sbocco (anello inguinale esterno) uno di entrata (anello inguinale interno). La mancata chiusura totale o parziale del dotto peritoneo vaginale può determinare l’ insorgenza di diverse patologie. Ernia inguinale Definizione Fuoriuscita di un organo o di un viscere dalla cavità addominale attraverso il canale inguinale percorrendolo in toto od in parte Fig.2 all’interno del dpv rimasto pervio. In età pediatrica l’ernia inguinale si definisce come congenita obliqua esterna. Il contenuto è rappresentato nel maschio principalmente da anse intestinali (Fig 2). Nella femmina più frequentemente è coinvolto l’ovaio. Incidenza L’incidenza dell’ernia inguinale nei bambini varia tra 0,8% e 4,4%; maggiore nei prematuri con percentuali che variano tra 16 e 25% (3). Più frequente nei primi anni di vita con un picco di incidenza durante i primi mesi (3). Sesso I maschi sono i più colpiti. Il rapporto medio tra i sessi va da 3:1 a 10:1. Rajput et al ritengono che i bambini con bassissimo peso alla nascita sviluppino un ernia nel 26% dei maschi e nel 7% delle femmine (3). Sede Predominanza del lato destro, Nei maschi il 60% delle ernie insorge sul lato destro, il 30% a sinistra e nel 10% bilaterale. Simile è l’incidenza nelle femmine (destra 60%, sinistra 32%, bilaterale 8%). L’11,5% dei pazienti ha una storia familiare di ernia, si ha maggiore incidenza nei gemelli, con il 10,6% nei gemelli maschi e il 4,1% nelle femmine (4). Etiopatogenesi La pervietà del dpv è il momento fondamentale per l’insorgenza dell’ ernia inguinale. La persistenza del dpv è un’ernia potenziale e, solo quando contiene alcune parti dei visceri addominali, diviene clinicamente evidente. Altri fattori favorenti sono: aumento della pressione addominale da derivazione ventricolo-peritoneale, dialisi peritoneale, criptorchidismo, genitali ambigui, fibrosi cistica, disordini del connettivo, mucopolisaccaridosi, lussazione congenita dell’anca, sindrome di Ehlers-Danalos o Marfan (2). Sintomatologia e Diagnosi I genitori riferiscono di tumefazione inguinale o inguino-scrotale che aumenta con il pianto o con la tosse e che scompare con il riposo. La tumefazione se clinicamente evidente presenta dimensioni variabili da una nocciola ad una grossa noce, di consistenza molle elastica, non dolente, se non complicata, e riducibile in addome con caratteristico rumore di gorgoglio intestinale. Nelle ernie inguino-scrotali la tumefazione può assumere dimensioni cospicue tali da sovradistendere il corrispondente emiscroto che appare turgido ed a superficie liscia, priva di plicature. In taluni casi può essere utile per facilitare la diagnosi compiere azioni che aumentino la pressione endoaddominale come tossire, saltare, gonfiare un palloncino. Se la storia clinica e l’esame obiettivo non conducono ad una diagnosi certa può essere utile far eseguire un esame ecografico che presenta una buona specificità e sensibilità (5). Sintomatologia dell’ernia inguinale complicata Le complicanze possono essere: Intasamento: quando le anse intrappolate nel sacco erniario non sono più riducibili in addome spontaneamente o con le opportune manovre di riduzione manuale. Clinicamente si manifesta con irritabilità, dolori addominali, vomito, alla visita è evidente una tumefazione inguinale o inguinoscrotale, tesa, di consistenza dura, non trans-illuminabile. Strozzamento: una volta non riducibili le anse intestinali vanno incontro ad edema e congestione fino a compromettere l’apporto vascolare da cui ne consegue l’occlusione intestinale con ischemia, necrosi e perforazione con peritonite che, se non riconosciuta, può portare all’exitus. Sul piano clinico la sintomatologia è data da: dolore, vomito biliare o fecaloide, segni di occlusione intestinale, presenza di massa inguinale o inguino-scrotale, ricoperta da cute arrossata, dolente. Diagnosi differenziale: Idrocele comunicante, Cisti del funicolo, Linfoadenite inguinale, Torsione del funicolo, Epididimiti e Orchiti, Ematomi, Tumori. Terapia Timing chirurgico: Nelle forme non complicate il trattamento deve essere programmato nel momento in cui viene posta la diagnosi allo scopo di prevenire le complicanze. Per i pazienti prematuri l’intervento può essere effettuato quando questi raggiungono un peso corporeo tra i 2 Kg e i 5 Kg. (6) Trattamento Il trattamento chirurgico dell’ernia congenita prevede la chiusura del dpv pervio e la plastica del canale inguinale. Scopo del trattamento chirurgico la chiusura alta del dpv In età pediatrica la tecnica più conosciuta è quella di Ferguson. Essa prevede, dopo l’isolamento del dpv e la sua chiusura con punto transfisso, la plastica del canale inguinale in cui il funicolo spermatico resta nella sua naturale posizione al di sopra del quale viene suturata la fascia del m. obliquo esterno al legamento inguinale di Poupart. Diverse le varianti (7). La tecnica di Mitchel-Banks prevede la legatura alta del sacco erniario senza l’apertura dell’anello inguinale esterno (8). Tecnica chirurgica laparoscopica. A partire dal 1990 la tecnica laparoscopica è stata utilizzata per la chiusura del dpv con un punto di sutura sull’anello inguinale interno guardando dalla cavità addominale (9). Questo tipo di accesso consente, inoltre, l’esplorazione dell’anello inguinale contro laterale (10). Non vi sono evidenze cliniche certe per cui la tecnica laparoscopica sia superiore a quella tradizionale per cui si rendono necessari trials randomizzati. Risultati Nelle forme non complicate la ripresa è rapida ed il trattamento viene eseguito in day surgery. Idrocele congenito Definizione Presenza di una variabile quantità di liquido all’interno della vaginale che riveste il testicolo. La differenza con l’ernia consiste nel calibro del dpv rimasto pervio e nel suo contenuto. Incidenza L’idrocele è comune nei lattanti e nei bambini e spesso si associa Fig.3 ad ernia inguinale. Presenta una maggiore incidenza a carico del testicolo di destra, ma può essere anche bilaterale. Sintomatologia La diagnosi differenziale con l’ernia inguinale viene fatta all’esame obiettivo: la tumefazione appare di consistenza tesoelastica, con polo superiore ben determinato, trans-illuminabile. Può subire variazioni durante la giornata con incremento delle dimensioni nelle ore serali, e quasi totale scomparsa al mattino. Quando ciò accade l’idrocele viene definito comunicante (Fig.3). Fig.4 L’idrocele si definisce non comunicante quando si ha l’obliterazione del tratto craniale del dpv. Si ha un idrocele funicolare quando il liquido interessa il tratto intrafunicolare del dpv (Fig. 4). Si definisce cisti del funicolo quando il dpv si oblitera nella sua porzione caudale e craniale. Terapia Nella maggior parte dei bambini con idrocele congenito il dpv si chiude spontaneamente entro i due anni di vita. Timing chirurgico: in prima istanza è raccomandato un atteggiamento di attesa fino all’età di 18-24 mesi. A questa età non potendo più sperare in una chiusura spontanea del dpv trova indicazione l’intervento chirurgico. Nei primi due anni di vita è indicato un trattamento chirurgico soltanto nel caso di idrocele comunicante, voluminoso e sotto tensione o vi sia associata ernia inguinale. Trattamento chirurgico: poco si differenzia per quanto già detto a proposito dell’ernia inguinale riguardo l’accesso chirurgico. Viene eseguita la legatura alta del dpv, la vaginale del testicolo viene aperta e drenata e viene poi effettuata sutura emostatica o, se necessario l’eversione (11). Scroto acuto Definizione Si intende una patologia acuta a carico dello scroto caratterizzata da dolore intenso, tumefazione edema ed eritema cutaneo. Le più comuni cause sono: la torsione del funicolo spermatico, la torsione delle appendici testicolari e l’orchiepididimite. Torsione del funicolo spermatico Incidenza È comune nell’adolescente ma può presentarsi anche prima della pubertà. Due picchi di incidenza: nel periodo neonatale e tra i 13 e i 16 anni (12). Eziopatogenesi Sono stati presi in considerazione l’eccessiva o anomala contrazione cremasterica, l’assenza o lassità del mesorchio. Fattori predisponenti sarebbero la disposizione orizzontale del testicolo, il criptorchidismo, i traumi scrotali. La torsione può essere prossimale all’inserzione della tunica vaginale del funicolo (entro il canale inguinale) o alla radice dello scroto: torsione extravaginale 6% dei casi, o distale a questa torsione, intravaginale, 94% dei casi. Può essere parziale o totale (360° o di 720°). Sintomatologia Neonato e lattante Paucisintomatico, decorso clinico subdolo. Bambino ed adolescente. Esordio improvviso, spesso durante il sonno, dolore locale intenso e talora irradiato alla regione inguinale omolaterale, testicolo tumefatto, privo della normale plicatura, arrossato, non trans illuminabile, aumentato di volume a volte più alto verso l’anello inguinale esterno. La palpazione provoca viva dolorabilità esacerbata dal sollevamento dello scroto (segno di Prehn). Difficoltosa identificazione degli elementi del funicolo. Il riflesso cremasterico è assente. Diagnosi L’ ecografia associata al doppler mostra assenza di flusso. Diagnosi differenziale: orchite – epididimite – torsione di appendici testicolari – traumi. Terapia Il paziente deve essere portato in sala operatoria nel più breve tempo (se possibile entro le otto ore dall’inizio della sintomatologia). L’approccio chirurgico è per via inguinale o scrotale, dopo derotazione si valuta il ripristino della vascolarizzazione osservando le modificazioni del colore della gonade e il sanguinamento all’incisione dell’albuginea (bleeding test), se la vitalità è recuperata si effettua fissazione del testicolo alla vaginale comune se invece è francamente necrotico si ricorre ad un orchiectomia (2). Risultati La torsione testicolare rappresenta una causa importante di infertilità maschile. Uno studio recente studio ha osservato in età adulta riduzione della fertilità e compromissione della spermatogenesi sia nei pazienti sottoposti a derotazione che in quelli sottoposti ad orchiectomia, verosimilmente per un danno a carico del testicolo contro laterale per una riposta autoimmune a danno ischemico da perfusione/riperfusione (13). Criptorchidismo Definizione Mancata discesa nello scroto per arresto o anomala migrazione della gonade. La classificazione più completa comprende tutti i vari tipi anatomo-clinici di ritenzione testicolare e viene riportata di seguito (Fig. 5). Fig. 5 Incidenza Colpisce il 3-4% di tutti i neonati a termine anche se la vera incidenza rimane controversa, in quanto molti dei neonati con diagnosi di criptorchidismo alla nascita non eseguono poi l’orchidopessi poiché il testicolo può raggiungere lo scroto entro i tre mesi post natali (14). Una maggiore incidenza si registra nei bambini prematuri, soprattutto per i nati con un peso al di sotto dei 1500g, con picchi del 60%-70%. Si pensa che la causa di questa aumentata incidenza sia dovuta al fatto che normalmente il testicolo raggiunge lo scroto intorno alla 35 settimana di gestazione. Molto spesso nei prematuri la discesa avviene fino a 12 settimane dopo la nascita (15) Embriologia Tra la III e la V settimana di gestazione inizia la differenziazione della gonade, verso la VI settimana avviene la migrazione delle cellule germinali primordiali. Intorno alla IX settimana di gestazione si sviluppano le cellule di Leyding e inizia la secrezione di testosterone, la discesa del testicolo non avviene prima della XXVIII settimana e la sua migrazione transinguinale completa avviene tra la 28 e la 40 settimana (16). Eziopatogenesi La discesa del testicolo avviene attraverso due meccanismi: uno meccanico è l’altro ormonale. Quello meccanico riconosce come elemento principale il gubernaculum testis che sin dalle prime fasi dello sviluppo embrionale mette in contatto il testicolo con la regione inguinale e la cui migrazione verso lo scroto determina la formazione del dpv. Il meccanismo ormonale implica l’azione combinata di testosterone, MIF e CGRP, un deficit dell’asse ipotalamo-gonade. Queste sostanze stimolerebbero il nervo genitofemorale che regola la migrazione del gubernaculum testis. Un’alterazione a carico di uno o entrambi questi meccanismi determinerebbe la mancata discesa del testicolo. (16) Sintomatologia I genitori riferiscono l’assenza della gonade nello scroto o la presenza di asimmetria tra le due borse scrotali. L’esame clinico deve tenere conto: a) forma dello scroto (un emiscroto normoconformato in genere lascia supporre di trovare il testicolo al di sotto dell’anello inguinale interno, mentre un’ipoplasia scrotale più o meno spiccata si correla a ritenzione alta o anorchia), b) va accuratamente ispezionata la regione inguinale, sovrapubica, scrotale, perineale e femorale per rilevare la presenza di eventuale forme di ectopia. Bisogna effettuare la palpazione bimanuale con paziente supino ed in ortostatismo. Sul piano clinico oltre al testicolo ritenuto vero va distinto il testicolo retrattile. In questa condizione il testicolo per una retrazione transitoria del muscolo cremasterico può risalire all’aditus scrotale o al III inferiore del canale inguinale per ritornare nello scroto. Diagnosi La diagnosi viene fatta con l’esame clinico nei casi in cui il testicolo sia palpabile, l’ecografia può essere un esame importante per valutare la localizzazione, la morfologia e la struttura della gonade. Nei casi in cui il testicolo non sia clinicamente palpabile è obbligatorio far eseguire un esame ecografico a cui seguirà ed, ove essa non fosse stata risolutiva, una RNM addome e regione inguinale. Oggi la video laparoscopia nel caso di testicolo NON palpabile è la tecnica più attendibile per porre diagnosi di gonade intraddominale o per dimostrarne inequivocabilmente la sua assenza. Terapia Terapia chirurgica Il trattamento del criptorchidismo è basato sull’assunto che un intervento precoce possa prevenire il danno a carico del testicolo causato dall’ipertermia a cui va incontro la gonade fuori dalla sua sede naturale. L’OMS consiglia la conclusione dell’iter terapeutico entro il secondo anno di vita, in quanto i segni iniziali di degenerazione delle cellule germinali sono presenti già nei primi 6 -12 mesi (17). Per il testicolo palpabile lungo la sua normale via di discesa e per alcune forme di ectopia, la tecnica chirurgica oggi più eseguita è l’orchidopessi sec. Shoemacker. Quando il testicolo è alla radice dello scroto, è possibile eseguire l’orchidopessi per via tran scrotale sec Bianchi e Squire (18). Quando il testicolo è allocato in addome o il funicolo è di lunghezza insufficiente a raggiungere lo scroto si può eseguire intervento chirurgico in due tempi. Oggi si preferisce eseguire un approccio video-laparoscopico ed eseguire la procedura secondo Fower- Stephens, nella quale vengono sezionati i vasi spermatici e può essere effettuata in uno o due tempi nei casi in cui il testicolo intraddominale è posizionato a distanza dal canale inguinale. Se invece il testicolo si trova vicino all’anello inguinale interno si preferisce l’orchidopessi video assistita dove l’orchidopessi è confezionata senza la sezione dei vasi spermatici. I vantaggi dell’orchidopessi video assistita sono rappresentati dal risparmio della vascolarizzazione testicolare; è simile alla tecnica open ma ha il vantaggio che il funicolo spermatico può essere sottoposto a dissezione per un segmento più alto e più lungo (19). Terapia medica La terapia medica trova un suo rationale nel ritenere che un deficit dell’asse ipotalamo-gonadi sia alla base della mancata discesa della gonade (20). La terapia non ha indicazione nei casi in cui vi sia associata ernia inguinale, o in caso di ectopia. La stimolazione si effettua con hCG e LHRH e vari sono gli schemi terapeutici proposti (21). Quanto più la gonade si avvicina allo scroto tanto più la terapia medica ottiene risultati soddisfacenti. Risultati La prognosi a distanza circa la funzionalità a del testicolo operato è legata soprattutto alle alterazioni preesistenti al trattamento quali la displasia testicolare e la dissociazione didimo- epididimo. Bibbliografia 1. Clarnette TD,Lam SK,Hutson JM: The genitofemoral nerve may link testicular inguinoscrotal descent with congenital inguinal hernia. Aust N Z J Surg 1996;66:612-617. 2. G.B.Parigi : Chirurgia Pediatrica Cap 22 .Ed. Masson 2000 ;408-425 3. Rajput A,Gauderer MW,Hack M: Inguinal Hernias in in very low birth weight infants. Incidence and timing of repair.J Pediatr Surg 1992 ;27:1322-1324 4. Bakwin H: Indirect inguinal hernia in twins. J Pediatr Surg 1971;6:165-168 5. Chen KC, Chu CC, Chou TY, Wu CJ: Ultrasonography for inguinal hernia in boys. J Pediatr Surg 1998;33:1784-1787 6. Miserez M : Inguinal hernia repair in a premature infant . Am J Surg 2004; 39:252 7. Ladd WE, Gross RE: Abdominal surgery of infants and childhood. Philadelfia WB Sauders, 1941. 8. Levitt MA, Ferraccio D, Arbesman MC et al: Variability of inguinal hernia surgical technique : a survey if North American Pediatric Surgeons. J Pediatr Surg 2002;37:745-751 9. Schier F, Montupet P, Esposito C: Laparoscopic inguinal herniorraphy in children: a tre center experience with 933 repairs .J Pediatr Surg 2002; 37:395-397 10. Holcomb GW, Stock JW, Morgan WM : laparoscopic evaluation for a controlateral patent processus vaginalis. J Laparoendosc Adv Surg Tech A. 2006 Dec 16(6):650-3. 11. Grosfeld et al :Pediatric Surgery sixth edition Chapter 74 p 1189 12. Clift VL, Hutson JM. :The acute scrotum in childhood .J Pediatr Surg Int 1989;4:185 13. Romeo C, Impellizzeri P et all: Late hormonal function after testicular torsion J. Pediatr Surg 2010; 45(2):411-3 14. Barthold JS, Gonzales R: The epidemiology of congenital cryptorchidism, testicular ascent and orchidopexy .J Urol 2003;170: 2396 15. Morley R, Lucas A :Undescended testes in low birth weight infants. BMJ 1987; 295: 753 16. G .B.Parigi : Chirurgia Pediatrica Cap 26 .Ed.Masson 2000;461-469 17. Huff DS Hadziselimovic F Snyder HM 3rd et al: Early postnatal testicular maldevelopment in cryptorchidism J Urol 1991; 146: 624 18. Bianchi A , Squire BR: Trans scrotal orchidopexy: Orchidopexy revisited. Pediatric Surg Int 1989; 4.189 19. Kanemoto K, Hayashi Y, KojimaY et al: The management of non palpable testis whit combined groin exploration and subsequent transiinguinal laparoscopy J.Urol 2002;167:674 20. Hadziselimovic F: Cryptorchidism: Management and Implication .Berlin, Springer Verlag 1983 21. Canavese F, Mussa A, Manenti M, Cortese MG, Ferrero L, Tuli G, Macchieraldo R, Lala R : Sperm count of young men surgically treated for cryptorchidism in the first and second year of life: fertility is better in children treated at a younger age. Eur J Pediatr Surg 2009; 19(6) 388-391 Varicocele Pietro Antonuccio, Pietro Impellizzeri, Tiziana Russo, Giorgio Lamberti, Roberta Gentile, Carmelo Romeo Cattedra di Chirurgia Pediatrica Dipartimento di Scienze Pediatriche Mediche e Chirurgiche Università di Messina È una situazione patologica causata da un’alterazione del drenaggio venoso del testicolo con conseguente comparsa di varici del plesso pampiniforme”. Premesse anatomiche Il plesso pampiniforme o spermatico è un dispositivo venoso a rete che origina da rami venosi testicolari superficiali e profondi e suddivisibile essenzialmente in 2 plessi, anteriore e posteriore largamente anastomizzati tra loro. Il plesso pampiniforme anteriore tributario della vena spermatica, drena il testicolo e la testa dell’epididimo e presenta anastomosi con le vene deferenziali e cremasteriche. Decorre nel retroperitoneo per sboccare a sinistra nella vena renale e a destra nella vena cava. Il plesso pampiniforme posteriore da cui originano la vena referenziale che drena nella ipogastrica, la vena cremasterica che drena nella vena iliaca esterna e la pudenda esterna che drena nella grande safena. Etiologia Riconosciamo forme primitive o essenziali e forme secondarie o sintomatiche. Forme primitive La maggiore frequenza del varicocele a sinistra ha indirizzato gli autori verso varie ipotesi patogenetiche: 1. Incompetenza del sistema valvolare della vena spermatica sinistra 2. Maggiore lunghezza della vena spermatica sinistra con conseguente maggiore stasi venosa e sbocco ad angolo retto nella vena renale omolaterale 3. Fenomeno di compressione della vena renale sinistra che rimane schiacciata tra l’arteria mesenterica superiore e l’aorta, fenomeno dello “schiaccianoci”. 4. Un aumento della portata di sangue arterioso al testicolo durante la pubertà che superi la capacità venosa con conseguente dilatazione e varicocele. I risultati degli studi sugli animali a sostegno di questa teoria sono interessanti, mancano tuttavia riscontri su esseri umani. Forme secondarie Compressione endo-addominale di qualsiasi natura sulla vena spermatica di sinistra o destra solitamente dovuta a tumori pelvici o retro-peritoneali. Incidenza L’incidenza del varicocele nell’adolescente è del 15-18% mentre l’incidenza di infertilità nei soggetti con varicocele primitivo è stimata all’incirca nel 30-50%. È più frequente a sinistra (90%), bilaterale nel 9% dei casi, raro (1%) a destra. Si manifesta nel periodo della pubertà ma occasionalmente si può riscontrare nel bambino preadolescente. Fisiopatologia Fisiopatologia del danno testicolare Molteplici fattori possono essere alla base del danno testicolare con conseguenze importanti sulla fertilità e molti di questi sono riproducibili in laboratorio su Aumentata pressione venosa ed ipossia Ipertermia animali da esperimento dopo legatura parziale della vena spermatica di sinistra. Reflusso di cataboliti surrenalici Stress Ossidativo Disfunzione Ormonale 9 Tra i principali troviamo: - L’ipertermia secondaria alla stasi venosa che determina un’alterazione delle funzioni enzimatiche di sintesi del DNA a livello testicolare con conseguente alterata spermatogenesi risultante in una riduzione degli spermatogoni. - La disfunzione dell’asse ipotalamo-ipofisi-testicolo provata da una eccessiva risposta gonadotropinica dopo stimolazione con GnRH. Tale risposta tende a rientrare nella normalità dopo intervento chirurgico correttivo. Livelli ridotti di Inibina B, ormone prodotto dalle cellule del Sertoli V. infra). - La possibile inversione di flusso nella vena spermatica con conseguente reflusso di cataboliti renali e surrenalici, tuttavia studi recenti su animali da esperimento hanno evidenziato come l’adrenalectomia non comporti un miglioramento degli effetti del varicocele. - La possibile azione di autoanticorpi i quali, sulla base di una alterazione della barriera ematotesticolare secondaria al varicocele, agirebbero sul testicolo controlaterale causandone alterazione consequenziale. - È stato dimostrato che nell’adolescente con varicocele è presente una condizione di stress ossidativo dovuto ad una iperincrezione di NO e a suoi metaboliti ancora più reattivi, condizione questa in grado di alterare la funzionalità spermatica, che sembra normalizzarsi a distanza di 1 anno dalla correzione chirurgica del varicocele. Diagnosi Il paziente affetto da varicocele è spesso asintomatico, possono raramente essere presenti sintomi quali pesantezza, fastidio o dolore testicolare, più spesso la diagnosi è posta come riscontro occasionale. L’esame obiettivo deve essere condotto tanto in clinostatismo quanto in ortostatismo, sia in condizioni di riposo, sia invitando il paziente a compiere la manovra di Valsala (espirazione forzata a glottide chiusa). L’esame clinico deve valutare inoltre la presenza di altre patologie venose (varici degli arti inferiori, ectasie del plesso emorroidario). La palpazione delle borse scrotali in posizione eretta prima e supina dopo permette di evidenziare dilatazioni delle vena testicolari non visibili ad occhio nudo, e l’esecuzione della manovra di Valsala può aiutare nella differenziazione di grado clinico. L'ultrasonografia morfologica valuta struttura, dimensioni, e diametri testicolari (comparativa) - eventuali masse addomino-pelviche L' ultrasonografia funzionale che sfrutta l' integrazione eco-Color Doppler valuta: - il reflusso venoso prima e dopo manovra di Valsala - i diametri delle vene del plesso pampiniforme Secondo le classificazioni di Sarteschi e Hirsh l'inquadramento anatomo funzionale del varicocele prende in considerazione l'entità del reflusso venoso misurato tramite indagine eco-color Doppler. Classificazione sec. Sarteschi: - Grado I: reflusso presente all'emergenza scrotale solo tramite manovre funzionali. - Grado II: reflusso presente in sede sopra-testicolare evidenziabile solo tramite manovre funzionali. - Grado III: reflusso peritesticolare evidente alle manovre funzionali. - Grado IV: reflusso evidente a riposo ed incrementabile con manovre funzionali. - Grado V: reflusso importante presente a riposo, e non modificabile significativamente tramite manovre funzionali. Gradi clinici di varicocele Classificazione di Dubin e Amelar grado 1: varicocele piccolo palpabile dopo manovra di Valsalva grado 2: varicocele moderatamente pronunciato, palpabile a riposo grado 3: voluminoso ammasso di vene che riempiono l’emiscroto, visibile a riposo Indagini di laboratorio: - dosaggi ormonali: tassi patologicamente elevati di FSH basale (indice di sofferenza gonadica) - test di stimolazione con GnRH con esagerato innalzamento di LH e FSH - spermiogramma: da eseguire nei maggiorenni, può evidenziare presenza di forme immature, ridotta motilità e depauperamento della densità spermatica. - Livelli di inhibina B: un recente studio condotto presso il nostro Istituto ha permesso di dosare i livelli di questa glicoproteina, la cui produzione da parte delle cellule del Sertoli, dipende da un regolare funzionamento ed interazione delle cellule del Sertoli e le cellule. I risultati hanno evidenziato una riduzione dei livelli di inhibina B nei pazienti affetti da varicocele ciò legato o a una alterazione termica sulle cellule germinali o a un depauperamento delle stesse in corso di patologia. I livelli di inhibina B possono quindi essere utili nella valutazione del timing chirurgico in adolescenti affetti da varicocele. Terapia È stato dimostrato come circa il 20% degli adolescenti con varicocele possa presentare, in età adulta, problemi di fertilità e come l'influenza negativa di tale patologia tenda ad aumentare con la durata della stessa. Inoltre è stato evidenziato un miglioramento dei parametri spermatici dopo varicocelectomia eseguita in età adolescenziale. Sono pertanto da considerare indicazioni all’intervento chirurgico in età adolescenziale in accordo con le linee guida della Società Europea di Urologia Pediatrica: - Riduzione delle dimensioni testicolari - Varicocele bilaterale - Alterazioni del liquido spermatico ( adolescenti in età avanzata) - Dolore testicolare - Test da stimolo al GnRH alterato - Varicocele di III grado clinico e/o IV V grado al doppler. In tutti gli altri casi è consigliabile un follow-up clinico e strumentale almeno annuale. Il razionale della terapia chirurgica è quello di eliminare la dilatazione del plesso pampiniforme mediante la legatura, a vari livelli, dei vasi venosi reflui dal testicolo. Esistono essenzialmente due approcci terapeutici: 1. Terapia chirurgica: - Convenzionale inguinale Consente al chirurgo di estrarre il funicolo e di identificarne più facilmente gli elementi costituenti Consente l’accesso alle vene spermatiche esterne ed alle vene del gubernaculum. L’introduzione di tecniche di microchirurgia ha consentito una sostanziale riduzione dell’incidenza di idrocele, azoospermia e atrofia testicolare. - Laparoscopia La tecnica laparoscopica rappresenta un approccio moderno al varicocele utilizzando una tecnica tradizionale. Si posizionano tre trocars in cavità peritoneale e si crea lo pneumoperitoneo. Si identifica l’anello inguinale interno sn e i vasi spermatici che da esso fuoriescono, si apre il peritoneo al di sopra dei vasi, si isolano gli stessi, li si chiude con delle clips metalliche e li si seziona. Si richiude il peritoneo al di sopra. 2. Embolizzazione percutanea Consiste nella sclero-embolizzazione delle vene spermatiche eseguita dal Radiologo Interventista che attraverso una via venosa periferica, dal braccio alla piega del gomito o dalla gamba all’inguine introduce angiografica Dopo sotto controllo fluoroscopico in sala una lieve anestesia locale, punta la vena, introduce un filo guida ed un piccolo catetere del diametro di 1.35 mm . Attraverso tale cateteri che viene portato a ridosso delle vene spermatiche di sinistra o di destra a seconda del lato del varicocele, si somministra un farmaco sclerosante che porta alla chiusura delle vene responsabili del varicocele. Studi prospettici randomizzati hanno documentato una ripresa della crescita testicolare dopo correzione del varicocele I parametri seminali sembrano migliorare negli studi prospettici dopo trattamento del varicocele nell’adolescente. Bibliografia 1. Santoro G, Romeo C. Normal and varicocele testis in adolescents. Asian J Androl 2001;3:259- 62. 2. Dubin L, Amelar RD. Varicocele size and results of varicocelectomy in selected subfertile men with varicocele. Fertil Steril 1970;21:606- 9. 3. Romeo C, Ientile R, Impellizzeri P, et al. Preliminary report on nitric oxide-mediated oxidative damage in adolescent varicocele. Hum Reprod 2003;18:26 - 9. 4. Esposito C, Monguzzi GL, Gonzalez-Sabin MA, Rubino R, Montinaro L, Paparella A et al: Laparoscopic treatment of pediatric varicocele: a multicenter study of the Italian Society of Video Surgery in Infancy. J Urol 2000; 163: 1944. 5. Dan B. French, Nisarg R. Desai and Ashok Agarwal: Varicocele repair: does it still have a role in infertility treatment? Current Opinion in Obstetrics and Gynecology 2008, 20:269– 274. 6. Philip Kumanov, Ralitsa N. Robeva, Analia Tomova. Adolescent Varicocele: Who Is at Risk? PEDIATRICS Volume 121, Number 1, January 2008. 7. Carmelo Romeo, Teresa Arrigo, Pietro Impellizzeri, Agatino Manganaro, Pietro Antonuccio, Giuseppe Di Pasquale, Maria Francesca Messina, Lucia Marseglia, Isabella Formica, Biagio Zuccarello. Altered serum inhibin b levels in adolescents with varicocele. Journal of Pediatric Surgery (2007) 42, 390– 394. 8. Jason Lee, Saleh Binsalhe, Kirk Lo, Keith Jarvi: Varicoceles: The Diagnostic Dilemma. Journal of Andrology, Vol. 29, No. 2, March/April 2008. 9. Robinson SP, Hampton LJ, Koo HP. Treatment strategy for the adolescent varicocele. Urol Clin North Am. 2010 May;37(2):269-78. 10. Romeo C, Santoro G. Varicocele and infertility: why a prevention? J Endocrinol Invest. 2009 Jun;32(6):559-61. Epub 2009 May 26. 11. Kumar Rajeev, Shah Rupi. Varicocele and male infertility : current status. J Obstet Gynecol India Vol. 55, No. 6 : November/December 2005. 12. Celestino Aso, Goya Enrıquez, Marta Fite, Nuria Toran, Carmen Piro, Joaquim Piqueras, Javier Lucaya. Gray-Scale and Color Doppler Sonography of Scrotal Disorders in Children: An Update. RadioGraphics 2005; 25:1197–1214. 13. S. Tekgül, H. Riedmiller, E. Gerharz, P. Hoebeke, R. Kocvara, R. Nijman, Chr. Radmayr, R. Stein. Guidelines on Paediatric Urology. European Society for Paediatric Urology. European Association of Urology 2009, Cap.8: pagg. 23-24. Ipospadia e Fimosi Francesco Arena, Tiziana Russo, Emanuela Santacaterina, Nunzio Turiaco, Antonio Costa, Carmelo Romeo Cattedra di Chirurgia Pediatrica Dipartimento di Scienze Pediatriche Mediche e Chirurgiche Università di Messina Ipospadia Definizione L’Ipospadia è caratterizzata da un’abnorme posizione del meato uretrale che può aprirsi lungo il rafe mediano in un punto qualsiasi compreso fra il perineo e il tratto prossimale ventrale del glande. Il meato uretrale esterno può essere ectopico sulla faccia ventrale del glande, o sulla porzione ventrale del solco coronale, sulla faccia ventrale dell’ asta e sempre medialmente sullo scroto e sul perineo. Si parla di ipospadia femminile, rara, quando il meato uretrale sbocca lungo la parete anteriore di una vagina normoconformata. Eziopatogenesi Lo sviluppo dei genitali esterni ha inizio alla 5 settimana di vita fetale. Nell’ area ventrale e caudale dell’ embrione compare il tubercolo genitale. Al di sotto del tubercolo genitale decorrono parallele due pliche che anteriormente allo sbocco del tratto intestinale terminale formano un’ ampia fossetta longitudinale che costituisce il solco uretrale. Lateralmente alle pliche genitali sono presenti gli abbozzi labioscrotali. Nel maschio il tubercolo genitale darà origine ai corpi cavernosi e al glande. Il solco uretrale accrescendosi per lo sviluppo dalla pliche laterali forma il tubo uretrale penieno che si completa alla 14° settimana. L’uretra glandulare si sviluppa a partire dall’ apice del glande verso la parte più profonda e l’incontro dei due tratti uretrali avviene a livello della fossa navicolare del glande. Lo sviluppo dei genitali esterni si completa alla 12° settimana di gestazione con il rivestimento cutaneo della parte ventrale del pene. Il mancato sviluppo dell’ uretra è la causa dell’ anomala configurazione del glande e della cute del pene. La congiunzione dei foglietti del solco uretrale avviene in senso caudo-craniale sicché l’ipospadia è tanto più grave quanto più è precoce l’arresto di sviluppo. I meccanismi chiamati in causa per la patogenesi sono legati ad anomalie cromosomiche che causano un alterato meccanismo di stimolazione ormonale androgena con carente o ridotta produzione di 5 alfa reduttasi o un deficit recettoriale dei tessuti embrionari, deficiente produzione di gonadotropina corionica e fattori ambientali, quali trattamento progestinico durante il periodo iniziale della gravidanza, diabete materno. Incidenza È stimata tra il 5,2 e 8,2 casi per 1000 maschi nati vivi. E’ presente una ipospadia nel 14% dei fratelli e nel 21% dei familiari prossimi. Sia associa ad altre patologie quali criptorchidismo, ernia inguinale, anomalia dell’ apparato urinario e, nelle forme più severe, ad ambiguità sessuale. Quadro Clinico Gli elementi fondamentali che consentono di distinguere fra loro i pazienti ipospadici e di quantificare il difetto sono rappresentati da: abnorme posizione del meato uretrale, prepuzio per lo più assente ventralmente e raccolto in un cappuccio dorsale, stenosi del meato ipospadico, palmatura (vela cutanea ventrale sull’asse del rafe mediano) torsione (il pene può presentarsi torto sul suo asse longitudinale in genere verso sinistra e con un’angolatura di 45°-90°, curvatura ventrale del pene in erezione. Classificazione Vengono suddivisi in cinque gruppi: forme distali (glandulare, coronale e sub coronale) intermedie (peniena anteriore e peniena posteriore), forme prossimali (peniena posteriore con incurvamento e penoscrotale), forme gravi (ipospadia scrotale e perineale). Nell’ ipospadia glandulare il meato ectopico è sulla faccia ventrale del glande a pochi millimetri dalla sede normale, il prepuzio è a ventaglio e i corpi cavernosi sono normali, nella forma coronale o sub coronale il meato uretrale esterno è a livello del solco coronale o un millimetro al di sotto di questo, il prepuzio è a ventaglio i corpi cavernosi sono regolari o si può osservare una modesta curvatura del glande. L’ipospadia peniena anteriore è caratterizzata da un meato uretrale esterno a livello del terzo distale della faccia ventrale dei corpi cavernosi, prepuzio a ventaglio, corpi cavernosi normali o con modesto incurvamento. L’ipospadia peniena posteriore presenta un meato situato nel terzo medio o prossimale della faccia ventrale dell’ asta e il prepuzio è a ventaglio, i corpi cavernosi sono più o meno incurvati. Nelle forme penoscrotali il meato uretrale è situato a livello della giunzione penoscrotale il prepuzio è a ventaglio i corpi cavernosi sono incurvati. La forma scrotale presenta un meato situato nello scroto che può essere bifido o vulviforme, il prepuzio è a ventaglio, i corpi cavernosi sono gravemente incurvati e vi può essere inversione penoscrotale. L’ ipospadia perineale è caratterizzata da un meato uretrale situato nel perineo con scroto bifido e vulviforme, il prepuzio è a ventaglio i corpi cavernosi sono gravemente incurvati tanto da offrire al pene un aspetto clitoridiforme con inversione penoscrotale. Diagnosi Ecografia vie urinarie: Può essere utile per escludere anomalie associate urologiche e valutare il volume vescicale residuo dopo minzione, specie nelle ipospadie prossimali; Ecografia pelvica, Cistografia minzionale, Dosaggi ormonali, Mappa cromosomica necessaria nelle ipospadie prossimali con aspetto ambiguo dei genitali; Ecografia testicolare, Dosaggi ormonali, Mappa cromosomica in associazione con il criptorchidismo (Sindrome da disgenesia testicolare) . Terapia Nell’ipospadia anche la migliore tecnica chirurgica non può essere presa come assoluta garanzia di successo e non esiste una tecnica applicabile a tutte le forme. L’ intervento è consigliato in un’ età compresa tra 12 e 18 mesi. Gli interventi correttivi in un unico tempo chirurgico sono preferibili a quelli in due o più tempi, qualunque sia la gravità dell’anomalia. Le tecniche chirurgiche descritte ed utilizzate sono numerosissime. Gli obiettivi della correzione chirurgica sono correzione della curvatura peniena, neomeato all’ apice del glande con getto minzionale dritto, neouretra elastica di calibro uniforme e cateterizzabile, confezionata con tessuto privo di peli e il più possibile simile all’endotelio uretrale, soddisfacente risultato estetico con ricostruzione del prepuzio. Complicanze Le più comuni complicanze sono le fistole uretrali, la stenosi del neomeato, la deiscenza completa della neouretra. Fimosi Definizione La fimosi è l'impossibilità di far scorrere verso il basso il prepuzio in modo da scoprire completamente il glande. Alla nascita la fimosi è praticamente fisiologica e non bisogna forzare l'apertura del prepuzio perché essa si risolve quasi sempre spontaneamente. Durante i primi 3-4 anni di vita, man mano che il pene si accresce, si accumulano detriti epiteliali biancastri, (smegma) sotto il prepuzio,che gradualmente separano il prepuzio dal glande. E’ bene evitare la retrazione forzata del prepuzio in quanto si possono formare le aderenze con il glande disepitelizzato dando luogo ad una fimosi vera secondaria ad un anello prepuziale infiammatorio cicatriziale. La fimosi vera è dovuta a incapacità di retrarre il prepuzio a causa di tessuto infiammatorio anulare troppo piccolo per far passare il glande. Diagnosi La diagnosi di fimosi è esclusivamente clinica e non richiede indagini di laboratorio o di immagine: Management In caso di prepuzio non retraibile e che non consente di visualizzare il meato uretrale bisogna valutare se vi è ostacolo alla minzione, se si sono verificati episodi di infezione (balanopostite), se si tratta di fimosi serrata di tipo cicatriziale. In caso positivo è indicato l’intervento chirurgico di plastica del prepuzio o di riduzione del prepuzio sclerotico senza sacrificare del tutto il prepuzio (cosiddetta plastica riduttiva del prepuzio, variante della classica circoncisione). In assenza di segni di ostruzione o di fatti cicatriziali si può attendere, specie nei bambini molto piccoli sino all’età di 2-3 anni. In questi casi può talora rendersi utile un ciclo di terapia locale con cortisone per 3 settimane, la terapia generalmente consente una minima retrazione del prepuzio rendendo visibile il meato ed è quindi utile nei bambini molto piccoli. Se invece l’esame obiettivo permette di vedere il meato uretrale, normalmente si è di fronte a delle aderenze balano-prepuziali che non vanno trattate, almeno sino all’età di 5-6 anni, epoca in cui è possibile eseguire, ambulatorialmente ed in anestesia locale, lo scollamento delle sinechie. Bibliografia 1. GianBattista Parigi. Chirurgia Pediatrica. Cap 26. Ed Masson 2. Laurence S.Baskin :Hypospadias. In Pediatric Surgery 6th ed.2006 Grosfeld et al.eds Cap 119 pagg 1870-189 Anomalie Congenite del Tratto Urinario (Idronefrosi, Megauretere primitivo, Reflusso vescico-ureterale, Valvole uretra posteriore) Francesco Arena, Emanuela Santacaterina, Tiziana Russo, Angela Simona Montalto, Pietro Impellizzeri, Carmelo Romeo Cattedra di Chirurgia Pediatrica Dipartimento di Scienze Pediatriche Mediche e Chirurgiche Università di Messina Idronefrosi Primitiva (IP) Definizione Per Idronefrosi Primitiva (IP) si intende una dilatazione della pelvi e dei calici renali dovuta ad una ostruzione congenita organica o funzionale a livello della giunzione pielo-ureterale. Nell’idronefrosi primitiva, l’ostruzione del giunto pielo-ureterale(GPU) non è mai completa. Fra le varie uropatie mal formative, l’IP è seconda per frequenza solo al reflusso vescico-ureterale(RVU). Eziologia e Patogenesi Possiamo distinguere forme “meccaniche” di IP, nelle quali è evidente una lesione anatomica macroscopica del GPU, e forme “funzionali”, nelle quali, al contrario, manca una lesione anatomica macroscopica. Forme Meccaniche: Vasi anomali: si tratta della compressione del GPU da parte di un peduncolo vascolare renale polare inferiore(c.d. vasi anomali). La compressione estrinseca da vasi anomali incide nelle varie casistiche fra il 9,5% e il 52% dei casi di IP. Briglie e membrane: le briglie e le membrane avventiziali, che fissano ed angolano l’uretere alla pelvi e/o al polo renale inferiore, sono un reperto relativamente frequente nell’idronefrosi. Impianto alto dell’uretere: l’impianto alto dell’uretere, in quanto anomalia primitiva, è estremamente raro. Valvole e Speroni: raramente valvole mucose di natura congenita sono presenti come elementi ostruenti primitivi. Forme funzionali: Nell’ 80-90% dei casi di IP non è riconoscibile alcuna causa ostruttiva di ordine meccanico. Con varie metodiche è tuttavia dimostrabile un rallentamento o un arresto della peristalsi a livello del GPU. In questi casi, si evidenzia un segmento patologico adinamico, proprio in corrispondenza del GPU, con marcata capacità di trasmettere le onde peristaltiche che fisiologicamente spingono l’urina dalla pelvi all’ uretere e da qui in vescica. Incidenza L’IP è una delle più frequenti malformazioni del tratto urinario. Essa viene al secondo posto dopo il reflusso vescico-ureterale e rappresenta la forma più comune di ostruzione del tratto urinario in età pediatrica. L’incidenza è di circa 1 su 1.500 neonati. È più frequente nei maschi che nelle femmine con un rapporto di 3 a 1. È bilaterale nel 10-30% dei casi. Quando è monolaterale, interessa più di frequente il rene sinistro. Quadro clinico Il diffondersi degli screening ecografici prenatali e neonatali ha sensibilmente modificato il quadro clinico di esordio della IP. Un numero più cospicuo di questi pazienti oggi viene diagnosticato in epoca pre e neonatale, in assenza di sintomatologia. Resta, tuttavia, ancora rilevante l’incidenza dei casi che giungono all’ osservazione perché sintomatici. Per quanto riguarda la sintomatologia, questa differisce a seconda delle età considerate. Nei neonati il segno più importante è la presenza di una massa addominale palpabile. Almeno il 40% delle masse addominali riscontrabili nel neonato sono dovute ad una IP, nel lattante e nella prima infanzia il rilievo di una massa addominale è determinante solo in 1/3 dei casi, seguita dalle infezioni recidivanti delle vie urinarie, clinicamente sospettabili in base alla sintomatologia, caratterizzata da febbre, anoressia, vomito, turbe gastroenteriche, ritardato accrescimento staturo-ponderale. Nel bambino più grande compaiono sintomi soggettivi: si tratta di episodi dolorosi al fianco tipo colica renale, con o senza macroematuria, disturbi disurici, vomito. Le coliche renali sono spesso ricorrenti ed a remissione spontanea. Diagnosi Ecografia: L’avvento dell’ecografia prenatale ha portato ad un notevole incremento nella diagnostica delle anomalie del tratto urinario, la più comune delle quali è l’idronefrosi. La diagnosi prenatale di “idronefrosi” può essere sospettata ecograficamente a partire dalla 18°-20° settimana di gestazione, ma è solo dopo la 22°- 24° settimana che i quadri ecografici possono divenire veramente significativi. La diagnosi prenatale di idronefrosi si basa sulla dimostrazione di cavità calico-pieliche dilatate. Cistouretrografia minzionale (CUM): una CUM va sempre eseguita in tutti i neonati in cui si sospetti una IP. Tale indagine risulta fondamentale per escludere anomalie associate delle basse vie urinarie, essa inoltre consente di documentare eventuali pielectasie secondarie a reflusso vescico-ureterale. Tale condizione viene oggi ricercata in prima istanza con la cistosonografia color-Doppler con m.d.c. Scintigrafia renale sequenziale con test al Lasix: la scintigrafia renale sequenziale con TC99m DTPA O MAG3 è un indagine fondamentale nei casi di IP perché fornisce dati precisi sulla funzione relativa del rene affetto rispetto al contro laterale sano e dati sufficientemente attendibili sui tempi di svuotamento delle cavità renali attraverso il GPU. La scintigrafia renale è opportuno sia eseguita quanto il neonato ha almeno 3-4 settimane di vita (è necessaria una attesa maggiore se si tratta di un prematuro). Urografia endovenosa: l’urografia e.v., oggi è stata quasi soppiantata dall’ecografia renale e dalla scintigrafia. A nostro avviso, rimane ancora un’ indagine molto importante nello studio dell’IP. Essa consente valutazioni quasi solamente morfologiche, tuttavia molto precise. La diagnosi di IP è presumibile in base all’ urografia, calicectasia e mancata visualizzazione dell’ uretere. Trattamento È ben noto come il 20% delle dilatazioni idronefrotiche neonatali, diagnosticate in utero, non siano scintigraficamente ostruite. Gran parte di queste dilatazioni, infatti scompariranno spontaneamente entro i primi due anni di vita. La funzione renale nelle IP neonatali è ben conservata nel 60% dei casi, moderatamente ridotta nel 35%, gravemente compromessa solo nel 5%, ed in questi ultimi è quasi sempre presente displasia renale. La funzione renale nei pazienti con IP non operati e sottoposti a controlli seriati, ha mostrato di non deteriorarsi nella grande maggioranza dei casi (8085%). È dimostrato, anche, che un certo numero di dilatazioni pieliche scintigraficamente ostruite guarirà spontaneamente. Negli ultimi anni, alla luce dei dati emersi dalla letteratura relativi alla possibilità di una risoluzione spontanea e della conservazione della funzione renale anche nei casi operati non precocemente, è quindi prevalso un atteggiamento di tipo conservativo sotto monitoraggio di alcuni parametri. Al 3° mese di vita i reni che avranno una funzione renale <40% verranno sottoposti a intervento chirurgico di pieloplastica. La maggioranza dei reni che hanno una buona funzione verranno trattati con terapia conservativa, monitorizzando, secondo il protocollo la funzione renale. In questo gruppo con una buona funzione renale sarà autorizzata la pieloplastica se la funzione renale diminuisce <40% al follow up o se insorge dolore lombare o infezione urinaria recidivante. Il rene poco funzionante alla nascita verrà precocemente sottoposto ad intervento chirurgico. Nelle forme ostruttive con funzione glomerulare già fortemente ridotta alla nascita una nerfrostomia percutanea ecoguidata decompressiva permetterà di valutare dopo 3-4 settimane la potenzialità di miglioramento del rene e quindi di giungere ad una scelta più ponderata tra chirurgia demolitiva o ricostruttiva. Nei casi giunti tardivamente all’ osservazione perché sintomatici la diagnosi di IP implica una indicazione chirurgica. Nelle idronefrosi bilaterali neonatali (10% dei casi), con funzione buona in entrambi i reni il trattamento chirurgico può essere intrapreso separatamente a sei e dodici mesi, lasciando il piccolo paziente sotto profilassi antibatterica e monitorizzando la dilatazione e la funzione renale. Nelle forme bilaterali in cui la funzione renale è compromessa da uno dei due lati si attuerà un trattamento chirurgico precoce dal lato più compromesso e quindi dopo qualche mese si praticherà la pieloplastica dall’altro lato. Senza alcun dubbio l’intervento di Anderson-Hynes costituisce oggi la plastica ureterale più diffusa, semplice e razionale ed è quella che ha dato i migliori risultati. Essa è applicabile praticamente in quasi tutti i casi di ostruzione del GPU, comprese quelli da vaso anomalo. Megauretere Primitivo Definizione Il termine megauretere è di per se generico perché indica entità patologiche di differente eziologia (ostruttiva, refluente, mista, primitiva, secondaria) che si evidenziano come una importante dilatazione dell’ uretere. Con il termine Megauretere Primitivo (MP) si esclude la presenza di RVU e i casi particolari di megauretere non ostruttivo e non refluente tipici della “Prune Belly Syndrome”. Eziopatogenesi Nel MP sembrerebbe che il tratto ureterale terminale della giunzione uretero-vescicale (GUV) per una lunghezza variabile da 0,5 a 4 cm, non trasmetta l’ onda peristaltica ureterale. Talvolta le fibre muscolari disposte circolarmente sono ipertrofiche, mentre le fibre più esterne disposte longitudinalmente sono scarsamente rappresentate. Il risultato di tale alterata struttura è indicato come la possibile causa dell’ ostruzione Incidenza Il MP è nettamente più frequente nel sesso maschile e nel lato sinistro ed è bilaterale nel 12% dei casi. Nel 9% si associa una agenesia renale contro laterale. È stata più volte segnalata familiarità della malformazione. Classificazione La classificazione prevede 3 categorie di megauretere: refluente, ostruttivo, non refluente non ostruttivo. Ciascuna categoria è, a sua volta, suddivisa in forma primitiva e forma secondaria. La categoria del megauretere ostruttivo comprende: ostruzione intrinseca della GUV, senza altre patologie (MP), ostruzione secondaria ad altre patologie quali ostruzioni cervicoureterali, vescica neurologica, ostruzioni estrinseche retro peritoneali. Il MP è quindi definibile come un uretere in vario grado dilatato a monte della GUV, in assenza di anomalie anatomiche, funzionali od organiche, congenite o acquisite del basso apparato urinario. Una classificazione in gradi è stata proposta da Pfister ed Hendren e prevede 3 forme: MP di grado moderato quando la dilatazione è limitata solo al tratto ureterale terminale, MP di grado medio quando la dilatazione è evidente a livello di tutto l’ uretere, modica a livello della pelvi e minima o assente a livello dei calici, MP di grado severo quando è presente una grave dilatazione con tortuosità sia ureterale (dolicomegauretere) che pielocaliceale (idroureteronefrosi). Quadro Clinico Nella prima e nella seconda infanzia l’ esordio sintomatico mostra il quadro tipico delle uropatie ostruttive che può comprendere: infezioni delle alte e delle basse vie urinarie, ematuria, massa palpabile, dolori addominali o al fianco, mentre quando il MP è bilaterale o in rene unico può manifestarsi con i segni dell’ insufficienza renale acuta o cronica. Diagnosi L’ esame strumentale di approccio è l’ ecografia che consente la diagnosi generica di megauretere anche in epoca prenatale. La cistouretrografia minzionale, quando esclude la presenza di RVU e di patologia ostruttiva cevicouretrale, circoscrive per esclusione la diagnosi al solo MP. Esame strumentale tuttora fondamentale in caso di MP è l’urografia e. v. che evidenzia: il grado di dilatazione dell’ uretere che, in caso di MP, deve comunque riguardare il tratto terminale dell’uretere, per poi estendersi verso l’alto per tutta la sua lunghezza, con tortuosità più o meno marcata, fino a coinvolgere la pelvi ed i calici a seconda della gravità, l’immagine “a coda di topo” che il mdc disegna nel tratto terminale giunzionale. Il grado di calicopielectasia associata con eventuale riduzione dell’ indice cortico-midollare; la più o meno pronta captazione ed eliminazione del mdc, che consente un primo giudizio sulla funzione renale e quindi, sulla presenza e sul grado del danno parenchimale. La scintigrafia renale dinamica resta un’indagine fondamentale in casi di MP perché è in grado di stabilire la funzione relativa del rene affetto rispetto al contro laterale sano e inoltre con il test al Lasix è possibile stabilire il grado di pervietà della GVU. Terapia Nei bambini giunti con sintomi tipici della uropatia ostruttiva o infezione delle vie urinarie e trovati essere portatori di MP, l’indicazione all’ intervento chirurgico è semplice, logica e doverosa. L’indicazione chirurgica, invece, è meno palese nei bambini asintomatici. In un MP asintomatico parametri importanti per l’ indicazione chirurgica sono la riduzione della funzione renale del lato affetto rispetto al contro laterale e il grado di dilatazione calicopielica. In generale una maggiore aggressività viene consigliata nei casi di MP bilaterale o in rene unico. Si considera indicazione all’intervento chirurgico una riduzione maggiore del 10 per cento rispetto al teorico 50% di lavoro previsto per il rene di un singolo lato. Con dati di funzione percentuale simmetrica tra i due reni o con differenza inferiore al 10% quando calici e pelvi sono modicamente dilatati si consiglia attesa vigile con profilassi disinfettante e in accordo con il pediatra verifica clinica, analitica ed ecografica ogni 3-4 mesi nel primo anno, ogni 6 mesi nel secondo e terzo anno. La scintigrafia renale viene ripetuta entro il terzo anno. È importante ottenere una graduale riduzione della dilatazione delle vie urinarie fino a quasi normalizzazione. Il dato di non peggioramento è indicazione all’ intervento dopo congrua attesa (3 anni circa). L’intervento chirurgico per MP prevede l’accesso extraperitoneale alla vescica, isolamento intravescicale o più spesso intrra ed extra vescicale del megauretere con sua rettificazione dopo avere eliminato le eventuali tortuosità; l’accorciamento dell’uretere per la porzione distale eccedente il livello della sinfisi pubica e l’eventuale rimodellamento longitudinale terminale con reimpianto ureterovescicale antireflusso con tecnica di Cohen. Reflusso vescico-ureterale (RVU) Definizione Il passaggio retrogrado di urina dalla vescica nell'uretere, verso le cavità renali, viene definito “reflusso vescicoureterale” (RVU). Il RVU può essere “primitivo”, cioè conseguenza di una malformazione o di un ritardo di sviluppo della giunzione ureterovescicale (GUV), oppure “secondario” qualora questa, costituzionalmente normale, perda la propria competenza a causa di fattori patologici, congeniti od acquisiti, vescicali od uretrali di tipo anatomico o funzionale (ad es. valvole dell'uretra posteriore, vesciche neurogene da spina bifida, etc..). Il RVU rappresenta l'uropatia più frequente in età pediatrica. Il trattamento del RVU (chirurgico o medico-conservativo) è necessario per la prevenzione e la terapia delle infezioni delle vie urinarie e dei disturbi minzionali, che sono conseguenza del reflusso, e per la prevenzione del danno e dell'ulteriore danneggiamento renale causati dal reflusso e dall'infezione ascendente. Incidenza L'incidenza del RVU in portatori di infezione urinaria varia dal 10% al 30%. Il RVU è complessivamente più frequente nel sesso femminile (58%). In epoca neonatale è molto più frequente nel maschio (80-90%) ed è quasi sempre bilaterale. Il RVU, se monolaterale, predilige il lato sinistro rispetto al destro. Da sottolineare è la familiarità del RVU che necessita di essere sempre indagata (si tratta di una ereditarietà genetica, autosomica dominante con penetranza incompleta). RVU primitivo In condizioni fisiologiche l'urina, spinta dall'attività peristaltica delle alte vie urinarie, scende verso il basso per raggiungere il serbatoio vescicale. Un corretto funzionamento della GUV impedisce all'urina contenuta in vescica di risalire nell'uretere verso il rene. Le strutture anatomiche che, con meccanismo valvolare, consentono un flusso unidirezionale e impediscono il reflusso, sono le porzioni prevescicale, intramurale e sottomucosa dell'uretere terminale, la fascia di Waldeyer, il trigono superficiale e profondo e la base vescicale, che svolge il ruolo di sostegno. L'integrità anatomica delle singole strutture della GUV e delle loro reciproche connessioni assicurano l'efficienza della valvola. Il meccanismo valvolare della giunzione ureterovescicale è principalmente passivo, ma coesiste, tuttavia, una componente attiva muscolare. L'azione passiva antireflusso è data dalla pressione intravescicale, che schiaccia il tratto sottomucoso dell'uretere sul piano muscolare sottostante; l'azione attiva antireflusso è data dalla contrazione delle fibre longitudinali dell'uretere intravescicale e determinano la chiusura del meato. Studi istologici hanno dimostrato l'associazione del RVU a un trigono debole, poco delineato e mal sviluppato e ad un uretere ipoplasico. Il danno renale Pielonefrite Il RVU è la causa più importante di pielonefrite cronica non ostruttiva, tanto che questo termine può essere sostituito dalla dizione “nefropatia da reflusso”. L'infezione delle basse vie urinarie senza RVU sembrerebbe essere difficilmente in grado di determinare un danno renale, mentre è controverso se il RVU senza infezione possa provocare una cicatrice renale. Nella pratica, comunque, le due componenti, e cioè RVU ed infezione delle vie urinarie, coesistono ed insieme minacciano il rene, l'organo nobile dell'apparato urinario, che detta la prognosi della malattia. La dimostrazione di una cicatrice pielonefritica è, in età pediatrica, quasi sempre seguita dalla dimostrazione di un RVU. Ad un RVU grave si associa più spesso una nefropatia grave. La prima e l'inizio della seconda infanzia sono il periodo più critico per l'evoluzione del danno renale da reflusso. Displasia renale Accanto alla componente della nefropatia dovuta al RVU, comunemente ritenuta più importante, di tipo acquisito, (reflusso-infezione-cicatrice renale), bisogna prendere in considerazione anche la componente congenita., che non è dovuta al reflusso, ma che con questo coesiste. Questa componente, particolarmente consistente e maggiormente supponibile nei reflussi di grado maggiore e scoperti molto precocemente, è rappresentata dalla displasia renale. Classificazione Il RVU viene suddiviso, per convenzione internazionale, in 5 gradi sulla base della CUM. 1°grado – reflusso in uretere sottile, incompleto: cioè il mezzo di contrasto radiopaco refluisce dalla vescica nell'uretere, ma non raggiunge la pelvi ed i calici renali. 2°grado – reflusso completo, con uretere e cavità renali non dilatate. 3°grado – reflusso completo, con modica dilatazione dell'uretere e delle cavità renali. 4°grado – reflusso completo, con cospicua dilatazione dell'uretere e delle cavità renali. 5°grado – reflusso completo. Con massima dilatazione e tortuosità dell'uretere ed importante idronefrosi. Quadro clinico Non esiste una sintomatologia specifica del RVU primitivo, che si manifesta, nella maggioranza dei casi, con i sintomi dell'infezione delle vie urinarie. Nel RVU di grado maggiore può verificarsi il fenomeno della doppia minzione: il bambino svuota la propria vescia in parte all'esterno attraverso l'uretra ed in parte nell'uretere dilatato e sede del reflusso; subito dopo aver terminato la minzione, dall'uretere si riversa in vescica una quantità tale di urina da provocare nuovamente il desiderio di mingere. Quando l'albero urinario non è dilatato, un RVU, che distenda acutamente l'uretere e la pelvi, può provocare dolore, specie durante la minzione allorché il reflusso si manifesta o si rinforza. La doppia minzione e la colica ureterale sono tuttavia sintomi d'esordio piuttosto infrequenti, ed anzi è giusto sottolineare come il quadro clinico sia di solito subdolo ed aspecifico e come, per giungere alla diagnosi, non debba essere trascurato alcun segno che possa far sospettare un'infezione delle vie urinarie. Diagnosi Posto il sospetto clinico ed eseguiti i normali esami per valutare la presenza dell'infezione e la funzione renale, l'iter diagnostico deve necessariamente comprendere la cistouretrografia minzionale (CUM). Lo studio cistouretrografico consente di stabilire la presenza ed il grado del RVU e di escludere anomalie vescicouretrali associate (importante, nei due sessi, è lo studio del profilo uretrale in proiezione laterale!). Per lo studio, invece, del quadro renale, cioè per rilevare l'eventuale presenza ed il grado del danno renale (nefropatia da reflusso), le scelte possono essere varie. L'urografia e.v. resta un esame molto attendibile e pratico ma, oggi è poco usato per la quantità di radiazioni cui è sottoposto il paziente e per il rischio di reazioni allergiche. L'ecografia renale e la scintigrafia renale parenchimale (DMSA), presentano vantaggi notevoli rispetto alla urografia e.v.. In caso, comunque, di referto ecografico di assoluta certezza di normalità delle alte vie urinarie e dei profili renali, riteniamo si possa non dare indicazione alcuna né alla urografia e.v., né al DMSA. In caso di rilievo ecografico di cicatrice pielonefritica la scelta tra urografia e.v. e DMSA sarà sicuramente a favore della scintigrafia renale DMSA. La cistouretroscopia, infine, in considerazione della necessità del ricovero e dell'anestesia generale, ma anche per la scarsa obiettività dei dati ottenibili, riteniamo abbia perso ogni significato prognostico. Terapia Il trattamento del RVU primitivo è argomento ampiamente dibattuto tra i fautori della terapia medico-conservativa ed i sostenitori della correzione chirurgica. Come già detto, ci si trova di fronte ad una anomalia strutturale della GUV responsabile della risalita delle urine verso il rene. Come conseguenza del reflusso si può verificare un'infezione delle vie urinarie. Il RVU infetto può essere causa di danno renale pilonefritico; il RVU sterile, invece, non provocherebbe nefropatia. Altra importante premessa è che l'anomalia della GUV può essere transitoria (ritardo di formazione invece che stabile malformazione) e la maturazione della GUV può comportare la progressiva, spontanea scomparsa del reflusso. Ancora, malgrado una efficace terapia medica o chirurgica è possibile assistere nel tempo, pur se di rado, al peggioramento della nefropatia da reflusso. Il RVU predispone entrambi i sessi (in particolare quello femminile) all'infezione delle vie urinarie e la persistenza del RVU è particolarmente rischiosa in gravidanza. Terapia medico-conservativa Si basa sul principio che sottoponendo il soggetto a terapia disinfettante (preventiva o mirata, a cicli o continua, etc. a seconda delle preferenze) si rende innocuo il reflusso perché sterilizzato, dando eventualmente il tempo alla GUV di maturare, determinando la scomparsa spontanea del RVU. Il trattamento avrebbe una efficacia dimostrata in alta percentuale (fino all'80% dei casi nell'uretere non dilatato e fino al 40% dei casi nell'uretere dilatato). Nei pazienti più giovani (sotto i 4 anni), con RVU di grado minore, le probabilità di guarigione definitiva sono accettabilmente buone in breve tempo (12-18 mesi) mentre nei pazienti più grandi e con reflusso di grado maggiore la guarigione è teoricamente possibile, ma in un periodo lungo di vari anni e comunque sempre in piccola percentuale. Nel corso del trattamento conservativo, a maggior ragione se è già presente un danno renale, il paziente deve sottoporsi a frequenti controlli medici e periodicamente devono essere eseguiti esami di laboratorio ed indagini strumentali. Terapia chirurgica Le attuali tecniche chirurgiche di reimpianto ureterovescicale antireflusso consentono di raggiungere percentuali di successo immediato (cioè dopo il primo e definitivo intervento) fino al 99% nel reflusso in un uretere non dilatato o dilatato modicamente, che rappresenta la grande maggioranza dei casi, e fino al 90% nel reflusso in uretere molto dilatato, che richiede anche il rimodellamento longitudinale dell'uretere terminale. La porzione sottomucosa dell'uretere intravescicale è la componete essenziale del meccanismo antireflusso di una GUV normoconformata. Nel RVU questo importante tratto ureterale è assente o solo modestamente rappresentato e l'uretere si inserisce in vescia quasi realizzando un'anastomosi diretta, avendo quindi perduto il caratteristico percorso obliquo. In una GUV normale le pressioni endovescicali che si raggiungono durante la minzione schiacciano l'uretere sottomucoso sino a farne collabire le pareti ed impediscono il reflusso d'urina; nella GUV malformata, per l'assenza o l'insufficienza del tratto sottomucoso, la pressione minzionale scatena, invece, il reflusso. Tutte le tecniche antireflusso si basano sull'essenziale principio di ripristinare un sufficiente tratto ureterale intravescicale e sottomucoso, garantendo alla stesso tempo una adeguata base di sostegno all'uretere. Tecnica di Cohen Il reimpianto antireflusso con tunnel sottomucoso trasversale e transtrigonale secondo Cohen, è la metodica chirurgica attualmente più affidabile in assoluto, più utilizzata al mondo. La tecnica di Cohen comporta l'isolamento dell'uretere, la realizzazione del tunnel trasversale, trantrigonale tra mucosa e muscolo, l'alloggiamento al suo interno dell'uretere, la sezione della parte eccedente di uretere distale e l'anastomosi tra uretere e vescica. Tecnica endoscopica Il principio della terapia endoscopica non si discosta da quanto indicato per la chirurgia “a cielo aperto”: si esegue l'iniezione endoscopica endovescicale, sottoureterale di una sostanza (DIFLAX) che possa creare un solido supporto al di sotto dell'uretere intravescicale (l'uretere terminale ottiene un' allungamento della porzione intravescicale, cioè della parte attiva nel meccanismo antireflusso. Comportamento personale Stabilito, come è prassi per ogni patologia e per tutte le età, che ogni caso merita valutazioni e decisioni individuali, in pratica, volendo generalizzare, si può dire che un RVU primitivo di 1° e 2° grado con assente o molto modesto danno renale dovrebbe essere, in prima battuta, di pertinenza medica. Un RVU di 3° e 4° grado sintomatico o non e con più o meno evidente nefropatia da reflusso deve essere, invece, avviato alla correzione chirurgica. Un RVU di 5° grado, quasi sempre associato a cospicuo danno renale e sintomatologia generale e locale. È di immediata pertinenza chirurgica. Molta importanza ha, in queste considerazione, l'età del paziente: al di sotto dei 2-3 anni un reflusso modesto ha buone probabilità di guarigione spontanea; al di sopra dei 5-6 anni un RVU importante offre invece scarse possibilità al trattamento conservativo. Inoltre non riteniamo in nessun caso urgente una chirurgia antireflusso in un neonato, pur in presenza di reflusso di grado elevato se asintomatico (screening). Sempre nel caso specifico del neonato affetto da RVU, molta attenzione va riservata alla profilassi che in questa epoca della vita, così predisposta alla pielonefrite, deve essere condotta con particolare efficacia onde garantire la sterilità delle urine. Esistono alcune condizioni anatomiche, che denunciano una malformazione evidente della GUV – quali il doppio distretto pieloureterale completo (doppio meato in vescica) e l'extravescicalizzazione estrema dell'uretere per presenza di un diverticolo paraureterale (di Hutch), che da sempre vengono considerate ostative alla possibilità di una guarigione spontanea e, quindi autorizzano la correzione chirurgica. Altro segno prognostico negativo, questa volta riferito alla possibile evoluzione di una cicatrice renale. È certamente la dimostrazione radiologica di un reflusso intrarenale, che in ogni caso porta o ad una terapia disinfettante più aggressiva o alla precoce correzione chirurgica. Valvole dell’uretra posteriore (VPU) Definizione Le valvole dell’uretra posteriore (VPU) rappresentano la più frequente malformazione ostruttiva uretrale maschile. Le forme più gravi di VPU causano una nefropatia che rappresenta una delle più frequenti cause di insufficienza renale terminale in età pediatrica. Le VPU sono formazioni endoluminali dell’ uretra posteriore maschile. Sono situate di regola distalmente al verum montanum e prossimalmente allo sfintere uretrale esterno. Risultano costituite da epitelio di transizione e da tessuto connettivo. Foggiate a “nido di rondine” con concavità prossimale, ostacolano più o meno gravemente il flusso urinario uretrale e di conseguenza, lo svuotamento della vescica. Si presentano come strutture “a lembi” (2 o 3) oppure “a diaframma”, di solito sottili, variamente protrudenti all’ interno del lume uretrale. Incidenza L’incidenza di VPU è compresa tra 1/8.000 e 1/25.000 nati vivi, ma questo è un dato che si riferisce solo ai casi più eclatanti di ostruzione uretrale. Nel 50% dei casi la diagnosi viene posta nel primo anno di vita, tuttavia, a causa di un esordio tardivo della sintomatologia clinica, è possibile che la diagnosi venga posta più tardivamente. Eziopatogenesi Per superare l’ostacolo al deflusso dell’ urina, che si manifesta durante la minzione, il detrusore (il muscolo della vescica) va incontro ad uno stato di ipertrofia che è direttamente proporzionale al grado di ostruzione. In rapporto al grado di ostruzione possiamo distinguere due forme di VPU: Quadro clinico Forme gravi di VPU. In queste forme a causa dell’elevato grado di ostruzione al deflusso dell’ urina le pareti vescicali vanno incontro ad una spiccata ipertrofia (vescica c.d. “da lotta” o “a colonne”). Inoltre, vengono raggiunte pressioni endovescicali elevate, con ripercussioni gravi su tutto l’albero urinario. In queste forme più gravi l’ uretra prostatica, dilatata ed allungata (a volte in maniera notevole) è compresa tra due punti di spiccato restringimento, che sono il collo vescicole ipertrofico, prossimalmente, e le valvole distalmente. In virtù delle notevoli dimensioni che la vescica può assumere viene anche definita dagli ecografisti come “megavescica”. In queste condizioni gli ureteri, la pelvi e i calici renali si svuotano con difficoltà e si dilatano progressivamente. Molto spesso si verifica un reflusso vescicoureterale (RVU) secondario; nella maggior parte dei casi viene interessato un solo uretere (più spesso il sinistro), meno frequenti ma più gravi, soni i casi di VUP con RVU bilaterale. A livello renale è possibile riscontrare gradi differenti di danno per il sovrapporsi della displasia (di tipo microcistico con danno maggiore a livello della corticale renale) e dell’ idronefrosi. Forme minori di VPU Nelle forme minori di VPU non si riscontrano, in genere, particolari conseguenze a carico della vescica e delle vie urinarie superiori. Tuttavia tali forme possono compromettere l’acquisizione di una fisiologica e coordinata dinamica vescicale e possono accompagnarsi ad enuresi, frequenza ed urgenza minzionale, piccola incontinenza diurna (spesso da urgenza). In questi casi l’eventuale presenza di RVU può essere interpretato come un fenomeno primitivo e non secondario, a meno che non si presuma che la presenza dell’ostacolo valvolare minore sia la causa di una disfunzione vescicale (vescica instabile), alla quale il reflusso potrebbe essere secondario. La sintomatologia è strettamente correlata con il grado di ostruzione che le valvole determinano e quindi con le ripercussioni che questo ostacolo causa sull’albero urinario. Ne consegue uno spettro di possibilità i cui estremi sono identificabili nella insufficienza renale e, all’ estremo opposto, in modeste disfunzioni minzionali. Generalmente la gravità del quadro clinico è inversamente proporzionale all’età della diagnosi e, quanto più serrata è l’ostruzione tanto più grave e precoce è l’esordio clinico. Inoltre gli screening prenatali e neonatali sono in grado di individuare un numero cospicuo di casi prima che possano diventare sintomatici. La sintomatologia può essere esaminata separatamente nelle diverse epoche pediatriche. Neonato Nell’ 80% dei casi all’ esame obiettivo di un neonato maschio è possibile palpare a livello sovrapubico una massa rappresentata dalla vescica ipertrofica. A volte si può essere in grado di apprezzare l’aumento di volume dei reni. In un terzo dei casi l’esordio può essere rappresentato da una grave insufficienza renale (iperazotemia, iponatriemia, iperkalemia, disidratazione ed acidosi). Questi pazienti sono in imminente pericolo di vita. In alcuni rari casi, una perforazione vescicale o, molto più spesso, una perforazione renale causano uno stravaso di urina, che può raccogliersi nello spazio retroperitoneale, formando una pseudocisti urinosa, oppure ancora passare in cavità pleurica dando un versamento pleurico urinoso. La minzione del neonato è francamente anormale; il mitto, appare sottile, debole, o al contrario, sotto pressione, intermittente, preceduto e seguito da gocciolamento ed accompagnato da sforzo. La ritenzione urinaria è rara. In un quinto dei casi c’è infezione delle vie urinarie. Il quadro clinico può essere dominato da una sintomatologia generale non urologica con distensione addominale, arresto della crescita, vomito, diarrea, anoressia e anemia. Anche se raramente un distress respiratorio, accompagnato da pneumotorace o pneumomediastino, può essere l’esordio di VPU. Lattante L’infezione delle vie urinarie e sintomi minzionali rappresentano i sintomi d’esordio del lattante con VPU. Tra i sintomi non urinari, vanno ricordati: l’arresto o la mancata crescita, vomito e febbre di origine sconosciuta, la distensione addominale, l’anemia, l’ipertensione arteriosa e l’irritabilità. Età prescolare e scolare Nell’età prescolare e scolare sono frequenti sintomi quali minzione “difficile” e che si avvale del torchio addominale, inizio stentato del mitto, minzione goccia a goccia, mitto debole, incontinenza. Occasionalmente sono descritte la ritenzione urinaria e l’ematuria. Diagnosi Diagnostica prenatale L’ecografia rappresenta una valida metodica nella diagnosi prenatale di VPU. Infatti già intorno alla 13-20 settimana sono evidenti i segni dell’ ostruzione: megavescica, idroureteronefrosi ed, in alcuni casi, l’uretra prossimale dilatata. Diagnostica post-natale In assenza di diagnosi prenatale nei pazienti con sospetto di VUP la prima indagine da eseguire è l’ecografia del rene e delle vie urinarie che spesso consente una precisa diagnosi. La cistografia minzionale è utile nella conferma diagnostica e per escludere la presenza di un eventuale reflusso vescicoureterale. Per valutare la morfologia e la funzione dell’apparato urinario e per individuare eventuali malformazioni associate è utile eseguire anche un’ urografia e. v. Nel follow-up è utile la scintigrafia renale che consente di valutare nel tempo la funzione renale. L’endoscopia permette di valutare le caratteristiche morfologiche delle valvole e di procedere alla loro ablazione. Terapia Nel neonato asintomatico si può procedere con la disostruzione uretrale endoscopica. Nel neonato o lattante sintomatico, con condizioni generali scadenti, è necessario posizionare un catetere “per uretram” o per via sovra pubica percutanea, al fine di derivare le urine vescicali. Talvolta le condizioni generali del paziente sono talmente gravi (sepsi, insufficienza renale, disidratazione) da richiedere il ricovero in terapia intensiva neonatale. La disostruzione uretrale rappresenta spesso l’unico e sufficiente trattamento delle VPU. La resezione endoscopica delle VPU prevede un’incisione della “vela” valvolare in alcuni punti critici e consente di ottenere l’ostruzione valvolare senza la totale asportazione dei lembi o del diaframma. Bibliografia 1. Mark C Adams, W.Hardy Hendren :Megaureter and Prune Belly Sindrome. In Pediatric Surgery 6th ed.2006 Grosfeld et al.eds Cap 114 pagg 1771-1780 2. Byron D.Joyner, Michael E. Mitchell: Ureteropelvic Junction Obstruction. In Pediatric Surgery 6th ed.2006 Grosfeld et al.eds Cap 111 pagg 1723-1737 3. GianBattista Parigi. Chirurgia Pediatrica.Cap 8. Ed Masson Patologie Malformative di interesse chirurgico (Atresia dell’esofago, Ernia diaframmatica congenita, Onfalocele e Gastroschisi) Francesco Arena, Gianfranco Scalfari, Emanuela Santacaterina, Tiziana Russo, Giorgio Lamberti, Angela Simona Montalto, Roberta Gentile, Carmelo Romeo Cattedra di Chirurgia Pediatrica Dipartimento di Scienze Pediatriche Mediche e Chirurgiche Università di Messina Atresia dell’esofago Definizione L'atresia esofagea (AE) è una patologia congenita caratterizzata dalla mancata formazione di un segmento intermedio di esofago. In circa il 90% dei casi coesiste un'anomala comunicazione tra uno dei due monconi esofagei (nella maggior parte dei casi il moncone inferiore) e la trachea (fistola tracheo-esofagea FTE). Embriologia L'esofago e le vie aeree hanno un progenitore comune il primitivo tubo intestinale superiore presente già nell'embrione di 19 giorni ed esteso dal faringe a quello che diventerà lo stomaco. La porzione ventrale di questo tubo darà luogo alle vie aeree, la porzione dorsale all'esofago. Eziopatogenesi Il meccanismo patogenetico alla base dell'atresia è poco chiaro, anche se verosimilmente si può attribuire ad una displasia assiale del mesoderma. Di più facile interpretazione è la modalità con cui si forma la fistola tracheo-esofagea: mancata separazione dell'intestino primitivo (foregut) in una porzione ventrale (trachea) ed una dorsale (esofago). L'eziologia è per tutt'ora sconosciuta. Classificazione anatomica L'AE può presentarsi con un ampio spettro di varianti anatomiche (Fig. 1). La classificazione più utilizzata è quella proposta da Ladd e Gross che prevede cinque principali tipi anatomici: TIPO I: Rappresenta circa il 5% dei casi. Tra i due monconi esofagei esiste un long-gap e non esiste alcuna II I comunicazione con l'albero bronchiale. In questo tipo di AE spesso non è possibile un' anastomosi primaria tra i due monconi. TIPO II: Tra i due monconi esofagei esiste un long- gap. III IV Fig. 1 V In questo tipo di AE esiste una fistola breve e ristretta che origina dal moncone esofageo superiore e termina direttamente in trachea. TIPO III: Rappresenta la forma più frequente (85% dei casi). Il moncone esofageo superiore è identificabile a livello della terza vertebra toracica e può, occasionalmente, avere una parete comune con la parete tracheale posteriore. Il moncone esofageo inferiore comunica con la trachea, il più delle volte a livello della carena. TIPO IV: Variante anatomica estremamente rara, caratterizzata dall'atresia e dalla presenza di una doppia fistola del moncone superiore e di quello inferiore. TIPO V: Caratterizzata dalla sola presenza di FTE definita ad “H”. Malformazioni associate Circa il 50% dei bambini con AE presenta malformazioni associate; nella maggior parte dei casi si tratta di anomalie muscolo-scheletriche, cardiovascolari genito-urinarie o gastrointestinali. Tali malformazioni possono presentarsi singolarmente o associarsi dando origine a quadri polimalformativi. Il più frequente quadro è rappresentato dall'associazione VACTERL caratterizzata da malformazioni vertebrali, ano-rettali, cardiovascolari, tracheali, esofagee, renali e degli arti. Quadro clinico La sintomatologia, già presente alla nascita,è caratterizzata da scialorrea, sindrome respiratoria, crisi di soffocamento e rigurgito ad ogni tentativo di alimentazione. La presenza di una FTE con l'esofago distale causa il passaggio di aria dalla trachea nello stomaco con distensione gastrica ed ulteriore ostacolo alla meccanica respiratoria. L'aspirazione dei succhi gastrici nelle vie aeree può inoltre causare una polmonite chimica. Più subdolo è l'esordio della sintomatologia nei pazienti con FTE senza AE; in questi pazienti il passaggio di aria nello stomaco causa distensione gastrica e difficoltà respiratoria mentre il passaggio di contenuto gastrico o esofageo nelle vie aeree è responsabile della tosse e delle bronchiti e broncopolmoniti di frequente riscontro in questi pazienti. Diagnosi La diagnosi prenatale si basa sulla dimostrazione ecografica del polidramnios e dell'assenza della bolla gastrica, segni indiretti della presenza di AE. In un recente studio questa metodica ha dimostrato un valore predittivo positivo nel 56% dei casi con una sensibilità del 43%. Un altro segno ecografico, più raro, è rappresentato da un' area anecogena situata a metà del collo del feto. Dopo la nascita la diagnosi di sospetto si pone con il sondaggio dell'esofago mediante l'uso di un sondino naso-gastrico. Normalmente la distanza tra l'orifizio orale e il cardias di un neonato nato a termine e di peso normale è di circa 17 cm; nei neonati con AE il sondino si arresta dopo circa 9-13 cm. La conferma diagnostica è fornita dall'esame radiografico del torace e dell'addome, che dimostra la posizione intratoracica del sondino, con la punta a livello della 2-3 vertebra toracica. La presenza di aria nello stomaco e nell'intestino è diagnostico per AE con FTE. L'esame radiografico è anche utile per escludere eventuali anomalie vertebrali e patologie respiratorie. Prima di procedere alla toracotomia può essere utile un 'indagine broncoscopica finalizzata ad escludere possibili segni di tracheomalacia, di malformazioni a carico dell'apparato bronchiale e a scoprire un eventuale tramite fistoloso prossimale. Prognosi È strettamente legata al peso alla nascita, alle eventuali malformazioni associate nonché alla tempestività della diagnosi e del trattamento. La classificazione in gruppi proposta da Spiz mette in relazione la sopravvivenza con il peso alla nascita e le malformazioni cardiache maggiori: GRUPPO I: neonati con PN > 1500 g senza malformazioni cardiache maggiori con sopravvivenza del 97%; GRUPPO II: neonati con PN < 1500 g o con malformazioni cardiache maggiori, con sopravvivenza del 59%; GRUPPO III: neonati con PN <1500 g e malformazioni cardiache maggiori, con sopravvivenza del 22%. Terapia Confermata la diagnosi è necessario stabilizzare le condizioni cliniche del neonato. Per impedire l'inalazione della saliva che si accumula nel moncone esofageo superiore è necessario posizionare un sondino tipo Reploge (a doppio lume e con fori multipli) che viene connesso ad un'aspirazione continua al fine di consentire il drenaggio continuo della saliva. Se necessario va instaurata la ventilazione meccanica; quella assistita con maschera non va praticata per evitare la sovradistensione gastrica. Inoltre è consigliabile stabilire una via venosa per assicurare un apporto idrico adeguato nonché la somministrazione di antibiotici. La scelta dell'intervento chirurgico è condizionata dal tipo di malformazione e dalla condizione cardiorespiratoria del paziente. In linea di massima nell'AE con FTE distale è indicato un intervento precoce (entro 24h), che consiste nella sutura della fistola e nell'esofago-esofagostomia termino-terminale attraverso un approccio transtoracico extrapleurico (4°-5° spazio intercostale). Nell'atresia esofagea senza fistola, se i due monconi sono distanti,la correzione non è urgente, a patto di assicurare il drenaggio della tasca esofagea superiore ed una adeguata alimentazione attraverso gastrostomia. Quest'ultima consente inoltre, di valutare mediante sonde metalliche, la distanza tra i due monconi esofagei: se è inferiore a due corpi vertebrali può essere presa in considerazione, dopo alcune settimane, l'anastomosi esofagea. In caso contrario, è preferibile praticare un'esofagostomia cervicale, rinviando all'età di sei mesi l'intervento di sostituzione esofagea. Nel periodo postoperatorio la ventilazione meccanica viene impiegata solo nei pazienti con sindrome respiratoria o quando l'anastomosi sia stata praticata sotto tensione. L'alimentazione enterale può essere iniziata già in seconda giornata. Le complicanze postoperatorie possono essere precoci e tardive. Tra le prime va ricordato il pneumotorace per rottura polmonare o deiscenza dell'anastomosi, in quest'ultimo caso è necessario inserire un drenaggio toracico, che generalmente evidenzia la fuoriuscita di saliva, e in caso dubbio, richiedere un esame con mezzo di contrasto. È consigliabile una nuova esplorazione toracica che generalmente consente una nuova sutura. Le principali complicanze a distanza sono rappresentate dalla stenosi esofagea, dai problemi respiratori e dal reflusso gastroesofageo. La stenosi, se evidenziata precocemente può essere trattata con successo mediante dilatazioni ripetute. Il trattamento del reflusso gastroesofageo, riscontrato nel follow-up dei pazienti operati di atresia esofagea con un'incidenza crescente, è analogo a quello dei pazienti con reflusso gastroesofageo isolato. Ernia diaframmatica congenita (EDC) Definizione L’ernia diaframmatica congenita è una malformazione caratterizzata dall’erniazione (fuoriuscita di organi attraverso un passaggio patologicamente aperto) di anse intestinali e occasionalmente del fegato e di altri organi intra-addominali nel torace. Embriopatogenesi L’embriopatogenesi dell’EDC non è ancora completamente conosciuta. Il diaframma deriva da diverse strutture embrionarie: il setto trasverso posto nella parte anteriore e laterale del torace embrionale, le membrane pleuroperitoneali nella parte posteriore e laterale del torace embrionale, il mesentere esofageo posteriormente, e i muscoli intercostali lateralmente. Si ritiene che l’ernia diaframmatica congenita sia dovuta alla mancata fusione o all’ipoplasia (ridotto sviluppo) di una di queste strutture embrionarie. Studi recenti fanno risalire l’embriopatogenesi dell’ernia diaframmatica a un difetto molto precoce, durante la formazione delle membrane pleuroperitoneali, in particolare nella regione dorsolaterale, dove ha sede la maggior parte dei difetti diaframmatici nell’uomo. A seguito del mancato sviluppo del diaframma, intorno alla 10° settimana di vita intrauterina, gli organi intra-addominali invadono la cavità toracica. Classificazione Esistono diverse tipologie di EDC che si caratterizzano sulla base della localizzazione del difetto diaframmatico. Pertanto si possono distinguere: ernie postero-laterali o di Bochdalek che rappresentano l'85% dei casi di cui il 75-90% a sinistra, il 10% a destra e il 5% bilaterali; ernie anteriori o parasternali di Morgagni-Larrey (2% dei casi); ed ernie centrali a livello del centro tendineo del diaframma amuscolare (molto rare). Fisiopatologia La classica ernia (di Bochdalek) situata a sinistra presenta un difetto postero laterale nel diaframma di 2.0-4.0 cm attraverso il quale i visceri addominali sono stati traslocati nell’emitorace (Fig.2). I contenuti erniari spesso includono il lobo sinistro del fegato, la milza, e molti tratti gastrointestinali. Lo stomaco è frequentemente nel torace e presenta un certo grado di ostruzione a livello della giunzione gastroesofagea. Questa ostruzione causa dilatazione dell’esofago. Fig. 2 ed ectasia Occasionalmente il rene può trovarsi nel torace insieme ai vasi renali. Nel caso in cui il difetto sia a destra, il grande lobo destro del fegato può occupare la maggior parte dell’emitorace in aggiunta agli altri visceri addominali. È stato ampiamente dimostrato come una compressione a lungo termine sullo sviluppo dei polmoni fetali da parte dei visceri addominali nella cavità toracica, porta ad un deficiente sviluppo ed ipoplasia polmonare. Poiché il processo dell’erniazione avviene durante il periodo della suddivisione bronchiale, è a questo stadio che lo sviluppo polmonare viene compromesso. Il letto vascolare polmonare è decisamente anormale nei polmoni dei pazienti affetti da EDC. È stato riportato una riduzione nel numero totale dei rami arteriosi nel parenchima di entrambi i polmoni. La combinazione di un polmone ipoplastico (Fig. 2) e di uno atelettasico e la conseguente ipertensione polmonare persistente comportano l'aumento delle resistenze vascolari polmonari con diminuzione del flusso ematico polmonare. Si verifica shunt destro-sinistro sia al livello del forame ovale che attraverso la pervietà del dotto arterioso, con grave ipossiemia. Epidemiologia L’incidenza dell’ernia diaframmatica congenita è stimata essere 1 su 2000-5000 nati. Tale patologia non è quasi mai ereditaria ma è stata descritta eccezionalmente in più elementi della stessa famiglia. Le femmine appaiono essere maggiormente colpite rispetto i maschi. I difetti sono più comuni nel lato sinistro con l’80% dei casi. Le donne sottopeso per la loro altezza hanno un maggior rischio di avere un bambino affetto da EDC. Anomalie strutturali cromosomiche sono presenti nel 9-34% dei bambini affetti da EDC e includono trisomie, delezioni e traslocazioni. Le cause di EDC sono poco conosciute. Si pensa siano collegate all’esposizione di individui predisposti geneticamente sia a fattori individuali che ambientali. L’esposizione ad un numero di agenti farmacologici e i rischi ambientali sono stati implicati nello sviluppo di EDC. Le anomalie associate possono coinvolgere diversi organi e/o apparati. Le anomalie cardiache associate risultano essere stimate intorno al 63%. Sono stati riportati anche difetti all'interno dell'albero tracheo-bronchiale quali stenosi, triforcazione e bronco tracheale. I difetti del tubo neurale più comuni riguardano anomalie del sistema nervoso centrale. Possono associarsi anche rare sindromi come la pentalogia di Cantrell e la sindrome di Beckwith-Wiedemann. Sintomatologia Nella maggior parte dei casi si tratta di neonati che presentano gravi disturbi respiratori e circolatori, legati alla dislocazione dei visceri addominali nel torace, con collasso polmonare e spostamento cardiomediastinico. Ogni inspirazione, esercitando un richiamo dei visceri addominali verso il torace, aggrava la difficoltà cardiorespiratoria; a ciò si aggiunge la distensione intestinale provocata dall’ingestione di aria. Lo spostamento dell’area di ottusità cardiaca (specialmente se da sinistra a destra) e la cianosi possono far pensare alla destrocardia con vizio cardiaco associato, ma l’assenza del murmure respiratorio e la presenza di borborigmi nell’emitorace sinistro o destro (a seconda della sede dell’ernia) dovrebbero indirizzare alla diagnosi giusta. Quando i visceri addominali passano in gran parte nel torace, l’addome può presentarsi avvallato anche detto “a barca” o “scafoide”. Diagnosi La diagnosi di EDC è spesso effettuata tramite l’esame ecografico prenatale che risulta preciso nel 40-90% dei casi. Il polidramnios è presente in più dell’80% di gravidanze affette da EDC. Il meccanismo attraverso il quale si instaura questo polidramnios è dovuto all’ostruzione gastroesofagea, dato a sua volta dalla traslocazione dello stomaco nella cavità toracica. Ad una scansione traversa è tipico il rilievo di una deviazione (shift) cardiaca e mediastinica verso il lato opposto a quello dell’ernia (verso destra, in caso di ernia sinistra e viceversa). L’esame ecografico inoltre mette in evidenza la dislocazione dello stomaco o parte delle anse intestinali nel torace fetale allo stesso livello del cuore, di difficile differenziazione dal polmone omolaterale. A questo si deve aggiungere l’assenza dello stomaco in cavità addominale e la presenza del fegato o altri visceri nel torace. Recentemente è stata impiegata la risonanza magnetica per la diagnosi, soprattutto in quei pazienti affetti da anomalie fetali complesse. La RM può inoltre essere usata per accertare più accuratamente il volume polmonare per determinare il grado di ipoplasia con conseguente correlazione all’esito finale. Indispensabile è risultato il supporto della RMN nella diagnosi differenziale tra ernia diaframmatica, eventrazione diaframmatica ed agenesia polmonare, patologie che sono definite da aspetti prognostici diversi, che possono beneficiare della precoce definizione diagnostica prenatale e di uno stretto follow up multidisciplinare in gravidanza. Alla nascita se il difetto diaframmatico è molto piccolo, può essere individuato solo alla Rx del torace, che mostra solo poche anse intestinali erniate nel torace. Se il difetto è ampio la Rx mostra tipicamente numerose anse intestinale distese dall'aria, che occupano un emitorace, e lo spostamento controlaterale del cuore e delle strutture mediastiniche. Se la Rx è eseguita immediatamente dopo il parto, prima che il bambino abbia ingerito aria, il contenuto addominale appare come una massa radiopaca priva di aria localizzata nell'emitorace interessato. Trattamento preoperatorio In passato l'ernia diaframmatica congenita era considerata una vera e propria emergenza chirurgica, oggi invece la stabilizzazione preoperatoria per almeno 12-24 ore ha ridotto il tasso di mortalità. Dopo la nascita e la conferma della diagnosi di EDC, il primo intervento è destinato a stabilizzare l’apparato cardiorespiratorio riducendo al minimo i rischi iatrogeni degli interventi terapeutici. È essenziale considerare che la EDC è un’emergenza fisiologica e non chirurgica. Il distress respiratorio associato all’ernia diaframmatica congenita è il risultato della combinazione di due fattori già discussi: l’ipoplasia polmonare e l’ipertensione polmonare potenzialmente reversibile. L’equilibrio tra questi due fattori determina la risposta alla terapia e infine l’esito. La rianimazione inizia con l’intubazione endotracheale e l’inserzione del sondino nasogastrico per decomprimere lo stomaco. La ventilazione attraverso la maschera e il pallone di Ambu è controindicato per evitare la distensione ulteriore dello stomaco e delle anse intestinali che possono trovarsi nella cavità toracica. La scelta del tipo di ventilatore meccanico necessario per i bambini affetti da EDC è un problema di preferenza personale ed istituzionale. Il fine del supporto ventilatorio è quello di mantenere una ventilazione per minuto con una Po2 superiore ai 60 mm Hg (Sao2 90%-100%) e una Pco2 corrispondente inferiore ai 60 mm Hg. Se le tecniche convenzionali di ventilazione meccanica non sono in grado di risolvere l’ipossiemia o l’ipercapnia, si può ricorrere all’uso di tecniche ad alta frequenza usando un ventilatore oscillatorio. Questa tecnica può essere efficace nel rimuovere il biossido di carbonio e nel stabilizzare temporaneamente il distress respiratorio nei neonati affetti da EDC. L’Ossido Nitrico (NO o più correttamente monossido di azoto) è un potente mediatore della vasodilatazione ed è stato originariamente identificato come fattore di rilascio endotelio derivato. Negli studi clinici l’NO è stato importante nell’aumentare i livelli di saturazione di ossigeno in neonati con insufficienza respiratoria dovuta all’ipertensione polmonare persistente. L’NO, infatti, diminuisce la pressione nell’arterie polmonari e aumenta la saturazione dell’ossigeno arterioso senza particolari effetti collaterali. Nonostante i recenti passi avanti nelle strategie di trattamento, la depressione respiratoria che richiede supporto ECMO (Extra Corporeal Membrane Oxygenation) si ha in neonati con EDC in percentuale dal 15% al 40%. Inizialmente i neonati venivano posti con ECMO dopo aver sviluppato insufficienza respiratoria che seguiva l’immediata chiusura del difetto diaframmatico. L’ECMO è adesso considerata parte del processo di stabilizzazione preoperatorio. Subito dopo la nascita, comunque, si deve procurare un accesso arterioso e venoso attraverso l’ombelico. Facendo passare il catetere venoso ombelicale attraverso il fegato nell’atrio destro è possibile monitorare la pressione centrale venosa. Come in ogni rianimazione neonatale, meticolose attenzioni sono messe in atto per mantenere un’appropriata regolazione della temperatura, della glicemia e un adeguato apporto di ossigeno. Ogni evento stressante può ulteriormente inasprire la già elevata pressione polmonare e portare ad un aumento del flusso dello shunt ed infine ad una desaturazione sistemica. I pazienti vengono sedati usando ogni diversa combinazione di farmaci quali midazolam, fentanyl o morfina. L’ipotensione sistemica e l’inadeguata perfusione tissutale devono essere tenute sotto controllo e trattate con la somministrazione di fluidi endovenosi quali prodotti cristalloidi e colloidi. Intervento chirurgico L’approccio di molti chirurghi al difetto è un’incisione sub costale, sebbene possa essere fatto altrettanto bene attraverso un’incisione in toracotomia anche utilizzando tecniche miniinvasive di laparoscopia o toracoscopia. Dopo divisione dei muscoli della parete addominale e l’entrata all’interno della cavità addominale i visceri sono delicatamente ridotti dal difetto e completamente eviscerati per un’adeguata visualizzazione. La mobilizzazione può risultare difficoltosa e deve essere fatta senza danno a nessuno degli organi. Una volta che il contenuto addominale è ridotto, il difetto nel diaframma in posizione postero laterale può essere esaminato. Se il difetto è piccolo, si può iniziare una riparazione primaria con una sutura interrotta con materiale non assorbibile. Se il difetto è troppo largo per essere chiuso con queste tecniche classiche sono state descritte un certo numero di tecniche ricostruttive che usano varie strutture vicine quali le fasce prerenali, la struttura delle coste e diversi fasci muscolari delle pareti toraciche e addominali. L’uso di materiale protesico per completare la chiusura diaframmatica è stato largamente accettato (PTFE o Gore-Tex). Nei casi di ernia diaframmatica severa, caratterizzati dall’erniazione del fegato e dal valore di LHR<1 (parametro che misura l’area del polmone controlaterale al difetto in rapporto alla circonferenza cranica ed è considerato un indice prenatale di severità dell’ernia diaframmatica), da alcuni anni è possibile eseguire una terapia prenatale definita con il termine FETO (Fetoscopic Tracheal Occlusion). L’intervento, eseguito tra la 26 -28 settimana gestazionale, consiste in una fetoscopia (inserimento di una sonda endoscopica di piccole dimensioni, circa 3 mm, all’interno della cavità uterina) con successivo posizionamento di un palloncino all’interno della trachea fetale, al di sotto delle corde vocali. Il palloncino viene gonfiato con una particolare soluzione isotonica (Omniscan), che è un agente di contrasto per immagini con risonanza magnetica. Una volta inserito, il palloncino, viene mantenuto in sede per alcune settimane, generalmente viene rimosso dopo circa 6 settimane attraverso un secondo intervento di fetoscopia o con una puntura sotto guida ecografica, questo permette di liberare le vie aeree prima della nascita. Il mantenimento in sede di questo palloncino per diverse settimane, permette di bloccare il normale flusso di liquido che viene prodotto in epoca prenatale, nelle vie aeree, in questo modo il liquido si accumula all’interno del polmone, permettendone l’espansione e lo sviluppo. L’espansione e lo sviluppo polmonare, secondario a questa tecnica, permette, nella maggior parte dei casi, di migliorare la prognosi del feto. Dati recenti dimostrano che il tasso di sopravvivenza di questo gruppo di pazienti trattato con FETO potrebbe passare dal 10-15% al 60%. Nel postoperatorio bisognerà continuare seguendo gli obiettivi di stabilizzazione iniziati prima dell’intervento con le modalità ventilatorie e di supporto delle attività vitali già descritte. Prognosi Nel complesso indici di sopravvivenza tra l’80 e il 90% sono stati raggiunti con le modalità di trattamento attuali. Sebbene le variazioni degli indici di sopravvivenza restano alti, restano significative differenze nella gestione di strategie e della risposta del paziente. È stata trovata in sopravvissuti di EDC un’elevata incidenza di reflusso gastroesofageo. Sono stati inoltre trovati un numero significativo di neonati con problemi nutrizionali e di crescita. La sorveglianza a lungo termine e la gestione nutrizionale aggressiva sono richiesti per questi neonati. Preoccupanti notizie stanno emergendo sulla comparsa di esofagiti di Barrett e malattie croniche polmonari secondarie alla cronicizzazione del reflusso gastro-esofageo. Sono stati riportati anche un certo numero di disturbi scheletrici tra cui difetti della parete del torace e scoliosi. Con l’evoluzione delle terapie interventistiche, sono emersi un nuovo gruppo di sopravvissuti con differenti tipi di patologie a lungo termine. Onfalocele Definizione È un difetto mediano della parete addominale anteriore a livello della regione ombelicale, attraverso il quale possono erniare visceri cavi e parenchimatosi, ricoperti in maniera uniforme da un sacco formato da due foglietti costituiti internamente dal peritoneo ed esternamente dalla membrana amniotica, usualmente di dimensioni superiori ai 4 cm di diametro. Il cordone ombelicale si inserisce direttamente all’ apice del sacco (Fig. 3). Fig. 3 Embriopatogenesi Dipende da un difetto di chiusura della parete addominale dovuto a un’ anomala formazione delle pieghe embrionali (craniale, caudali e laterali) correlato a un mancato ritorno in addome del primitivo intestino medio intorno alla 6 -10 settimana di vita gestazionale. Incidenza Prima del 1970, l’onfalocele era il più comune dei difetti della parete addominale; esso ora è secondo alla gastroschisi. L’ incidenza è stimata intono a 1-2.5 su 5000 nati vivi, con una maggiore predominanza nei maschi. L’ onfalocele si associa ad altre anomalie in una percentuale che varia dal 20 al 70%. Il 45 % dei pazienti presenta anomalie cardiache (difetti del setto interventricolare, atresia della tricuspide, coartazione aortica, ipertensione polmonare persistente). Un 40 % presenta anomalie cromosomiche (trisomia del 13, 14, 15, 18, 21), difetti del tubo neurale e muscolo scheletrici, criptorchidismo e malattia da reflusso gastroesofageo. Tipicamente presente nella Sindrome di Beckwith-Wiedemann (onfalocele, macroglossia, gigantismo, visceromegalia e ipoglicemia) e nella pentalogia di Cantrell (onfalocele epigastrico, diastasi dei retti, ernia diaframmatica anteriore, cleft sternale distale, difetti del pericardio, spostamento anteriore del cuore e malformazioni cardiache). Diagnosi Oggi la diagnosi può essere fatta attraverso l’ ecografia prenatale a partire dalla 13°-14° settimana di età gestazionale, tale diagnosi verte sulla evidenziazione di un difetto di parete a localizzazione centro addominale con presenza di un sacco erniario contenenti visceri, all’ apice del quale si inserisce il cordone ombelicale. Si associa inoltre ad elevati valori di alfa feto proteina nel sangue materno e di acetilcolinesterasi nel liquido amniotico. Terapia Subito dopo il parto, da preferire ove possibile parto programmato con taglio cesareo, bisogna procedere alla copertura dell’ addome con garze imbevute di soluzione fisiologica tiepida, posizionamento di sondino naso gastrico per detendere lo stomaco, posizionamento di sonda rettale per liberare dal meconio l’intestino distale mediante irrigazioni e posizionamento di un catetere venoso centrale (CVC) per la nutrizione parenterale totale (NPT). In caso di onfaloceli di piccole e medie dimensioni si può procedere alla chiusura primaria con escissione del sacco, previa legatura dei vasi ombelicali, stretching della parete addominale e sutura a tutto spessore. Nei casi in cui l’ onfalocele sia di dimensioni tali da non permettere la chiusura primaria (onfalocele magno, con fegato extracorporeo) si può eseguire una tecnica che prevede l’ escissione del sacco, l’ utilizzo di due fogli di materiale sintetico (Silastic, Teflon o Goretex ) suturati ai margini laterali della fascia e chiusi a raccogliere i visceri. Si procederà a riduzione quotidiana dell’ involucro con completa chiusura della parete in 8-12 giorni. Più recentemente questa tecnica viene eseguita con un rivestimento preformato in silastic noto come “spring loaded silo”. Il silo è una protesi cilindrica in Silastic che serve a contenere le anse al suo interno e presenta una estremità chiusa e una aperta che termina con un cerchio rinforzato. Raccolte le anse nel silo, il cerchio rinforzato deve essere posizionato al di sotto del difetto di parete, in questo modo si lascerà agire la forza gravitazionale per un periodo che varia dai 4 ai 7 giorni fino ad avere un completo ritorno delle anse in addome. Una volta rientrare si procede alla chiusura chirurgica del difetto. Complicanze e prognosi La complicanza più temibile è rappresentata dal diminuito ritorno venoso al cuore destro dalle parti declivi e dalla ipomobilità diaframmatica che si possono instaurare per il notevole aumento di pressione, una volta che i visceri sono riposizionati in addome. La prognosi è correlata alle malformazioni associate, in assenza di gravi anomalie cardiache o polmonari la prospettiva di vita è ottima. Gastroschisi Definizione La gastroschisi è un piccolo difetto completo della parete addominale, localizzato alla destra del cordone ombelicale e da questo frequentemente separato da un ponte cutaneo, che permette la fuoriuscita dell’ intestino non ricoperto da peritoneo (eviscerazione) (Fig. 4). Embriopatogenesi Fig. 4 L’ ipotesi embriologica più accreditata è legata alla regressione in utero della vena ombelicale destra(28°-33° giorno di età gestazionale) che determinando un locus minoris resistentia porterebbe all’ erniazione dello intestino primitivo. Incidenza L’incidenza è circa 2-4.9 su 10.000 nati vivi, più frequente nei prematuri con predominanza nei maschi. È più frequente nei figli di giovani madri, con età inferiore ai 20 anni, o nei nati da madri tossicodipendenti. Le anomalie associate sono rappresentate da stenosi, atresie intestinali, duplicazioni intestinali o diverticolo di Meckel. Diagnosi L’ecografia prenatale dovrebbe documentare un difetto addominale localizzato alla destra del cordone ombelicale e la presenza di anse intestinali libere e ispessite nel liquido amniotico. Terapia Poiché il paziente è frequentemente un prematuro è importante garantire adeguato supporto respiratorio, valutare la dispersione di calore e di liquidi dovuti alla matassa intestinale esposta. Per tale motivo è importante avvolgere le anse con flanelle imbevute con soluzione fisiologica tiepida o blandamente iodata e copertura con un telo di plastica per evitare la disidratazione, posizionamento di sondino naso-gastrico per detendere lo stomaco, e introduzione di sonda rettale per liberare dal meconio l’ intestino distale mediante irrigazioni, e posizionamento di un CVC per l’NPT. La strategia chirurgica per la correzione del difetto deve essere ben ponderata in funzione della perdita del diritto di domicilio del viscere, delle condizioni di vascolarizzazione delle anse e delle eventuali stenosi o atresie associate. Si può effettuare una ricostruzione chirurgica primaria della parete addominale, allargando la breccia con un’ incisione longitudinale sia cranialmente che caudalmente e riposizionando le anse in cavità, previa manovra di stretching della parete. In altri casi è necessario ricorrere a chiusura differita del difetto, in quel caso si può ricorrere allo “spring loaded silo” come già descritto per l’onfalocele. È possibile anche effettuare il riposizionamento manuale delle anse in addome, senza ampliare la breccia parietale con successiva sintesi del difetto, eseguita con il bambino sveglio o in sedazione ma non in anestesia (Minimal intervention management o tecnica di Bianchi). Complicanze e prognosi Le complicanze possono essere rappresentate da compressione endoaddominale con mancato ritorno venoso e ipomobilità diaframmatica, enterocolite necrotizzante, occlusione intestinale che possono portare ad ampie resezioni intestinali con sindrome da intestino corto. La prognosi è comunque buona, la guarigione avviene in più del 90% dei pazienti. Bibliografia 1. GianBattista Parigi . Chirurgia Pediatrica. Ed.Masson. Capp 2,3,11, 2005 2. JL Grosfeld et al. Pediatric Surgery 6th Edition . Ed Mosby-Elsevier Voll. 1 e 2 Capp.60, 67, 73, 2006 3. Bianchi A, Dickinson AP: Elective delayed reduction and no anesthesia: Minimal intervention management for gastroschisis. J Pediatr Surg 1998;33:1338 Stenosi Ipertrofica del Piloro Pietro Impellizzeri, Pietro Antonuccio, Emanuela Santacaterina, Giorgio Lamberti, Angela Simona Montalto, Roberta Gentile, Carmelo Romeo Cattedra di Chirurgia Pediatrica Dipartimento di Scienze Pediatriche Mediche e Chirurgiche Università di Messina Definizione Ostruzione del lume pilorico dovuto ad una ipertrofia ed iperplasia delle fibrocellule muscolari lisce dello strato circolare e longitudinale. Cenni storici Blair nel 1717 (1) per primo descrisse in un bambino i reperti autoptici compatibili con Stenosi Ipertrofica del Piloro (SIP). La prima completa descrizione si deve ad Hirschprung nel 1888 (2). Epidemiologia È la più comune causa di occlusione intestinale nel neonato con un’ incidenza compresa tra 1.5 e 4 su 1000 nati vivi. Predilezione per la razza europea. Più frequente nel sesso maschile con un rapporto M/F da 2:1 a 5:1. E’ stata rilevata un’influenza stagionale con una prevalenza di casi nei mesi di aprile-maggio ed ottobre-novembre (3). Etiopatogenesi Pur essendo stata oggetto di numerosi studi scientifici, l’etiopatogenesi della SIP resta ancora oggi poco conosciuta. Nella fisiopatologia sembrano giocare un ruolo importante sia fattori genetici che ambientali. A favore dei primi vengono invocati: la maggiore incidenza in alcune popolazioni rispetto ad altre ed un aumentato rischio nei nati con familiarità per stenosi ipertrofica del piloro. Tra i fattori ambientali si suppongono: alimentazione al seno versus alimentazione artificiale, alimentazione con sondino trans pilorico, l’andamento stagionale della SIP, genesi iatrogena da somministrazione di eritromicina. Numerosi studi hanno preso in considerazione alterazioni del meccanismo di rilasciamento del muscolo pilorico investigando sia sull’anatomia e fisiopatologia della fibrocellula muscolare liscia che della sua innervazione. Alcuni AA hanno focalizzato l’attenzione sulla trasmissione peptidergica, come possibile fattore patogenetico; numerosi peptidi intestinali sono stati studiati quali la gastrina, sostanza P, somatostatina, enteroglucacone, neurotensina (4). La sostanza P sembra essere presente in alta concentrazione nel muscolo pilorico di pazienti affetti da SIP, tale neurotrasmettitore è considerato responsabile della contrazione mioenterica e produrrebbe un pilorospasmo prolungato che porta ad ipertrofia muscolare (5). Anche alcuni fattori di crescita sono stati correlati con la malattia quali EGF TGF-alfa, IGF-I ed evidenziata un’aumentata espressione genica di tali fattori (6). Studi sull’innervazione del muscolo pilorico hanno riscontrato alterazioni delle cellule del Cajal, pacemaker cellulari dell’intestino, riduzione dell’eme-ossogenasi-2 che può giocare un ruolo nella trasduzione di segnale tra cellule del Cajal e fibrocellula muscolare liscia (7). Vanderwiden ha dimostrato l’assenza di Ossido Nitrico (NO) nella muscolatura circolare ipertrofica del piloro, suggerendo un importante ruolo dell’attività nitrinergica nei meccanismi di rilasciamento del muscolo pilorico (8). Altri AA nel confermare il ruolo del NO ipotizzavano un’alterazione delle interazioni tra la fibrocellula muscolare liscia e la matrice extracellulare. (9). Altri studi hanno dimostrato che l’assenza dei sarcoglicani (componenti del citoscheletro della cellula muscolare liscia) comporta alterazioni della struttura e della funzione contrattile della fibrocellula (10). Sintomatologia Il muscolo pilorico ipertrofico causa un allungamento ed un aumento dello spessore del canale pilorico con riduzione del lume e conseguente ostruzione al passaggio del contenuto gastrico. L’esordio clinico è tipico dell’età neonatale (2-4 settimane) fino all’ottava settimana di vita con un picco di incidenza fra la terza e la quinta settimana. Nei neonati prematuri l’insorgenza si verifica tra la 32° e 87° giornata di vita. Il segno principe della SIP è il vomito. Il vomito si presenta bianco sempre più ingravescente fino a diventare costante dopo ogni poppata, assumendo la caratteristica di “vomito a getto”, latte si presenta coagulato. Raramente possono essere presenti tracce ematiche, segno di una gastrite e/o esofagite concomitante. Alvo chiuso a feci presenza di feci verdi (feci da fame). Una diagnosi tardiva, occasione ormai sempre più rara, può comportare grave disidratazione con conseguente alterazione dell’equilibrio idro-elettrolitico con alcalosi ipocloremica (per perdita di ioni Cl-), iposodiemia, ipopotassiemia, iperazotemia. Sul piano clinico tutto si traduce in un arresto dell’accrescimento ponderale e facies tipica (infossamento degli occhi e delle fontanelle), possibilità di crisi tetaniche. All’ispezione a volte è possibile notare una distensione della regione epigastrica. Alla palpazione dell’addome superiore, a destra della linea mediana, è possibile apprezzare la tumefazione pilorica, descritta classicamente a “forma di oliva”, di consistenza dura e compatta. Diagnosi Il sospetto clinico di SIP si basa sulla raccolta dei dati anamnestici e clinici. Oggi l’ecografia è l’esame strumentale di prima scelta consentendo di evidenziare l’oliva pilorica come “immagine a coccarda” dovuta alla muscolare ispessita ed anecogena mentre la mucosa appare iperecogena. I parametri ecografici presi in considerazione sono: lo spessore del muscolo pilorico, la Diagnosi Differenziale Errato regime Atresia pilorica dietetico Sindrome adrenoDuplicazione gastrica genitale Turbe metaboliche Atresia prima porzione duodenale Ipertensione Reflusso gastroendocranica esofageo Intolleranza alle Sepsi proteine del latte vaccino lunghezza del canale pilorico, il diametro del lume pilorico. I requisiti per soddisfare la diagnosi ecografica di SIP sono: diametro pilorico di valore uguale o superiore a 1,5 cm, lunghezza canale pilorico di valore uguale o superiore a 1,8 cm, diametro pilorico di valore uguale o superiore a 3,0 mm. La tecnica presenta i seguenti vantaggi: a) non espone il paziente a radiazioni, b) è priva di rischio ab ingestis durante l’esame, c) possibilità di visualizzare il piloro nelle sue tre dimensioni, d) l’esame può essere ripetuto. Gli svantaggi invece sono: a) difficoltosa la visualizzazione dello stomaco e del tratto intestinale sotto il duodeno, b) richiede esperienza e quindi operatore dipendente. La metodica offre una sensibilità del 97% ed una specificità del 100%.In caso di dubbia lettura diagnostica dei criteri clinici ed ecografici si può ricorrere allo studio radiologico dell’apparato digerente superiore con m.d.c. Figura 1 Figura 2 Terapia Trattamento medico preoperatorio. Necessario posizionare un sondino naso-gastrico allo scopo di evitare fenomeni di ab ingestis e detendere lo stomaco. Correggere lo squilibrio idroelettrolitico e la disidratazione con opportune infusioni glucosalina per via parenterale. Utile la monitorizzazione con emogasanalisi. La terapia della SIP, pur essendo chirurgica, non rientra nelle urgenze assolute. Occorre, infatti, ripristinare l’equilibrio idroelettrolitico in modo da consentire al bambino di affrontare l’intervento chirurgico in condizioni ottimali. Trattamento chirurgico. Dufour e Fredet per primi nel 1908 proponevano il trattamento chirurgico con l’incisione dello strato muscolare e la sua chiusura trasversalmente (11). Ramstedt nel 1912 modificava la tecnica ritenendo non necessario la chiusura del muscolo pilorico (12). La tecnica di piloromiotomia extramucosa sec. Fredet-Ramstedt è quella attualmente utilizzata. Essa può essere eseguita open o per via laparoscopica. La tecnica open. Si esegue un’incisione al quadrante superiore destro 2-3 cm sotto il margine epatico, aperta la cavità addominale si identifica l’oliva pilorica che viene esteriorizzata, sulla superficie avascolare del piloro viene praticata un’incisione dal versante gastrico a quello duodenale (Fig 1) penetrando lo spessore della muscolare in modo da favorire l’estroflessione o erniazione della mucosa (Fig 2). Per meglio dissezionare le fibre del muscolo pilorico il chirurgo si avvale di un’apposita pinza detta appunto di Ramstedt. Nel 1986 Bianchi e Tan (13) proponevano una variante riguardante solo l’accesso alla regione pilorica attraverso un’incisione lungo il margine superiore della cicatrice ombelicale per poi raggiungere la cavità addominale attraverso i muscoli retti addominali. Nel corso degli anni sono state proposte ulteriori modifiche a questa tecnica. (1415) Tecnica laparoscopica. La piloromiotomia extramucosa condotta per via laparoscopica è stata introdotta nel 1990 (16). La tecnica ovviamente prevede la creazione di uno pneumoperitoneo con un trocar di 5 mm attraverso la cicatrice ombelicale e da cui viene introdotta l’ottica. Altri due accessi vengono posizionati sotto visione diretta della telecamera ai quadranti addominali superiori di destra e di sinistra. La piloromiotomia viene eseguita sec la tecnica di Fredet-Ramstedt. I vantaggi di questa tecnica vengono riassunti in: minore tempo di degenza, migliori risultati estetici. Un recente studio di meta-analisi mettendo a paragone i due accessi conclude che l’approccio laparoscopico risulta più vantaggioso solo per la riduzione delle infezioni della ferita chirurgica (17). I risultati di un recente trial randomizzato in cui sono stati comparati l’approccio open e quello laparoscopico concludono che entrambi sono sicuri ed efficaci e pur riconoscendo alcuni vantaggi dell’accesso laparoscopico gli AA ne raccomandano l’utilizzo solo nei centri con provata esperienza (18). Ripresa dell’alimetanzione. Il paziente inizia ad essere rialimentato per os dopo 4-6 ore dall’intervento chirurgico con soluzione glucosata e successivamente con latte in quantità sempre più crescenti fino a raggiungere nell’arco di 24-36 ore il fabbisogno necessario. Risultati Buona la prognosi. La complicanza più temibile è la perforazione iatrogena della mucosa pilorica durante l’esecuzione della piloromiotomia che se, misconosciuta, richiede un reintervento. Bibliografia 1) Blair P.: On the dissection of child much emacied. Phil Trans:30:631, 1717. 2) Hirschprung H.: Falle von angeborener pylorus stenose. J. Kinderheilk; 27:61, 1888. 3) Benson C.: Infantile pyloric stenosis, historical aspects and current surgical concepts. Pr. Ped Surg 1: 63, 1970. 4) Spitz L, Zail SS: Serum gastrin levels in congenital hypertrophic pyloric stenosis. J Ped Surg 11:33, 1976. 5) Tam PK.: Observation and perspective of the pathology and possible aetiology of infantile hypertrophic pyloric stenosis: a histological, biochemical and immunocytochemical sudy. Ann Acad Med Singapore, 14:523, 1985. 6) Shima H, Ohshiro K, Puri P: Increased local synthesis of epidermal growth factors in infantile hypertrophic pyloric stenosis. Pediatr Res 47:201, 2000. 7) Piotrwaska AP, Solari V, Puri P: Distribution of heme oxygenase-2 in nerves and intestitial cells of Cajal in the normal pylorus and infantile hypertrophic pyloric stenosis. Arch Pathol Lab Med 127:1182, 2003. 8) Vanderwiden JM, Mailleux P, Schiffmann SN et Al: Nitric Oxyde Synthase activity in infantile hypertrophic pyloric stenosis. N Engl J Med 327:511, 1992. 9) Gentile C, Romeo C, Impellizzeri P et Al: A possible role of the plasmalemmal cytoskeleton, nitric oxide synthase, and innervation in infantile hypertrophic pyloric stenosis. A confocal laser scanning microscopic study. Pediatr Surg Int 14(1-2):45-50, 1998. 10) Romeo C, Santoro G, Impellizzeri P, et Al: Sarcoglycan immunoreactivity is lacking in infantile hypertrophic pyloric stenosis. A confocal laser scanning microscopic study. Pediatr Med Chir. 29(1):32-7, 2007. 11) Dufour H, Fredet P: La stenose hypertrophique du pylore chez le nourisson et son traitment chirurgical. Rev Chir 37:208, 1908. 12) Ramstedt C.: Operation der angerbonen Pylorus Stenose. Med Klin 8:1702, 1912. 13) Tan K, Bianchi A: Circumbilical incision for pyloromiotomy. Br J surg 73:399, 1986 14) Alberti D, Cheli M, Locatelli G. A new technical variant for extramucosal pyloromyotomy: the Tan-Bianchi operation moves to the right. J Pediatr Surg. 39(1):53-. 2004 15) Yokomori K, Oue T, Odajima T, et al:. Pyloromyotomy through a sliding umbilical window. J Pediatr Surg. 41(12):2066-8, 2006. 16) Alain JL, Grousseau D, Terrier G: Laparoscopy and video-surgery in the surgical treatment of hypertrophic stenosis in infants. Presse Med. 8;19(42):1950, 1990. 17) Sola JE, Neville HL. Laparoscopic vs open pyloromyotomy: a systematic review and metaanalysis. J Pediatr Surg. 44(8):1631-7, 2009. 18) Hall NJ, Pacilli M, Eaton S et Al.: Recovery after open versus laparoscopic pyloromyotomy for pyloric stenosis: a double-blind multicentre randomised controlled trial. Lancet. 31;373(9661):390-8, 2009 Malattia di Hirschsprung o Megacolon Congenito Agangliare Angela Simona Montalto, Gianfranco Scalfari, Antonio Centorrino, Saveria Parisi, Francesco Arena, Carmelo Romeo Cattedra di Chirurgia Pediatrica Dipartimento di Scienze Pediatriche Mediche e Chirurgiche Università di Messina Considerazioni generali La malattia di Hirschsprung (HD) nota con il termine di megacolon congenito agangliare è la forma più conosciuta tra le anomalie dello sviluppo del sistema nervoso enterico (SNE), le cosidette disganglionosi intestinali (IDs) e delle quali fanno anche parte le displasie neuronali intestinali, le ipoganglie e l’acalasia neurogena dello sfintere anale interno. Al momento attuale soltanto la HD è riconosciuta come entità clinico-patologica mentre le altre non sono universalmente accettate e diagnosticate come tali; il maggiore dibattito riguarda, infatti, l’origine di queste anomalie: “sono malformazioni congenite o fenomeni acquisiti?”. Le IDs corrispondono ad un importante capitolo nell’ambito dell’occlusione intestinale, della pseudo-ostruzione intestinale cronica e delle stipsi pediatriche. Definizione e cenni storici Una definizione aggiornata di HD è quella di un gruppo di affezioni congenite, più che una singola malattia, tutte caratterizzate dall’assenza congenita dei neuroni del SNE (cellule gangliari) a livello dei plessi sottomucoso (Meissner) e mioenterico (Auerbach) intestinali nel tratto retto-colico distale con estensione prossimale variabile cui si associa un’abnorme innervazione intestinale sottomucosale. Harald Hirschsprung presentò la classica descrizione della malattia in occasione di un congresso pediatrico di Berlino nel 1886, riportando due casi di bambini deceduti con i classici segni clinici e le caratteristiche anatomiche della malattia che oggi porta il suo nome. Embriologia ed embio-eziopatogenesi Conoscere il normale sviluppo embriologico del ENS è necessario per poter comprendere l’origine della HD. Il SNE maturo è considerato un secondo cervello, esso è infatti una struttura assolutamente unica e differente da ogni altro distretto del sistema nervoso periferico in grado di mediare i riflessi in completa assenza di input dal cervello o dal midollo spinale. Il SNE proviene da una struttura embrionale, la cresta neurale che nell’uomo ha origine al termine della 3 settimana di sviluppo attraverso un importante processo detto neurulazione ad opera dell’ectoderma. La cresta neurale è un aggregato temporaneo di cellule, che compare accanto alla struttura che diventerà il cervello ed al midollo spinale di tutti gli embrioni dei vertebrati e che poi scompare quando le sue cellule, prese dalla voglia di girovagare, intraprendono diversi viaggi attraverso l’embrione. Le cellule nervose enteriche derivano dalla regione vagale della cresta le cui cellule colonizzano l’apparato intestinale per tutta la sua estensione oroanale ma anche da emigranti provenienti dalla regione sacrale della cresta che colonizzano solo la porzione Fig 1.Colonizzazione dell’intestino e sviluppo del SNE dell’apparato intestinale che si trova sotto l’ombelico, l’intestino posteriore. (Fig 1) In particolare, cellule nervose arrivano primariamente in esofago alla 5 settimana di gestazione, alla 7 raggiungono l’intestino tenue e completano la migrazione nel colon distale alla 12 settimana. Il plesso mioenterico è il primo ad essere colonizzato successivamente quello sottomucoso. Le cellule della cresta neurale, inoltre, per dare origine a cellule gangliari normali sono guidate nella loro migrazione da glicoproteine come la fibronectina e acido ialuronico (proteine laminari) presenti nella matrice extracellulare, così come da fattori neurotrofici per la loro maturazione, da molecole di adesione cellulare neuronali e non in ultimo sono stati chiamati in causa fattori immunologici. Quest’ insieme complesso di eventi è regolato da meccanismi cellulari e molecolari ancora poco conosciuti. Alla luce di queste considerazioni, benché molte possano essere le ipotesi embriopatogenetiche alla base dell’HD, le più accreditate sono due: l’una, che ha conosciuto maggiori consensi, prevede un difetto della migrazione craniocaudale dei neuroblasti, motivo per il quale la HD è anche definita una “ neurocristopatia” semplice; L’altra è quella dell’ambiente ostile secondo la quale i neuroblasti migrati normalmente non sono supportati da un microambiente favorevole al loro insediamento, sviluppo e maturazione. L’eziopatogenesi dell’HD riconosce fattori addizionali rappresentati attualmente da 9 geni causativi (malattia multigenica); tuttavia quello causativo maggiore è stato identificato nel proto-oncogene RET sul cromosoma 10, le cui mutazioni sono responsabili di forme autosomico-dominanti a penetranza incompleta. Le mutazioni di RET rendono conto del 50% dei casi familiari e meno del 30% di quelli sporadici. Il gene RET è coinvolto anche in altre forme di neurocristopatie complesse, come la sindrome da endocrinopatie multiple (MEN 2A, MEN2B). Fisopatologia Da un punto di vista fisiopatologico il segmento colpito dalla malattia è caratterizzato da un’alterata motilità intestinale ed in particolare da un’incapacità di rilasciamento e progressione del bolo fecale. Ne consegue il ristagno di materiale fecale nel segmento gangliare (dilatato) a monte del segmento agangliare (ristretto ed ipoplasico). Il segmento intermedio (di transizione) è ipogangliare. La spiegazione risiede nella assenza delle cellule gangliari dei plessi enterici e nel marcato incremento (da 2 a 3 volte il normale) delle fibre colinergiche di origine sacrale ad azione prevalentemente eccitatoria il cui neurotrasmettitore è l’acetilcolina (ACh) nonché dalla complessa alterazione che coinvolge il sistema inibitorio non adrenergico-non colinergico che utilizza trasmettitori come il peptide intestinale vasoattivo (VIP) o l’ossido nitrico (NO). Incidenza L’incidenza della HD è di circa 1:5000 nati vivi con una spiccata prevalenza nel sesso maschile (7480% dei casi). Circa la familiarità è stato documentato l’aumentato rischio di ricorrenza della malattia in fratelli di soggetti affetti (4%), in rapporto all’incidenza nella popolazione generale. Anomalie associate HD è generalmente un disordine isolato ma una delle più comuni malformazioni associate è la sindrome di Down (trisomia 21) riportata essere presente con una percentuale che va dal 4.5 al 16% dei bambini affetti. In letteratura sono stati descritti altresì casi di atresia del piccolo intestino, più raramente atresia colica ed ano-rettale in associazione alla HD. Altre anomalie associate sono la trisomia 18, una varietà di neurocristopatie parte delle quali sono state precedentemente menzionate e la triade di Currarino che è un particolare tipo di regressione caudale caratterizzata da malformazione ano-rettale, agenesia sacrale (emisacro con I vertebra sacrale intatta) e massa presacrale (teratoma e/o meningocele anteriore). Classificazione La HD si suddivide in 3 gruppi principali di affezioni secondo uno schema classificativo proposto da Bettex nel 1976 che si basa sull’estensione dell’aganglia, sulle caratteristiche cliniche e i criteri terapeutici : I gruppo: comprende le “forme classiche” di HD (80%) in cui l’aganglia interessa il retto, il rettosigma o il colon discendente sino alla flessura splenica. Sono caratterizzate dal classico megacolon, prossimale al segmento agangliare. II gruppo: comprende le “forme ultracorte” di HD con aganglia limitata agli ultimi 2-3 cm distali del retto. Sul piano clinico sono caratterizzate dal quadro del megaretto. III gruppo: comprende le “forme ultralunghe” di HD (8%) con aganglia colica di più di metà del colon traverso o più frequentemente totale. Sono inclusi anche casi di aganglia estesa all’intestino tenue (sindrome di Jirasek-Zuelzer-Wilson). È importante però ricordare l’esistenza, seppur controversa, di una condizione definita “skip segment Hirschsprung’s disease” caratterizzata da un’area di intestino gangliare circondata prossimamente e distalmente da aganglionosi. Una review della letteratura ha evidenziato 24 casi (1954-2009), in cui tale condizione era presente prevalentemente in forme di aganglia colica totale. Sono stati, altresì, riportati casi estremamente rari, anche in età adulta, di “aganglionosi zonale”. Si tratta di un fenomeno che coinvolge invece un segmento isolato di aganglionosi preceduto e seguito da un intestino normalmente innervato. L’embriologia di queste condizioni è sconosciuta. Clinica La storia clinica della HD è variabile. Si manifesta generalmente alla nascita con ritardata emissone di meconio, dopo le prime 24 ore di vita, costipazione, progressiva distensione addominale. Tale sintomatologia può regredire spontaneamente o interrompersi con l’uso di sonde rettali, clisteri di pulizia. Un’esplorazione rettale per la valutazione del tono sfinteriale (generalmente aumentato) può essere seguita da una esplosiva emissione di gas e feci. Spesso inoltre si assiste ad una parziale emissione di meconio ed il primo segno clinico di malattia può non essere riconosciuto. I quadri clinici di presentazione, pertanto, differiscono per forma e severità: Occlusione neonatale persistente. Si instaura poco tempo dopo la nascita per l’accumulo eccessivo di feci e gas nell’intestino dilatato a monte del segmento agangliare. Sul piano clinico si assiste ad assenza di evacuazioni spontanee, marcata distensione addominale e vomito. Costipazione cronica progressiva. Questo quadro caratterizza quei pazienti nei quali l’iniziale segno clinico di malattia, legato alla ritardata emissione di meconio si risolve spontaneamente ma col tempo si configura una stipsi cronica ingravescente che se da un lato risponde ai normali clisteri di pulizia può intervallarsi a crisi ricorrenti subocclusive legate al compattamento fecale ed alla formazione di fecalomi. Alla palpazione dell’addome è possibile apprezzare masse mobili di natura fecale mentre all’esplorazione rettale l’ampolla risulta generalmente priva di feci. Esordio sfumato con evoluzione ostruttiva. I segni della malattia perdurano in forma lieve per settimane o mesi sino a sfociare in stipsi cronica ostinata. In questi bambini si evidenzia una grave distensione gassosa dell’addome con segni di distrofia generale, anoressia ed episodi infettivi ricorrenti. Enterocolite precoce secondaria. E’ conseguenza delle alterazioni della mucosa colica dovute alla stasi fecale, alla sovrapposizione batterica, al reflusso fecale cieco-ileale e la “diarrea paradossa” con feci liquide, miste a muco e maleodoranti ne rappresenta la manifestazione clinica. Nei pazienti con HD, tale fenomeno riconosce non solo cause meccaniche ma complesse alterazioni immunitarie nella mucosa di questi soggetti. Nell’inquadramento clinico dei pazienti con HD, considerando l’eterogeneità di esordio meritano considerazione e rafforzano l’indicazione ad approfondimenti diagnostici, quell’insieme di segni aggiuntivi che, se presenti, potrebbero indirizzare verso la probabile presenza di una causa organica di stipsi. Si tratta dei cosiddetti “red flags” quali ano anteriorizzato o ristretto, asimmetria o appiattimento dei muscoli glutei, nevi o fistola in regione lombosacrale, multiple macchie caffèlatte, indicativi di neurocristopatie e l’HD di per sé è definita una neurocristopatia. Diagnosi differenziale Diverse condizioni patologiche rientrano nella diagnosi differenziale dell’HD: Ileo da meconio, atresia del colon o dell’ileo distale condizioni che inizialmente possono mimare una HD e che al clisma opaco evidenziano quadri di microcolon. Sindrome da “plug” di meconio, in questo caso un clisma opaco può essere diagnostico e terapeutico. “Small left colon syndrome”, affezione che colpisce il 40-50% dei bambini nati da madre diabetica il cui quadro ostruttivo è caratterizzato da un colon sinistro arrotondato e di piccolo calibro che contrasta con la brusca dilatazione del colon a monta della flessura splenica. Queste due sindromi oltretutto possono essere associate ad HD. Prematurità. Sepsi, squilibri elettrolitici ed ipotiroidismo possono dare un quadro di ostruzione gastrointestinale nell’infanzia. Forme funzionali di stipsi. Diagnostica strumentale Radiogramma diretto: utile per evidenziare i segni di ostruzione bassa incompleta, distensione gassosa del colon o del tenue, eventuale presenza di livelli. La presenza di aria nel retto non esclude la diagnosi. Clisma opaco: serve a definire sede ed estensione del segmento ipo-agangliare. Nel neonato, la dilatazione del segmento prossimale ganglionico può non essere ancora sviluppata e l’indagine può pertanto essere inaffidabile. Va eseguito senza alcuna preparazione intestinale. Il segno radiologico principale è Figg 2-3. Clisma opaco. Segno del fumaiolo nelle proiezioni obliqua e laterale rappresentato dalla disparità di calibro tra il segmento a monte, dilatato e quello a valle patologico (segno del fumaiolo). Tra i due si rileva una zona conformata ad imbuto (cono di transizione) in cui il calibro varia più o meno progressivamente. (Figg 2-3). Nell’aganglia colica totale si osserva un quadro di microcolon da non uso. Elettromanometria ano-rettale: Fornisce informazioni sull’attività retto sfinteriale. Tale indagine è gravata da un periodo di 2-3 giorni d’accurata pulizia intestinale, da una lunghezza d’esecuzione e risulta anch’essa scarsamente affidabile nei pazienti di pochi mesi di vita. Il dato più suggestivo nella HD è rappresentato dall’assenza del riflesso anale inibitore (RAI) che corrisponde al mancato rilasciamento dello sfintere anale interno indotto dalla stimolazione dell’ampolla con un volume adeguato (riproduzione del riflesso defecatorio). Reperto questo comune all’acalasia dello sfintere anale interno, la conferma di HD sarà dunque bioptica. Biopsia rettale: rappresenta il gold-standard nella diagnosi di HD. Nella fase preoperatoria la biopsia per “suzione”, eseguita con strumenti appositi (Fig 4), consente di ottenere prelievi multipli e distanziati (a 1, 2, 4, 5-7 cm dalla linea pettinata) comprendenti lembi di mucosa e sottomucosa rettali, per cui, i plessi di Auerbach non sono evidenziabili, ma è ben documentato che le alterazioni evidenziate nei plessi di Meissner riflettono Fig 4. Solo –RBT. Strumento specifico per biopsia rettale perfettamente quelli nei plessi di Auerbach. Con questo tipo di materiale bioptico si procede alla diagnosi istochimica-enzimatica con un kit specifico per HD che comprende tests per l’AChE (acetilcolinesterasi), ANE (alfa naftil esterasi), NADPH-d (diaforasi), SDH (succinico deidrogenasi), LDH (lattato deidrogenasi). La positività del quadro istochimico nell’ HD è espressa in particolare dal drammatico aumento delle fibre nervose colinergiche con attività acetilcolinesterasica a livello della muscolaris mucosae e nella lamina propria del retto che disegnano un caratteristico reticolo marrone associato all’assenza di gangli sottomucosi del plesso di Meissner (Fig 5). AChE Lamina propria Musc. mucosae Gangli Mioenterici NORMALE HIRSCHSPRUNG Fig 5. Schema pattern innervativo nell’intestino normale e nella HD L’ANE, la NADPH-d, la SDH e la LDH dimostrano la presenza delle cellule gangliari sottomucose, assenti in caso di malattia. La diagnosi preoperatoria deve essere confermata dallo studio istochimico estemporaneo intraoperatorio su biopsie sieromuscolari (non a tutto spessore) eseguito durante il confezionamento di un’enterostomia derivativa o durante l’intervento radicale. Le biopsie vengono effettuate a diversi livelli per individuare il tratto di intestino normogangliare. L’esplorazione laparoscopica consente l’identificazione dei segmenti intestinali permettendo di effettuare multiple biopsie mirate. In questa fase ci si avvale della tecnica rapida per la determinazione dell’attività AChE mentre l’ANE, la NADPH-d e la LDH possono essere usate per stabilire l’estensione del tratto da resecare. Terapia chirurgica Il trattamento chirurgico ha lo scopo di resecare il tratto agangliare e ripristinare il funzionamento del colon normoinnervato. Colostomia ed enterostomia si eseguono in casi complicati, per forme ultralunghe e con rischio di occlusione intestinale o enterocolite secondaria con lo scopo di detendere temporaneamente il colon normogangliare e prepararlo così all’intervento radicale nonché di prevenire complicanze quali l’enterocolite persistente o il megacolon tossico. La colostomia o l’ileostonia derivativa si confezionano sul segmento intestinale normogangliare (enterostomia di livello). Nella maggior parte dei casi si attua l’intervento radicale senza praticare la colostomia. Attualmente le tecniche chirurgiche di scelta per il trattamento radicale della HD sono: Intervento di pull-through addomino-perineale secondo Soave-Boley: contempla l’esecuzione della mucosectomia rettale e dell’abbassamento endorettale con esteriorizzazione del colon gangliare; la modificazione secondo Boley prevede l’anastomosi immediata tra mucosa rettale evertita e colon normogangliare abbassato. Intervento secondo Georgeson-Soave: questa variante, particolarmente agevole nei neonati e nei lattanti, prevede la mobilizzazione laparoscopica del colon sinistro e del retto a cui segue l’esteriorizzazione del colon mobilizzato e successiva anastomosi primaria all’ano. Essendo una tecnica miniinvasiva offre numerosi vantaggi clinici rispetto alla chirurgia tradizionale quali minore disagio postoperatorio, riduzione dei tempi di degenza ed ottimi risultati estetici. Queste tecniche, se eseguite correttamente, preservano i plessi lombo-sacrale e sacrale ed impediscono lesioni della muscolatura sfinterica evitando disturbi alla vescica, agli organi genitali nonché complicanze quali l’incontinenza fecale e la stipsi persistente. ALGORITMO DIAGNOSTICO MALATTIA DI HIRSCHSPRUNG ANAMNESI ESAME OBIETTIVO SOSPETT0 STIPSI NEUROGENA STIPSI FUNZIONALE RX CLISMA OPACO EVENTUALE MANOMETRIA BIOPSIA RETTALE PER SUZIONE (AChE, LDH, NADPH-Diaforasi) POSITIVA per HD INTERVENTO CON ESAMI ISTOCHIMICI INTRAOPERATORI (AChE rapida, ANE) INTERVENTO RADICALE SOAVE-BOLEY O LAPAROSCOPICO CRISI OCCLUSIVA O ENTEROCOLITE COLOSTOMIA DI LIVELLO Bibliografia 1. Martucciello G., Jasonni V. Disganglionosi intestinali. Malattia di Hirschsprung. In: Parigi GB. Chirurgia Pediatrica. Masson, 2005: 88-97. 2. Martucciello G, Pini Prato A, Puri P, Holschneider AM, Meier-Ruge W, Jasonni V, Tovar JA, Grosfeld JL. Controversies concerning diagnostic guidelines for anomalies of the enteric nervous system: A report from the fourth International Symposium on Hirschsprung’s disease and related neurocristopathies. J Pediatr Surg 2005; 40: 1527-1531. 3. Teitelbaum DH, Coran AG. Hirschsprung’s disease and related neuromuscolar disorders of the intestine. In: Grosfeld JL, O’Neill JA, Fonkalsrud EW Jr, Coran AG. Pediatric surgery. Mosby, 2006:1514-1559. 4. Pini-Prato A, Martucciello G, Jasonni V. Rectal suction biopsy in the diagnosis of intestinal dysganglionoses: 5-year experience with Solo-RBT in 389 patients. J Pediatr Surg 2006;41: 1043-1048. 5. O’Donnell AM, Puri P. Skip segment Hirschsprung’s disease: a systematic review. Pediatr Surg Int 2010;26:1065-1069.
Scarica