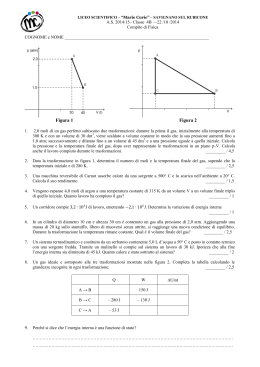
Verifica del 27/03/2013 Problema n.1 Una certa quantità di gas perfetto si trova alla temperatura di 65 °C, alla pressione di 340 kPa e occupa un volume di 37 L. Qual è il numero di molecole contenute nel gas? Quale pressione avrebbe il gas se si dimezzasse il volume del contenitore, mantenendo costante la temperatura? Dati: t=65°C⟹(273+65)K=338K p=340kPa⟹340x103Pa V1= 37 L⟹37 x10-3m3 V2=V1/2 Problema n.2 Calcola a quale temperatura il volume di un gas perfetto è 22 dm3, sapendo che a 85 °C e alla stessa pressione il volume è 44 dm3. Dati: t=85°C⟹(273+85)K=358K Vi=44 dm3=44x10-3 m3 Vf=22 dm3=22x10-3 m3 Problema n.3 Un “gas” è formato da 4,4 1010 molecole di massa 2,1 10–26 kg con velocità di modulo rispettivamente 3500 m/s, 1000 m/s, 2000 m/s e 500 m/s. Il gas può essere considerato perfetto. Calcola la sua energia interna. Dati: N=4,4 1010 m=2,1 10–26 kg v1=3500 m/s v2=1000 m/s v3=2000 m/s v4=500 m/s Problema n.4 Tre moli di gas monoatomico occupano un contenitore di 0,040 m3 alla pressione di 110 kPa. Calcola il valor medio dell’energia cinetica delle molecole del gas. Dati: moli=3⟹N=3mol x 6,02x1023mol-1 3 V=0,040 m p=110kPa=110x103Pa Problema n.5 Calcola la velocità quadratica media delle molecole di un gas perfetto alla temperatura di 130 °C, formato da molecole puntiformi di massa 3,3 10–27 kg. Dati: t=130 °C ⟹(273+130)K=403K m=3,3 10–27 kg kb=1,38x10-23J/K
Scarica