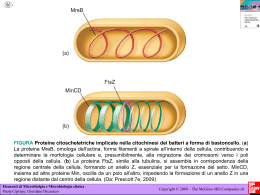
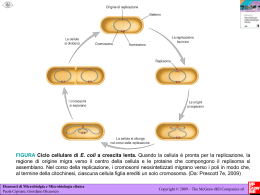
ISTOLOGIA. INTRODUZIONE. CENNI STORICI. Nasce alla metà del secolo scorso con la denominazione originaria di Istologia descrittiva, la quale aveva essenzialmente finalità descrittive e classificatorie della morfologia dei vari tessuti, senza preoccuparsi di analizzarne la componente funzionale. Successivamente, in seguito alla rivoluzione che accompagna dottrina cellulare, la scoperta dei meccanismi morfofunzionali della cellula, e più ancora in seguito alla evidenziazione delle principali macromolecole organiche (con l’abbassamento del potere risolutivo della microscopia ottica e con la microscopia elettronica), l’accezione puramente morfologica che accompagnava un’analisi di tipo istologico non soddisfece più, e si sostituì ad essa un’accezione più prettamente morfofunzionale. In questo senso, dunque, si iniziò a prestare grande attenzione a quello che viene comunemente definito metabolismo cellulare, cioè a dire: “Il complesso delle trasformazioni chimiche e chimico-fisiche che consentono la produzione di energia che viene impiegata nelle attività cellulari”. Infatti, i legami che trattengono gli atomi nelle molecole e le molecole fra loro esprimono una E.P. (energia potenziale) che può essere opportunamente utilizzata dalle cellule per l’espletamento delle loro esigenze funzionali. Da un punto di vista storico, quindi, distinguiamo tre fasi di diversificazione ed evoluzione del pensiero istologico, in accordo alla diversificazione ed evoluzione delle tecniche di microscopia: 1) Stato cellulare. 2) Stato colloidale. 3) Stato macromolecolare. DEFINIZIONI. - Istologia classica: “Studio della struttura delle entità di ordine microscopico o strutturale (con la microscopia ottica) e submicroscopico o ultrastrutturale (con la microscopia elettronica)”. - Istochimica e istotopochimica: (con cui viene introdotta la rivoluzione e si comincia a dare il giusto peso all’aspetto funzionale). “Studio della localizzazione e distribuzione di sostanze chimiche nelle strutture e substrutture cellulari, condotto con mezzi di microscopia ottica ed elettronica”. - Istologia moderna: “Studio delle strutture e delle funzioni delle entità di ordine di grandezza microscopico, submicroscopico e macromolecolare”. Quindi, in questo senso, un indirizzo di studio semplicemente descrittivo-morfologico diviene morfo-funzionale: importanza della funzione correlata alla struttura. Se, infatti, una procedura di indagine istologica necessita dell’utilizzo di tecniche di microscopia, quando ancora il progresso in questo campo era molto limitato, “ambiti di studio” come quello macromolecolare erano appannaggio della Chimica e della Chimica Fisica, le quali si servivano di differenti altre procedure d’indagine. Successivamente, però, con la miglioria delle tecniche di microscopia ottica e soprattutto con l’avvento della microscopia elettronica, “ambiti di studio” come il suddetto entrarono pienamente a far parte della Istologia. Oggigiorno, è possibile effettuare una ulteriore classificazione che ci consente di collocare l’Istologia in un campo di interesse a metà tra quello della Chimica biologica e quello della Anatomia. La Istologia, al contrario, può essere suddivisa in tre branche, a seconda del particolare campo di interesse a cui si rivolge: 1) Microscopico. Ci si serve di strumenti come i cosiddetti “microscopi a luce”, che hanno un campo di interesse che va dai 0,2 µ (2000 A) ai 0,15 µ (1500 A), cioè dalla Luce Ordinaria alla Luce U.V. 2) Submicroscopico. Il campo di interesse questa volta è indirizzato alle cosiddette microstrutture (ad es., l’apparecchio membranoso) e ci si serve dei cosiddetti “microscopi elettronici a trasmissione” (TEM), che hanno un range di risoluzione di 0,002-0,001 µ (20-10 A). 3) Macromolecolare. Si occupa dell’analisi di strutture realmente molto piccole (come il citoscheletro), e quindi con una capacità di risoluzione inferiore ai 10 A, consentita solo dall’utilizzo dei cosiddetti “microscopi elettronici ad alta tensione”. Vediamo, adesso, di dare qualche altra definizione generale. - Cellula. “Unità elementare di sostanza vivente dell’ordine di grandezza microscopico”. - Citodifferenziazione. “Processo di acquisizione graduale di caratteristiche strutturali e di attitudini funzionali, proprie di ciascun citotipo”. Molti organismi pluricellulari, infatti, possiedono un’importantissima caratteristica strutturale, che prende il nome di pleiotropismo, ovvero la eterogenea presenza di cellule citotipicamente differenti. E tale differenza, che quindi determina il pleiotropismo, è determinata da quel graduale processo che abbiamo definito di citodifferenziazione, Ci si potrebbe chiedere, infatti: come mai dalle cosiddette “cellule staminali” (lo zigote), si originano poi cellule così diverse, come sono quelle caratterizzate da pleiotropismo di un soggetto biologicamente evoluto, come l’uomo? In quanto le “cellule staminali” sono totipotenti, cioè presentano già in potenza tutti i molteplici indirizzi istogenetici che poi gradualmente si reprimono e si sviluppano, con il processo cosiddetto della citodifferenziazione. In particolar modo, lo zigote, che è una cellula totipotente, può condurre essenzialmente a due differenti processi evolutivi: 1) Cellule somatiche. Cioè, tutte quelle cellule che, da un punto di vista morfologico e funzionale, presiedono alla costruzione del soma. (Ed è interessante notare, a tal proposito, le molteplici caratterizzazioni patologiche che possono venire a presentarsi. Ad es., per le cellule tumorali è come se si ripercorresse al contrario il normale processo di evoluzione e cioè di differenziamento delle cellule staminali. E a riprova di ciò, si può notare come la stessa terminologia risulta essere particolarmente affine. Si parla, ad es., di amitosi (riproduzione delle cellule tumorali) piuttosto che di mitosi (riproduzione delle cellule normali). Al posto di “differenziamento” si parla di sdifferenziamento, per intendere: “L’attitudine moltiplicativa molto intensa delle cellule tumorali che ricorda quella delle cellule embrionali”. 2) Cellule germinali. Cioè, i gameti: la cellula uovo e lo spermatozoo. Quindi, è come se il concetto di Sdifferenziazione debba intendere specularmente quello di Differenziazione. Tutte le suddette affermazioni, ci conducono a due corollari di fondamentale importanza: 1) L’apprendimento non soltanto dell’organizzazione morfologia delle varie strutture di interesse istologico, ma anche il loro risvolto funzionale (è facile capire, infatti, che, in linea generale, un cattivo funzionamento corrisponde a una cattiva struttura, e viceversa). 2) La proprietà fondamentale di ogni elemento strutturale che acquisisce funzioni e strutture ad esso congeniali. Cioè a dire, il concetto della citodifferenziazione per cui, da cellule staminali totipotenti è possibile evolvere verso due diversi destini istogenetici con competenze morfofunzionali assolutamente diverse: la linea delle cellule somatiche e la linea delle cellule germinali (che consentono la perpetuazione della specie). - Anaplasia. “Proprio di cellule, come quelle tumorali, che già differenziate in ben determinati citotipi, che, in seguito a un processo di Sdifferenziazione, ripercorrono al contrario il processo di Differenziazione, per ricordare più o meno alla lontana, a seconda del grado di atipia, la fisionomia delle cellule staminali”. Alla luce di tutto ciò, è ovvio che cellule come le cellule tumorali abbiano un’evoluzione di tipo anaplastico e atipico, che fa assumere loro una attività moltiplicativa intensissima e assolutamente non funzionale. Il processo di citodifferenziazione è, quindi, un processo piuttosto complesso, se si considera ad es. che esistono circa 200 citotipi costitutivi della nostra mole somatica. Ma le cellule, una volta che si differenziano, che destino subiranno? Si ha quella che viene definita una attività mitotica, per cui si produce un innumerevole quantità di cellule figlie con la stessa identità morfologica e funzionale della cellula madre. In altri termini, alcune cellule assumono la stessa identificazione morfologica e funzionale. Ed è questo il meccanismo che produce la formazione dei differenti tessuti: si ha la cosiddette istodifferenziazione. Ovviamente, negli organismi unicellulari (che spesso hanno un significato patogeno), tutto è devoluto alla singola cellula che pertanto fallisce nel processo di citodifferenziazione e soprattutto istodifferenziazione. Nell’uomo e negli altri organismi pluricellulari biologicamente evoluti, si ha una vera e propria ripartizione dei compiti in relazione alle varie identità tissutali. E il tutto, come prestazione morfologica e funzionale, confluisce nel concetto di organismo. - Istodifferenziazione. “Processo di acquisizione graduale di caratteristiche strutturali e di attitudini funzionali proprie delle cellule di un determinato territorio”. - Tessuti. “Aggregati di cellule andate incontro a un identico processo di differenziazione morfofunzionale ed aventi la stessa derivazione embrionale”. - Organi. “Associazioni di tessuti che collaborano da un punto di vista funzionale”. Si tratta di entità dimensionalmente maggiori. Per cui, un organo è un’entità politessutale. Ad es., nell’organo polmonare confluiscono più tessuti che hanno fisionomie strutturali diverse le une dalle altre: il tessuto alveolare, in cui si compiono gli atti primordiali della respirazione, cioè gli scambi di ossigeno e di anidride carbonica; il tessuto bronchiale; il tessuto bronchiolare; ecc. E tutti collaborano nel funzionamento globale dell’organo. In realtà, qualsiasi organo rappresenta un’unità pluritessutale. In ogni organo, comunque, riconosciamo essenzialmente 2 tipologie tissutali: 1) Un primo gruppo di tessuti funzionalmente attivi a cui viene direttamente demandata l’attività funzionale e a cui si dà genericamente la denominazione di Parechima. (Per cui, ad es., nei polmoni, il parechima è costituito dai tessuti alveolare e bronchiale). 2) Un secondo gruppo di tessuti è costituito da tessuti, per così dire, “di supporto”, con una “funzione servile”. Tessuti di questo tipo costituiscono lo Stroma. E fanno parte dello stroma i cosiddetti tessuti connettivi a cui si appoggiano topograficamente i tessuti parechimali. Ma una gerarchizzazione di questo tipo fra tessuti parechimali e tessuti stromali è eccessiva e sicuramente imprecisa. Nel tessuto connettivo stromale, infatti, si adempiono funzioni come il rifornimento nutritizio del parechima. Quest’ultimo è costituito, infatti, essenzialmente da tessuti epiteliali, che tuttavia non hanno una base e che debbono essere riforniti dal sangue e dai tessuti connettivi stromali. Inoltre, un gerarchizzazione non avrebbe senso anche da un punto di vista più specificatamente patologico. Esistono, infatti, patologie che interessano tanto il parechima quanto lo stroma, e i loro effetti sono egualmente nefasti. Ad es., l’alveolite (la volgare polmonite) è una malattia del tessuto alveolare, e in questo senso quindi, i tessuti connettivi non sono immediatamente interessati. Al contrario, la fibrosi è una patologia del tessuto connettivo, ma egualmente si hanno ripercussioni sui tessuti parechimali: in seguito all’accrescimento cellulare del tessuto connettivo si ha, infatti, un soffocamento del parechima nobile. E ancora, la cirrosi epatica non è una patologia del tessuto parechimale del fegato, bensì un soffocamento di quest’ultimo in seguito alla proliferazione incontrollata del tessuto stromale. Quindi, una gerarchizzazione non è ammissibile non soltanto da un punto di vista eruditivo, ma anche patologico. - Apparati. “Associazione di organi che pur non presentando analogie di struttura e di origine, collaborano nell’espletamento di un’identica funzione”. E’ importante puntualizzare che alcune patologie che colpiscono direttamente alcuni organi o alcuni tessuti, poi determinano un malfunzionamento dell’intero apparato. - Sistemi. “Associazioni di organi che presentano analogie di struttura, funzione e origine”. (Di conseguenza, la differenza con il concetto di apparato ha un significato puramente eruditivo: nel caso dell’apparato, infatti, non si hanno analogie di funzione, struttura e origine. - Organismo. “Insieme di sistemi (es., il sistema nervoso) e di apparati (es., gastroenterico, cardiovascolare, respiratorio, orinario, scheletrico, muscolare, ecc.). E non è raro avere strette correlazioni fra sistemi ed apparati: basti pensare ai disturbi da somatizzazione dell’apparato gastrico. DIMENSIONI DELLA CELLULA. Il range dimensionale risulta essere sotto questo punto di vista molto ampio: si va da cellule delle dimensioni di 1-2-3 µ a cellule di ben più ragguardevole volume. Ad es., le cellule piramidali del tessuto nervoso di dimensioni di ben 150 µ. Nell’ambito di questa consistente variabilità fisiologica sono stati introdotti 2 corollari. 1) Legge di Driesch. Essa deriva ad esempio dalla constatazione che le cellule di ben determinate organi non sono caratterizzate dimensionalmente dalla mole corporea di provenienza. Ad es., la confrontabilità dimensionale delle cellule epatiche di diversi animali, perché c’è una sorta di costanza della grandezza del volume, che vale per tutti i citotipi e che si esprime con un indice: indice nucleoprotoplasmatico. Esso consiste nella misurazione del valore dimensionale del nucleo nei confronti dell’intero citoplasma. Quindi, il protoplasma estende il suo volume e in conseguenza, mediante un’opportuna attività mitotica, si ristabilisce il corretto e costante valore del rapporto NUCLEO\CITOPLASMA. E’ interessante notare che questa, che altro non è che la legge di Driesch, trova una sua applicazione per buona parte, ma non per tutte le tipologie cellulari della massa molare somatica. 2) Legge di Levi. A differenza delle altre cellule, ad es., le cellule nervose possono variare il loro volume caratteristico in relazione alle variazioni della mole somatica. In altri termini, si stabilisce una proporzione diretta fra la grandezza della mole somatica e la grandezza di queste cellule nervose. Ci possiamo chiedere il perché di ciò e la risposta risiede nella variazione dell’estensione del territorio di innervazione. Dal momento che, infatti, la cellula nervosa è tributaria, con le sue propaggini, delle periferie corporee, all’aumentare di queste dovrà pure aumentare la sua stoffa costitutiva. La ragione risiede in una proprietà particolare delle cellule nervose: esse acquisiscono molto precocemente (già in epoca embriofetale) le loro proprietà morfofunzionali. Ma altrettanto precocemente perdono, rispetto alle altre cellule del soma, le capacità riproduttive. Ecco perché dovrà adeguare il proprio volume, supplendo così alla sua carenza mitotica, proporzionalmente al territorio di innervazione. Tuttavia, il fatto che la riproduttività delle cellule nervose sia molto limitata non deve far pensare che esse non siano in grado di ripopolare un tessuto danneggiato, ad es., da cause morbose: si ha la cosiddetta Neuroplasticità. MOMENTO COSTITUTIVO DELLA CELLULA. PROTOPLASMA. Esso si suddivide in: 1) Carioplasma. Protoplasma che riempie l’ambiente nucleare. 2) Citoplasma. Protoplasma che riempie l’ambiente endocellulare, dal nucleo all’interno della membrana plasmatica. Lo studio del Protoplasma può essere condotto alla luce di vari aspetti: - Studio fisico-chimico. - Studio chimico. - Studio morfofunzionale. CARATTERIZZAZIONE DEL PROTOPLASMA DA UN PUNTO DI VISTA FISICO-CHIMICO. Esso si definisce: “Sistema colloidale complesso che passa alternativamente dalla fase di Sol alla fase di Gel”. Si tratta della identificazione dello stato fisico-chimico del protoplasma che avvenne nel tempo transeunte che corre tra i primordi della microscopia ottica e l’innovazione della microscopia elettronica. Si concepisce il Protoplasma come uno stato colloidale complesso, una quasisoluzione, in cui la fase disperdente è sicuramente acqua e la fase dispersa è costituita da sostanze che non si miscelano omogeneamente e che costituiscono una sospensione di natura micellare. E’ una soluzione falsa, in cui le micelle iniziano a flottare, a galleggiare. Ovviamente, si stabiliranno dei gradienti di concentrazione. Ora, se il sistema progredisce verso un aumento della fase dispersa si avrà una gelificazione, mentre al contrario, se si avrà una progressione del sistema verso la fase disperdente, si avrà una sua progressiva soluzione. Ecco perché si suole dire che in relazione al traffico di sostanze dall’interno all’esterno delle cellula, e viceversa, si passa alternativamente dalla fase di Sol a quella di Gel, dal momento che si avrà la modificazione delle concentrazioni rispettivamente della fase dispersa e della fase disperdente. La concezione protoplasmatica come sistema complesso colloidale consentì a Frey Wyssling di intuire che queste strutture citoplasmatiche, mediante un’opportuna indagine ai raggi X, risultano essere poste in comunicazione fra di esse stesse. Venne così elaborata l’ipotesi del reticolo tridimensionale di Frey Wyssling. E infatti, diciamo con il senno di poi, che cos’è il citoscheletro? Esso è la “risultante di un insieme di macromolecole disposte in strutture filamentose”. Quindi, una componente del citoscheletro, reticolo microtrabecolare è il costituente del citoscheletro che corrisponde al reticolo tridimensionale. Oggigiorno, è stato dimostrato abbastanza incontrovertibilmente in seguito all’apporto fornito dalle tecniche di microscopia ottica che il concetto del reticolo microtrabecolare rappresenta la concretizzazione molecolare della vecchia ipotesi del reticolo tridimensionale. Ad esso si ascrive tutta una serie di funzioni primigenie il cui danneggiamento può determinare una vasta gamma di patologie cellulari, al punto che la diagnostica moderna individua le cause di molte sofferenze cellulari (che spesso possono determinare un esito anaplastico-tumorale) nelle variazioni o nell’assemblaggio anomalo delle molecole che costituiscono il reticolo microtrabecolare. CARATTERIZZAZIONE DEL PROTOPLASMA DA UN PUNTO DI VISTA CHIMICO. La disamina della componente istochimica ha una notevole incidenza nell’ambito dello studio della prestazione funzionale della cellula stessa. La conoscenza dell’aspetto chimico, infatti, ci consente di ravvisare le modalità caratteristiche fisiologiche e talora anche patologiche cellulari. Le macromolecole organiche, inoltre, non costituiscono entità stabili o cristalizzate, ma entità fortemente dinamiche, in continuo trasformismo da un punto di vista della reattività chimica. Le macromolecole vengono continuamente modificate: esse possono essere scomposte nelle loro componenti chimiche di base e quindi ne deriva una Energia Potenziale (di legame) che può essere trasferita in Energia Attuale. Infatti, il metabolismo cellulare nelle sue fasi costitutive presuppone l’utilizzo di alti quantitativi energetici per l’adempimento di svariate funzioni (come, ad es., la funzione secretiva esplicata da varie tipologie cellulari). Questo del metabolismo cellulare, in effetti, è l’esempio paradigmatico che si suole apporre, un’attività cellulare che richiede un grande dispendio energetico; esso è la chiave di volta che ci consente di comprendere come la cellula, sfruttando l’energia, possa compiere le sue attività; e come, in seguito a un malfunzionamento, si possa compromettere il corretto funzionamento biologico. Il metabolismo cellulare consta essenzialmente di due fasi: l’anabolismo e il catabolismo. Ed infatti, i cataboliti sono i “prodotti di rifiuto” dell’attività metabolica cellulare. Tali reazioni chimiche di tipo metabolico avvengono spontaneamente, sebbene con grande lentezza. Ma in condizioni emergenziali (come intensa attività fisica), per la sollecitazioni di tali attività metaboliche, intervengono entità enzimatiche che fungono da catalizzatori biologici. In alcune condizioni morbose, ci può essere un incremento delle necessità metaboliche e una conseguente risposta di tali attività enzimatiche molto lenta, tardiva: molecole che tardano ad effettuare il loro ufficio catalitico. Ciò potrebbe essere determinato da fattori genici e da una carenza connatale. Fatto sta che le patologie di carenza enzimatica sono molte e ovviamente con una genesi molecolare. Per molte di queste malattie molecolari da un punto di vista terapeutico spesso c’è poco o nulla da fare. In relazione a quanto detto, dunque, si può ben capire che buona parte della fisiologia ed in effetti anche della patologia della cellula dipendono da fattori di tipo esclusivamente chimico. E di conseguenza, conoscere la struttura chimica cellulare è una necessità assolutamente imprescindibile. Caratterizzazione chimica del protoplasma. 1) Componenti inorganici (acqua, sali, ioni…). 2) Componenti organici (glicidi, peptidi, lipidi, enzimi, vitamine ecc.). E’ interessante notare che tutte le tipologie cellulari hanno il loro metabolismo: la presenza dei metaboliti è una nozione funzionale comune a tutte le cellule. Troviamo sempre gli stessi componenti della ruota metabolica, ma, in alcune cellule e non in tutte, è possibile individuare anche delle altre “sostanze specifiche”, in aderenza alla funzione di secrezione, accanto ai metaboliti (che, al contrario, sono sostanze comuni a tutte le cellule). La differenza tra metaboliti e secreti è insita nella peculiarità secernente di alcuni citotipi. 1) Componenti inorganici. Si tratta essenzialmente di acqua e sali che conferiscono al protoplasma la particolare caratterizzazione di “soluzione vera”, infatti i sali disciolti in ambiente acquoso non costituiscono una “dispersione colloidale” dal momento che i sali sono completamente disciolti nel suddetto ambiente acquoso. Inoltre, l’acqua è il costituente percentualmente più cospicuo dell’ambiente cellulare. Essa può trovarsi: - libera in soluzione. - legata a molecole organiche, determinando formazioni cellulari che conferiscono al protoplasma la caratterizzazione colloidale: complessi macromolecolari non completamente disciolti. Le sue principali funzioni, invece, sono: - fungere da solvente. - fungere da componente dei prodotti di rifiuto: i cataboliti. Essi vengono veicolati dall’acqua che, pertanto, ne facilita l’eliminazione. La non eliminazione di tali componenti, infatti, provocherebbe uno stato di sofferenza. Ecco perché mediante l’utilizzo di una terapia farmacologica che sfrutti diuretici e stimolatori si favorisce, in condizioni particolari, l’eliminazione dei cataboliti. - consentire un isolamento termico e in particolar modo fungere da regolatore omeotermico. I sali, al contrario, sono sostanze completamente miscibili in ambiente acquoso. Essi possono trovarsi in forma dissociata e in forma non dissociata. La dissociazione ionica si determina sottoponendo ben determinate sostanze all’azione di un campo elettrico. Con il processo dell’elettroforesi, inoltre, si determina la migrazione degli ioni. Alcuni esempi sono: - i cloroioni (Cl-): sostanze edificate ex novo dalla cellule per fornire prodotti interessanti come l’HCl. - Gli ioni Na+ e K+, la cui concentrazione è critica e deve obbedire a limiti precisi espressi nella pratica clinica in m-equivalenti (ad es., K+ 4-4,5 m-equivalenti). Si parla di transmineralizzazione: la concentrazione all’interno e all’esterno dell’ambiente cellulare deve essere ottimale per non creare squilibri elettrolitici. Si tratta di valori realmente molto piccoli, risibili, ma egualmente di fondamentale importanza. Fra le principali funzioni che essi svolgono: - regolazione degli equilibri acido-base. - stabilizzazione delle concentrazioni cellulari (legandosi a molecole di acqua). 2) - Componenti organici. Glucidi. Proteine. Lipidi. Enzimi (a costituzione in parte proteica e in parte non proteica) vitali per il buono e sollecito espletamento delle funzioni cellulari. - Glucidi. Idrati del carbonio. Composti ternari di C,H,O. Funzione. Eterogenea 1) Energetica 2) Strutturale. Rappresentano le sostanze più facilmente utilizzabili a livello energetico-metabolico. E’ importante precisare, però, che essi esplicano anche funzione strutturale-plastica: essi costituiscono la base di strutture e ultrastrutture protoplasmatica. Classificazione. a) Monosaccaridi. b) Oligosaccaridi (fino a 10 unità monosaccaridiche). c) Polisaccaridi. a) Monosaccaridi. Si classificano in base al numero di atomi di carbonio e in base al gruppo carbonilico (se aldosi o chetosi). I principali esempi sono: Fruttosio; Glucosio; Lattosio; Mannosio. b) Oligosaccaridi. I principali esempi sono: Saccarosio; Maltosio; Cellobiosio. Hanno un’importante funzionalità energetica. Si tratta di polimeri costituiti da corte catene di monosaccaridi, legati con legame glicosidico e succedentisi in sequenze non rigide. Nelle condizioni protoplasmatiche raramente li troviamo in forma libera, ma mediante legami di tipo covalente, legati ad altre formazioni come le proteine: si avrà, pertanto, la formazione di glicoproteine. Essi svolgono essenzialmente funzioni di tipo strutturale nei plasmalemmi (stato limite periferico che contrassegna l’individualità delle singole cellule). O anche, possono costituire alcuni prodotti di secrezione specifica (come, ad es., il muco gastrico) da parte di alcune cellule: quelle del tessuto di rivestimento interno delle cellule dell’epitelio dello stomaco. Un altro esempio è costituito dalle cellule calciformi, disperse nell’ambito dei tessuti di rivestimento. Le cellule calciformi sono anche dette cellule mucipare, con il muco come prodotto di secrezione specifico di questi particolari citotipi. Nell’architettura spaziale delle glicoproteine c’è un filamento centrale proteico che lega varie formazioni oligosaccaridiche. La sede di sintesi di queste formazioni oligosaccaridiche è nelle membrane del complesso del Golgi, in cui si trovano particolari enzimi (glicosiltransferasi) che catalizzano la sintesi degli oligosaccaridi e dei polisaccaridi. c) Polisaccaridi. - Con funzione energetica (Es.: Amido, Glicogeno). - Con funzione strutturale: 1) Nei tessuti animali glucosamminoglicani (GAG), precedentemente denominati mucopolisaccaridi. 2) Nei tessuti vegetali glicomannani (che hanno un’importanza essenzialmente terapeutica). La differenza tra lo sfruttamento energetico di un monosaccaride e quello di un polisaccaride risiede nel fatto che i monosaccaridi vengono immediatamente demoliti. Al contrario, il polisaccaride viene sfruttato tardivamente, in situazioni emergenziali e viene custodito in alcuni parechimi. Un polisaccaride animale è il Glicogeno, concentrato nelle cellule del fegato. L’equivalente delle piante è, invece, l’Amido. Ora, si possono verificare delle patologie da teaurismosi: se le cellule epatiche falliscono nelle loro capacità di glicogenosintesi e non si può applicare un processo di glicogenolisi nelle singole cellule; o anche, nel caso in cui si verifica una glicogenosintesi superiore alle attività di glicogenolisi. Patologie di questo tipo sono, ad es., la glicogenosi, una malattia infantile ed ereditaria di carenza enzimatica dovuta alla incapacità degli enzimi che esercitano la glicogenolisi. - GLUCOSAMMINOGLICANI (GAG). Si tratta di polimeri di disaccaridi (amminozuccheri), acidi uronici e talvolta radicali solfati. Gli esempi più caratteristici sono: - Acido ialuronico. Esplica funzioni particolari nell’ambito di alcuni tessuti. - Acidi condroitinsolforici A e B. Riguardano i tessuti cartilaginei. - Keratansolfato. Riguarda l’epidermide. - Dermatansolfato. Riguarda il derma. - Eparansolfato. - Eparina. Sostanza anche sfruttata commercialmente per scopo anticoagulante. Presente in alcune cellule di tessuti connettivi (mastociti) rientra nel novero dei fattori che regolano i processi coagulativi. Per scopi farmacologici, vengono sintetizzate nei laboratori sostanze che mimano la “forma” dell’eparina e che, pertanto, prendono il nome di eparinoidi. Ad eccezione dell’acido ialuronico, tutti i GAG sono legati covalentemente con una proteina (coreprotein) formando così i Proteoglicani. Sede dei glicosamminoglicani e proteoglicani. Essenzialmente, possiamo individuare 2 possibili sedi per i Glicosamminoglicani e, dunque, anche per i Proteoglicani: 1) Componenti della matrice intercellulare: sostanze interposte tra le cellule di tessuti trofomeccanici. Si definisce “matrice intercellulare” quella sostanza interposta tra le cellule di alcuni tessuti e non di tutti. Mentre le cellule del tessuto epiteliale, infatti, vengono a diretto e mutuo contatto, le cellule di alcuni altri tessuti (come, ad es., in primo luogo, i tessuti connettivi, ovvero, appunto, dei tessuti trofomeccanici) sono separate da sostanze cementanti di matrice intercellulare. A tal proposito, occorre precisare che la matrice intercellulare venne intesa per lungo tempo erroneamente come una componente amorfa. Questa erronea convinzione era determinata dalle deficienze delle passate tecniche di microscopia ottica. Oggigiorno, le recenti tecnologie hanno stabilito che, al contrario, questa matrice intercellulare è essenzialmente costituita da Proteoglicani. E tutto questo, grazie al Microscopico Elettronico ad Alta Tensione che, appunto, ha consentito di individuare questa componente organica che costituisce il metaplasma (la sostanza intercellulare dei tessuti trofomeccanici) in proporzioni maggioritarie è appunto costituita da Proteoglicani. E’ interessante notare che neppure con il TEM (microscopico elettronico a trasmissione) si poterono studiare tali strutture macromolecolari. La dizione “componente amorfa”, dunque, perché priva di strutture visibili, è assolutamente obsoleta e imprecisa. In realtà, anche in passato si distingueva una componente strutturata oltre alla componente amorfa rappresentata da fibre e visibile già con tecniche di microscopia tradizionale e con espedienti quali apposite colorazioni. 2) Componenti del mantello cellulare che sormonta, come una specie di feltro, i bordi apicali di tutte le cellule che fanno parte dei tessuti di rivestimento (es., cellule del tessuto epiteliale). Oggigiorno, sulla base dell’evoluzione delle tecniche di microscopia ottica, si parla di cell coat, a differenza del passato in cui, sulla base delle passate tecniche di microscopia ottica, si parlava di glicocalice. Organizzazione spaziale dei Proteoglicani. E come sono organizzate spazialmente queste macromolecole? Abbiamo già puntualizzato che tutti i GAG, ad eccezione dell’acido ialuronico, sono legati covalentemente con una proteina (coreprotein) formando così i Proteoglicani. A sua volta, una macromolecola di Proteoglicano (che viene, appunto, definita subunità di Proteoglicano) viene a costituire un edificio di dimensioni enormi che è costituito da svariate molecole di Proteoglicani legate a un componente che, abbiamo detto, non si legava ai GAG per formare i Proteoglicani, che è l’acido ialuronico mediante una particolare proteina (proteina A o proteina di legame). Quindi, riassumendo, l’acido ialuronico costituisce un asse portante centrale a cui, mediante l’apporto delle proteine A, si legano i vari Proteoglicani. GLICOMANNANI. Polisaccaride con funzione strutturata di origine vegetale. Esse sono oggetto di studio in quanto tali sostanze possono essere sfruttate nella terapia di alcuni eventi morbosi che riguardano l’uomo. Si tratta di polisaccaridi ramificati che vengono estratti dalle radici di una pianta (Konjak) coltivata in India e in Indonesia. Funzioni dei Proteoglicani. - Idrofilia. Questa è essenzialmente una funzione dei Glicomannani. Si viene a formare, infatti, una massa poltigliosa utilissima da un punto di vista terapeutico. Si somministrano in tutti quei casi in cui c’è un ritardo della evacuazione intestinale (stipsi o stitichezza). Si sostituisce ai lassativi o ai purganti che, a lungo andare, finiscono con il determinare l’irritazione della “membrana mucosa”, cioè della parete interna del colon. L’assunzione di Glicomannani, infatti, agendo su un tratto del segmento colico che è l’ampolla rettale, richiamando acqua, distende i tessuti e determina così i meccanismi fisiologici dell’evacuazione. - Sostegno. Essendo presenti, come abbiamo detto, nel metaplasma dei tessuti trofomeccanici connettivi ed essendo i tessuti connettivi i costituenti della componente stromale dei vari organi ed essendo la componente stromale quella “servile” di sostegno e apporto trofico della componente parechimale, possiamo sicuramente dire che sensu latu i Proteoglicani esplicano un’importantissima funzione di sostegno. - Affinità per il Ca. Importantissimo, perché questo ione esplica il suo particolare ufficio connesso con la contrattilità, in particolare a livello dei visceri e a livello dei vasi. - Attività anticoagulante. Controllo della fluidificazione del sangue e impedimento della formazione di trombi. Esplicano tali funzioni i Proteoglicani derivanti, come abbiamo già detto, dall’Eparina come Glucosamminoglicano, prodotta in particolari tipologie cellulari come i mastociti. In condizioni deficitarie di queste particolari sostanze, si hanno le cosiddette diatasi trombofiliche: tendenza a costituire dei trombi all’interno del sistema cardiovascolare. Alterazioni dei Proteoglicani. - Iper. Un eccesso di deposito determina gravi patologie che prendono il nome di mucopolisaccaridosi. Il gruppo di queste malattie, che coinvolgono l’età infantile, si caratterizzano per il ristagno eccessivo di tali sostanze nelle cellule di alcune tipologie tissutali. - Ipo. Condizioni deficitarie che fanno sentire il loro effetto soprattutto in corrispondenza dei tessuti connetivi articolari e pararticolari, il che comporta una minore funzionalità di tali Proteoglicani malattie artroreumatiche. - Protidi. Composti quaternari costituiti da C,H,O,N. Funzioni. Eterogeneaenergetica e strutturale. I 2 aspetti si invertono rispetto ai glucidi in termini di preminenza. 1) Funzione plastica. Esistono varie Proteine di struttura (dell’apparecchio membranoso del citoplasma) coinvolte nell’edificazione di varie strutture cellulari. 2) Funzione energetica. L’attribuzione energetica alle proteine risiede nel fatto che alcune macromolecole proteiche sono quei catalizzatori biologici che intervengono nel metabolismo cellulare e quindi anche a livello energetico. Si tratta, quindi, di Proteine enzimatiche. 3) Funzioni specifiche. Costituiscono sostanze biologicamente attive. Funzione ormonale. Esistono proteine ormonali ipotalamiche, ipofisarie, tiroidee. (L’ipotalamo è un settore dell’encefalo detto diencefalo. E’ proprio grazie allo studio di questo distretto del cervello che la Endocrinologia fu sostituita dalla Neuroendocrinologia, grazie alle ricerche degli anni ’50 dei coniugi Scherrer che dimostrarono in maniera inconfutabile, nonostante l’iniziale diffidenza degli ambienti scientifici, che alcune cellule nervose sono in grado di elaborare ormoni. Di conseguenza, lo studio delle strutture endocrine deve essere sottoposto, in termini di gerarchia funzionale, al sistema nervoso). L’ormone è un prodotto di secrezione specifica di alcune cellule. A seconda delle modalità di secrezione, i secreti possono assumere diverse connotazioni. L’ormone è un secreto di alcune tipologie cellulari versato direttamente nel cicolo ematico: infatti, si parla di ormone o increto. Pertanto, l’ormone può esplicare la sua azione a distanza. Si tratta di una sostanza molto attiva biologicamente e che esplica la sua azione in condizioni minimali dell’ordine dei picogrammi. La loro carenza, tuttavia, provoca uno squilibrio dello stato di equilibrio del nostro organismo (cenestasi: condizione di benessere). L’Endocrinologia e la Neuroendocrinologia sono le discipline che si occupano dello studio delle cellule ormonopoietiche. Alcuni ormoni sono di natura proteica, altri, vedremo, sono di natura lipidica. Funzione difensiva. Esplicata dalle cosiddette proteine anticorporali. Esse hanno il compito di assicurare i processi di difesa specifica del nostro organismo. Esistono, infatti, fondamentalmente 2 meccanismi di difesa: 1) Meccanismi di difesa specifici. In cui rientrano sostanze di anticorpali di natura proteica che determinano interazioni con gli antigeni mediante movimenti umorali, cioè attraverso il sangue. 3) Meccanismi di difesa aspecifici. Gli anticorpi sono elaborati dalle plasmacellule del tessuto connettivo. Funzione di trasporto transmembranale. Si tratta di proteine carrier scaglionate nelle membrane plasmatiche per finalità di trasporto attivo. Si distingue in proteine canali: adibite al trasporto di sostanze diverse; e proteine pompa: per il trasporto di ioni. Funzione recettoriale. Si tratta di recettori di membrana. Non trasportano sostanze, ma ancorano sostanze di varia natura (es., farmaci), pur non facendole penetrare all’interno delle cellule. Dall’interazione tra queste proteine recettrici e le sostanze che ad esse si legano, si innescano meccanismi molto importanti da un punto di vista biologico. Si ha una condizione molto discriminata e caratterizzata da grande specificità. Struttura. - Struttura primaria: catene polipeptidiche costituite da amminoacidi in sequenze stabili e definite. - Struttura secondaria: struttura spaziale di tipo elicoidale. - Struttura terziaria: ripiegamento ulteriore della struttura secondaria, solo per alcune formazioni proteiche. - Struttura quaternaria: associazione di più molecole proteiche, solo per alcune formazioni proteiche. Classificazione. 1) Proteine semplici. (Es.: Albumine, Globuline, Istoni, Protamine). 2) Proteine complesse o coniugate. 1) Proteine semplici. Albumine. E’ interessante premettere che sussiste un rapporto costante tra la concentrazione di albumine e quella di globuline presente nell’organismo. E una variazione di tale rapporto ha importanti conseguenze patologiche. Sono elaborate dagli Epatociti (le cellule parenchimali epatiche) secondo un ritmo obbligato che deve corrispondere alla loro concentrazione ottimale nel sangue. Sono caratterizzate da un intenso potere idrofilo che esplicano all’interno dei vasi sanguigni. Avevamo, infatti, già discusso di potere idrofilo a proposito dei Proteoglicani. Esse sono responsabili di un importantissimo valore pressorio che prende il nome di pressione oncotica: gradiente pressorio esplicato dalle albumine in relazione alla loro capacità di attrarre acqua. La volemia (volume ematico), infatti, dipende specificatamente, fra l’altro, proprio dalle albumine. Per cui, aumentando la concentrazione delle albumine aumenterà anche il valore della pressione oncotica e, di conseguenza, lo stesso volume ematico. Al contrario, una carenza di Albumine fa inevitabilmente diminuire il gradiente di pressione oncotica, determinando una particolare patologia che prende il nome di iponchia plasmatica. Che cosa avviene? L’iponchia plasmatica comporta una fuga di acqua dall’interno dei vasi alla volta dei tessuti interstiziali, dal momento che questa quantità di acqua non è più opportunamente trattenuta dalla Albumina. Si avrà, pertanto, come detto, l’invasione di alcune cavità organiche: essenzialmente, la cavità pleurica e la cavità addominale, determinando quella manifestazione morbosa che prende il nome di edema. E una manifestazione esplicita di epatopatie, infatti, è dato proprio dalla cosiddetta ascite. Da un punto di vista terapeutico, in passato, si cercava di eliminare la presenza di liquidi mediante apposite punture evacuative (paracentesi). Ma non si raggiungeva lo scopo previsto in quanto, non essendo stata eliminata la causa determinante (e cioè, la carenza di albumine), in tempi più o meno lunghi, si ha la formazione rinnovata di liquido. In altri casi, si interviene mediante terapie sintomatiche che consistono nell’uso di diuretici. Oggi, infine, in maniera ben più ragionata, si interviene con la somministrazione di albumine, pratica che egualmente può presentare pro e contro, come una problematica tolleranza da parte di alcuni pazienti. Infine, abbiamo detto, la pressione oncotica è un concetto molto importante in quanto la concentrazione delle albumine nel siero del sangue è in rapporto costante con la concentrazione delle Globuline. Globuline. A differenza delle Albumine (elaborate dalla quota parenchimale del fegato), le Globuline sono elaborate dalla quota stromale del fegato. Esse rappresentano lo specchio del buon andamento dei processi infiammatori. Si parla, infatti, di una difesa specifica umorale, che si realizza mediante le proprietà anticorpali delle suddette Globuline. Si ha un’attività antagonistica e specifica nei confronti di aggressori che prendono il nome di antigeni. Il tasso di anticorpi è lo specchio dei nostri poteri di difesa. Mediante questi ultimi, infatti, l’organismo difende l’integrità della nostra costituzione somatica. Si possono avere svariate patologie da immunodeficienza, che culminano nell’AIDS. Si ha una nefasta diminuzione di linfociti e plasmacellule, le cellule che producono i vari anticorpi. Esistono, tuttavia, anche patologie da eccesso di sintesi di Globuline, derivante dalla indiscriminata proliferazione delle cellule che costituiscono il connettivo epatico. Questa ipertrofia, questa iperplasia può determinare un eccesso di sintesi delle globuline, che sfocia in malattie come la cirrosi epatica, che comincia con un’intensissima e perniciosa produzione di Globuline e che culmina nel vero e proprio soffocamento del Parenchima epatico. Abbiamo già discusso, a proposito delle Albumine, della costanza del rapporto Albumine\Globuline. Fra le formazioni globuliniche a carattere immunitario, occupano una posizione di riguardo le Immunoglobuline. - IMMUNOGLOBULINE (Ig). Proteine animali di natura globulinica che esplicano un’attività anticorpale di tipo immunitario (difesa specifica). Metodo di studio: Immunoelettroforesi. Campo elettrico applicato a un campione di sangue che determina lo spostamento delle diverse tipologie proteiche (frazionamento) in relazione alla loro carica e alla loro massa. Composizione chimica fondamentale comune. 2 catene polipeptidiche pesanti (catene H: catene high), a PM 50000. 2 catene polipeptidiche leggere (catene L: catene low), a PM 20000. E’ possibile individuare le 2 differenti tipologie di Ig, quella costituita da 2 catene pesanti e quella costituita da 2 catene leggere, mediante la classica procedura di Immunoelettroforesi. E’ interessante questo aspetto del problema da un punto di vista terapeutico, perché esistono alcune malattie molecolari dette “malattie delle catene pesanti” e alcune altre dette “malattie delle catene leggere”. Ciò a dimostrazione dell’estrema specificità con cui si individua l’eziologia di alcune alterazioni macromolecolari caratteristiche. Eterogeneità. Le varie forme immunoglobuliniche, in affermazione della estrema specificità che le caratterizza, sono appunto caratterizzate da un’estrema multiformità che dipende da vari fattori: - Massa molecolare. - Diversa mobilità elettroforetica. - Sede di azione (è questo l’aspetto più studiato. Esso concerne anche le producono, le cellule che secernono questi prodotti specifici. Classi. 1) Immunoglobuline sieriche. Quote presenti nella parte fluida del sangue: plasmao siero. Per la loro sede, sono responsabili della difesa specifica di tipo umorale. Citotipo di sintesi: plasmacellule. Localizzate specificatamente nei tessuti connettivi, hanno un carattere ubiquitario dal momento che i tessuti connettivi sono propri di tutti gli organi. Ne esistono diversi tipi, e le principali sono: IgG, IgA, IgM, IgD, IgE. Nelle varie patologie, possono venire a mancare alcune di queste. 2) Immunoglobuline secretorie. (Sono le ultime acquisizioni istologiche di Ig, cronologicamente parlando). Si ritrovano nelle secrezioni esterne prodotte da particolari cellule esocrine di alcuni tessuti. Fanno parte, quindi, di un sistema che compendia questa attività secretoria: “Sistema immune secretorio” (Secretory Immune System). Citotipo di sintesi: plasmacellule mucosali (che fanno parte delle membrane mucose. Si tratta di lamine costituite da 2 tessuti: tessuto di natura epiteliale sovrastante e tessuto sottostante di natura connettiva. Tipologia bitessutale che ricopre le cavità interne di organi fornite di lume. Es., i visceri o la cavità gastrica. Infatti, la lamina più interna della parete gastrica è la lamina gastrica) e che elaborano una frazione di Ig, frammista a prodotti specifici di secrezione. 3) Immunoglobuline di membrana. Vengono dette Sm-Ig (Surface Membrane-Ig). Abbiamo già parlato di alcune tipologie proteiche che interessano la membrana (Es.: proteine-canali, proteine con funzione recettiva di membrana…), adesso tratteremo di quest’ultima formazione proteica che ha scopi essenzialmente difensivi: sta a fronteggiare alcune aggressioni di carattere antigenico. Cenotipo di sintesi: linfociti B. La specificazione “B” sta per abbreviazione di “Bone”. Essi, infatti, vengono prodotti dal midollo osseo o tessuto mieloide, un organo di natura emopietica. E non a caso, nella circostanza di malattie che interessano i linfociti B (linfomi) siamo in grado di effettuare una tipizzazione delle medesime, non attraverso semplici indagini di tipo morfo-strutturale, dal momento che, in caso di cellule tumorali, si ha una modificazione così estrema della struttura delle cellule normali da rendere praticamente impossibile ogni forma di riconoscimento strutturale, bensì attraverso le specifiche tipologie di SM-Ig che sono secrete dalle stesse cellule tumorali e che, inevitabilmente, ci riportano alle loro precedenti condizioni di normalità. 2) Proteine complesse o coniugate. Classificazione. Nucleoproteine (istoni + acidi nucleici). Gli acidi nucleici costituiscono il rappresentante prostetico di questo tipo di proteine, mentre gli istoni costituiscono il rappresentante proteico di proteine semplici. Di Acidi Nucleici, ne esistono fondamentalmente 2 tipi: 1) Acido Desossiribonucleico (DNA). 2) Acido Ribonucleico (RNA). Esso occupa una sede citoplasmatica e un ruolo di fondamentale importanza nel meccanismo della sintesi proteica. - RNA ribosomiale. Ha concretizzazione morfologica perché presente nei ribosomi. - RNA solubile o di trasporto (transfer). - RNA messaggero. METODI DI VISUALIZZAZIONE ISTOCHIMICA. - Metodo di Feulgen: valido per il DNA. - Metodo di Brachet: valido per l’RNA. Lipoproteine (apparecchio membranoso del citoplasma). In questo caso, il gruppo prostetico è di natura lipidica. Hanno una rilevanza come fattore di rischio delle malattie cardiovascolari. Possono essere di 2 tipi: 1) Lipoproteine di struttura o insolubili. Esse possono costituire lo scheletro compositivo delle membrane cellulari, cristallizate nelle biomembrane o plasmalemmi. Fanno parte anche dei dispositivi membranari che costituiscono l’apparecchio membranoso. In questo senso, hanno essenzialmente funzione plastica. 2) Lipoproteine seriche. Hanno una valenza funzionale perché una loro frazione è presente nel siero del sangue. Anche in questo caso, la quota proteica consente metodi di indagine come l’elettroforesi. Ne esistono varie tipologie: - CHILOMICRONI. Già a occhio nudo, si percepisce che campioni di sangue di individui affetti da ipertrofia chilomicronica assumono un aspetto lattescente, dovuto appunto all’aumento della loro concentrazione. Esse vengono secrete dal Pancreas, un’importante ghiandola del sistema digerente, con la basilare funzione di emulsionare i grassi. Una condizione di morbosità, dunque, evidentemente determina la cosiddette pancreatiti. - VLDL (Very Low Density Lipoprotein). Un eccesso e un ristagno di un loro componente, l’acido urico, determina varie patologie articolari come l’iperuricemia. Talvolta, si può sfociare addirittura nella Gotta, una manifestazione patologica fortemente dolorosa. - LDL (Low Density Lipoprotein). Determinano varie vasculopatie come l’aterosclerosi prematura: un processo di degenerazione delle componenti di un vaso, che coinvolge l’età giovanile. (A differenza dell’arteriosclerosi, che comporta un irrigidimento delle pareti del vaso e che ha un carattere più specificatamente senile). - HDL (High Density Lipoprotein). In condizioni morbose, rischio di malattie cardiovascolari (es., infarto, trombosi…). Mucoproteine: sialomucine. Cromoproteine. Hanno un gruppo prostetico colorato (donde la qualifica). Le più importanti sono: - Emoglobina. Formata da un componente proteica (globina) e da una componente proteica (gruppo eme). Consente la fisiologia della respirazione grazie ad alcune cellule come gli eritrociti. - Emocianina. Analogo vegetale dell’emoglobina da cui si originano i citocromi. - Citocromi. - Lipidi. Caratteristica fondamentale: insolubili in acqua e solubili in solventi organici (es.: xilolo, alcoli, cloroformio, tetracloruro di carbonio). Funzione: eterogenea (energetico-strutturale). Funzione energetica. Entrano nell’ambito dei processi metabolici quando, per motivi patologici, è bloccato il metabolismo glucidico (es., il diabete mellito). Si tratta di fonti energetiche di riserva o di deposito. In questi casi parafisiologici, detti di cachessia, essi sono presenti nel tessuto adiposo sottocutaneo. E l’utilizzo di lipidi a funzione energetica determina come effetto visibile appunto quello del dimagrimento. Funzione plastica. Facenti parte dell’apparecchio membranoso del citoplasma, come costituenti del protolemma. Funzioni specifiche (biologicamente attive). (ormoni surrenalici, ormoni sessuali, acidi biliari e complesso vitaminico D). Lo abbiamo detto, gli ormoni sono sostanze che agiscono in quantità minime, elaborate dalle cellule endocrine. - ORMONI SESSUALI. Sono elaborati da cellule di organi particolari: le gonadi. Si tratta di un organo che, secondo la etimologia del termine, è preposto alla costituzione delle cellule della linea germinale (spermatozoo e cellula uovo). Ma, come detto, le gonadi sono anche costituite da cellule che non hanno niente a che fare con la gametogenesi, ma sono deputate esclusivamente alla produzione di ormoni maschili (androgeni) e ormoni femminili (estrogeni e progestinici). Quindi, le gonadi sono organi a funzione mista. - ACIDI BILIARI. Gli Acidi Biliari, pur non essendo ormoni, sono prodotti di secrezione specifica di alcune cellule che compongono delle vie canalicolari che prendono il nome di vie biliari. Gli acidi biliari rappresentano una quota della Bile: il prodotto dell’attività secretoria dell’organo epatico. Sono adibiti alla digestione dei grassi. Oggigiorno, c’è uno spunto terapeutico interessantissimo. Somministrando acidi biliari, è possibile, infatti, dissolvere alcune concrezioni patologiche di alcune componenti della bile: calcolosi. Si distinguono in: 1) Acidi Biliari Primari. Eliminati fisiologicamente con la bile. (Es.: acido colico e acido chenodesossicolico, coniugati con glicina e taurina). 2) Acidi Biliari Secondari. - Acido desossicolico. - Acido ursodesossicolico per la terapia, come abbiamo visto, di alcune calcolosi, per l’accrescimento delle proprietà solubilizzanti della bile. Si tratta di un “prodotto naturale” che non paventa gli effetti nocivi che sono tipici di tutti i farmaci. Si tratta di un tipo di farmaci endecolidi: prodotti dall’organismo stesso. Esso inibisce, per via enzimatica la sintesi di un componente che nel fegato rappresenta il capostipite di alcuni componenti della bile: il colesterolo. Classificazione. Si basa sul grado di complessità molecolare. Si distinguono in: 1) Lipidi semplici. 2) Lipidi complessi. 1) Lipidi semplici. Prodotti di esterificazione di acidi grassi a basso o elevato numero di atomi di carbonio con alcoli di diversa natura. Si suddividono in: - Gliceridi o grassi neutri. - Ceridi. - Steridi o steroidi. - Esteri di carotenoidi. GLICERIDI O GRASSI NEUTRI. Esteri di acidi grassi superiori con un alcol trivalente (glicerolo). Si formano tre tipologie di gliceridi a seconda del numero alcoli esterificati: - Monogliceridi. - Digliceridi. - Trigliceridi. Il dosaggio dei trigliceridi è la spia del metabolismo dei lipidi semplici: esiste, infatti, un range ottimale al di là del quale c’è una condizione patologica. CERIDI. Acidi grassi con alcoli monovalenti. Si utilizzano in un preparato istologico per favorire la pratica della inclusione, che consiste fondamentalmente in un rapprendimento del ceride e, di conseguenza, un’agevole pratica di sezionamento. Ad es., la paraffine è una sostanza molto utilizzata. STERIDI E STEROIDI. Gruppo di fondamentale importanza biologica. Si tratta di esteri di acidi grassi con alcoli ciclici (detti steroli) Gli steroli sono derivati da un “nucleo chimico fondamentale” che prende il nome di ciclopentanoperidrofenantrene. Derivano da quest’ultimo: - Colesterolo. Un elemento precursore della biosintesi di alcuni steroidi, mediante appositi enzimi detti enzimi della steridogenesi. - Acidi biliari. - Ormoni sessuali maschili e femminili. Prodotto di increzione di organi ghiandolari a funzione mista (ovaio e testicoli): non solo funzione gametogenetica, ma anche ormonopoietica. - Sostanze cardioattive. Sostanze primitivamente estratte da piante (come lo Strofanto officinalis, da cui deriva il gruppo delle strofantine. Vengono utilizzate in caso di insufficienza cardiaca o in caso di deficienza della capacità contrattile. - Complesso vitaminico D. - Ormoni corticosurrenalici. (Infatti, le ghiandole surrenali sono costituite da 2 comparti: la corteccia (da cui vengono prodotti gli ormoni corticosurrenalici) e il midollo. ESTERI DI CAROTENOIDI. Pur essendo pigmenti del regno vegetale, sono costituenti di alcune sostanze di estrema importanza biologica: le vitamine. Ad es., il Retinene: precursore del gruppo vitaminico A (implicato nei processi chimici della percezione visiva oltre che nella pratica dermatologica) e la stessa Vitamina A. Funzioni del Colesterolo. - Trasporto degli acidi grassi nel siero. Il colesterolo ha, infatti, una carica elettrica anfipatica per cui è parzialmente solubile nel sangue e parzialmente negli acidi grassi insaturi che vengono trasportati in forma esterificata. - Precursore degli acidi biliari e di ormoni steroidei. - Composizione della quota lipidica dell’apparecchio membranoso del citoplasma. Esso funge da “stabilizzatore” dei fosfolipidi di membrana (sempre grazie alla sua parziale solubilità in ambiente acquoso): i fosfolipidi, infatti, sono impiegati nella plasticità delle membrane plasmatiche. - Isolante elettrico. La colesterolemia (concentrazione del colesterolo) ha un range ben definito 150220 mg%. Ed in effetti, un valore esterno al range determina condizioni patologiche: le placche aterosclerotiche come patologie di ipercolesterolemia. 2) Lipidi complessi. Esteri di acidi grassi con glicerolo o amminoalcoli, contenti acido fosforico, basi azotate (puriniche e pirimidiniche) e idrati di carbonio (zuccheri). Classificazione eseguita o sulla base delle sedi o sulla natura dei componenti. Fosfolipidi. (glicerolo+acidi grassi+acido fosforico+basi azotate). Es.: - Acido Fosfatico o Acido Glicerofosfatidico. - Fosfatidilinositolo. - Fosfatidiletanolammina. - Fosfatidilcolina o Lecitina. - Fosfatidilserina. - Surfattante alveolare. SURFATTANTE ALVEOLARE. Viene così definita una miscela di fosfolipidi prodotta da particolari cellule dette pneumociti di II tipo, cellule terminali degli alveoli polmonari. Questa miscela di fosfolipidi costituisce un rivestimento parietale interno (si parla di “film”: sottile strato di copertura dell’epitelio degli alveoli, il più semplice degli epiteli di rivestimento. Si parla, infatti, di Epitelio Pavimentoso Semplice: costituito da un singolo strato. E non a caso, poiché un ispessimento determinerebbe una compromissione del processo respiratorio) che si stratifica essenzialmente nel tessuto alveolare e che non impedisce la fisiologia della respirazione, ma anzi è responsabile della tensione alveolare, indispensabile per l’espletamento dei meccanismi di respirazione. Esso, infatti, regola le variazioni volumetriche inspiratorie ed espiratorie, per cui una sua mancanza può determinare una deficienza negli atti respiratori alla nascita: sindrome da membrane ialine, molto studiata in America. In America, addirittura, esistono “banche del surfattante”. Il tessuto placentare contiene grandi quantità di surfattante. Nella pratica farmacologica, il surfattante esplica un’azione di anti-irritante. L’azione del surfattante è valida anche per le vie superiori bronchiali e quelle finitime bronchiolari. Sfingofosfolipidi (classificazione chimica) o sfingomieline (classificazione di sede): (sfingosina, un amminoalcol+acido grasso+acido fosforico+colina). Lo troviamo nella guaina mielinica: struttura fondamentale con funzione di involucro per le cellule neuroniche. Sfingoglicolipidi o Cerebrosidi. (sfingosina+acido grasso+galattosio). Gangliosidi. (sfingosina+acido grasso+esoso+galattosammina+acido neuraminico). L’acido neuranimico, del resto, è un composto di natura specificatamente gangliosidica e tale, dunque, da consentirne un esplicito riconoscimento. Li troviamo nei gangli cerebrospinali: organi del sistema nervoso periferico, costituiti da cellule gangliari. Destino di rimaneggiamento dei Fosfolipidi. Essi vengono metabolizzati, catabolizzati. In altri termini, subiscono una parziale demolizione. I processi di rimaneggiamento hanno costituito un punto di partenza per lo studio dei processi della senescenza cellulare che, in condizioni patologiche, può verificarsi precocemente determinando un danneggiamento parafisiologico ed involutivo di questi costituenti, i fosfolipidi, delle membrane cellulari. Si parla, pertanto, di membranopatie. FOSFOLIPIDI | | | (Fosfolipasi) | | | -- ------- ACIDO ARACHIDONICO---| (Ciclossigenasi) | 1) Prostaglandine 2) Trombossani | (Lipossigenasi) | 1) Leucotrieni ACIDO ARACHIDONICO. Si tratta di un acido grasso superiore, frutto del catabolismo dei fosfolipidi. Abbiamo precedentemente detto che il catabolismo produce in linea di massima “prodotti di rifiuto”, detti appunto cataboliti. In realtà, così non è sempre. In questo caso, infatti, si ha un vero e proprio riciclaggio delle sostanze che da un edificio molecolare complesso, come i fosfolipidi, produce un vero e proprio ciclo metabolico che ha come capostipite proprio l’acido arachidonico. CICLOSSIGENASI. Rende possibile l’attuazione di composti biologicamente importanti come le prostaglandine e i trombossani. Si tratta di un enzima ad azione catalitica della reazione di modificazione dell’acido arachidonico. LIPOSSIGENASI. Rende possibile l’attuazione di composti biologicamente pericolosi, se presenti in quantità massive, come i leucotrieni. Si tratta di un enzima ad azione catalitica della reazione di modificazione dell’acido arachidonico. CORTISONICI. Sostanze ormonali elaborate dalla corteccia surrenale. Utilizzati per scopi terapeutici per le loro proprietà antinfiammatorie. Non c’è capitolo della patologia iatrogena (determinata dagli errori dei medici) che non compendi “effetti indesiderati” che concernono i cortisonici (come il cortisone). In realtà, tuttavia, la denominazione di “effetti indesiderati” è alquanto impropria. Si tratta, infatti, di effetti assolutamente prevedibili alla luce della conoscenza del meccanismo di azione di queste sostanze. Che cosa producono come “effetto collaterale” (che poi è normale)? L’assunzione protratta può determinare lacerazioni gastriche (ulcera, emorragie gastriche…). Ma perché? La risposta risiede nel fatto che essi bloccano l’attività dei fosfolipidi di membrana e quindi la sintesi di acido arachidonico e quindi la produzione di sostanze come le prostaglandine (che, guarda caso, esplicano un’azione protettiva dell’integrità della mucosa gastrica che, pertanto, viene danneggiata dall’azione corrosiva dell’HCl). Come si può porre rimedio? Banalmente, assumendo prostaglandine (che si trovano in commercio). FANS (Farmaci Antinfiammatori Non Steroidei). Si tratta di un gruppo di sostanze che, analogamente ai cortisonici, ma per cause diverse, determina il danneggiamento della mucosa gastrica. Essi, infatti, bloccano la sintesi degli enzimi ciclossigenasi che, a partire dall’acido arachidonico, consente la sintesi delle prostaglandine. LEUCOTRIENI. Esplicano un’azione quasi speculare rispetto alle prostaglandine. Sono coinvolti in processi di spasmo delle vie respiratorie (che sfociano in patologie asmatiche). Ci si serve di sostanze antileucotrieniche che limitano tali conseguenze dovute all’eccesso di leucotrieni. PROSTAGLANDINE. C’è una grande rosa di attività funzionali: - Sistema cardiovascolare (con azione vasodilatante). Sistema nervoso (regolamento delle trasmissioni nervose). Sistema immunitario (ne regolano la prontezza di risposta). Apparato respiratorio (opposta a quella dei leucotrieni: broncodilatante). Sistema endocrino e riproduttivo (usate come farmaci che possono indurre l’aborto perché, assunte in dosi adeguate, determinano una contrazione eccessiva dell’utero). - Apparato urinario. - Processi cancerosi. - Apparato gastroenterico. CARATTERIZZAZIONE MORFOLOGICA DEL CITOPLASMA. Organizzazione strutturale (possibile mediante tecniche di microscopia ottica). Descrizione morfofunzionale delle strutture: - Membrana plasmatica o Plasmalemma. - Citoplasma. - Nucleo. Sulla base delle passate tecniche di microscopia ottica, si pensava che il citoplasma fosse sostanzialmente amorfo (ialoplasma). A causa del limitato potere di risoluzione, infatti, si riusciva a distinguere solo alcune “strutture filamentose scarsamente definite” (come i mitocondri) e che, vedremo, sulla base della più potente microscopia elettronica, verranno ascritte a quello che definiremo apparecchio membranoso del citoplasma. Organizzazione ultrastrutturale (possibile mediante microscopi elettronici a trasmissione e a scansione). La microscopia elettronica amplifica il corredo dell’organizzazione ultrastrutturale: si dice che l’ultrastruttura è l’oggetto d’indagine della microscopia ottica. Si individuò un complesso di entità membranoso che, nel loro insieme, compenetrano la maggior parte del protoplasma, anticamente considerato “componente amorfa”. Queste strutture sembrano rappresentare le propaggini interne, le emanazioni interne della membrana plasmatica. Esistono forme svariate: tondeggianti, irregolari, allungate… Queste ultrastrutture ripetono l’organizzazione morfologica del protolemma del quale, pertanto, sembrano propagazioni. Porta in senso unitario alla presenza di alcune membrane che conducono alla funzionalità dei vari citotipi. - Apparecchio membranoso del citoplasma. Organizzazione macromolecolare (possibile mediante microscopi ad alta tensione e ad alta risoluzione). Si impoverisce ulteriormente, così, il concetto di ialoplasma. - Reticolo microtrabecolare. - Citoscheletro. MEMBRANA PLASMATICA. Struttura che, come tutti gli altri “dispositivi cellulari” ha una sua composizione chimica di base. COMPONENTE PROTEICA. Anticamente, si credeva che le membrane biologiche avessero esclusivamente una composizione chimico-strutturale: in parte lipidica e in parte proteica. Oggi, si dà il giusto peso anche alla componente glicidica (sia pure in diversa proporzione rappresentativa) che entra a pieno titolo e con un alto grado di dignità nella costituzione delle biomembrane. - Proteine totali. 57-63% Proteine semplici. Proteine complesse. Gruppi prostetici costituiti da oligosaccaridi (glicoproteine). COMPONENTE LIPIDICA. E’ quella che, nella storia, è stata maggiormente oggetto di studio. - Lipidi totali. 42% Fosfolipidi. 55% Alcuni obbligatoriamente costitutivi delle membrane plasmatiche (detti, essenziali). I principali sono: - Fosfatidilcolina. Fosfatidiletanolammina. Fosfatidilinositolo. Fosfatidilserina (importante per le cellule nervose). Fosfatidilglicerolo. Acido Fosfatidico. Cardiolipina. Sfingomieline. 17% Importanti per alcune componenti di rivestimento nelle membrane delle cellule nervose: “fibre nervose”. Colesterolo ed esteri. 17% Con funzione di stabilizzazione della quota lipdica. Trigliceridi. 7% Intervengono nella plasticità. Glicolipidi. 4% COMPONENTE GLICIDICA. - Glicidi totali. 2-10%: percentuale sicuramente riduttiva rispetto a proteine e lipidi. Eppure, questa blanda presenza non impedisce un importante ruolo funzionale. Oligosaccaridi legati a proteine (glicoproteine) o legati a lipidi (glicolipidi). Glicosamminoglicani (GAG). Si trovano nelle matrici intercellulari del tessuto connettivo e in quella copertura extracellulare che prende il nome di mantello cellulare (o glicocalice o cell coat). Proteoglicani. Si trovano nel mantello cellulare o glicocalice. La componente proteica è ancorata saldamente alla membrana plasmatica per cui riesce difficoltosa la distinzione fra le proteine di membrana e quelle del glicocalice. Disposizione e posizionamento configurativo e spaziale. (Vedi Figura 1). Osservando la disposizione del Fosfolipide rispetto alla membrana plasmatica, si nota come essi espongono la “testa polare” all’ambiente acquoso endocellulare ed esocellulare ed allontanano la “coda idrofoba”. Pertanto, essi sono allocati perpendicolarmente a un tangente immaginaria della membrana plasmatica. Si può osservare, anche, come il Colesterolo, che ha una caratterizzazione chimica analoga, abbia uguale configurazione. (Vedi Figura 2). Pertanto, si parla di bi-layer o strato bimolecolare, come si può vedere in figura, della componente lipidica che, appunto, volge le teste polari all’esterno e mantiene all’interno le lunghe code apolari. Si vede come i Fosfolipidi siano orientati in maniera perfettamente perpendicolare alla membrana. Configurazione di Davson e Danielli o “modello tradizionale”. (Vedi Figura 3). Si deve aggiungere, tuttavia, alla suddetta componente lipidica, anche una componente proteica (ancora, non si è raggiunto un grado di conoscenza tale da includere anche la componente glicidica). Si hanno le proteine disposte in due frontiere l’una in corrispondenza del versante endocellulare, l’altra in corrispondenza del versante esocellulare, ed entrambe parallelamente rispetto alla tangente immaginaria della membrana cellulare. Quindi, le proteine interagiscono con la “testa” della “forchetta lipidica”. I gruppi polari idrofobi sono rappresentati dalle molecole di acidi grassi. Essi sono rappresentati con linee pieghettate perché insaturi. (Vedi Figura 4). Si parla, pertanto, di “idea del tramezzino”. Ma, fino a questo momento, quando ancora non si perviene alla individuazione della componente glicidica, sussistono varie problematiche nello studio delle funzionalità della membrana plasmatica. Ma la membrana plasmatica non è una “frontiera inerte”: al contrario, con un’attività di selettività bidirezionale c’è un passaggio di sostanze in entrambi i sensi. Secondo questo schema di Danielli e Davson, si potrebbe pensare che possano attraversare la membrana biologica solo “sostanze solubili”. Poiché una condizione di questo tipo è assolutamente inaccettabile, per superare questo impasse, si propose la presenza di pori (entità fisiche reali, dimensionalmente ben definite) che garantiscano il passaggio di sostanze non solubili nei lipidi (che, peraltro, sono la maggior parte). Questa interpretazione crea un’immagine statica, cristallizzata della membrana plasmatica. (Vedi Figura 5). In realtà, però, le immagini della microscopia elettronica sembrerebbero confermare l’ipotesi di Davson e Danielli. Si interpretano i 2 versanti elettron-opachi come componenti proteiche e il frammezzo chiaro come componente lipidica. Tuttavia, questa interpretazione è concettualmente inaccettabile. Ci si servì, allora, di un’altra tecnica: raffreddamento fino a bassissime temperature con N liquido (fino a –180) e fissurazione con lamine molto sottili: tecnica del criodecappaggio. E ciò consentiva, con l’impiego di particolare fissativi, di individuare una qualche ultrastruttura che compenetra lo strato fosfolipidico affondandosi completamente o parzialmente in esso: si tratta di formazioni proteiche. Ipotesi del mosaico fluido di Singer e Nicolson. La tecnica del criodecappaggio portò al secondo modello di membrana. A differenza del modello di Davson e Danielli, le proteine non sono solo estrinseche di membrana, ma anche intrinseche. Ci deve essere una ragione pratica di questo posizionamento non rigido, ma dinamico, plastico. Si attribuiscono particolari prestazioni a queste proteine intrinseche di membrana, per cui il modello dei “pori” viene abbandonato. Le proteine sono in grado di agganciare alcune sostanze e di veicolarle all’interno o all’esterno dell’ambiente cellulare. Si parla, pertanto, di proteine carrier. (Vedi Figura 6). Si vede dal disegno una sorta di “linea centrale” che dà l’idea di un “canale”: in realtà, il canale altro non è che la modificazione della configurazione spaziale delle proteine per l’espletamento delle funzioni di trasporto. Quindi, non si parla più esclusivamente di trasporto passivo, come è quello che determinerebbero i pori. In realtà, oltre a un trasporto passivo (legato al trasferimento, attraverso la membrana, di acqua e componenti disciolte in essa: i sali) , si ha anche un trasporto attivo (c’è un trasporto selettivo che si realizza compiendo un lavoro metabolico). In caso di trasporto passivo, la membrana si comporta come un componente inerte, per cui si realizza un gradiente osmotico. Il trasporto attivo urta con le leggi dell’osmosi, ma ciò comporta un dispendio di energia. Ruolo delle proteine di membrana. Sono indispensabili per il mantenimento dell’integrità strutturale (proteine di struttura) e funzionale delle biomembrane. Sono potenzialmente mutevoli come assetto: esse galleggiano e fluttuano nel mare fosfolipidico. Ciò è reso possibile dal fatto che il “tramezzino lipidico” non è né troppo rigido (per cui, le proteine non avrebbero nessuna mobilità) né troppo labile (per cui, le proteine non avrebbero alcun sito di ancoraggio). Sono ancorate sul versante endocellulare mediante microtubuli e microfilamenti. Si tratta di componenti del citoscheletro, ultrastrutture filamentose piene in un caso (microfilamenti) e vuote nell’altro (microtubuli), responsabili, fra l’altro, della mobilità delle proteine. Talvolta, l’ancoraggio avviene mediante altre apposite proteine. Sul versante esocellulare, i punti di sostegno sono rappresentati dalla componente lipidica con cui le proteine stabiliscono alcune interazioni: non esistono, infatti, glicidi liberi, ma essi sono legati sempre a lipidi o a proteine per formare il glicocalice, costituito da glicoproteine e proteoglicani. Proteine enzimatiche. Attivano il metabolismo di membrana: trasporto attivo. - Adenosintrifosfatasi (ATPasi). - 5-Nucleotidasi. - Disaccaridasi. Sono allocati sul bordo libero delle cellule intestinali. Hanno un ruolo fondamentale nel primo smaltimento degli idrati di C. E questo essenzialmente nei primi mesi di vita post-natale, quando, appunto, consentono l’assorbimento del glicidi, specie dal latte. Tuttavia, spesso, in condizioni patologiche, la cellula non riesce ad attrezzarsi sufficientemente con tali enzimi che non giungono a maturazione. Si hanno, pertanto, tutta una serie di malattie pediatriche che, non a caso, vengono definite “malattie o sindromi di mal assorbimento”: il bambino non soltanto non ricava alcunché dall’assunzione del latte, ma addirittura si ha una condizione di rigetto che si manifesta con il vomito. Mediante prelievi di tipo bioptico di porzioni di tessuti intestinali, si va a vedere se, nelle cellule intestinali, si ha la presenza di disaccaridasi. Talvolta, l’acquisizione piena e la maturazione dei suddetti enzimi arriva con l’età. Ma, se si tratta di carenze enzimatiche congenite, esse sono assolutamente non emendabili, anche mediante terapia. - Adenilciclasi (o Adenilatociclasi). E’ responsabile della ciclizzazione di un composto imparentato con l’ATP, un composto che normalmente ha una configurazione lineare, e che prende il nome di AMP ciclico. Oggi sappiamo che si tratta di un vero e proprio messaggero chimico che opera a livello delle membrane plasmatiche, compendiato dal meccanismo di “trasduzione” dal versante esocellulare al versante endocellulare. E’ importante conoscere questa proteina enzimatica per capire come i messaggi chimici si trasferiscano dall’esterno all’interno dell’ambiente cellulare. Proteine-pompa. Trasferiscono attraverso le biomembrane ioni Na+ e K+, in senso bidirezionale. Si ha un particolare fenomeno che prende il nome di transmineralizzazione (trasferimento di ioni attraverso la membrana plasmatica). La concentrazione deve obbedire a dei valori ben precisi e ben definiti, altrimenti si hanno gravi squilibri ionici. Proteine-canali o trasportatrici o vettrici (carriers). Si comportano come vie selettive di membrana, attraverso le quali fluiscono specifiche sostanze. Proteine giunzionali. Entrano nella costituzione dei dispositivi membranali. Si tratta di ben determinate proteine di membrana a livello di ben determinati distretti tissutali caratterizzati da cellule fra di loro a mutuo contatto (es., le cellule epiteliali), e quindi privi di matrice intercellulare. Si tratta, dunque, di un mezzo di appoggio, di ancoraggio, di giunzione delle cellule suddette, a mutuo contatto mediante tali particolari proteine. In realtà, in alcuni casi, il loro ruolo è ancora più sofisticato: mezzo di comunicazione chimica intercellulare fra cellule che sono a diretto contatto mediante proteine giunzionali. Meccanismi di funzionamento delle proteine di membrana. Ne esistono fondamentalmente 2: 1)Meccanismo della porta chimica girevole. 2)Meccanismo dei pori oscillanti. 1) Meccanismo della “porta chimica girevole”. (Vedi Figura 7). Si tratta di un primo esempio di meccanismo con cui si effettua il passaggio di sostanze attraverso le membrane. Si può vedere come la proteina modifichi la propria struttura. Si ha, pertanto, una vera e propria mutazione conformazionale che consente il passaggio delle sostanze all’interno della cellula e che, poi, fa assumere alla proteina la configurazione iniziale. Tale modificazione è consentita dal “metabolismo energetico” cellulare, dal momento che sono richiesti grandi quantitativi energetici perché la proteina esplichi le sue funzioni. Il sistema, tuttavia, in questo senso, è termodinamicamente sfavorito: sono richiesti quantitativi energetici troppo consistenti. Ecco che, allora, è stato individuato un altro meccanismo di funzione delle proteine di membrana. 2) Meccanismo dei “pori oscillanti”. (Vedi Figura 8). E’ come se vi fosse un “sistema a pinza”: la proteina, infatti, si apre ad una delle due estremità e contemporaneamente si chiude all’altra, e viceversa. In questo senso, il sistema è termodinamicamente più favorito. E questo è, pertanto, il meccanismo più accreditato. Si tratta di modelli che si basano su tutta una serie di condizioni sperimentali. Abbiamo già detto che il malfunzionamento di queste proteine di membrana determina gravi patologie che prendono il nome di membranopatie. Ruolo dei lipidi di membrana. Sono indispensabili per il mantenimento dell’integrità strutturale delle biomembrane delle quali regolano la struttura fondamentale e l’organizzazione molecolare, essenzialmente sotto forma di fosfolipidi polinsaturi essenziali (E.P.L.) che, essendo molecole anfipatiche formano spontaneamente doppi strati (bi-layer lipidico). Ciò consente al tramezzino lipidico di costruirsi da sé ed, entro certi limiti, di rimaneggiarsi se lacerato. Questa, tuttavia, è un’accezione di carattere prettamente generale perché, per la particolare caratterizzazione fisica dei lipidi di membrana che, ad eccezione dei lipidi di delimitazione (che attorniano, inguainano le proteine integrate nella membrana) che hanno un assetto fisico stabile, costituiscono un fluido bidimensionale. La fluidità del corpo lipidico consente l’ancoraggio delle proteine integrate, dal momento che non è né troppo rigido né troppo fluido. Tale particolare condizione è determinata da alcuni particolari fattori, quali: - Temperatura. Regola l’aspetto termodinamico. In caso di temperatura eccessivamente alte si ha un assetto eccessivamente liquido e, al contrario, temperature basse determinano un assetto gelificato. - Grado di insaturità. Numero di doppi legami degli acidi grassi. Si vede che quanto più elevato è il numero di doppi legami tanto più l’assetto diviene fluido. - Presenza del Colesterolo. Ne abbiamo già descritto l’effetto stabilizzante. La mutevolezza dell’assetto fisico del bi-layer consente alle proteine di diffondere liberamente al suo interno. Ciò, inoltre, consente quel rinnovamento che segue il ciclo vitale di tutti i gruppi chimici che vengono sostituiti se le strutture di cui fanno parte sono invecchiate o danneggiate. E ciò si verifica attraverso uno spostamento di gruppi molecolari, che può essere essenzialmente di 2 tipi: (Vedi Figura 9). - Spostamento di lateralità. All’interno del medesimo monostrato, che ha teste adiacenti di Fosfolipidi: tali movimenti sono frequenti perché non richiedono grandi quantitativi energetici. - Spostamento di traslazione verticale. Dall’uno all’altro strato mediante movimenti di giravolta o di flip-flop. Tali movimenti sono più rari, dal momento che, essendo particolarmente complessi, richiedono grandi quantitativi energetici. Il fatto che siano richiesti grandi quantitativi energetici è ulteriormente dimostrato dalla presenza di enzimi specifici che catalizzano le reazioni di metabolismo cellulare (come ad es., la Fosfatidilcolina, un fosfolipide che, per far avvenire movimenti di flip-flop, necessita di un apposito enzima: metiltransferasi). Regolando lo stato di fluidità dei plasmalemmi e, conseguentemente, esercitando un controllo sulla mobilità delle proteine, i lipidi di membrana regolano l’intensità degli scambi bidirezionali attraverso i plasmalemmi. Attivano i sistemi enzimatici ancorati a membrana. Esplicano, in altri termini, una “azione permissiva” sulle proteine enzimatiche che, dunque, senza questi lipidi, non potrebbero essere attivate. Alcuni esempi sono: - β-idrossibutirrico deidrogenasi. Che regola le attività di biosintesi della steridogenesi. - Enzimi della catena respiratoria mitocondriale. - ATPasi. Attivano la sintesi di Prostaglandine. Non a caso, il loro precursore è l’acido arachidonico, il cui metabolismo di sintesi, a sua volta, è regolato dai lipidi di membrana. Agiscono da trasportatori intramembranosi del messaggero chimico che il recettore proteico di membrana (sul versante esocellulare) trasmette all’unità catalitica adenil-ciclasi (sul versante endocellulare). Ruolo dei Glicidi di membrana. Si trovano sempre esposti sul versante esocellulare delle biomembrane, non liberi ma associati a proteine (glicoproteine) o a lipidi (glicolipidi). Intervengono nei meccanismi di riconoscimento tra le cellule e nella caratterizzazione della identità cellulare. Si parla di “teoria del self e del non-self”: riconoscimento di ciò che è consono all’ambiente cellulare da ciò che è ad esso estraneo. In caso di malfunzionamento, si ha la produzione di anticorpi che distruggono le nostre stesse cellule: malattie da autoimmunizzazione. Ad es., “formazioni antianticorpiche” distruggono le cellule del tessuto tiroideo perché fallisce questa particolare funzionalità dei Glicidi. Intervengono nei meccanismi di interazione cellulare, mediante dispositivi di adesione: placche e cappucci. Ad es., le cellule coltivate in vitro aderiscono proprio mediante tali formazioni al fondo del recipiente. Intervengono nei processi di regolazione della crescita cellulare. Intervengono nei processi di divisione cellulare (mitosi). Intervengono nel processo di costituzione del mantello cellulare o glicocalice o cell-coat. (Vedi Figura 10). Struttura di una glicoproteina. Strutture della membrana delle cellule tumorali. Le cellule tumorali cominciano ad alterarsi proprio nell’aspetto strutturale dei suoi componenti di membrana. Si stabilisce un grado di insaturazione eccessivo degli acidi grassi dei Fosfolipidi. Una depolimerizzazione dei GAG. Un disancoraggio delle proteine dalla struttura della membrana. APPARECCHIO MEMBRANOSO DEL CITOPLASMA. L’estensione del citoplasma effettivamente priva di struttura è molto esigua. Ci sono vari dispositivi cavitari, filamentosi… E’ un aspetto di competenza della microscopia elettronica ad alta definizione. Nel corso dell’evoluzione tecnologica, si è, pertanto, passato dal concetto di protoplasma amorfo (ialoplasma) a quello di protoplasma con dispositivi membranari, ultrastrutturali e macromolecolari. Si parla, dunque, di Apparecchio Membranoso: insieme di dispositivi con diversa fisionomia che, collaborando fra loro, esplicano un’importante sinergia funzionale, garantendo la prestazione ultima dell’elemento cellulare a cui appartengono. Questi dispositivi cavitari vengono detti organuli. Tali organuli si scambiano informazioni chimiche ed elementi strutturali. Reticolo endoplasmico. Qualifica attribuita da un ricercatore di nome Porter, in base a ciò che la microscopia elettronica tradizionale consentiva di individuare. Si ha una precisa spiegazione della qualifica: - Reticolo: insieme di strutture filamentose che, nell’ambito delle cellule, rappresentano una costituzione reticolare. - Endoplasmico: identificazione locativa. Nella zona più interna del citoplasma, zona perinucleare. Tali definizioni, molto imprecise, vanno riviste alla luce delle precisazioni attuali della microscopia elettronica. In realtà, non si tratta di una struttura esclusivamente reticolare, ma di un insieme di microcavità appiattite ma disperse nelle tre dimensioni dello spazio, affastellate le une alle altre e comunicanti mediante apposite microvie. Inoltre, non è proprio corretto parlare di “endoplasmicità”: si ha una comunicazione labirintica che si estende dal’endoplasma alla zona immediatamente interna della membrana plasmatica. Si tratta di vere e proprie “scorciatoie” per l’espletamento delle principali funzioni cellulari. Esistono fondamentalmente 2 tipologie di Reticolo Endoplasmico: 1) Reticolo endoplasmico rugoso e granulare. 2) Reticolo endoplasmico liscio o agranulare. 1) Reticolo Endoplasmico Rugoso o Granulare. Si tratta di ampi spazi appiattiti, delimitati da membrana: vere e proprie “valve”. Si ha una condizione di mutevolezza della spazialità tridimensionale. Si parla di struttura granulare perché la superficie esterna della membrana è orlata da strutture minutamente puntiformi adese alla sua struttura: i ribosomi. La presenza di queste strutture rende intuibile la prestazione funzionale: collegata all’andamento della sintesi proteica citoplasmatica: proteine di struttura, ormonali, enzimatiche, vettrici… In realtà, già la microscopia elettronica tradizionale dava l’idea del polimorfismo costitutivo. La rimanente porzione del citoplasma è costellata da altre strutture puntiformi ribosomiali, dette ribosomi liberi. Questa quota di ribosomi liberi trae ancoraggio da strutture che microscopia elettronica tradizionale non consentiva di individuare: il reticolo microtrabecolare. Oggigiorno, per il Reticolo Endoplasmico si parla di ergastoplasma, tralasciando l’accezione di “struttura indipendente” che, in passato, si considerava. Si parla, invece, di struttura caratterizzata da una capacità di sintesi molto intensa (per cui, ad es., si parla di ergastoplasma per le plasmacellule, devolute all’attività di anticorpopoiesi). In questi termini, i processi di protidosintesi inizierebbero proprio nel Reticolo Endoplasmico Granulare. Ed esistono evidenze sperimentali inoppugnabili che dimostrano ciò. Tali processi, tuttavia, in un secondo momento, si trasferiscono, si completano e si perfezionano a carico di altri particolari dispositivi, che esamineremo e che lavorano in maniera sequenziale. Il metodo, la tecnica di indagine che ci consente di affermare ciò consiste nella autoistoradiografia: un processo di marcatura con isotopi radioattivi. In genere, si marcano le unità strutturali fondamentali: gli amminoacidi. Ciò consente di seguire il cammino della sostanza a livello dei vari dispositivi cellulari, ad es. con un contatore Gaiver, dal Reticolo Endoplasmico Rugoso (ergastoplasma) alle altre strutture cellulari. Dopo il Reticolo Endoplasmico Rugoso si ha un passaggio delle strutture proteiche al Complesso del Golgi (che, infatti, si mostra con una condizione di continuità con il Reticolo Endoplasmico). Ed infine, si passa al bordo apicale delle cellule dove si formano i cosiddetti granuli di zimogeno. Si tratta di “materiale proteico quasi confezionato”. Il contenuto, infine, viene riversato all’esterno e rappresenta il prodotto finale proteico. Quindi, la protidosintesi è una funzione condivisa: non assolutamente ascrivibile a un organulo piuttosto che a un altro. 2) Reticolo Endoplasmico Liscio o Agranulare. A questo si sono temporalmente appuntate le ricerche di molti scienziati. In genere, c’è una commistione delle 2 tipologie di reticolo, così come ci può essere un’apparente esclusività che contraddistingue una funzione esaltata o dell’uno o dell’altro. Ad es., durante la sintesi proteica, si avrà una forma esaltata del Reticolo Endoplasmico Rugoso. Di conseguenza, la proporzionalità di presenza dei 2 tipi di Reticolo è dovuta all’indirizzo funzionale della cellula stessa. Esistono particolari metodiche di laboratorio che consentono di esaltare la forma del REL, ad es. somministrando alla cavia da laboratorio particolari farmaci, come i farmaci barbiturici che, se somministrati in dosi massive, inducono un’attività ipnogena intensa ma che, a piccole dosi, determinano un accrescimento del REL. Essi, infatti, agiscono come “induttori del REL” e si dà vita al fenomeno della “induzione enzimatica”. Esiste un gruppo di sistemi enzimatici che potenziano la caratterizzazione morfologica e funzionale dell’organulo, enzimi che hanno specificatamente a che fare con lo smaltimento dei barbiturici. In generale, il farmaco deve essere smaltito velocemente, subito dopo che ha esplicato il suo effetto terapeuticamente utile. Di conseguenza, questi enzimi rientrano nei cosiddetti processi di detossicazione farmacologica. Quanto detto, vale essenzialmente per le cellule epatiche: infatti, lo stesso organulo, in cellule differenziate, può essere indirizzato per svolgere differenti funzioni. Diversa funzionalità esplica, infatti, ad es., il REL delle cellule interstiziali del testicolo: la gonade maschile (organo, abbiamo detto, con duplice funzione: ormonopoiesi e gametogenesi). Queste cellule della quota stromale interstiziale (cellule di Laidig) producono la formazione di androgeni, come ad es. il testosterone, che uno steroide. Qui, infatti, sono presenti gli enzimi della steridogenesi. Altra tipologia ha il REL delle cellule dei tessuti muscolari. Il REL si dispone in correlazione con la prestazione finale delle cellule in cui si trova: la contrattilità. Quindi, questi organuli modificano la propria forma, disponendosi opportunamente, per favorire la contrazione. Si parla di Reticolo Sarcoplasmatico (dal termine “sarcos”, carne, perché, nell’accezione generale, le cellule contrattili costituiscono proprio la nostra massa muscolare). Si organizza in forme a struttura cavitarie, prevalentemente tubolari, adeguate alle unità contrattili delle cellule in senso parallelo: miofibrille. Il REL, pertanto, è disposto in tubuli disposti parallelamente al maggior asse delle miofibrille. Ad intervalli regolari, confluiscono in uno spazio più ampio cavitario che fa parte dello stesso organo (cavità cisternali), trasversalmente rispetto alle miofibrille. Infine, laddove due cisterne si affrontano, c’è un’intercapedine, un interstizio di forma tubolare che non appartiene al Reticolo Endoplasmico, ma che si insinua fra due cisterne e che fa parte della membrana plasmatica interna (sarcolemma). Si costituisce quella che è impropriamente descritta come “triade muscolare”. Ciò serve alla distribuzione di sostanze implicate nei processi contrattili (lo ione Ca++): forma che favorisce la funzione. Proprietà fisiologiche del Reticolo Endoplasmico. Propagazione, concentrazione e metabolismo di sostanze provenienti dall’ambiente extracellulare (mediante i meccanismi già osservati) e nell’ambiente intracellulare (si tratta di uno smistamento delle sostanze che devono essere cedute o distribuite, fra le varie strutture subcellulari. Sostanze caratterizzate da un loro specifico turn-over o metabolismo ciclico, a livello del citoplasma). Partecipa alla sintesi delle proteine, nelle fasi di primo confezionamento (Reticolo Endoplasmico Rugoso). Partecipa alla sintesi dei lipidi, come, ad es., le lipoproteine secrete dagli epatociti (Reticolo Endoplasmico Liscio). Trasporto e smistamento di vescicole contenenti lipidi e proteine neosintetizzate alle varie substrutture cellulari (Reticolo Endoplasmico di Transizione) e di sostanze nel citosol (Reticolo Endoplasmico Granulare e Liscio). Sintesi degli ormoni steroidei (Reticolo Endoplasmico Liscio) secondo il meccanismo della steridogenesi e di sostanze steroidee non ormonali: vitamine del gruppo vitaminico D e Acidi Biliari. Detossicazione farmacologica (il complesso sistema enzimatico che metabolizza i farmaci) in caso di “effetti indesiderati” (ad es., a causa di una somministrazione intensa e prolungata) o di intolleranza. Si parla, infatti, di Drug Metabolization System (Reticolo Endoplasmico Liscio). Partecipa ai fenomeni della contrattilità miofibrillare (dove, le miofibrille sono formazioni filamentose con funzionalità contrattile), mediante particolari enzimi come la ATPasi e lo ione Ca++. Glicosilazione (ad es., in caso di diabete mellito, per cui si ha un blocco del metabolismo glicidico) di alcune sostanze proteiche (Reticolo Endoplasmico Granulare), in particolari situazioni emergenziali. Probabile partecipazione tramite un proteina non ancora identificata al meccanismo di flip-flop. Complesso del Golgi. Assume tale denominazione dal nome di un ricercatore, Camillo Golgi, che lo studiò per tutta la vita, mediante l’utilizzo di particolari coloranti di sua invenzione. Inizialmente, fu definito da quest’ultimo apparato reticolare interno, in ossequio a tutto quel (ben poco) che poteva essere osservato mediante la microscopia ottica. Le identificò (molto imprecisamente), in alcune cellule gangliari (che, evidentemente, presentavano tale formazione ultrastrutturale particolarmente sviluppata, a causa dei partcolari uffici biologici a cui sono preposte) come apposite strutture filamentose, talvolta organizzate in grumi e che, spesso, sembravano interessare anche il nucleo. In realtà, quella di Camillo Golgi era inevitabilmente un’idea falsata perché, ad es., tali strutture non interessano il nucleo, ma passano sul nucleo. Per tutta la vita, Golgi fu osteggiato dagli ambienti scientifici, perché si riteneva che questa ultrastruttura fosse inesistente e unicamente il frutto di una procedura di colorazione imperfetta. La microscopia elettronica degli anni ’50 ha però dato ragione a Golgi, dimostrando che: 1) Il Complesso del Golgi è presente in tutti i citotipi. 2) Esso non è costituito da un insieme semplice di strutture filamentose, ma da un insieme eterogeneo ed articolato di ultrastrutture. Ecco perché oggi si parla più specificatamente di Complesso del Golgi: una struttura molto complicata, propria di tutti i citotipi, frutto della riunione di molte unità ultrastrutturali. Vediamo adesso di identificare alcune tipologie cellulari che presentano una marcata evidenziazione del Complesso del Golgi. CELLULE CALICIFORMI O CELLULE MUCIPARE. Si tratta di cellule secernenti sostanze a composizione essenzialmente carboidratica, che costituiscono il cosiddetto muco. Anche in queste cellule non nervose, Golgi, negli ultimi anni della sua vita, riuscì, servendosi unicamente della microscopia ottica, ad identificare quelle “strutture filamentose del reticolo interno” che, più tardi, mediante la microscopia ottica, verranno ridefinite come Complesso golgiano. Organizzazione strutturale e funzionale del Complesso del Golgi. Questo organulo è il dispositivo citoplasmatico più dinamico. I processi micronelettronici, infatti, lo colgono soltanto in una determinata fase della sua funzionalità, ma esso, in realtà, è costantemente sottoposto a modificazioni nell’ambito della sua composizione ultrastrutturale. (Vedi Figura 1). Come si vede, sono presenti strutture di forme svariate e di dimensioni diverse. Sulla “faccia inferiore” (quella convessa della “struttura a ferro di cavallo”) si ha la presenza di formazioni che, a primo impatto, possono correttamente essere definite microvescicole, per poterle distinguere dalle formazioni egualmente vescicolari, ma dimensionalmente ben più consistenti, sulla “faccia superiore” (quella concava della “struttura a ferro di cavallo”), che definiamo macrovescicole. Inframmezzato e occupante la maggiore estensività è quel settore dell’organulo che sembra essere costituito da cisterne regolarmente impilate e sovrapposte. Inoltre, alcuni dei complessi vescicolari sembrano “liberi”, come se si separassero dalla struttura sacculare cisternaria, altri sembrano estroflettersi direttamente da quest’ultima. Con la microscopia elettronica, si perfezionò l’aspetto tridimensionale. La ricostruzione tridimensionale comportò alcune modifiche sostanziali, ma ribadì anche alcuni dei precedenti concetti: - Rimangono di forma vescicolare le microvescicole e macrovescicole. - Le cisterne, invece, assumono l’aspetto di dischi e sacculi, disposti gli uni sugli altri con una certa estensività. Nella realtà dei fatti, le microvescicole non fanno parte della struttura primigenia del Complesso del Golgi, ma provengono da altre sedi. Esse sono “vescicole di trasferimento” (microvescicole transfert) che si incorporano al primo disco golgiano, detto “disco fermante”. La integrità dei sacculi del Complesso golgiano dipende da un equilibrio di strutture vescicolari che ad esso pervengono e da esso si distaccano. Oltre alle vescicole di trasferimento (in entrata), si hanno grosse vescicole che vengono dismesse quasi fossero strutture di secrezione (in uscita), dette “vescicole di secrezione”. Ecco perché questo organulo è un dispositivo cellulare fortemente dinamico e in continua trasformazione. Ed ecco perché una sua precisa identificazione strutturale risulta essere molto complessa. Le microvescicole provengono da dismissioni del RER. I tubuli terminali del RER, infatti, estroflettono queste piccole vescicole (che trasportano materiale proteico) e che vanno a finire proprio sul Complesso golgiano. Quindi, la sintesi proteica è condivisa dalle due entità: il RER, dove si ha il primo confezionamento delle proteine, e il Complesso del Golgi, dove si assiste ad un ulteriore rimaneggiamento delle medesime. Le formazioni proteiche passano, in un secondo momento, nei dispositivi cisternari. Ed infine, in seguito ad un rimaneggiamento, vengono eliminate mediante “vescicole di exocitosi” (l’exocitosi è una particolare funzione delle membrane delle vescicole e del plasmalemma) che costituiscono i cosiddetti granuli di zimogeno: materiale proteico praticamente ultimato nel suo confezionamento, ben visibile mediante tecniche di microscopia elettronica. Un esempio di questa correlazione si ha nelle cellule del Pancreas. Ma il Complesso del Golgi viene chiamato dall’economia metabolica dei vari citotipi a compiere funzioni autonome nell’ambito del metabolismo glicidico e nella sintesi di materiale glicidico complesso. Si tratta di polisaccaridi e di materiale glicidico ben determinato. E’ interessante fare qualche esempio pratico anche in questo senso. CELLULE CALICIFORMI O MUCIPARE. Sede, lo abbiamo già detto, già alla luce della microscopia ottica, di un Complesso del Golgi particolarmente sviluppato. Si tratta di cellule secernenti. L’apice delle cellule, infatti, è stipato di grosse gocce contenenti materiale polisaccaridico: il muco. Qui, il Complesso del Golgi ripete come estensione quella che caratterizzava l’ergastoplasma nei processi di sintesi proteica. Al contrario, il Reticolo Endoplasmico è assai poco sviluppato. La tecnica che ci consente di trarre tali considerazioni, è la stessa tecnica utilizzata per cellule con RER amplificato: l’autoistoradiografia. In questo caso, tuttavia, non si potrà utilizzare un processo di marcatura che riguarda gli amminoacidi, bensì gli zuccheri semplici. Mediante tale tecnica si può anche seguire il percorso della sintesi dei materiali glicidici: - Nell’animale da esperimento, già dopo 5 min., il materiale glicidico si concentra, sotto forma di microvescicole, nel complesso cisternario del Complesso golgiano. - Circa 40 min. dopo, la reattività si concentra sulle macrovescicole secretorie. - Poi, 4 ore più tardi, la reattività si sposta sui granuli di zimogeno situati sul settore apicale della cellula. Alcuni esempi: CONDROCITI (CONDROBLASTI). A proposito dei polisaccaridi, inoltre, abbiamo parlato di Proteoglicani. Ci sono cellule in alcuni tessuti organici che secernono materiale proteoglicanico. Si tratta di un materiale che, abbiamo detto, è presente nella matrice intercellulare dei tessuti connettivi trofomeccanici, quella che abbiamo definito metaplasma. Si tratta, pertanto, di citotipi caratteristici di tali tessuti che secernono questa componente proteoglicanica polisaccaridica. Ad es., nei tessuti cartilaginei, che sono tessuti connettivi trofomeccanici, si trovano i condrociti che, in uno stato di intensa attività funzionale, vengono detti condroblasti. E appunto, quando spengono la loro attività, si chiameranno condrociti (con uguale accezione, si parla anche di osteoblasti, fibroblasti ecc. Un esempio a parte è dato dagli eritroblasti che, al contrario, sono cellule senza maturità di sviluppo e si adopera tale denominazione perché, a differenza delle altre cellule che nascono e muoiono negli stessi tessuti in cui si trovano, le cellule del sangue nascono in appositi distretti ematopoietici). Il condroblasto edifica GAG: Condroitinsolfato A e B e una parte proteica. FIBROBLASTI. Lo stesso accade in alcune cellule del “tessuto connettivo propriamente detto”: i fibroblasti. Tali cellule generano quella componente strutturata del metaplasma a cui, con la microscopia ottica, si era dato il nome di fibre. Oggi, più accuratamente: i fibroblasti elaborano quel materiale chimico che costituisce le future “fibre del connettivo”, come la molecola del tropocollagene, una glicoproteina. Le singole molecole si appaiano e dalla polimerizzazione si forma la protofibrilla, mentre dalla condensazione di più protofibrille si costituiscono le fibre del connettivo. In questi citotipi, la intensa produzione di polisaccaridi non può non richiedere la costituzione di amplificati Complessi del Golgi. OSTEOCITI (OSTEOBLASTI). Così come le tipologie cellulari precedenti si occupano della sintesi di una componente polisaccaridica a carattere essenzialmente proteoglicanica o glucosamminoglicaniche. SPERMATOZOO. Si ha una struttura apicale cefalica, di nome acrosoma. Si tratta di una grossa vescicola apposta a guisa di cappuccio. E’ il frutto della condensazione, della coalescenza di più vescicole secretorie del Complesso golgiano. Essa contiene enzimi di natura saccaridica che gli consentiranno di realizzare la perforazione, la lisi della membrana della cellula uovo. CELLULE NERVOSE. A livello delle cellule nervose il Complesso golgiano (che, abbiamo detto, essere, se in comunicazione con il RER, volto ad un ulteriore confezionamento dei materiali peptidici che provengono da quest’ultimo; se in lavorio autonomo, volto alla sintesi di materiali di natura polisaccaridica, mediante processi cosiddetti di glicosilazione) svolge un’attività di secrezione di materiali specifici. E anche qui è connesso con altri elementi ultrastrutturali neurocitoplasmatici (il citoplasma delle cellule nervose è così detto), che analizzeremo a tempo debito. Il fatto che le cellule nervose abbiano potere secernente consentì, abbiamo anche detto, intorno agli anni ’50, ad opera dei coniugi Scherrer, di passare dalla restrittiva Endocrinologia (quella branca che si occupa dello studio di specifici prodotti di secrezione che prendono il nome di ormoni o increto) alla Neuroendocrinologia (in base, appunto, all’acquisizione del concetto della potenzialità secernente delle stesse cellule nervose). E le sostanze che possono essere secrete dalle suddette cellule nervose sono sostanzialmente di 2 tipi: 1) Sostanze neurormonali. Proprio come per le cellule endocrine. 2) Sostanze neurotrasmettitrici. Che mediano la trasmissione neuronica. In entrambi i casi, è di fondamentale importanza la potenzialità secernente. Per l’elaborazione di questi materiali, il Complesso del Golgi è congiunto con altri dispositivi cavitari nel neuroplasma, che adesso analizzeremo più specificatamente. Dispositivi cavitari di questo tipo sono, oltre al RER, anche i lisosomi. Tratteremo, in un secondo momento, più specificatamente di questi ultimi organuli. Fin da adesso, tuttavia, diciamo che si tratta di vescicole secretorie riempite di sostanze tipiche a carattere litico. E trattandone la genesi strutturale, si vede che si tratta del frutto di estroflessioni distaccantisi dalla struttura del Complesso del Golgi. Questo rapporto cooperativo tra Complesso del Golgi, RER e lisosomi è maggiormente sentito nel caso della cellula nervosa, per il quale Norikov ha creato un acronimo: GERL complex. Nelle cellule nervose, questi tre dispositivi cavitari e membranari collaborano per la sintesi di neurosecreti (neurotrasmettitori e neurormoni). Si ha quella che viene definita una “sintonia correlativa”. E’ interessante notare che il coinvolgimento dei lisosomi in questo processo contrasta con la “normale” funzionalità del lisosoma: un’attività essenzialmente litica, degradante. Ciò, evidentemente, creò qualche perplessità: è possibile che uno stesso dispositivo presenti da un lato funzioni litiche e dall’altro funzioni sintetiche? In realtà, ciò è il frutto di un processo citodifferenziativo che riguarda, in primo luogo, gli stessi organuli ultrastrutturali cellulari che, a seconda del tessuto di appartenenza, possono svolgere attività diametralmente opposte. Funzioni del Complesso del Golgi. Facciamo, infine, una breve ricapitolazione di quelle che sono le principali funzioni del Complesso golgiano. Concentrazione di sostanze proteiche, mediante: - Microvescicole transfer (uscenti dal RER alla volta del Complesso). - Macrovescicole secretorie (distaccantisi dal Complesso). Concentrazione e sintesi di polisaccaridi e GAG (autonomamente): - Confezionamento dell’acrosoma. - Sintesi della frazione glicidica del muco delle cellule caliciformi. - Sintesi della frazione glicidica in cellule particolari: condroblasta, fibroblasta, osteoblasta. Formazione dei lisosomi primari. Partecipa al riciclaggio dei componenti di membrana (ricava dal RER e cede a sua volta strutture membranarie). Sintesi dei materiali neurosecretori (GERL complex). Lisosomi. Etimologicamente “corpo lisante”, in relazione alla sua attività funzionale di degradazione. Appena scoperti, vennero identificati come microapparati digerenti di cui è disponibile la cellula. Questa attribuzione deriva dalla primaria individuazione di una sostanza a carattere enzimatico che è il “marcatore funzionale” del lisosoma (che la contiene): la fosfatasi acida. Tuttavia, una cognizione di questo tipo, seppur corretta, è alquanto generica è riduttiva. La fosfatasi acida è, infatti, un enzima proteolitico, e dunque caratteristico del metabolismo degradativo, del catabolismo protidico. Ciò indusse, per molto tempo, a pensare erroneamente che il lisosoma avesse unicamente questo ruolo. Oggi, si è a conoscenza di una vera e propria batteria di enzimi, contenuta in esso, protesa anche verso il metabolismo lipidico e glicidico. In sostanza, verso le principali classi macromolecolari esistenti. L’identificazione del lisosoma, come organello cellulare, non si deve, tuttavia, all’Istologia, ma è ascrivibile alla Biochimica. Ci si servì di una particolare tecnica, detta di “ultracentrifugazione su gradiente di densità” (ovviamente, successiva ad una omogeneizzazione, mediante appositi mortai elettrici, della intera struttura cellulare) che consentì, appunto, la scoperta del corpo lisosomiale. Al microscopio ottico, le potenzialità visive sono molto ridotte. Sfugge la membrana (che, rispetto alla membrana cellulare, che presenta una struttura molto più ripetitiva e ben organizzata, rispetto a quella lisosomiale) che presenta un alto livello di semplicità molecolare-strutturale. Riesce nella sua individuazione la microscopia elettronica, identificando il lisosoma come una struttura cavitaria, membranaria, elettron-opaca che contiene enzimi litici. In microscopia ottica, essi vennero individuati mediante la tecnica della transilluminazione a fluorescenza su campo scuro, che li identificava come strutture puntiformi giallastre. Ma, del resto, neanche la microscopia elettronica, consente potenzialità visive di molto maggiori. Venne successivamente individuato un altro metodo che consiste in una marcatura istoenzimatica della fosfatasi acida, che consentì di avere, anche mediante la microscopia ottica, un’idea più fedele del lisosoma. Alcuni esempi di enzimi lisosomiali. Carboidrati (GAG, Proteoglicani, Sfingolipidi): - Acetilglucosaminidasi. - Glucosidasi. - Neuraminidasi. Esteri fosforici. - Fosfatasi acida. - ATPasi. Acidi Nucleici. - Ribonucleasi acida. - Deossiribonucleasi acida. Proteine. - Capsine. - Collagenasi. - Aminopeptidasi. Lipidi semplici e complessi. - Sfingomielinasi. - Glucocerebrosidasi. - Ceramidasi. - Fosfolipasi. - Lipasi acida. Integrità della membrana lisosomiale. E’ importantissimo questo concetto dell’integrità della membrana lisosomiale. Si distingue, infatti, fra lisosoma intatto e lisosoma leso (ovvero, alterato nella struttura e\o nell’attività permeabilizzante della membrana). Nel primo, la tanto indispensabile (in condizioni fisiologiche) quanto pericolosa (in condizioni patologiche, se l’attività lisante è impropriamente esplicata all’interno dell’ambiente citoplasmatico) batteria enzimatica rimane “impacchettata” all’interno della membrana lisosomiale ed è inaccessibile. Nei lisosomi lesi si ha, al contrario, la fuoriuscita degli enzimi lisosomiali, con le funeste conseguenze della solubilizzazione enzimatica citoplasmatica delle attività litiche del lisosoma. In questo caso, infatti, essi attaccano con le proprie attività degradative indiscriminatamente tutte le ultrastrutture cellulari. E ciò fece avere loro la impropria nomea di sacchetti suicidi. Esistono svariate cause di tali alterazioni patologiche: - Radiazioni ionizzanti e radionuclidi (si tratta di metodiche diagnostiche particolarmente impiegate nella pratica clinica. Esse, tuttavia, si è appurato, possono essere anche causa di un danneggiamento dell’integrità della membrana lisosomiale, con le funeste conseguenze che ne derivano). - Omogeneizzazione (quale tecnica di indagine di laboratorio). - Protezione osmotica inadeguata. - Congelamento e scongelamento. - Ultrasuoni. - Batteri, virus, enzimi come la Lecitinasi (contenuta nella saliva dei serpenti, che pertanto è velenosa), alcuni detergenti e alcuni solventi. - Mancanza di ossigeno (ad es., un prelievo di tessuto per una indagine istologica determina la disconnessione del suddetto tessuto dall’insieme vascolarizzato di cui faceva parte e, dunque, un mancato apporto di ossigeno che può essere, in prima istanza, causa della alterazione del lisosoma e, quindi, la necrosi della cellula stessa. Questa condizione, detta di Ipossia o Anossia, è limitata, in laboratorio, mediante la tecnica della fissazione). Significato funzionale dei lisosomi. Eterolisi. Attività degradativa nei confronti di sostanze esterne allo stato corpuscolato o Liquido di sostanze assunte dalla cellula. In questo senso, il lisosoma è un vero e proprio cimitero fisiologico. Tale attività non danneggia la cellula poiché si esplica all’interno dell’organulo stesso. Autolisi. Attività degradativa nei confronti di strutture autoctone, proprie della cellula. In questo senso distinguiamo 2 tipi di autolisi: 1) Autolisi fisilogica. Normale. Nei confronti di dispositivi membranosi endocellulari invecchiati che devono essere sostituiti (non è un processo dannoso, poiché avviene all’interno dello stesso corpo lisosomiale). 2) Autolisi patologica. Anormale: a causa di un’alterazione della membrana lisosomiale. Nei confronti di dispositivi membranosi endocellulari ancora validi, con un attacco indiscriminato. Da qui deriva il concetto del cosiddetto “sacchetto suicida”. Escrezione di pigmenti biliari. La cellula epatica secerne componenti specifici della bile e, nel processo di estrusione dei componenti biliari, intervengono i lisosomi. Si tratta dunque, di una funzione speciale che i lisosomi esplicano all’interno delle cellule epatiche che secernono una componente fondamentale della bile, a patire da una sostanza fondamentale: la bilirubina. I lisosomi, nell’ambito delle cellule epatiche, si occupano del trasporto della bilirubina da un punto all’altro della cellula epatica. (Vedi Figura 2). Le cellule epatiche, come si vede, sono costituite da 2 polarità segnate dai confini della membrana plasmatica. Le cellule epatiche non sono direttamente unite, ma distanziate. Da queste 2 cellule affiancate ha origine un canale che costituisce le cosiddette vie biliari: vie di escrezione dei prodotti delle cellule epatiche. Tali vie epatiche conducono la bile, che ha funzionalità emulsionanti dei grassi, nella seconda sezione del duodeno. La bilirubina viene assunta all’interno delle cellule epatiche attraverso quello che prende il nome di polo ematico, che si affaccia direttamente su un capillare sanguigno in cui si scorre il torrente sanguigno, che ha, fra le sue componenti, anche una quota di bilirubina. La bilirubina, infatti, viene assunta dal circolo ematico. All’interno della cellula epatica, la bilirubina viene processata e coniugata con un’altra sostanza di natura glucidica (acido glucuronico), con la formazione di bilirubinaglucuronite. Tale sostanza viene veicolata all’altro polo della membrana citoplasmatica della cellula epatica, il polo biliare, caratterizzato da una fine pieghettatura che facilita l’espulsione di queste sostanze. Queste attività di trasferimento sono regolate dalla attività dei lisosomi della cellula epatica che si incaricano, appunto, del trasferimento intercellulare di queste sostanze. I lisosomi, all’interno della cellula epatica, occupano la cosiddetta posizione peribiliare: si affastellano, cioè, al di sotto del bordo libero della membrana cellulare che prospetta le vie biliari. Se il meccanismo di trasporto esplicato dai lisosomi fallisce si ha un mancato riversamento della bilirubinaglucuronite. E allora si ha, in un primo momento, un ristagno patologico di queste sostanze all’interno della cellula epatica che determina uno stato di sofferenza e, in un secondo momento, un riversamento all’interno del circolo ematico, tuttavia non di bilirubina vera e propria, bensì di bilirubina coniugata, di bilirubinaglucuronite. Ecco allora che la sintomatologia di ciò è una colorazione anomala giallastra della cute e a livello endoculare, dovuta all’immissione all’interno del torrente circolatorio della suddetta sostanza: l’ittero. Ittero che, dunque, è una manifestazione dello stato di sofferenza, della disfunzione della cellula epatica la cui eziologia consiste, appunto, nella non funzionalità lisosomiale. Dalla analisi di citotipi epatici mal funzionanti, si può manifestamente notare come i lisosomi perdolo la loro funzione. Anziché essere ordinati al di sotto della membrana biliare delle cellule epatiche, i lisosomi si disperdono dando vita a dannosi fenomeni di autolisi. Queste disfunzioni sono ravvisate in seguito alla incongrua somministrazione di farmaci (quindi, per cause iatrogene), come un indebito sovradosaggio, per cui il REL non riesce ad esplicare la sua normale funzione di detossicazione, che pertanto vengono detti “farmaci epatolesivi”. Fra questi, in particolar modo, farmaci utilizzati per psicopatologie come, ad es., gli antidepressivi. Come tecnica diagnostica, ci si serve di quella che consiste in un prelievo di un frammentino di fegato in vivo (biopsia epatica), attraverso cui si può vedere, ad es., se il danno è ascrivibile ai lisosomi. Controllo dell’attività neurosecretoria. Analizzata precedentemente a proposito del Complesso del Golgi (GERL complex). Nelle cellule nervose, i lisosomi svolgono un’altra funzione ancora. Ciò determinò ingenti perplessità interpretative. Ci si chiese, infatti: come mai il lisosoma, che è una ultrastruttura cavitaria ricolma di idrolasi (e cioè, enzimi a carattere idrolitico), può esplicare una attività tanto importante in processi di sintesi dei neurotrasmettitori? In realtà, i neurotrasmettitori sono molecole piccolissime costituite dall’assemblaggio di poche, pochissime unità amminoacidiche. Si parla, infatti, di neuropeptidi. Ora, il fatto è che i lisosomi non esplicano un’attività immediatamente sintetica di tali formazioni oligoamminoacidiche, ma si occupano della demolizione dei grandi edifici proteici da cui esse scaturiscono. Così, indirettamente, a spesa di un coinvolgimento del Complesso del Golgi e del RER, si ha l’allestimento di amminoacidi semplici disposti in pochissime filiere (circa 12), ma che, comunque, costituiscono la grandissima ed eterogenea classe dei neuropeptidi. Ecco che, in questo senso, anche i lisosomi sono responsabili del processo di neurosecrezione. Schema riassuntivo di funzioni e disfunzioni del lisosomi (Vedi Figura 3). Come si vede, il RER fornisce al lisosoma il corpus enzimatico di cui è dotato; il Complesso del Golgi, al contrario, gli fornisce la struttura (esso è, infatti, il prodotto della estroflessione macrovescicolare dalla struttura del Golgi). Il lisosoma primario, successivamente, può avere 3 diversi destini: - Azione eterolitica: 1) Di materiali solidi Fagocitosi. Per cui il lisosoma assume la qualifica di fagolisoma. 2) Di liquidi Pinocitosi. Per cui il lisosoma assume la qualifica di pinolisoma. Si riscontra, nel conseguente processo evolutivo, la formazione di un vacuolo detto corpo residuo, che consiste nel lisosoma che, per funzioni digestive, ha inglobato sostanze esterne alla cellula, sia natura solida che di natura liquida. I materiali rimangono all’interno del lisosoma come cataboliti e vengono successivamente eliminati dal corpo lisosomiale mediante un processo di exocitosi (un processo che, senza alcuna lacerazione della membrana plasmatica, ma mediante una complessa interazione fra la membrana plasmatica e la membrana lisosomiale, consente l’espulsione di tali sostanze). - Azione autolitica: Il lisosoma che ingloba frammenti di strutture cellulari ormai inservibili, divenendo un Citolisoma. Anche in questo caso si dà vita a una formazione vacuolare che prende il nome di vacuolo di accumulo. Anche in questo caso, si ha l’eliminazione dei suddetti materiali di rifiuto sotto forma di cataboliti. - Autolisi patologica: Alterazione che può essere ascritta a svariate cause lesive. La funzione del lisosoma può fallire a livello del fagolisoma o del pinolisoma. In alcune patologie infantili, ci può essere una carenza totale o parziale degli enzimi litici del lisosoma. Si tratta di patologie connatali (le cosiddette malattie da accumulo intralisosomiale), per cui, sostanze che di norma vengono smaltite, si accumulano indebitamente (tesaurismosi) all’interno del corpo lisosomiale. Incidenza di radionuclidi, radiazioni ionizzanti e ultrasuoni sui lisosomi. Le metodiche diagnostiche scintigrafiche impiegano radionuclidi. I radionuclidi sono sostanze che vanno a localizzarsi a livello di vari parenchimi organici (renale, epatico, tiroideo) che, per il loro tropismo caratteristico, danno segno di sé in una mappa che fornisce la configurazione dell’organo con isotopi radioattivi. Ci si serve, nella pratica diagnostica, di diversi radionuclidi (ad es., lo iodio per la tiroide, diuretici marcati per il parenchima renale…). Ma, ci si chiede: tali sostanze sono realmente innocue, come per molto tempo si è creduto, per il paziente che le riceve? Si è ormai dimostrato incontrovertibilmente che, soprattutto in dosi massive, danneggiano gli organi in cui si concentrano. Oggigiorno, infatti, ci serve di radioisotopi non offensivi. In genere, le lesioni che si producono sono reversibili, ma intanto si producono e producono ai lisosomi un danno autolitico di natura patologica. Ci possiamo rendere conto di possibili danni, mediante apposite tecniche istochimiche che rivelano alcuni degli enzimi lisosomiali. E già mediante tali tecniche, si possono ravvisare alcune differenze patologiche dalla condizione di normalità. Solitamente, si marca la fosfatasi acida del lisosomi. In condizioni patologiche, all’inizio si avrà la formazione di microgranuli. Se il processo evolve, in un secondo momento si hanno granuli più dimensionati e, se si procede ancora, si avrà la fuoriuscita all’interno del citoplasma dei vari enzimi lisosomiali. La diagnostica moderna si serve anche ultrasuoni per varie indagini ecografiche: effettuate o in presenza di eventi morbosi o, peggio, durante la stessa gravidanza. Effettivamente, si sono avuti dei responsi che rendono perplessi circa la sicurezza degli ultrasuoni nei confronti dei pazienti. Gli ultrasuoni erano, infatti, normalmente impiegati, nella pratica istologica, per rompere le membrane biologiche (e quindi possono danneggiare anche la membrana dei lisosomi). 20 anni dopo nascono le tecniche ecografiche che sfruttano gli ultrasuoni per scopi diagnostici. Ciò, evidentemente, creò molte perplessità, tanto che in base a uno studio di un Comitato americano opportunamente costituitosi, si è stabilito che: “Gli ultrasuoni possono non rappresentare un rischio per tutti, ma è necessario che ciò venga dimostrato prima che milioni di bambini vi siano esposti. Diversamente sarà come giocare alla roulette russa, ma con la salute dei nostri figli”. I mitocondri. I mitocondri rappresentano, nell’ambito dell’apparecchio membranoso del citoplasma, le prime ultrastrutture cellulari identificate con la microscopia ottica. Furono identificati come “strutture filamentose”. Inizialmente, si parlò di condrioma: costituente cellulare costituito dall’insieme dei mitocondri. Si definì gli stessi mitocondri come condriosomi. E, alla luce del perfezionamento delle tecniche di microscopia ottica, anche di condriomiti (tipo di elemento del condrioma, costituito da una serie lineare di granuli) e condrioconte (nome con cui, nell’apparato del condrioma, si indicano i condriosomi in forma di bastoncelli omogenei o di fibrille). Si tratta di dispositivi cavitari muniti di membrana. E, per essere più precisi, si ha una condizione speculare rispetto ai lisosomi Mentre, infatti, i lisosomi possiedono una struttura membranosa molto semplificata, i mitocondri, addirittura, possiedono 2 membrane. Una membrana esterna che appare continua e un secondo foglietto di membrane interno che forma delle introflessioni, dispositivi in parte in disposizione perpendicolare e in parte parallele al maggior asse dell’organulo che assume un aspetto ellissoidale. Tali formazioni vennero definite creste mitocondriali. Più internamente, si vede anche una matrice: un materiale di aspetto finemente granulare e relativamente opaco; un gel, discretamente viscoso, nel quale si trovano molecole proteiche ad attività enzimatica. I dettagli aggiuntivi forniti dalla microscopia elettronica e, soprattutto, da specifiche tecniche di laboratorio che esamineremo hanno fornito interessanti informazioni circa la componentistica strutturale delle membrane: esse ripetono, scheletrizzate nella loro componentistica, la disposizione delle molecole lipidiche e proteiche del plasmalemma (e sempre più si concretizza, così, il concetto di “membrana unitaria”). Fra le funzioni principali del mitocondrio individuiamo sicuramente la funzione energetica. Sono considerati sedi di sfruttamento energetico, delle vere e proprie “centrali elettriche” in miniatura di cui dispone la cellula per assolvere a tutta una serie, vasta ed eterogenea, di attività biologiche che presuppongono un dispendio energetico e delle quali alcuni esempi caratteristici sono: - Motilità\Contrazione. Attività sintetiche cellulari. Trasmissione degli impulsi. Attività secretoria. Riproduzione cellulare (cariocinesi). Irribitabilità. I materiali entranti ed uscenti sono: ADP+P (forma inattiva) OSSIGENO PROTIDI, GLUCIDI, LIPIDI ATP (forma MITOCONDRIO attiva) ANIDRIDE CARBONICA E ACQUA (materiali combusti) Cicli metabolici. Nell’attività funzionale del mitocondrio, si possono individuare 3 ruote metaboliche. PROTIDI Ciclo di Krebs, detto anche GLICIDI “ciclo degli acidi tricarbossilici” (con eliminazione di anidride LIPIDI (con enzimi Deidrogenanti e carbonica ed elettroni, che Decarbossilanti, che strappano vengono sfruttati dalla successiva acqua e anidride carbonica) ruota metabolica) Catena respiratoria o (con eliminazione di acqua e ossigeno, prodotti di primaria importanza per la cellula) “di trasferimento elettronico” (mediante i Citocromi) Tanto il Ciclo di Krebs quanto la Catena respiratoria convergono nell’ultima ruota metabolica: Ciclo di Krebs Sistema ossidativo mitocondriale Catena respiratoria CICLO DI KREBS. Si tratta della prima ruota metabolica che compendia lo sfruttamento di macromolecole chimiche come i Protidi, i Glicidi e i Lipidi e, mediante “enzimi deidrogenanti” ed “enzimi decarbossilanti”, produce, come prodotti di scarto, anidride carbonica ed elettroni, che verranno sfruttati dal ciclo metabolico successivo. CATENA RESPIRATORIA. A seconda dell’andamento della catena respiratoria, per l’economia della cellula, è possibile avere conseguenze positive o negative. L’ossigeno, infatti, è un elemento fondamentale per la vita della cellula, ma, se presente in concentrazioni anomale, tanto superiori quanto inferiori, può determinare più o meno gravi conseguenze. Ad es., in concentrazioni eccessive, esso può dare vita a specie chimiche fortemente reattive, i radicali liberi, che finiscono per danneggiare la stessa cellula. Si ha il cosiddetto danno radicalico, che finisce per ripercuotersi soprattutto sulle membrane dell’apparecchio membranoso, con uno scombussolamento strutturale che prende il nome di perossidazione lipidica. E’ dalla conseguente alterazione delle membrane plasmatiche e ultrastrutturali che hanno origine i processi di invecchiamento cellulare che, se non fisiologici, possono determinare anche danni gravissimi. Ecco perché l’evoluzione ha fatto sì che gli organismi dispongano di particolari sostanze, denominate scavenger (“spazzini” naturali dei radicali liberi) che, eliminando i radicali liberi, si contrappongono al danno radicalico. SISTEMA OSSIDATIVO MITOCONDRIALE. Terza ruota metabolica del mitocondrio, che sfrutta i prodotti derivanti dai primi 2 cicli. Viene più correttamente detto Sistema della fosforilazione ossidativa, dal momento che si determina uno scambio di radicali fosforici altamente energetici. Generica e tradizionale localizzazione istochimica degli enzimi mitocondriali nella struttura mitocondriale. Matrice. Pochi sistemi enzimatici che hanno a che fare con il metabolismo degradativo dei lipidi. Membrane. Enzimi del Ciclo di Krebs. - Deidrogenanti (specifici per i vari metaboliti del Ciclo: acido succinico, acido fumarico, acido isocitrico, acido malico). - Decarbossilanti. - Diaforasi (che esplicano un’azione permissiva nei confronti delle prime 2 classi enzimatiche. Possono essere attentamente studiati da un punto di vista metabolico. Alcune cellule dell’epitelio dello stomaco, ad es., sono incaricate della produzione di HCl. Tale attività, che fra l’altro è compendiata nell’elenco precedentemente proposto di attività di alto dispendio energetico. Ora, si nota, essendo tali attività connesse con l’attività energetica dei mitocondri e quindi anche degli enzimi che la regolano, una relazione tra la succinodeidrogenasi delle cellule cloridropoietiche e la quantità stessa di HCl prodotta. Ciò può essere sfruttato in maniera realmente interessante per scopi clinici. Ad es., nel caso in cui vi siano patologie caratterizzate da una produzione eccessiva di HCl, come la gastrite, una diagnosi di tipo bioptico potrà far ravvisare un aumento, rispetto ai normali valori di concentrazione, della succinodeidrogenasi perché è necessario un maggior quantitativo energetico per l’espletamento di questa anormale, accresciuta funzionalità metabolica. O, al contrario, in caso di cancro allo stomaco, si avrà una minore produzione di HCl e, di conseguenza, una minore concentrazione di succinodeidrogenasi rispetto ai valori normali). Enzimi della Catena respiratoria. - Citocromo a. - Citocromo a3 (detto citocromossidasi). - Citocromo c. Enzimi della Fosforilazione ossidativa. - Coenzima q. - ATPasi. Precisa localizzazione istochimica degli enzimi mitocondriali nella struttura mitocondriale. A dire il vero, in questo senso, l’indagine micronelettronica, benché l’accresciuto potere di risoluzione, non consente una magnificazione dell’immagine particolarmente più consistente rispetto alla microscopia ottica. Consente unicamente una maggiore percezione della struttura della membrana, con l’utilizzo di ben determinati fissativi e tecniche di laboratorio che consentono di prelevare opportunamente frammentini di membrana. Una tecnica di questo tipo è quella detta della sonicazione, che presuppone l’utilizzo di ultrasuoni. Tuttavia, si tratta pur sempre di un procedimento molto drastico, che tuttavia è stato abbandonato per la drasticità. Oggigiorno, si preferisce il meccanismo di trasporto passivo caratteristico dell’osmosi. Si pongono i mitocondri: - preliminarmente, in un mezzo osmotico a concentrazione bassa, sicché si verifica una prima modificazione della struttura della membrana che prende il nome di osmolisi. - Secondariamente, in un ambiente a tono osmotico elevato. - Ed infine, si applica una “centrifugazione in gradiente di densità”. Si vede che gli enzimi del Ciclo di Krebs sono localizzati sulla membrana esterna. Qui si trovano rilievi proteici in cui sono incastonati gli enzimi caratteristici. Sulla membrana interna sono presenti particelle peduncolate che racchiudono in parte gli enzimi della Fosforilazione ossidativa e in parte quelli della Catena respiratoria e che assumono la denominazione di ribosomi mitocondriali. (Vedi Figura 4). Si vede che si ha una grande base idrofobica, successivamente la struttura denominata Fattore F-0 e quella denominata Fattore F-1, in cui sono contenute le sostanze ad attività catalitica. Si può notare come non sia affatto casuale la dislocazione dei vari enzimi all’interno della struttura ribosomiale, ma secondo un ben preciso criterio logico. Non a caso gli enzimi della prima ruota metabolica (Ciclo di Krebs) sono disposti sulla membrana esterna, mentre quelli delle altre 2 ruote metaboliche successive si trovano sulla membrana interna. Microbodies (Rhodin, 1959) o Perossisomi (De Duve e Baudhuin, 1966). Si tratta di strutture scoperte in tempi relativamente vicini, in quanto sfuggenti alle tecniche di indagine istochimica e suscettibili a ingiusta omologazione ai lisosomi. Sono organuli, infatti, che presentano le stesse dimensioni dei lisosomi, una uguale caratterizzazione membranaria e, addirittura, uguale coefficiente di sedimentazione se sottoposte a tecniche di centrifugazione. Strutture che, tuttavia, come vedremo, presentano un diversissimo corpus enzimatico ed una completa autonomia funzionale. Sono dispositivi cavitari presenti in tutte le cellule eucariotiche (prevalentemente renali ed epatiche), di forma tondeggiante o ovalare (0.5 µ di media), delimitati da membrane semplificate (come i lisosomi). A differenza dei lisosomi non contengono enzimi idrolitici (l’Idrolasi Acida), bensì enzimi ad attività ossidativa (Ossidasi), che impiegano ossigeno molecolare per ossidare vari substrati. Caratteristiche ultrastrutturali. Sono variabili in funzione di vari fattori, come: - La specie animale. - L’organo che li ospita. - La suscettibilità dei diversi substrati ad essere interessati da particolari farmaci. Le affezioni morbose che li caratterizzano prendono il nome di Perossisomopatie. Nei nefrociti e negli epatociti dell’uomo, dello scimpanzé, dei cani dalmata e degli uccelli, i perossisomi appaiono costituiti da una matrice omogeneamente elettronopaca e finemente granulare. Nei nefrociti e negli epatociti di tutti gli altri mammiferi, nel contesto della matrice perossisomica, si visualizza una struttura bastoncellare (nucleoide) di natura cristallina, fortemente elettron-opaca, costituita da un fascio di minuscoli tubuli (che prenderemo in esame, trattando del reticolo microtrabecolare) e che contiene uricasi. (L’uricasi è un enzima chiave nell’ambito del metabolismo purinico, perché l’acido urico è il metabolita ultimo delle basi puriniche). Quindi, alcune specie animali (fra cui anche l’uomo) difettano di uricasi nei microbodies. E allora, in condizioni anomale si possono avere abnormi precipitazioni di acido urico nei tessuti articolari e pararticolari (tofo), che determinano un patologia ad elevato potere algizzante, che è la gotta. Caratterizzazione enzimatica. Enzimi implicati nel metabolismo del perossido di idrogeno (da cui la denominazione di Perossisomi). Le ossidasi perossisomiche, così si chiamano, impiegano ossigeno molecolare per asportare atomi di H da diversi substrati, formando perossido di idrogeno. Al tempo stesso, un altro enzima, la catalasi, utilizza e distrugge perossido di H, formando acqua molecolare. Evitano così pericolosi accumuli intracitoplasmatici di perossido di H, un forte ossidante. I Perossisomi, così, proteggono la cellula da aggressioni ossidative, con Formazione di radicali liberi, responsabili dell’invecchiamento cellulare. Ciò li ha fatti definire “organuli della giovinezza”. Il danno radicalico inizia, abbiamo detto, con un danneggiamento della membrana plasmatica e si conclude con la senescenza dell’intera cellula. Sono questi gli enzimi tradizionalmente noti dei Microbodies. Enzimi implicati nel metabolismo degli acidi grassi a catena molto lunga (2028 C), fino a comparsa di acido palmitico e acido stearico, ulteriormente demoliti dai mitocondri. E’ un processo detto di β-ossidazione ausiliaria, che si realizza in cooperazione con quella mitocondriale. Enzimi implicati nella fase finale della biosintesi del colesterolo (HMG, CoH riduttasi…) e degli acidi biliari (acido colesteronico. La cui fase iniziale inizia nel REL, dove si hanno le fasi iniziali del meccanismo della steridogenesi, e il cui completamento avviene proprio nei Perossisomi). Enzimi implicati nella fase iniziale della biosintesi dei plasmalogeni (Hayra), per cui i Perossisomi sono necessari per lo sviluppo corporeo (vita effimera dei neonati affetti da una turba accrescitiva che prende il nome di sindrome di Zelewenger). (In realtà, molte attività funzionali enzimatiche dei Perossisomi sono state scoperte sulla base del dato patologico. E così, è stato possibile risalire dalla patologia alla fisiologia. Quello della sindrome di Zelewenger non è affatto un caso isolato). Enzimi (d-amminoacidossidasi o destro-amminoacidossidasi) implicati nella desamminazione ossidativa degli amminoacidi. Tali enzimi attaccano gli amminoacidi nella forma destrogira (che non sono quelli naturali). E’ interessante notare che nel metabolismo proteico delle cellule tumorali prevale non a caso la forma destrogira. Enzimi implicati nel ciclo del glicossilato, importanti per le piante e, soltanto per fini patologici, per l’uomo. E’ un ciclo degenerativo, per cui si derivano indebitamente dagli acidi grassi i carboidrati. Enzimi implicati nel metabolismo dell’acido urico. L’uricasi, enzima perossisomico precedentemente introdotto, si occupa della demolizione dell’acido urico, il cui ristagno nelle zone articolari e pararticolari determina la gotta. In questo senso, si è distinto fra organismi a ricambio uricotelico e a ricambio ureotelico. I primi (fra cui l’uomo, lo scimpanzé e i cani dalmata) non sono in grado di demolire l’acido urico, non presentando uricasi. Viceversa, i secondi. Uno spunto terapeutico che può ovviare al deposito di acido urico consiste nello intervenire con farmaci uricosurici, che demoliscono l’acido urico e lo eliminano mediante le vie urinarie. Una somministrazione sconsiderata può, tuttavia, determinare vari effetti collaterali, come il deposito di acido urico nelle stesse vie urinarie (calcolosi). IL TESSUTO EPITELIALE (classificazione generale). Una generica classificazione spesse volte, ma impropriamente, proposta è la seguente. di rivestimento TESSUTO EPITELIALE ghiandolare SEMPLICE Di rivestimento PSEUDOSTRATIFICATO-CILINDRICO STRATIFICATO SEMPLICE Pavimentoso (incluso l’Endotelio) Cubico-ciliato Cilindrico-non ciliato PSEUDOSTRATIFICATO-CILINDRICO Ciliato Non ciliato STRATIFICATO Pavimentoso Cubico Cilindrico Di transizione ENDOCRINO Ghiandolare ESOCRINO ENDOCRINO Tipo cordonale Tipo follicolare ESOCRINO Semplice Tubolare Alveolare Composto Tubolare Alveolare Tubolare-alveolare Questa classificazione, tuttavia, in molti casi risulta essere grossolanamente errata. Ad es., l’epitelio ghiandolare è un epitelio presente in un organo secernente (è corretta la dizione di organo, perché costituito da una morfologia politissutale), che prende il nome di ghiandola. Ora, è vero che l’epitelio ghiandolare è un particolare tipo di epitelio secernente, ma non è affatto vero che ogni epitelio secernente è un epitelio ghiandolare, poiché esistono svariati esempi di epiteli che, pur avendo una funzionalità secernente, non costituiscono certo epiteli ghiandolari. E questo è solo un esempio dei molti che si potrebbero fare. Pur tuttavia, possiamo individuare un connotato morfologico comune a tutti gli epiteli. Connotato morfologico comune a tutti i tessuti epiteliali. In termini piuttosto generici, si dice che le cellule dei vari tessuti epiteliali si caratterizzano per l’essere direttamente e strettamente a contatto, le une alle altre. E cioè a dire, senza alcuna interposizione di sostanza intercellulare. Questa funge da nota discriminante dei tessuti epiteliali rispetto ai tessuti trofomeccanici (dei quali, il tessuto connettivo è solo un esempio) che si contraddistinguono per un dato morfologico esattamente speculare: presenza di matrice intercellulare. Tuttavia, una classificazione di questo tipo ha una valenza puramente didatticoeruditiva. Si è chiarito, infatti, che anche nei tessuti epiteliali si ha la presenza di un insieme di sostanze chimiche disposte all’esterno della cellula e che ricoprono il bordo libero di 2 cellule contigue: le cosiddette giuzioni. Si tratta di meccanismi di un attracco altrimenti non realizzabile. CLASSIFICAZIONE PIU’ CORRETTA DEI TIPI DI TESSUTO EPITELIALE. Si è così osservato che la maniera migliore per distinguere i diversi tipi di epitelio, non è su base unicamente morfologica (fermo restando il carattere morfologico comune, che abbiamo evidenziato), bensì su base funzionale e, più specificatamente, morfofunzionale. Epiteli di rivestimento. Con funzione di copertura, di protezione e di salvaguardia dell’integrità delle cellule che costituiscono l’epitelio stesso e dei tessuti sottostanti. Epiteli secernenti. Tessuti di natura epiteliale, differenziatisi per l’espletamento di una attività secretoria. Si ha, pertanto, l’elaborazione di sostanze specifiche e non dei cosiddetti metaboliti comuni. Abbiamo anche detto che, nel caso in cui l’epitelio secernente, faccia parte della conformazione politissutale che costituisce l’organo di secrezione denominato ghiandola, l’epitelio secernente assumerà la individuazione specifica di epitelio ghiandolare. Ma è un errore quantomai grossolano considerare l’epitelio ghiandolare come l’unica specie di epitelio secernente, perché esistono epiteli secernenti a carattere non ghiandolare. Epiteli sensoriali. Si tratta di un gruppo di epiteli differenziatisi non per eplicare le canoniche funzioni di copertura o quelle specifiche di secrezione, ma di tipologie di tessuti epiteliali coinvolti nei fenomeni di recettività di ben determinati stimoli, spesso chimici, provenienti dall’esterno. Questa “irritabilità” è peculiare anche della cellula nervosa, ma è grave errore confondere una cellula del tessuto epiteliale con la ben più caratterizzata e complessa cellula nervosa. Ciò che differenzia una cellula nervosa da una cellula del tessuto epiteliale di rivestimento è che quest’ultima condensa, accumula gli “stimoli di senso”, ma, a differenza della cellula nervosa, non li può trasmettere autonomamente. Epiteli particolarmente differenziati (detti anche, derivati epiteliali). Subiscono un grado talmente spinto di differenziazione che, all’occhio inesperto, potrebbero anche apparire come tessuti non epiteliali. Un es., caratteristico potrebbe essere lo smalto, un tessuto di rivestimento del dente che è, appunto, di derivazione epiteliale. O ancora, una struttura che fa parte del nostro bulbo oculare: il cristallino. PIANO DI ORGANIZZAZIONE DEGLI EPITELI DI RIVESTIMENTO. Ci si può porre, tuttavia, dopo averne effettuato questa primaria classificazione, come siano disposti, nell’organismo, i vari epiteli di rivestimento. Una prima risposta corretta è: solidalmente a un altro tessuto. Infatti, gli epiteli di rivestimento formano con il tessuto sottostante, un tessuto trofomeccanico e quindi connettivo, che esplica un’azione meccanica di sostegno e trofica, una lamina. Il tessuto connettivo sottostante esplica un’azione trofica di apporto nutritizio di cui il tessuto epiteliale di rivestimento necessita, in quanto non vascolarizzato. Al contrario, il tessuto connettivo trofomeccanico, che è interamente percorso da vasi sanguigni. Si ha, pertanto, il passaggio di questo materiale nutritizio preliminarmente al metaplasma e, in un secondo momento, per trasudazione, al tessuto epiteliale di rivestimento. Il tessuto epiteliale di rivestimento riveste superfici esterne e superfici interne di organi cavitati. Si tratta, dunque, di una lamina bitessutale epitelio-connettivale, che, vedremo, assume una denominazione specifica differente, a seconda della sede in cui si trova. Analizziamone, adesso, i vari tipi. - Cute EPIDERMIDE (componente epiteliale) DERMA (componente trofomeccanica-connettiva) Lamina bitessutale (la possiamo compiutamente definire organo in quanto entità politissutale) che riveste la superficie del nostro corpo. Al solito, il tessuto esterno è di natura epiteliale e prende il nome di epidermide, mentre quello più interno, di natura connettivale, assume la denominazione di derma. Non sussiste alcuna caratterizzazione sinonimica rispetto a un’altra entità politissutale, che prende il nome di pelle o tegumento. - Pelle o Tegumento EPIDERMIDE DERMA IPODERMA Come si vede, essa è costituita solo parzialmente dalla cute (che quindi, ne è un costituente) ed ulteriormente da un tessuto sottocutaneo connettivale che prende il nome di ipoderma. Questi prime 2 disposizioni del tessuto epiteliale di rivestimento riguardano essenzialmente il rivestimento della superficie esterna. Abbiamo, tuttavia, già detto che esso si occupa anche del rivestimento delle superfici interne di organi cavitati. Anche in questo caso, troverà una particolare disposizione in lamine politissutali, congiuntamente a tessuti connettivi che esplicano un’azione trofomeccanica. Ora, in questo caso, si dovrà distinguere se: - le cavità siano comunicanti (aperte) - o non comunicanti con l’ambiente esterno. E, nel caso in cui lo siano, se lo sono: - direttamente - o indirettamente. Nel caso in cui, la lamina bitessutale sia comunicante con l’ambiente esterno, si avranno: - Membrane mucose EPITELIO DELLA MUCOSA (quota epiteliale) TONACA PROPRIA o CORION (connettivo epiteliale) In realtà, in Istologia, per corion si può intendere sia la quota connettiva delle membrane mucose sia un annesso embrionale. Ma dove troviamo, ad es., le membrane mucose? Gli organi viscerali sono, per la maggior parte, organi cavitati, e quindi rivestono di un epitelio di rivestimento: - Cavità orale: cavità aperta direttamente. - Faringe: cavità aperta indirettamente. - Esofago: cavità aperta indirettamente. - Stomaco: cavità aperta indirettamente. - Intestino tenue (duodeno, digiuno, ìleo): cavità aperta indirettamente. - Intestino crasso (cieco, colon, retto): cavità aperta indirettamente. - Sfintere anale :cavità aperta direttamente. Tutti questi organi, essendo organi cavitati, avranno una membrana mucosa. Qui si riconosce la stratificazione parietale: l’epitelio è un epitelio di rivestimento che, però, di volta in volta, assume particolari attitudini funzionali. Si è visto che le formazioni neoplastiche a carattere tumorale si originano proprio in segmenti di epitelio di membrana, sia essa mucosa o sierosa. Nel caso in cui la lamina bitessutale sia propria di organi non comunicanti con l’esterno (chiusa), si parlerà di: - Membrane sierose MESOTELIO (parte epiteliale) CONNETTIVO SOTTOMESOTELIALE (parte connettivale) Quindi, abbiamo detto, che riveste cavità chiuse: che non comunicano con l’esterno né direttamente né indirettamente. Mesotelio: un tipo di epitelio del tutto particolare perché, a differenza degli altri tessuti epiteliali che derivano o dall’ectoderma (il più esterno) o dall’endoderma (il più interno) dei tre foglietti germinativi embrionali, deriva dal mesoderma. Ed, in ragione di questa derivazione, se ne spiega il nome. Nella pratica clinica si ricordano i mesoteliomi: tumori che colpiscono il mesotelio. Alcuni esempi di cavità chiuse che dispongono proprio di mucose sierose sono: - Cavità pleurica. - Cavità pericardica. - Cavità peritoneale. Nel caso della cavità pleurica (che ha una sua allocazione nel torace), i limiti sono rappresentati da un lato dalla superficie esterna dei polmoni e dall’altro da quella interna della parete toracica. Nel caso della cavità peritoneale, i limiti sono rispettivamente la superficie esterna degli organi addominali e quella interna della parete viscerale. Ed infine, nel caso della cavità pericardica, il limite interno è rappresentato dalla superficie esterna del cuore e quello esterno dal pericardio. In ogni caso, siamo, tuttavia, come appena visto, in grado di distinguere 2 foglietti delle membrane sierose: - Foglietto viscerale: che aderisce alla superficie esterna del viscere, dell’organo. - Foglietto parietale: che riveste la superficie interna della parete. CLASSIFICAZIONE MORFOLOGICA DEGLI EPITELI DI RIVESTIMENTO. Si ispira a 2 parametri: 1) La forma delle cellule che lo costituiscono. 2) Il numero degli strati che compongono i diversi epiteli di rivestimento. Sulla base della forma si distinguono 3 tipi di epiteli di rivestimento: 1) Epiteli pavimentosi. Assumono tale denominazione, abbiamo detto, in relazione alla forma che delle cellule che lo costituiscono: schiacciate, assottigliate, ad altezza esigua, con superficie ragguardevole, estensiva. Sono cellule morfologicamente molto simili alle mattonelle di un impiantito. 2) Epiteli prismatici. In genere, caratterizzati da cellule di altezza più ragguardevole rispetto a quella degli epiteli pavimentosi. A sua volta, la classe degli epiteli prismatici si differenzia in altre 2 sottoclassi: - Epiteli isoprismatici o cubici. Caratterizzati da cellule con un’altezza equivalente alla base di appoggio, tale da fare assumere loro, appunto, la denominazioni di epiteli isoprismatici o cubici. - Epiteli batiprismatici o cilindrici o colonnari. Caratterizzati da cellule con un’altezza maggiore rispetto alla base di appoggio, tale da fare assumere loro, appunto, la denominazione di epiteli batiprismatici o cilindrici o colonnari. Il nucleo si colloca nella parte mediana-bassa della struttura cellulare. Rivestono superfici mucosali molto importanti da un punto di vista biologico. 3) Epiteli di transizione. Caratterizzati da una forma non inquadrabile in uno schema fisso: hanno, infatti, una forma transeunte, mutevole, in funzione dello stato funzionale del viscere che li ospita. Appartengono specificatamente all’apparato urinario, in qualità di epiteli mucosali, in conformità alla plasticità degli organi che li ospitano. Sulla base del numero e della struttura degli strati che li compongono, le classi epiteliali precedentemente considerate, si diversificano ulteriormemente: - Epiteli pavimentosi SEMPLICI (o monostratificati) COMPOSTI (o pluristratificati) Cheratinizzati Non cheratinizzati (Si deve, tuttavia, nella realtà istologica, correggere la drasticità della classificazione. Ad es., si vede che l’epitelio pavimentoso composto, all’atto pratico, di pavimentoso ha effettivamente ben poco: la forma delle cellule non è così schiacciata, spesse volte, come la dizione di epitelio pavimentoso potrebbe far credere; ma, al contrario, esse hanno spesso una forma isoprismatica o batiprismatica). Si vede che gli epiteli pavimentosi composti o pluristratificati si differenziano ulteriormente in 2 varianti a seconda che si stabilisca una modificazione regressiva, involutiva, fisiologica a livello degli strati superficiali: 1) Cheratinizzazione o Corneizzazione. Si tratta di una continua degenerazione, espoliazione delle cellule degli strati superficiali che la subiscono, muoiono e vengono sostituite. Si ha, pertanto, un’altissima capacità di rinnovamento. Si ha la continua perdita di cellule degli strati superficiali e, allo stesso tempo, un continuo apporto sostitutivo di cellule da parte degli strati sottostanti che, pertanto, ne garantiscono l’integrità. Riguarda l’epitelio di rivestimento della cute: l’epidermide. Quindi, diremo che l’epitelio dell’epidermide è un tessuto pavimentoso, composto, cheratinizzato. Si tratta dell’epitelio di rivestimento a più alto turn-over: ciclo riproduttivo. Ne sono caratterizzati gli strati epidermici costantemente soggetti ad usura, come quelli delle palme delle mani e delle piante dei piedi: zone sottoposte a microtraumi di diversa natura. 2) Non cheratinizzazione. Nel caso in cui le cellule degli strati superficiali non subiscano questa continua modificazione e non siano caratterizzate dal deposito di questa particolare sostanza di natura proteica, la cheratina, che determina un indurimento degli strati cellulari. Ecco, appunto, che tali tessuti vengono definiti “non cheratinizzati” o “molli”. - Epiteli isoprismatici SEMPLICI (o monostratificati) COMPOSTI (o pluristratificati) Quanto detto per gli epiteli pavimentosi, è parimenti proponibile per gli epiteli isoprismatici che sono egualmente differenziati in: - SEMPLICI (o monostratificati). - COMPOSTI (o pluristratificati). - Epiteli batiprismatici SEMPLICI (o monostratificati) COMPOSTI (o pluristratificati) PSEUDOSTRATIFICATI o PLURISERIATI o PLURIFILIARI o A PIU’ FILE DI NUCLEI Alcuni di questi epiteli, appunto, assumono un’ulteriore caratterizzazione rispetto a quelle degli epiteli già analizzati: quella di possibili epiteli pseudostratificati. C’è l’impressione di una stratificazione che in realtà non esiste. Ma che cosa determina tale stratificazione? L’occhio inesperto può essere ingannato dalla diversa altezza a cui si collocano i nuclei, in maniera sfalsata, nelle cellule contigue. Essi sono disposti su più piani, su più file. Ciò può indurre l’occhio inesperto a ravvisare una stratificazione che in realtà non esiste. Ecco perché si parla di pseudostratificazione o pluriseriazione. Tali tessuti sono esclusivi di determinati distretti corporei: le grandi vie respiratorie (le vie bronchiali) che, appunto, sono caratterizzati da un epitelio mucosale pseudostratificato. - Epiteli di transizione POLIMORFI SEMPRE COMPOSTI E’ l’epitelio di un segmento delle vie urinarie: la vescica. E’ quindi l’epitelio della mucosa vescicale. La forma delle cellule dello strato intermedio di questo epitelio è caratteristicamente clavata. Ma la forma si modifica sostanzialmente (donde il nome di epitelio di transizione) a seconda che la vescica si colma di urina o vuota. Si ha, infatti, nel caso in cui la vescica sia colma di urina uno stiramento del tessuto vescicale e le cellule subiscono una modificazione strutturale, stirandosi in senso laterale. Le cellule che subiscono una maggiore modificazione sono appunto le cellule dello strato intermedio. CLASSIFICAZIONE TOPOGRAFICA DEGLI EPITELI DI RIVESTIMENTO. Epitelio pavimentoso semplice. - E. P. S. DEGLI ALVEOLI POLMONARI. Tipologia sottilissima di epitelio che si trova nelle “sacche” finitime delle vie resiratorie, in cui si verificano gli scambi gassosi di ossigeno e anidride carbonica: ematosi. Non a caso, si avrà un epitelio pavimentoso semplice, indispensabile per consentire il meccanismo fisiologico della respirazione. Tanto che un anomalo ispessimento di questo tessuto epiteliali ha conseguenze dannosissime, compromettendo irrimediabilmente il processo. Al microscopio, si può notare come le singole cavità di “sacchi alveolari” siano delimitate da segmenti molto sottili costituiti da epiteli di rivestimento. Al di sotto, scorrono piccoli vasi capillari che assorbono, legano, attraverso l’emoglobina, ossigeno molecolare, mentre la carbossiemoglobina scarica, sempre attraverso di essi, l’anidride carbonica all’esterno. E’ chiaro, dunque, come giochi un ruolo di primaria importanza per l’espletamento degli scambi gassosi, la estrema sottigliezza (si tratta, infatti, di un epitelio semplice) di questo epitelio, che può essere compromessa a causa di affezioni patologiche come la polmonite, meglio detta alveolite e che può concretizzarsi nell’indebito ispessimento del tessuto. Due affezioni patologiche diametralmente opposte sono l’edema (una trasudazione di liquido dai vasi alle cavità alveolari, per cui gli alveoli non garantiscono gli scambi gassosi, essendo inondati di liquido) e l’enfisema (un ristagno di aria. Ma, pur essendo aumentato il volume di aria, si ha una eguale interruzione della funzionalità respiratoria). - E. P. S. DELLA RETINA. Lo strato epiteliale è uno dei ben 10 strati di cui essa è costituita. Qui si creano i presupposti biochimici della percezione visiva: le cellule si riempiono di viamina A, un composto che consente, appunto, il processo biochimico della visione. Analizzando al microscopio le cellule che lo costituiscono, si nota come il citoplasma di ciascuna cellula sia infarcito di granuli, che danno vita a quella che viene comunemente definita porpora visiva. - E. P. S. DELLA MEMBRANA TIMPANICA. E’ disposto perpendicolarmente al condotto uditivo, separando l’orecchio esterno dall’orecchio medio. E’ necessariamente così sottile, perché su di esso impattano le onde sonore. Si vanno così a stimolare altre cellule di natura epiteliale: le cellule degli epiteli sensoriali. In processi patologici che lo riguardano, le otiti, si ha una flogosi della membrana timpanica che, oltre al carattere algizzante, determina una tumefazione dell’organo (ovvero, dei tessuti che lo costituiscono). E un tale ispessimento (come per ognuno degli epiteli precedentemente descritti che risultano, non a caso, essere costituiti da ben determinati tipi di epitelio di rivestimento semplici) determina una deficienza funzionale dell’organo stesso, che prende il nome di ipoacusia, poiché viene appunto meno la caratteristica di esiguità di spessore. - E. P. S. DELLA PARETE DEL LABIRINTO MEMBRANOSO. Caratterizza i distretti più interni dell’apparato uditivo. Qui hanno locazione gli organi che regolano l’equilibrio. - E. P. S. DELLA CAPSULA DI BOWMAN. Organo di primaria importanza per l’eliminazione di sostanze nocive. Si tratta del Glomerulo del Malpighi: un involucro di capillari che, se considerato ricoperto da capsula (come effettivamente è), prende il nome di Capsula di Bowman. Come detto, il glomerulo è un vero e proprio involucro di capillari in cui scorre sangue ricco di sostanze di scarto. Esso è ricoperto da una capsula costituita da 2 foglietti. Il foglietto più interno, quello direttamente a contatto con i capillari, è detto foglietto viscerale ed è appunto costituito, non a caso, da un epitelio pavimentoso semplice. La sottigliezza, infatti, consente il processo della filtrazione glomerulare dei prodotti tossici dal circolo ematico alla zona cavitaria della capsula, costituita dai 2 foglietti, in cui si dice che si riversa la preurina, e attraverso la quale si ha l’immissione della preurina nei tubuli escretori. Affezioni patologiche come le glomerulonefriti o glomeruliti determinano un ispessimento dell’epitelio pavimentoso semplice che costituisce il foglietto viscerale e una compromissione del meccanismo di filtrazione glomerulare che sfocia in un ristagno nel sangue di prodotti tossici. Si determina, allora, una anuria (non viene più prodotta urina) e una uremia (cioè, un ristagno nel sangue di prodotti tossici). Un parametro che consentono di evidenziare un malfunzionamento di questo tipo è, ad es., l’azotemia. - E. P. S. DELLE MEMBRANE SIEROSE (LA QUOTA EPITELIALE DELLA MEMBRANA SIEROSA: IL MESOTELIO). Anche in questo caso, lo spessore esiguo rappresenta un requisito tecnico critico per l’espletamento dell’organo. Quando la pleura (la membrana sierosa che riveste i polmoni e le pareti toraciche), in seguito a un processo infiammatorio che prende il nome di pleurite, si ispessisce, si ha la produzione di un liquido, un essudato, che si raccoglie nel cavo pleurico. I 2 foglietti che la costituiscono, in un primo momento della flogosi, strofinano con conseguenze realmente dolorose, poiché nel connettivo sottomesoteliale si ha una gran quantità di terminazioni nervose. In un secondo momento, a causa della presenza del liquido, i 2 foglietti vengono distanziati: cessa il dolore intenso, ma il sofferente non può respirare a causa della compressione che si viene ad esercitare. In passato, da un punto di vista terapeutico, si interveniva con la dolorosissima pratica della toracentesi. Oggigiorno, si preferisce una accurata terapia farmacologica. Nel caso in cui la terapia sia stata fortunata, si avrà una sinechia: l’adesione dei 2 foglietti. Epitelio pavimentoso complesso. Si distingue in: - Epitelio pavimentoso complesso cheratinizzato: epidermide. Diremo, quindi, che l’epitelio dell’epidermide è cheratinizzato o corneificato. L’epidermide è costituita da più strati che, procedendo dall’interno verso l’esterno sono: 1) “Strato delle cellule basali” o “Strato germinativo” o “Strato germinatore”. E’ continuamente animato da processi riproduttivi. Si tratta dello strato più profondo e viene detto basale perché su di esso poggiano tutti gli altri strati. Le cellule che lo compongono danno vita a tutti i cheratinociti degli strati sovrastanti. Le cellule che lo costituiscono sono alte (cubiche o cilindriche), sono disposte in un solo ordine, con il loro asse maggiore perpendicolare alla superficie dell’epitelio, e poggiano su una sottile membrana basale che separa l’epidermide dal derma. 2) “Strato delle cellule spinose” o “Strato del Malpighi”. Rappresenta il momento di transizione dalla microscopia ottica alla microscopia elettronica. E’ proprio studiando le cellule di questo strato che si cercò di capire come le cellule adiacenti fossero collegate le une alle altre. Alla luce della microscopia ottica, sembrò chiara l’individuazione di veri e propri “ponti intercitoplasmatici” tra cellule contigue, che inizialmente vennero chiamati spine (da cui, la denominazione di “strato delle cellule spinose”). In realtà, il problema venne risolto e corretto mediante la microscopia ottica: i “ponti spinosi” corrispondono a quei dispositivi di giunzione, frutto della differenziazione dei versanti plasmalemmatici di due cellule contigue che si affrontano. E, mediante una analisi, ultrastrutturale e macromolecolare più corretta, consentita unicamente dalla microscopia elettronica, si ha l’individuazione di vere e proprie proteine di giunzione, che prendono il nome di desmosomi. 3) “Strato granuloso” o “Strato granulare”. 4) “Strato molle”, o meglio “Strato lucido”. 5) “Strato corneo”. - Epitelio pavimentoso complesso non cheratinizzato o molle. Esempi di strutture che presentano Epitelio Pavimentoso Complesso sono: - E. P. C. DELLA CORNEA. Struttura di natura epiteliale che raddoppia la porzione anteriore del bulbo oculare. In varie condizioni infelici, per la sua estrema delicatezza, può essere soggetto a microtraumi che lo discontinuano. E allora, perde la funzione di copertura a cui è preposto. - E. P. C. DELLA MUCOSA VAGINALE. Essa è sede di particolari modificazioni a carattere ciclico e periodico, tanto che in Endocrinologia si parla di ciclo vaginale. Nella pratica clinica, per stabilire alcune situazioni ormonali, si pratica uno “striscio vaginale”, che consiste nel prelevare, con una piccola spatola, un frammentino di epitelio e, successivamente, di effettuare lo striscio vero e proprio: procedimento tecnico che consiste nel distendere su un apposito supporto uno strato sottile di cellule, per effettuarne un analisi microscopica. Quando parliamo di “ciclo”, parliamo, in generale, di un complesso di funzioni che si ripetono con un certo periodismo. Oltre che di ciclo vaginale, ad es., si parla anche di ciclo uterino. - E. P. C. DELLA MUCOSA DELL’URETRA FEMMINILE. Si tratta dell’ultimo segmento delle vie urinarie. - E. P. C. DELLA META’ SOPRADIAFRAMMATICA DEL TUBO DIGERENTE (BOCCA-FARINGE-ESOFAGO). E’ interessante effettuare la distinzione del tubo digerente nelle due porzioni di: 1)Tubo digerente della metà sopradiaframmatica e 2) Tubo digerente della metà sottodiaframmatica. Tale distinzione viene effettuata perché, come si vedrà, cambia, nei 2 distretti le caratterizzazioni morfofunzionali degli epiteli rispettivi. Ad es., nel passaggio dall’esofago allo stomaco, si ha il passaggio da un epitelio pavimentoso complesso ad un epitelio prismatico semplice. (Il diaframma è un muscolo piatto aponeurotico, ove l’aponeurosi è una membrana fibrosa che riveste i muscoli, che separa la cavità toracica da quella addominale). Epitelio isoprismatico o cubico semplice. - E. C. S. DELLA SUPERFICIE OVARICA. - E. C. S. DEI PLESSI CORIOIDEI. Si tratta di “gettoni vasculo-connettivali” rivestiti da epitelio e che ritroviamo sul tetto di cavità corporee naturali nello spessore dell’encefalo (che prendono specificatamente il nome di cavità ventricolari), in cui si elabora il cosiddetto liquido cerebro-spinale. - E. C. S. DELLA FACCIA INTERNA DEL CRISTALLINO. Che ritroviamo come una lente biconvessa sulla superficie anteriore del bulbo oculare. - E. C. S. DEI CONDOTTI ESCRETORI. I condotti escretori sono canali di veicolazione del secreto di particolari tipi di ghiandole e più specificatamente degli adenomeri di molti tipi di ghiandole (intendendo specificatamente con il termine adenomero o la parte terminale della struttura ghiandolare o, meglio, quella più attiva funzionalmente). Epitelio batiprismatico o cilindrico o colonnario semplice. - E. B. S. DELLA META’ SOTTODIAFRAMMATICA DEL TUBO DIGERENTE. Dal cardias allo sfintere anale. - E. B. S. DELLA MUCOSA DELL’UTERO. L’utero è un organo cavo mediano dell’apparato genitale femminile, posto nel piccolo bacino, destinato ad accogliere l’uovo fecondato e a sostenerne lo sviluppo e ricoperto da una membrana mucosa. La mucosa dell’utero è propriamente detta endometrio, ed è soppannata da una struttura muscolare contrattile, che prende il nome di miometrio. Abbiamo già detto che la cavità uterina è caratterizzata da un grande dinamismo, tale da farle subire delle nette modificazioni morfofunzionali periodiche, che prendono il nome di ciclo uterino. - E. B. S. DELLA TUBA. La tuba uterina è un condotto tubolare dell’apparato genitale interno femminile, che va dall’ovaio all’utero. Si può notare che la comunicazione tra tuba ed utero si verifica con una soluzione di continuità, non altrettanto per la connessione tra tuba ed ovaio che, al contrario, si presenta con un grado di connessione molto meno marcata, che prende il nome di contiguità. Ecco perché, talvolta, la cellula uovo che matura nell’ovaio e che deve subire il processo di fecondazione, può non imboccare il cammino tubarico, determinando ben precise conseguenze. - E. B. S. DEI CONDOTTI ESCRETORI DI MOLTE GHIANDOLE. Che non presentano come rivestimento un epitelio cubico semplice. - E. B. S. DEI PICCOLI BRONCHI. Si tratta quasi delle vie finitime delle vie respiratorie, a livello dei bronchioli, prima che questi condotti si aprano sugli alveoli polmonari. - E. B. S. DELLA COLECISTI. Costituisce la quota epiteliale della mucosa della colecisti. Per colecisti o cistifellea si intende la vescichetta a forma di pera piuttosto allungata applicata alla faccia inferiore del fegato, in cui si raccoglie la bile. Considerazioni aggiuntive meritano alcuni di questi tessuti epiteliali. Epitelio batiprismatico o cilindrico o colonnario semplice della mucosa gastrica. Alla luce della stessa microscopia ottica, sono evidenziabili successive ed alternantisi introflessioni ed estroflessioni. Si avrà dunque la conformazione detta delle “creste villose”. E occorre stare ben attenti alla terminologia. Si parla, infatti, di “creste villose” e non di “villi”, in quanto, pur essendo presente una caratteristica analogia conformazionale con i cosiddetti “villi intestinali” (i “villi” propriamente detti), sono tuttavia presenti anche notevoli discrepanze. Si tratta di preminenze irregolari della mucosa dello stomaco, mentre (ed è già questa una prima differenza) i villi presentano una dislocazione molto più cospicua e regolare. Gli intervalli fra le creste villose sono appunto depressioni che terminano al fondo con una piccolissima apertura: le cosiddette fossette gastriche, le cui funzioni adesso analizzeremo. Si ha, comunque, è bene sottolinearlo, un andamento prettamente irregolare. Per lo studio di questi preparati istologici spesso ci si serve di particolari coloranti, come l’ematossina e l’ossina. Tali coloranti hanno la caratteristica capacità di rivelare possibili prodotti di secrezione. La presenza di una caratteristica colorazione blu (derivante dall’azione dell’ematossina e dell’ossina) sul bordo apicale di queste cellule epiteliali, ne rivela una caratterizzazione funzionale aggiuntiva oltre alla canonica di copertura: quella secernente. Tali cellule, infatti, elaborano un secreto di natura glicoproteica: il muco. In questo caso, dunque, il concetto di epitelio secernente distinto da epitelio di rivestimento (proposto nello schema iniziale) fa difetto. Il muco costituisce un importantissimo film protettivo, per 2 fondamentali ragioni: - In esso rimangono imprigionate possibili sostanze irritanti ingerite, che potrebbero determinare un’irritazione dell’epitelio. - (Ed è la funzione principale) esercita un’azione protettiva nei confronti dell’acido forte HCl, che è uno dei costituenti principali del succo gastrico. Occorre, però, fare qualche precisazione aggiuntiva: l’HCl non proviene dall’attività secretoria epiteliale, ma dalla tonaca propria (e cioè, dalla parte connettivale della membrana sierosa) della mucosa gastrica. E, più specificatamente, l’HCl prodotto raggiunge la cavità gastrica vera e propria attraverso le fossette gastriche, che quindi assumono questa specifica funzione. Il muco, dunque, ha una funzione essenzialmente protettiva. Tuttavia, esso non è l’unica sostanza prodotta dalle cellule dell’epitelio della mucosa gastrica. In termini generali, possiamo individuarne fondamentalmente 3: 1) Il muco. 2) Bicarbonati. In maniera chimicamente più mirata dello stesso muco, servono a neutralizzare l’azione corrosiva dell’HCl. 3) Prostaglandine. In termini generali, queste sostanze rappresentano la barriera muco-bicarbonatoprostaglandinica. Alla domanda: quante cellule dell’epitelio della mucosa gastrica hanno attività secernente?, va risposto: tutte. Si tratta, infatti, abbiamo detto, di uno specifico caso di superficie epiteliale secernente, concetto ben diverso da quello di superficie epiteliale ghiandolare, sebbene in entrambi i casi vi sia l’elaborazione di sostanze specifiche che prendono il nome di secreti. Si tratta, quindi, in generale di cellule con una canonica funzionalità protettiva, ma che presentano egualmente quella secretiva. In campo patologico, nel caso delle gastriti iperacide si presume che vi sia un’esaltata produzione di HCl, tale da superare la capacità naturalmente protettiva della barriera muco-bicarbonato-prostaglandinica. Si determinano, allora, gravi erosioni dell’epitelio mucosale. In condizioni di maggior gravità, l’HCl può addirittura ritornare indietro nella sede che lo ha prodotto, compromettendo dunque l’integrità della tonaca propria, e determinando una condizione particolarmente dolorosa che prende il nome di ulcera. Va considerato, inoltre, che essendo la tonaca propria intensamente vascolarizzata, ciò può provocare emorragia. Ecco, dunque, che quando un paziente presenta ematoemesi (e cioè, vomita sangue), la causa di ciò può essere ascritta o a un cancro (che, a differenza delle gastriti, interessa preliminarmente la tonaca propria. Si parla di adenocarcinoma, perché è una formazione tumorale che agisce sulle strutture ghiandolari) o, molto più spesso, a un’ulcera. Oggigiorno, tuttavia, la patogenesi dell’ulcera ha subito grandi rinnovamenti. Prima si pensava, come detto, che essa fosse determinata da un’eccessiva azione corrosiva dell’HCl. Oggi, invece, si è scoperto che nel 95% dei casi essa è determinata da uno specifico germe, le cui lisine hanno un’azione prettamente corrosiva. Ciò modifica molto. A differenza di quanto si pensava prima, si è visto che l’ulcera è altamente contagiosa. Alla luce della microscopia elettronica a scansione, ovviamente, si avrà un ben superiore potere risolutivo. Si può meglio notare, ad es., l’andamento tormentato, irregolare delle creste villose. Si possono distinguere gli stessi filamenti di muco. Si vede come le singole creste villose sono costituite dalle sommità apicali delle varie cellule. E che ogni cellula superficialmente è minutamente estroflessa, per consentire l’attività secernente. Si vedono chiaramente le fossette gastriche da cui risale l’HCl prodotto dalla tonaca propria. Epitelio batiprismatico o cilindrico o colonnario semplice dell’intestino tenue. Anche qui individuiamo delle caratteristiche protuberanze. Tuttavia, a differenza delle creste villose della parete gastrica, i villi (adesso è il caso di parlare specificatamente di villi) dell’intestino tenue si presentano con una distribuzione ben cospicua e più regolare. Tali formazioni, inoltre, sono dimensionalmente più consistenti, tanto da riuscire a coglierli quasi ad occhio nudo (in realtà, ad occhio nudo, si percepisce come la mucosa intestinale presenti un aspetto “finemente vellutato”, determinato proprio alla presenza dei villi). Un’altra importante differenziazione funzionale dalle creste villose è che le cellule dei villi intestinali non hanno la funzione di secernere, bensì di assorbire. Il villo, infatti, è un geniale espediente della natura che serve ad estendere consistentemente la superficie di contatto nei confronti del materiale che deve essere assorbito. L’asse, il contenuto di queste prominenze che prendono il nome di villi e costituiti superficialmente da un tessuto epiteliale batiprismatico semplice (semplice per favorire l’assorbimento delle sostanze nutritizie) è dato dalla tonaca propria di questa lamina mucosale. In termini generali, tale epitelio, abbiamo detto, è formato da cellule cilindriche. Di tanto in tanto, sono tuttavia presenti, inframmezzate a queste, anche cellule di un colore verdastro, che prendono il nome di cellule caliciformi. Queste ultime non hanno niente a che fare con l’attività prettamente assorbente delle altre cellule cilindriche. Elaborano muco, ma un altro tipo di muco rispetto a quello delle cellule dell’epitelio della mucosa gastrica precedentemente considerato. Analizzando, mediante la microscopia elettronica, la struttura dell’epitelio di un villo intestinale, si può notare un ispessimento del loro bordo apicale, che prende il nome di cuticola striata. In realtà, il bordo libero di queste cellule si ripiega in forma di minutissime estroflessioni digitiformi del loro plasmalemma, che assumono la caratteristica denominazioni di microvilli. Possiamo dire che, in piccolo, i microvilli hanno la stessa funzione che, più in grande, ha il villo. Se andiamo più a fondo nell’osservazione micronelettronica, si vede che i microvilli sono a loro volta sormontati da quella protezione (che peraltro facilita l’assorbimento) e che abbiamo definito glicocalice o mantello cellulare o cellcoat. Epitelio batiprismatico o cilindrico o colonnario composto. - E. B. C. DEL FORNICE CONGIUNTIVALE. Formato dalla riflessione della congiuntiva nel passaggio dalla palpebra (congiuntiva palpebrale) al globo oculare (congiuntiva oculare). La congiuntiva è la mucosa che riveste, congiungendole, la parte interna delle palpebre e la parte esterna della sclera. - E. B. C. DELLA MUCOSA DELL’URETRA CAVERNOSA NELL’UOMO. L’uretra, il tratto terminale dell’apparato urinario, è suddivisa in tanti piccoli distretti, ed uno di questi è proprio l’uretra cavernosa. - E. B. C. DELLA EPIGLOTTIDE. Cartilagine laringea a forma di racchetta che chiude la glottide, e cioè di quello spazio compreso fra le corde vocali. - E. B. C. DELLA MUCOSA ANALE. Abbiamo già parlato dell’epitelio batiprismatico semplice della metà sottodiaframmatica del tubo digerente, che va dal cardias allo sfintere anale e che, dunque, caratterizza attivamente la stessa mucosa anale. Qui, tuttavia, siamo in grado di individuare anche un epitelio a carattere batiprismatico composto. Si ha, dunque, un’interazione sostanziale tra le 2 forme di epitelio. E’ interessante, però, ravvisare che un possibile slittamento dell’ordine cellulare può portare ad una condizione di atipia, anaplastica e neoplastica propria delle cellule tumorali. - E. B. C. DEI CONDOTTI ESCRETORI DELLE GHIANDOLE LACRIMALI E SALIVARI. Abbiamo già discusso degli epiteli batiprismatici semplici dei condotti escretori di molte ghiandole. In questo caso, tuttavia, essi concernono particolari condotti escretori di formazioni ghiandolari. Epitelio batiprismatico pseudostratificato o pluriseriato o plurifiliare o a più file di nuclei. (Abbiamo già detto della erronea impressione di pluristratificazione a causa delle diverse altezze a cui si pongono i nuclei delle diverse cellule. In sostanza, tutte le cellule hanno la stessa base di impianto, a livello della tonaca propria, ma non tutte effettivamente raggiungono la medesima altezza). - E. B. P. DELLA MUCOSA DELLE VIE RESPIRATORIE. E cioè, specificatamente, della trachea e delle grandi vie bronchiali. - E. B. P. DEL CONDOTTO DELL’EPIDIDIMO. Primo segmento delle vie spermatiche, che si diparte dai tubuli seminiferi (il parenchima del testicolo). Trattandosi di un segmento viscerale cavo, ovviamente, presenterà un rivestimento interno di natura epiteliale. L’epitelio in questione è, appunto, un epitelio batiprismatico pseudostratificato. Epitelio di transizione polimorfo composto o epitelio delle vie urinarie. - E. T. C. DELLE VIE URINARIE. E cioè a dire, nell’ordine: calici canali, ureteri, vescica, uretra. Questo aspetto formale transeunte è specifico delle vie escretrici urinarie. I calici renali sono i primi confluenti nel contesto del rene del quale costituiscono quella porzione che prende il nome di ilo (e cioè il distretto a livello del quale i vasi penetrano l’organo irrorandolo e ne fuoriescono quelli venosi). L’uretere è il distretto canalicolare che segue che porta l’urina alla vescica. Segue un condotto terminale che segue la sequenza delle vie urinarie: l’uretra. Tutti questi distretti sono caratterizzati da una estrema plasticità, e cioè la capacità di modificare la propria forma, in relazione a uno stato possibile di vacuità o empimento. Epitelio di transizione composto della vescica. La vescica è il distretto delle vie urinarie in cui in maniera più eclatante si verificano queste modificazioni di forma. Si tratta di un epitelio di transizione composto, con particolari effetti formali differenti rispetto alle condizioni di vacuità ed empimento. Analizziamo, preliminarmente, lo stato dell’epitelio vescicale, quando è in una condizione di vacuità, e cioè vuoto di urina. C’è uno strato di cellule che rappresentano la base dell’epitelio, che poggia direttamente sul corion vescicale. Sono cellule di aspetto isoprismatico. Le cellule dello strato sovrastante, che si insinuano con le basi minute fra le cellule dello strato basale, hanno una forma svasata, tanto da far definire questo strato come strato delle cellule clavate. Sulla sommità si adagiano le cellule dell’ultimo strato che, poiché polinucleate, danno via a formazioni simplastiche, il cui bordo inferiore è caratteristicamente festomato, ovvero fatto da tutta una serie di concavità che vanno ad incastrarsi perfettamente con le sommità delle cellule dello strato sovrastante. Non a caso, per la loro caratteristica forma, esse assumono la denominazione di cellule a ombrello o cellule a paracadute. Tutto questo in condizione di vacuità. Se, invece, consideriamo lo stato di empimento, noteremo una modificazione sostanziale. A subire le maggiori modificazioni non sono dello strato basale e le cosiddette cellule ad ombrello, bensì le cellule dello strato intermedio, le cellule clavate che perdono il caratteristico aspetto clavato e ne assumono uno sostanzialmente isoprismatico. Va notato che, nell’organizzazione di una mucosa in genere, molto spesso, tra lo stato basale epiteliale e il corion si interpone uno straterello di fine tessuto connettivo particolarmente variegato, a cui è dato il nome di membrana basale. La sua valenza è di determinare una certa indipendenza funzionale tra l’epitelio e il connettivo sottostante, benché l’epitelio sia succubo di quest’ultimo da un punto di vista trofico e di sostegno. Quindi, attraverso la membrana basale si ha l’apporto del materiale nutritizio. Ma la membrana basale è fondamentale anche per comprendere l’origine e l’evoluzione di alcune patologie tumorali della vescica, così come di tutte le mucose dotate di membrana basale. Ciò vale, dunque, ad es., anche per la mucosa uterina, la cui porzione epiteliale, detta endometrio (ed è bene puntualizzare che le formazioni cancerose si originano sempre dallo strato epiteliale) può essere interessata da formazioni atipiche ed anaplastiche a carattere tumorale. Da un punto di vista della stadiazione, si parla di stadio zero, che è un tempo esteso, che può durare anche alcuni anni, la cui manifestazione si limita esclusivamente all’epitelio. Si parla, allora, di carcinoma in situ. La prima riproduzione a distanza (le metastasi) si verifica nella tonaca propria, e in questo caso si parla di metastasi per contiguità. In questo senso, la membrana basale ha la funzione specifica di limitare un possibile insorgere di metastasi nel tessuto connettivale. E, dal momento che lo strato connettivale risulta essere interamente vascolarizzato, è possibile dar vita ad una funesta propagazione delle metastasi per via ematica (è interessante notare che una formazione cancerosa, pur essendo costitutivamente “anarchica”, segue un’evoluzione assolutamente regolare: attraverso il sistema ematico e quello linfatico). E allora, se diagnosticato in tempo, il cancro può essere guarito, effettuando un’opportuna asportazione dell’endometrio. E’, dunque, importante, con un esame istologico, esaminare, quando si ha il sospetto di formazioni tumorali, l’integrità strutturale della membrana basale e, ad ogni modo, per stabilire la stadiazione dell’evento tumorale. PRECISAZIONI TERMINOLOGICHE SULL’ANDAMENTO DEL PROCESSO SECRETIVO. Si distingue in: CELLULE ESOCRINE. CELLULE ENDOCRINE. CELLULE PARACRINE. CELLULE AUTOCRINE. Attribuiamo queste differenti qualifiche non sulla base del meccanismo di secrezione (che è praticamente analogo nei vari citotipi), bensì sulla base di altri fattori: - Sulla base delle modalità con cui il prodotto di secrezione esercita i suoi effetti al di fuori della cellula che l’ha generato. - Sui diversi stadi fondamentali di sviluppo, e cioè sui diversi destini istogenetici seguiti dai rispettivi citotipi. - E quindi sulla modalità di riversamento all’esterno. Quando parliamo di cellule secernenti non parliamo sempre ed in ogni caso di cellule che costituiscono necessariamente una ghiandola (e, quando parliamo di ghiandole, parliamo di organi, in quanto unità pluritessutali). Quindi, altra cosa sono le cellule secernenti e altra cosa sono le ghiandole, proprio perché non sempre le cellule secernenti sono ghiandole, perché possono esistere cellule isolate che no fanno parte diorgani ghiandolari e che svolgono pur sempre funzione secernente . Inoltre, come si è visto, è possibile effettuare un’ulteriore differenziazione delle cellule (o ghiandole) secernenti in esocrine ed endocrine. Ed ancora, in paracrine ed autocrine (se il prodotto di secrezione svolge il suo effetto terminale all’interno della stessa cellula, regolando, modulando il comportamento funzionale di alcune componenti della cellula stessa). Come detto, il modo migliore per potere discernere una cellula endocrina da una esocrina è di riferirsi ai differenti stadi di sviluppo. (Vedi Figura 1) Come si vede dalla figura, benché si abbiano 2 differenti destini evolutivi, la funzione secretiva si acquisisce nel corso dello svilippo. Le strutture secernenti nascono da un epitelio di rivestimento (come, l’epitelio della mucosa gastrica) da cellule che, nel corso dello sviluppo, hanno acquisito una differenziazione in senso secretivo. (2) Si ha una proliferazione di cellule, che danno vita a una struttura detta zaffo, al di sotto dell’epitelio di rivestimento, nel connettivo vascolarizzato sottostante. Ed è a questo punto che si possono imboccare 2 differenti indirizzi istogenetici. (3) Ghiandole endocrine. Primo destino istogenetico. Il piccolo zaffo si distacca. Segrega nel connettivo sottostante e si stabilisce fra queste cellule e i piccoli vasi presenti nella tonaca propria un rapporto molto intimo. Le cellule poi assumeranno una funzionalità secretoria. Quindi, una formazione esocrina nasce come introflessione dell’epitelio di rivestimento, dal quale perde successivamente contatto e si distacca, prendendo attivamente contatto con il torrente circolatorio. Il prodotto versato all’interno dei vasi sanguigni diventa un increto e allora si ha un’azione a distanza del medesimo rispetto alla sede che lo ha elaborato. Si ha il cosiddetto ormone. Un’altra interessante caratterizzazione funzionale è che gli ormoni agiscono in quantità minimali, dell’ordine dei millesimi di mg, dei picogrammi. Ma influenzano la cenestasi, lo stato di benessere del nostro organismo, agendo sui cosiddetti organi-bersaglio. Ed ecco che, allora, sorge una branca specialistica di studi che prende il nome di Endocrinologia. Le canoniche ghiandole endocrine nell’organismo sono pochissime. Ma a fronte abbiamo un vastissimo microcosmo di cellule isolate a funzione secernente endocrina . Si parla, infatti, di Sistema neuroendocrino diffuso (dal quale vengono secreti più di 200 diversi tipi di ormoni). (4) Ghiandole esocrine. L’altro processo istodifferenziativo è quello delle cellule e delle ghiandole esocrine. In questo caso accade che il piccolo zaffo, pur proliferando nel tessuto connettivo sottostante (e quindi, pur mantenendo un rapporto con i vasi che qui si trovano), si mantiene in diretto contatto con quello epiteliale mediante una sorta di peduncolo, di picciolo. Inoltre, si provvede di un lume. Si ha anche in questo caso una differenziazione in senso secretivo. Le cellule basali di questa struttura ne costituiscono l’adenomero. E’ detta correttamente ghiandola esocrina perché il secreto viene veicolato sulla superficie dell’epitelio di origine. Non è corretto dire (ma generico e restrittivo): si parla di ghiandole esocrine perché il secreto viene veicolato “all’esterno” del corpo; esistono, infatti, solo 2 ghiandole esocrine di questo tipo (mentre tutte le altre formazioni ghiandolari sono disposte sulla superficie interna di un organo cavo): le ghiandole sebacee e le ghiandole sudoripare. Nella realtà istologica, è pur necessario precisare che queste strutture rimangono comprese nel tessuto connettivo e i vasi si possono mettere in contatto con le cellule che le compongono. Quindi, così come per le cellule secernenti endocrine si ha un diretto contatto con i vasi. E, d’altronde, non potrebbe essere altrimenti, dal momento che proprio dal torrente circolatorio si assumono le sostanze di preparazione necessarie per il confezionamento del prodotto di secrezione proprio della suddetta cellula esocrina. Il secreto, tuttavia, non prende la via del sangue (che pur bagna le cellule e conferisce loro un apporto trofico). Quindi, riassumendo, possiamo discriminare le cellule secernenti esocrine dalle endocrine da un punto di vista 1) dei diversi destini istogenetici seguiti da i differenti citotipi secernenti, per cui le prime e le seconde si originano da un’introflessione dell’epitelio da cui originano nello strato trofomeccanico sottostante, ma mentre nel secondo caso si ha il distaccamento del piccolo zaffo dallo strato epiteliale, nel primo non si ha alcun distaccamento dal suddetto strato epiteliale, al quale rimane connesso mediante un peduncolo cavitato attraverso cui passa il prodotto di secrezione. E ancora 2) da un punto di vista della sede raggiunta da i prodotti di secrezione: organi-bersaglio allocati anche a consistente distanza dal distretto di secrezione e raggiungibili mediante il torrente circolatorio (in cui viene riversato l’increto ormonale) nel caso delle cellule secernenti endocrine; e la superficie dell’epitelio di origine al quale rimane connesso il piccolo zaffo mediante un peduncolo cavitato attraverso cui è trasmesso il prodotto di secrezione, nel caso delle cellule esocrine. Ed infine, 3) sulla base della modalità secretiva, per cui si suole dire che i 2 differenti citotipi secernenti funzionano con polarità diversa. Questo concetto merita di essere analizzato più approfonditamente. La polarità diversa delle cellule esocrine ed endocrine. Ad es., le cellule esocrine secernenti sostanze di natura proteica dovranno (ed effettivamente, abbiamo detto, lo fanno essendo pur sempre a contatto con il circolo ematico, proprio come le cellule secernenti endocrine, ma non riversante in esso il prodotto secretivo) assumere le unità fondamentali di confezionamento (come gli amminoacidi) dal torrente circolatorio. Successivamente, vi sarà quella sequenza specifica di eventi a livello ultrastrutturale intracellulare, che abbiamo già analizzato trattando dell’attività funzionale del cosiddetto apparato membranoso interno del citoplasma. Ed infine, si riversa il prodotto secretivo sull’epitelio di origine con cui queste cellule mantengono l’intimo contatto. Si ha quindi una polarità di traversata assolutamente unidirezionale. Proprio come accade, ma con modalità differenti, per le cellule secernenti endocrine. In questo caso, infatti, si ha una differente polarità. La cellule secernente endocrina, infatti, contrae un rapporto molto intimo con un capillare sanguigno. Da quest’ultimo assume sempre gli elementi fondamentali costitutivi del prodotto di secrezione ormonale (ad es., amminoacidi se l’ormone è di natura proteica; acidi grassi e alcoli, nel caso in cui vengono prodotti ormoni lipidico-steroidei). Sono sempre attivamente coinvolti i vari componenti ultrastrutturali (ovviamente, disposti in maniera differente rispetto alla cellula secernente esocrina). Ed infine, lo sbocco di tali sostanze è nel circolo ematico. Si ha, in altri termini, una polarità invertita rispetto a quella delle cellule esocrine. Cellule secernenti paracrine. Come l’analisi etimologica dello stesso termine rende esplicito, si tratta di cellule secernenti che riversano il loro prodotto di secrezione in prossimità (para) alla loro allocazione. E’ insolito assegnare ad una cellula epiteliale la dotazione di un prolungamento, eppure esso è un elemento costitutivo fondamentale della cellula secernente paracrina. (Vedi Figura 2) Come si vede dalla figura, si ha una coalescenza di granuli di secrezione in corrispondenza della membrana interna del prolungamento. E poi, con un processo exocitotico, si ha l’emissione del secreto nell’ambiente immediatamente circostante al prolungamento. Tuttavia, le cellule secernenti paracrine possono, nel caso in cui, il prodotto di secrezione imbocchi la via del sangue, anche assumere una connotazione endocrina. (Quindi, possiamo dire che la differenziazione fra cellula endocrina e cellula paracrina viene effettuata essenzialmente sulla base delle diverse modalità di trasmissione. Mentre, al contrario, come abbiamo visto, la discriminazione fra cellula endocrina ed esocrina viene inizialmente effettuata sulla base del differente destino istogenetico seguito). Sulla base di questa particolare caratterizzazione endocrina delle cellule paracrine si introduce il concetto di Sistema neuroendocrino diffuso. Adesso possiamo capire perché si aggiunge il prefisso “neuro”. Esso deriva dalla estrema somiglianza di questi citotipi alle cellule nervose. Ed in effetti, questa somiglianza non è affatto casuale. Le cellule secernenti paracrine sono cellule isolate che trovano una precisa allocazione nel foglietto ectodermico dell’embrione in abbozzi prossimi a quello da cui originerà il sistema nervoso: il tubo neurale. Al di sopra di esso troviamo, appunto, escrescenze specifiche che prendono il nome di creste neurali, da cui si sviluppano le cellule paracrine del sistema neuroendocrino diffuso. Si ha, dunque, con le cellule nervose, un rapporto di parentela topografica, tanto che, per questo motivo, le suddette cellule paracrine assumono la caratteristica denominazione di paraneuroni. Il contrassegno di un elemento nervoso è quello di avere un numero più consistente di propaggini. Tutto ciò ha importanti incidenze anche nel campo della patologia. Ci possono essere, infatti, tumori che originano proprio da questi particolari citotipi. Un es. di cellule paracrine lo troviamo nella tonaca propria della mucosa gastroenterica (e cioè, gastrointestinale). In questo caso, l’adenomero ha forma tubolare ed è costituito essenzialmente da cellule secernenti esocrine. Nell’ambito di questa struttura si individuano, in forma isolata, alcune formazioni cellulari abbarbicate sulla sua superficie esterna e che svolgono un’attività essenzialmente paracrina secernendo sostanze come la somatostatina. Essa non imbocca la via del tubulo escretore, ma manifesta la sua azione sulla stessa struttura esocrina. Questa è un’osservazione di sconvolgente importanza in quanto rileva che una netta separazione fra le diverse cellule secernenti, benché corretta da un punto di vista concettuale, da un punto di vista topografico non è assolutamente ammissibile. In questo caso, infatti, si ha la presenza di cellule paracrine all’interno di strutture a natura esocrina. Ed ancora, vedremo, si potrà avere la presenza di cellule endocrine all’interno di strutture esocrine. Cellule secernenti autocrine. L’ultima acquisizione da parte degli ambienti scientifici. In questo caso, il prodotto di secrezione non viene estruso dalla cellula secernente, ma agisce sullo stesso citoplasma delle cellule che lo hanno prodotto, modulando alcune funzioni dell’apparato membranoso. PRECISAZIONI TERMINOLOGICHE SULLE STRUTTURE SECERNENTI ESOCRINE. Cellule secernenti isolate. Si tratta di cellule singole, incastonate nell’ambito di un tessuto epiteliale di rivestimento da cui, appunto, derivano. E’ contraddittoria e quindi assolutamente inaccettabile la dizione di “ghiandole unicellulari”, talvolta impropriamente attribuita loro. La ghiandola, infatti, è un organo, in quanto formazione pluritissutale. Ovviamente, una singola cellula, dunque, non può rappresentare certo una ghiandola. Un esempio abbastanza caratteristico di cellule secernenti isolate è offerto dalle cellule caliciformi dell’epitelio dello stomaco. Cellule secernenti diffuse. Caratterizzazione speculare rispetto a quella delle cellule secernenti isolate. In questo caso, infatti, le cellule costituiscono un epitelio che pur presentando la primigenia funzione di rivestimento hanno subito un destino differenziativo in senso secretivo. Un es. abbastanza caratteristico di epiteli di rivestimento a funzione secernente, lo ritroviamo nell’epitelio della mucosa gastrica e della mucosa della colecisti. ( Epiteli ghiandolari. Si tratta della quota epiteliale della ghiandola, in quanto entità pluritissutale. Ovviamente, si tratta di un epitelio a funzione secernente. Se le cellule non fanno parte di una ghiandola, andranno, a seconda delle particolari caratterizzazioni, a far parte di una delle 2 classi precedenti. ( Ghiandole. Si tratta di un organo a funzione secretiva. Tuttavia, trattandosi di un organo è un’entità pluritessutale, costituita sì, quindi, da un epitelio secernente, ma anche da un connettivo e dal sangue e da nervi. CRITERI DI CLASSIFICAZIONE DELLE GHIANDOLE ESOCRINE. ( Morfologico. ( Chimico. ( Topografico. ( Modalità secretiva (in relazione al modo in cui il citoplasma di queste cellule partecipa al processo di secrezione) Classificazione morfologica delle ghiandole esocrine. Tiene conto di 2 componenti: Forma dell’adenomero. Comportamento del sistema escretore (è corretto dire “comportameto” e non “forma”, poiché interessa il rapporto tra l’adenomero e il sistema dei condotti escretori). FORMA DELL’ADENOMERO. (Vedi Figura 3) Come si vede, esistono 3 fondamentali tipologie: Adenomero tubolare. Si tratta di una cavità delimitata da una parete costituita da cellule secernenti. Adenomero alveolare. Si tratta di una struttura globare, similtondeggiante. E’ interessante, però, notare che la cavità interna ripete la forma esterna. Adenomero acinoso. La struttura esterna è praticamente analoga a quella dell’adenomero tondeggiante. Le cellule che costituiscono la parete, tuttavia, essendo dimensionalmente più consistenti, limitano una cavità assai più ridotta. COMPORTAMENTO DEL SISTEMA ESCRETORE. E’ interessante notare che ognuno dei seguenti sistemi escretori sono attribuibili, ad incrocio, ad ognuno degli adenomeri precedentemente presi in esame. Sistema escretore semplice. Un condotto unico semplice a cui sta agganciato un singolo adenomero. Sistema escretore ramificato. Si individua un singolo condotto principale a cui sono connesse varie ramificazioni. All’estremità di ciascuna ramificazione ai avrà un adenomero. Sistema escretore composto. Anche in questo caso si individua un singolo condotto principale, da cui si dipartono svariate ramificazioni. All’estremità delle singole ramificazioni e, in questo caso, anche alle loro estremità si avranno degli adenomeri. Classificazione chimica delle ghiandole esocrine. Tiene conto della natura chimica del secreto, per cui si distinguono 2 diversi tipi di secrezione: Secrezione sierosa. Secrezione mucosa. Questa diversa composizione chimica determina anche una differente incidenza visiva nella microscopia micron-elettronica. Quelle che presentano una secrezione mucosa e che, dunque, saranno ricolme di muco (che si presenta come una sostanza trasparente) risulteranno apparire come “vuote” nell’indagine microscopica. Al contrario, quelle ricolme di secrezione sierosa presenteranno un citoplasma con un aspetto “finemente polverulento”. Classificazione topografica delle ghiandole esocrine. In questo caso, si fa riferimento alla posizione degli adenomeri nel contesto della parete di un viscere cavo da cui l’epitelio ghiandolare ha avuto origine. Infatti, le ghiandole che abitano nella parete di un organo cavo (come accade per la maggior parte delle ghiandole esocrine, fatta eccezione per le ghiandole sebacee e le ghiandole sudoripare) sono disposte a diverse altezze. Si distinguono in: ( extraparietali ( intraparietali. A loro volta, quelle intraparietali si distinguono in: Intraepiteliali. Intracoriali. Sottomucose. Sulla base della precisa dislocazione nei vari strati tissutali della parete del viscere. A questo proposito può essere utile fare un esempio pratico analizzando la parete dell’intestino. CARATTERIZZAZIONE GHIANDOLARE DELLA PARETE INTESTINALE. Essa è costituita da una sovrapposizione di più tessuti, dei quali quello più interno è la mucosa intestinale. E’ possibile individuare, in laboratorio, i vari strati ed, effettuando una sezione trasversa, si individuano, procedendo dal più interno al più esterno i seguenti strati: Mucosa. Sottomucosa. Tonaca muscolare. Tonaca sierosa. Dall’epitelio della mucosa intestinale si originano i villi. Al di sotto della mucosa, troviamo un tessuto di natura connettivale trofomeccanica vascolarizzata, che prende il nome di tela o tonaca sottomucosa. Al di sotto della sottomucosa, individuiamo 2 o 3 lamine di tessuto contrattile, le cui cellule caratteristiche sono le miocellule, cellule dalla forma allungata. Quando le mio cellule sono disposte perpendicolarmente al maggior asse formano una struttura che prende il nome di strato circolare. Quando, invece, si orientano parallelamente formano il cosiddetto strato longitudinale. E si ha, infine, il foglietto viscerale, detto peritoneo. E’ possibile individuare cellule secernenti esocrine isolate nella struttura dell’epitelio della mucosa intestinale: le cellule caliciformi (ghiandole intraparietali intraepiteliali). La maggior parte di ghiandole esocrine, però, si ritrova nella zona coriale, tant’è che si parla di ghiandole intraparietali intracoriali. E’ presente anche un numero sparuto di ghiandole intraparietali sottomucosali, le cosiddette ghiandole sottomucose di Bunner (che ritroviamo nel duodeno). Ovviamente, poiché i prodotti di secrezione verranno riversati sempre all’interno del tubo intestinale, via via che la dislocazione nei vari strati parietali risulta essere sempre più lontana dalla cavità interna, dal momento che gli adenomeri saranno via via sempre più distanti dai punti che li hanno generati, si avrà un incremento della lunghezza dei condotti escretori. E’ interessante notare che non si trovano formazioni ghiandolari nel contesto della tonaca muscolare e della tonaca sierosa. Talvolta, tuttavia, nel processo di zaffaggio, può avvenire che ghiandole già collocate nella parte più esterna della parete dell’organo, finiscano per distaccarsene, pur rimanendo in contatto, mediante un complesso sistema di dotti afferenti, con l’epitelio intestinale di origine in cui riversano i propri prodotti di secrezione. Si parla, allora, di ghiandole extraparietali, delle quali il fegato e il pancreas sono esempi più che caratteristici. I condotti di riversamento del prodotto di secrezione (che prendono rispettivamente il nome di vie biliari e vie pancreatiche) perforano la parete intestinale e sboccano sulla superficie dell’epitelio del duodeno. Il SISTEMA NEUROENDOCRINO DIFFUSO. CENNI STORICI. E’ relativamente recente l’acquisizione di ghiandole isolate che esplicano un’azione incretiva-ormonale di significato endocrino all’interno di strutture mucosali o di strutture ghiandolari tradizionalmente considerate esocrine. Abbiamo già analizzato la caratteristica polarità di queste ghiandole a significato endocrino, che le fa differire enormemente da quelle esocrine. Esse, infatti, assumono dal torrente circolatorio le sostanze di edificazione del loro prodotto secretivo (come del resto, le stesse ghiandole esocrine), ma, a differenza delle ghiandole esocrine (e cioè, in seguito a un differente processo istodifferenziativo), non sono dotate di uno sbocco sull’epitelio di origine. E così, il prodotto secretivoè riversato direttamente nel circolo ematico. Vedremo che queste ghiandole isolate endocrine fanno parte di quell’organizzazione ghiandolare che prende il nome di Sistema neuroendocrino diffuso. Vedremo con che accezione. Il concetto di ghiandole endocrine isolate nasce storicamente nell’ambito della mucosa dell’apparato gastroenterico, ad opera di due istochimici italiani: Vittorio Espamer e il suo maestro Vialli. Poi, gli studi vennero accresciuti ad opera dell’inglese Pierce (che conierà il caratteristico acronimo APUD, vedremo con che significato). Queste cellule, di cui non venne chiarita subito la natura ormonopoietica endocrina, vennero scoperte sfruttando una loro caratteristica proprietà: la cromo-affinità e l’argento-affinità. Si tratta di una proprietà che si manifesta come la capacità caratteristica di queste cellule di fissare e ridurre chimicamente sali di metalli pesanti (come il Cr e l’Ag) nel loro citoplasma. Ecco perché, al momento della loro scoperta, esse vennero definite appunto cellule cromo-affini e cellule argento-affini. Seguitando nel loro studio, Espemer scoprì che queste cellule possedevano la capacità di elaborare una sostanza speciale a cui venne inizialmente attribuita la generica denominazione di enteramina. In un secondo momento, riuscì anche a caratterizzarla chimicamente: si tratta della serotonina. La serotonina è una sostanza monoaminica biogena. La confusione nacque perché questa sostanza venne ritenuta un prodotto a significato ormonale e ciò verrebbe in apparenza a cozzare con il concetto generico di struttura secernente esocrina, quale è l’epitelio secernente dello stomaco. Su questa base, l’istochimico inglese Pierce continuò nello studio di queste cellule e formulò un’ipotesi per cui si ribadì che queste cellule sono in grado di processare sostanze monoaminiche biogene, tra cui la stessa serotonina e di altre sostanze dette catecolamine (come l’adrenalina e la noradrenalina). Lo si dimostra sperimentalmente offrendo a questi citotipi i precursori delle due sostanze (la serotonina e le catecolamine) i loro precursori: - Levodopa Catecolamine. - 5-idrossitriptofano Serotonina. Enzimi specifici, presenti in queste cellule, captano il precursore aminico e lo decarbossilizzano. Ecco che si spiega, allora, il significato dell’acronimo APUD, creato da Pierce: A Amine P Precursores U Uptake D Decarbossilation (Aggancio dei precursori aminici e decarbossilazione). Si va avanti nella ricerca e si scopre che queste cellule svolgono, a fianco di queste proprietà monoaminergiche (di elaborazione di monoamine, come la serotonina e le catecolamine), sono presenti anche proprietà peptidergiche (che conferiscono a questa struttura una impronta ormonopoietica e, quindi, a significato endocrino). Questi prodotti di secrezione sono utilizzati come neurotrasmettitori chimici dell’impulso nervoso. Pierce estese lo studio di queste sostanze anche ad altri organismi che occupano le posizioni più basse della scala evolutiva, come, ad es., gli anfibi (e soprattutto le rane). Se ne è individuata la presenza sulla cute di questi animali. E si è fatta una interessante comparazione con molte di quelle prodotte nello stomaco, che, pertanto, è una formidabile fonte di lipidi. L’assimilazione non è sempre applicabile: in alcuni casi, infatti, si tratta di sostanze altamente velenose per la specie umana. Egualmente, vanno notate queste proprietà comuni alle varie specie. Dislocazione di queste cellule secernenti endocrine nell’ambito di una struttura ghiandolare esocrina. (Vedi Figura 1). Abbiamo considerato le ghiandole tubulari semplici (del corpo dello stomaco) e le ghiandole tubulari ramificate (della zona cardiale e pilorica). Si vede che nel fondo degli adenomeri si evidenzia la presenza di queste cellule cromo-affini e argento-affini. (Vedi Figura 2). Abbiamo preso in esame anche l’epitelio secernente della parete intestinale. Qui, si individuano delle estroflessioni villose e delle introflessioni. Si vede la presenza di queste cellule cromo-affini e argento-affini a carattere endocrino nelle introflessioni e sulla superficie dei villi. Morfologia di una cellula endocrina isolata gastroenterica. (Vedi Figura 3). L’analisi è condotta mediante tecniche di microscopia ottica. Si individuano fondamentalmente 2 contrassegni ultrastrutturali caratteristici: - Presenza di granuli di deposito nella zona basale. Si tratta di sostanze miste che conferiscono alla cellula la cromo-affinità e la argento-affinità. - Presenza di vescicole, in cui sono contenute le sostanze peptidiche (che non producono assolutamente la caratteristica cromo-affinità e argento-affinità). Sistema neuroendocrino diffuso monoaminergico e peptidergico (sistema APUD). (Il prefisso “neuro” dipende dalla condizione di parentela con le cellule nervose. Queste cellule endocrine isolate trovano una precisa allocazione nel foglietto ectodermico dell’embrione in abbozzi prossimi a quello da cui originerà il sistema nervoso: il tubo neurale. Al di sopra di esso troviamo, appunto, escrescenze specifiche che prendono il nome di creste neurali, da cui si sviluppano alcune di queste cellule endocrine isolate. Si ha, dunque, un rapporto di parentela topografica, tanto che, per questo motivo, le suddette cellule assumono la caratteristica denominazione di paraneuroni). Si possono distinguere il vasto microcosmo delle cellule isolate endocrine (che annovera oltre 200 citotipi) in 3 grandi classi: - Cellule endocrine APUD del Sistema nervoso centrale e periferico. - Cellule endocrine APUD del Sistema GEP. - Cellule endocrine APUD di Sistemi organici variamente distribuiti. Si parla di Sistema GEP (Sistema gastro-enterico-pancreatico). Si effettua questa assimilazione per la stessa caratterizzazione strutturale (fra cui, presenza di cromo-affinità ed argento-affinità) e per le molte analogie funzionali. Tanto che, vedremo, anche a livello di nomenclatura, spesso, ci si serve di nomi, per distinguere i vari citotipi, analoghi. Esempi di ghiandole endocrine variamente distribuite li si individua nel cuore e negli organi gonadali. Parametri comuni ai citotipi endocrino-diffusi. Che consentono l’identificazione dei vari citotipi nei 3 principali Sistemi APUD. Caratteristiche ultrastrutturali. Caratteristiche istochimiche. - Funzione monoaminergica. - Funzione peptidergica. Caratteristiche embriologiche. Vediamo di analizzare più nello specifico questi aspetti. CARATTERISTICHE ULTRASTRUTTURALI. - Disposizione dell’apparecchio membranoso del citoplasma. Che, peraltro, presenta le stesse caratteristiche generali delle cellule ad elevata attività protidosintetica: RER e Complesso del Golgi in forma attivata e loro vicinanza al nucleo. - Sede, forma, volume e aspetto elettron-microscopico dei granuli. In base a queste caratteristiche possiamo distinguere le varie tipologie di cellule endocrine isolate le une dalle altre. - Sequenza degli eventi ultrastrutturali di ormonopoiesi. - Dispositivi ultrastrutturali (microvilli terminali assonici) correlati alla stimolazione dell’ormonopoiesi. In base a quest’ultima classificazione distinguiamo ulteriormente in: 1) Cellule di tipo aperto. Se affiorano sulla superficie del lume. Ad es., nel lume gastroenterico la loro sommità e post-tubulare. Esse hanno un meccanismo di regolazione dell’attività secernente in funzione della natura chimica delle sostanze ingerite, poiché entrano a diretto contatto con queste ultime avendo la sommità post-tubulare. 2) Cellule di tipo chiuso. Se non si ha alcuna apertura sulla superficie luminale, ma sull’interno, sul connettivo. Caratteristiche istochimiche. Affinità per i sali di metalli pesanti. Si distingue in: - Cromo-affinità e Argento-affinità. - Cromo-filia e Argento-filia. E va precisato che sussiste una grande differenza fra le 2 proprietà. Le prime 2 indicano, infatti, la capacità dei citotipi che la possiedono di assumere e ridurre sali di metalli pesanti, mentre le ultime 2, la capacità di assumere e non di ridurre sali di metalli pesanti. Metacromasia spontanea e mascherata. Reattività all’azione di alcuni coloranti che le colorano in maniera differente rispetto al colore iniziale. Attività enzimatiche. Se possiedono la proprietà monoaminergica, ad es., dovranno possedere gli enzimi specifici che la catalizzano. Caratteristiche istogenetiche. Abbiamo già citato il rapporto di parentela topografica embrionale nel foglietto ectodermico con le cellule prettamente nervose, tanto da parlare di paraneuroni. E questo rapporto di parentela non si individua unicamente a livello topografico, ma anche funzionale. Ad es., le cellule della porzione midollare della ghiandola surrenale (che, non a caso, derivano istogeneticamente proprio dalle creste neurali) secerno catecolamine. Vero è che in questo caso queste sostanze sono immesse nel circolo ematico sotto forma di sostanze ormonali, mentre nel caso delle cellule endocrine diffuse si ha, spesso, una secrezione di tipo paracrino, localizzata nella zona prossima alla cellula secernente e svolgente un’azione stimolatrice su altre cellule contigue, ma si tratta sempre dello stesso tipo di sostanze, chimicamente parlando. E’ questo un classico esempio di stesse sostanze che in distretti differenti esplicano un differente ruolo funzionale. (Vedi Figura 4). Come si vede, da un’unica locazione embrionale, le creste neurali, si originano svariati citotipi che possiamo distinguere inizialmente in: - Cellule del Sistema nervoso-enterico. - Cellule del Sistema endocrino diffuso. E, per il primo caso, distinguiamo in: - Cellule endocrine. - Cellule paracrine. Mentre, per il primo caso, parliamo di: - Cellule gangliari. Principali esempi di cellule endocrine dello stomaco. - Cellule G gastrina (sono le più antiche). - Cellule D somatostatina. - Cellule D-1 VIP (peptide vaso-attivo intestinale). Principali esempi di cellule endocrine dell’intestino. - Cellule D-1 VIP. (E’ chiaro che, come detto, individueremo citotipi con analoghe caratteristiche funzionali e strutturali nell’intestino, nello stomaco e nel pancreas. Tanto da parlare di GEP complex e da attribuire la stessa nomenclatura a vari citotipi dei 3 organi). DISLOCAZIONE TOPOGRAFICA DELLE GHIANDOLE ESOCRINE CLASSIFICATE SULLA BASE DELLA FORMA DELL’ADENOMERO. Tubulo-alveolari. E quindi, in forma mista. Si distinguono in: 1) RAMIFICATE. - Ghiandole esocrine della prostata. La prostata è una ghiandola annessa in parte alle vie genitali maschili che, oggi sappiamo, esplica non solo una funzione esocrina, ma anche endocrina. - Ghiandole esocrine duodenali di Brunner. Ne abbiamo già parlando, trattando la caratterizzazione ghiandolare della parete intestinale. Si tratta dell’unico caso di ghiandole intraparietali sottomucosali. Acinose. Se ne distinguono più tipi 1) SEMPLICI. - Ghiandole sebacee minori. Sempre a secrezione olocrina. 2) RAMIFICATE. - Ghiandole sebacee maggiori. - Alcune ghiandole salivari minori (quelle del palato, della radice linguale e delle guance). 3) - COMPOSTE. Alcune ghiandole salivari minori (linguali anteriori). Alcune ghiandole oroesofagee. Pancreas esocrino. Grosso organo ghiandolare disposto posteriormente allo stomaco. Vi si riconosce una funzionalità in parte esocrina ed in parte endocrina (ad opera delle cosiddette Isole di Langherans). Ma non fa più scalpore il fatto che nella organizzazione di una ghiandola a significato esocrino, si individuino anche strutture secernenti a carattere endocrino. - Ghiandole salivari maggiori (la parotide, la sottomascellare e la sottolinguale). Da un punto di vista topografico sono ghiandole extraparietali. Sono 3 per ciascun lato della linea mediana. La loro porzione parenchimale è rappresentata da un tessuto epiteliale che rappresenta gli adenomeri. Ghiandole salivari acinose ramificate. Si tratta di strutture ghiandolari ramificate (i cui grappoli sono rappresentati dagli adenomeri) che assumono la cosiddetta “conformazione a grappolo”. (Vedi Figura 1). Nella figura è rappresentata solo una porzione terminale dell’intera struttura ghiandolare. Quello che appare come un condotto principale (e che, in realtà, è solo una diramazione estrema) prende il nome di condotto salivare. A sua volta, il condotto salivare si ramifica ulteriormente in ramificazione terminali che vengono dette “condotti preterminali”, a cui, in forma di grappoli, sono appesi i vari adenomeri ghiandolari. Nel corso degli anni, è sorta una notevole confusione in merito allo studio del tipo di secrezione di queste ghiandole. A differenza delle parotide che ha una caratterizzazione di secrezione sierosa pura (priva, cioè, di alcuna componente mucosale), la sottomascellare e la sottolinguale hanno una caratterizzazione di secrezione e sierosa e mucosa. Ma gli adenomeri delle ultime 2 formazioni ghiandolari hanno una caratterizzazione unicamente sierosa. E allora ci si chiede: da dove proviene la componente mucosa? Il condotto preterminale ha pareti costituite da cellule prismatiche. Tuttavia, in alcune sezioni del tubulo preterminale le cellule parietali aumentano in numero e in dimensioni: sembrano rigonfie e risultano essere addossate e compresse in quanto occupano uno spazio troppo ristretto per la locazione consentita loro dall’origine istogenetica. Il loro nucleo sembra schiacciato da un certo contenuto. Si sono differenziate in senso secretivo e, in effetti elaborano una secrezione mucosa, tanto che l’immagine microscopica che se ne ha è di un citoplasma quasi “vuoto”, dal momento che il muco appare trasparente. Al contrario, sezionando gli acini si vede che essi appaiono all’indagine microscopica con un aspetto “finemente polverulento”, granulare, caratteristico di una secrezione di tipo sieroso. Ecco che allora è sorto l’equivoco di supporre la presenza di acini a secrezione mucosa: in realtà, come detto, gli acini sono solo a secrezione sierosa e la secrezione mucosa è elaborata da una quota parte delle suddette cellule parietali, che hanno questa specifica funzione secernente. (Vedi Figura 2). Spesso, però, la presenza di queste cellule del tubulo preterminale a secrezione mucosa determina una caratteristica modificazione della struttura dell’adenomero acinoso a causa delle forze pressorie determinate dal rigonfiamento caratteristico delle cellule parietali preterminali adibite ad una funzione secernente mucosale. Talvolta, queste strutture cellulari entrano addirittura parzialmente all’interno della struttura adenomerica, determinandone una manifesta mutazione conformazionale da acinosi a semilunari. Si parla, infatti, di “semilune del Giannuzzi” e di ghiandole semilunari. Esse hanno ulteriormente sostanziato la erronea convinzione di molti circa l’esistenza di formazioni adenomeriche secernenti a carattere mucosale. Per cui, per sottomucosali e sottomascellari si avrà una secrezione mista di tipo seiromucosa (perché si ha la prevalenza della componente sierosa). Ovviamente, le formazioni semilunari avranno una caratterizzazione muco-sierosa (i termini sono invertiti poiché la secrezione mucosa prevale su quella sierosa). Ed infine, le ghiandole parietali che avranno una caratterizzazione esclusivamente sierosa. (Vedi Figura 3). Inoltre, gli acini all’esterno si trovano, molto spesso, soppannati da cellule speciali che osservate frontalmente mostrano atteggiamenti morfologici particolari: sono provviste di prolungamenti attraverso i quali si abbarbicano sulla superficie esterna della struttura adenomerica imbrigliandola. Possono ricordare, per la loro attività contrattile, cellule muscolari. Ma si tratta di cellule del tessuto epiteliale. Esse sono dette cellule mioepitelioidi o cellule a canestro o basket cells. Hanno la funzione di esercitare una vera e propria spremitura degli acini. Molte cellule della struttura, infatti, sono distanti dal condotto escretore. E così, perché il loro prodotto di secrezione ne imbocchi la via è necessaria una sorta di vis a tergo: una spremitura. Ancora una volta si ha un intimo rapporto tra struttura e funzione. COSTELLAZIONE NEUROENDOCRINA. Sistema ipotalamo-ipofisiario e ghiandole endocrine bersaglio. Sistema neuroendocrino diffuso. Vediamo di capire, tuttavia, genericamente, perché si parla di “Sistema neuroendocrino” e non semplicemente di “Sistema endocrino”. Tale terminologia è stata acquisita alla fine degli anni ’50 sulla base di alcune precise acquisizioni. Precedentemente, infatti, si parlava di ghiandole e costellazioni endocrine. E, in questo contesto, l’ipofisi sembrava, mediante una secrezione di natura ormonale, esercitare la funzione di ghiandola-controllore e regolatore della intera costellazione di ghiandole endocrine che, pertanto, vennero definite ghiandolebersaglio. Successivamente, però, si destituì l’ipofisi della carica di ghiandola-direttrice e ghiandola-maestra , perché sembrava, a sua volta, subire l’azione regolatrice di una struttura della base encefalica: l’ipotalamo. Si tratta di una formazione impari e mediana dell’encefalo del quale occupa la superficie ventrale, formando la parte inferiore del diencefalo che da un punto di vista topografico sovrasta l’ipofisi. Così, oltre che topograficamente (ed anche embriologicamente, si scopre in seguito), queste zone del sistema nervoso ne sono sovrastanti l’ipofisi anche da un punto di vista funzionale. Ecco che, allora, si parla di Sistema ipotalamo-ipofisiario e delle ghiandolebersaglio. Ed in effetti, se è vero che l’ipotalamo esercita la suprema azione di controllo sull’ipofisi mediante secrezioni a carattere incretivo-ormonale, è pur vero che anch’esso può, a tutti gli effetti, essere considerato una struttura a carattere endocrino, tanto che si parla di Ipotalamo endocrino. D’altra parte, però, anche una tale classificazione risulta essere incompleta. Si scoprirono, infatti, e si continuano a scoprire tutt’oggi, accanto al Sistema neuroendocrino e delle ghiandole-bersaglio tradizionale, un vasto, complesso ed eterogeneo sistema di oltre 200 citotipi, a carattere incretivo-ormonale, con le dislocazioni più disparate (anche all’interno di strutture a carattere esocrino), che danno vita al cosiddetto Sistema neuroendocrino diffuso. Infatti, il numero di strutture secernenti a carattere manifestamente endocrino è realmente molto piccolo. Ma a fronte, si ha un vero e proprio microcosmo di strutture secernenti, sebbene in molti casi isolate, che costituiscono il Sistema neuroendocrino diffuso. Criteri di classificazione del Sistema ipotalamo-ipofisario e delle ghiandole-bersaglio. Morfologico-topografico. Chimico (di analisi dell’increto). Aspetto morfologico-topografico. Tiene conto della conformazione e della locazione di queste strutture ghiandolari. Si distingue in: - Ghiandole follicolari. Le cellule che ne sono costitutive si dispongono caratteristicamente in modo da formare vescicole, e quindi strutture cavitate di aspetto tondeggiante. - Ghiandole cordonali. Si hanno quando le cellule endocrine sono appunto disposte in filiere, in cordoni. - Ghiandole interstiziali. Questa volta, la classificazione è sulla base della sede di locazione: gli interstizi degli organi, e cioè il loro stroma e mai nel parenchima (i cui citotipi hanno funzioni diverse). Esse sono: nella donna, le ghiandole interstiziali dell’ovaio; nell’uomo, le ghiandole interstiziali dei testicoli. - Ghiandole a rete. Quando si dispongono in filiere molto sottili che si intrecciano, dando vita ad una struttura a rete e a maglie larghe. Il timo ne è l’esempio più caratteristico. Aspetto chimico. - Ormoni glicoproteici. - Ormoni lipidici: steoidi. L’IPOFISI. Un aspetto morfologico caratteristico di quest’organo è una propaggine, un peduncolo che lo collega alle strutture sovrastanti, di natura nervosa. (Vedi Figura 1). Come si vede, sono presenti cellule nervose i cui prolungamenti sfioccano nei 3 settori in cui si può suddividere l’ipofisi: - Lobo (o distretto) anteriore. - Lobo (o distretto) intermedio. - Lobo (o distretto) posteriore. ADENOIPOFISI O IPOFISI GHIANDOLARE (LOBO ANTERIORE). Il lobo anteriore è la classica adenoipofisi. Esso fa assumere specificatamente all’ipofisi l’attribuzione di ghiandola: ipofisi ghiandolare. Si ha un processo secretivo di tipo endocrino. Sicuramente, è costituita da cellule che elaborano ormoni che regolano il comportamento delle ghiandole-bersaglio: gli ormoni tropici o tropine. LOBO INTERMEDIO. Anche al lobo intermedio è tradizionalmente ascritta la proprietà ormonopoietica, per l’elaborazione di un ormone che prende il nome di intermedina. IPOFISI NERVOSA O NEUROIPOFISI (LOBO POSTERIORE). Il lobo posteriore è quello la cui interpretazione funzionale ha suscitato più problemi. Per lungo tempo è stato erroneamente considerato produttore di ormoni. E’ stato definito neuroipofisi perché la parte più alta è costituita da una sorta di peduncolo, che pone in contatto l’intera ipofisi con le strutture nervose sovrastanti. E allora si commette l’errore di pensare a una possibile secrezione incretiva ormonale: i cosiddetti ormoni neuroipofisari. In realtà, si ha un vero e proprio rapporto di sudditanza dell’ipotesi all’encefalo: ed ecco che si parla di Sistema ipotalamo-ipofisario. Si ha un collegamento delle 2 strutture istologiche, attraverso i prolungamenti delle cellule nervose, i cui corpi abitano nell’ipotalamo, e che si immettono proprio in questo lobo dell’ipofisi. Proprio per questo motivo si parla di ipofisi nervosa o neuroipofisi. In passato si credeva, appunto, che le cellule della neuroipofisi (dette cellule pituicitarie o cellule di nevroglia (complesso di elementi cellulari di origine ectodermica che ha stretto rapporto con i neuroni ma che è funzionalmente distinto dal tessuto nervoso vero e proprio) elaborassero sostanze ormonali: gli ormoni neuroipofisari. Adesso, si è capito che, in realtà, queste sostanze ormonali non nascono in loco, ma sono il frutto dell’attività secretiva delle sovrastanti strutture nervose. Si parla, allora, correttamente, di neurosecrezione dell’ipotalamo. Quindi, riassumendo, gli elementi che ci consentono di definire il lobo posteriore dell’ipofisi “Neuroipofisi” o “Ipofisi ghiandolare” sono fondamentalmente 2: 1) Il fatto che questa sezione della ipofisi è in comunicazione, sul suo versante apicale, tramite una sorta di peduncolo, con le strutture nervose sovrastanti. 2) Perché da un punto di vista embriologico, a differenza del resto della ipofisi, in parte deriva dalle suddette strutture nervose. Derivazione embriologica della neuroipofisi. (Vedi Figura 1). (1) Come si vede, da un punto di vista embriologico, si individuano: - Una grande struttura di derivazione del tessuto osseo da cui, in seguito ad ulteriori modificazioni conformazionali si originerà l’osso sfenoidale. - Una grande cavità della quale si individua il rivestimento ectodermico, per cui si parla di rivestimento ectodermico della cavità buccale primitiva. - Una sopraelevazione dell’ectoderma della cavità buccale primitiva. - Uno strato di derivazione delle strutture nervose adeso su una delle due superfici del rivestimento ectodermico della cavità buccale. (2) Come si vede, si avrà una consistente estroflessione del rivestimento ectodermico della cavità buccale primitiva e, conseguentemente, dello strato sovrastante di derivazione nervosa. Si forma quella struttura che prende il nome di tasca di Riske. Conseguentemente, accanto alla suddetta estroflessione vi sarà la formazione di una introflessione. (3) Intanto lo strato di derivazione del tessuto osseo si è ulteriormente modificato, dando vita alla conformazione dell’osso sfenoidale. La estroflessione del passaggio precedente che, ormai, sembra essersi interamente chiusa su se stessa, appare essere interamente inglobata in uno spazio cavitato dell’osso sfenoidale. Lo strato di derivazione delle strutture nervose sembra ripiegarsi ulteriormente dando vita ad una struttura quasi ad ansa. (4) E’ come se le 2 entità considerate si condensassero in un’unica struttura più o meno globata, che rientra nell’incavo naturale dell’osso sfenoidale, costituendo l’ipofisi. E di questa distinguiamo 3 settori, fra i quali uno risulterà essere di derivazione prettamente nervosa e sarà quello posteriore della neuroipofisi o ipofisi nervosa. Meccanismo di feedback: di regolazione e controregolazione. Abbiamo detto che la ipofisi anteriore è quella porzione della ipofisi devoluta alla regolazione delle ghiandole-bersaglio facenti parte della costellazione delle ghiandole endocrine. Tale operazione di controllo e di regolazione si fonda sul tasso di ormoni lanciati proprio da questa porzione della ipofisi nel sangue. Essi, in parte sono suscettibili all’azione di coloranti in parte non lo sono, e pertanto li si distingue in cromofili e cromofobi. Dal momento che presentano un tropismo caratteristico nei confronti delle varie ghiandole-bersaglio, abbiamo detto, si parla specificatamente di tropine ipofisarie. Queste sostanze ormonali vanno a stimolare la produzione dei vari ormoni a livello delle varie ghiandole-bersaglio, mediante una via che prende il nome di segmento anterogrado: perché procede in senso vettoriale dalla ipofisi alle ghiandole-bersaglio. D’altro canto, si ha un meccanismo di controregolazione: segmento retrogrado, che procede in senso vettoriale dalle ghiandole-bersaglio all’ipofisi. Il sistema prevede che, in conseguenza di un’eccessiva produzione di ormoni da parte delle varie ghiandole-bersaglio, in conseguenza di un’eccessiva stimolazione da parte della ipofisi con la sua secrezione ormonale, vi sia un bloccaggio dell’attività di secrezione della ipofisi stessa, in conseguenza di una sua stimolazione da parte degli ormoni prodotti dalle ghiandole bersaglio, che avranno raggiunto range di concentrazione superiori alla norma. Ovviamente, dunque, si tratta di un sistema di controllo che si realizza per via ematica e che si fonda su un equilibrio di concentrazione sia degli ormoni tropici dell’anteipofisi sia degli ormoni delle ghiandole-bersaglio. Va precisato che, in un caso e nell’altro, quando parliamo di secrezione endocrina parliamo di produzioni minimali dell’ordine dei millesimi di mg, dei picogrammi. Le varie ghiandole-bersaglio che devono essere stimolate sono: - Tiroide. - Ghiandole surrenali. - Strutture endocrine del testicolo e dell’ovaio. - Strutture di stimolo dell’accrescimento osseo. - Ghiandole mammarie in corso di allattamento. Ipopituitarismo e Panipopituitarismo. Nel primo caso, condizione morbosa che si caratterizza per una deficienza delle funzioni ipofisarie, a seconda del grado di distruzione delle cellule dell’Anteipofisi, a causa di agenti anomali come formazioni neoplastiche. In questo caso, lo smantellamento delle cellule secernenti che producono le tropine che andranno a stimolare le ghiandole-bersaglio è solo parziale, e così altrettanto parziale è la compromissione delle funzionalità realizzate dall’attività secernente dell’ipofisi. Al contrario, nel secondo caso, si avrà, sempre a causa di agenti tumorali, la distruzione di una sostanziale quota parte delle cellule secernenti adenoipofisarie e , di conseguenza, una totale compromissione della loro attività funzionale. Con le nefaste conseguenze che ne derivano. IPOTALAMO ENDOCRINO. 1) Sistema ipotalamico-neuromagnocellulare. 2) Sistema ipotalamico-neuroparvicellulare. Fin d’ora, tuttavia, è necessario fare una precisazione. Nel caso del Sistema ipotalamico-neuromagnocellulare non si ha alcun esercizio di regolazione nei confronti della neuroipofisi (e cioè, nei confronti della porzione della ipofisi in cui le sostanze prodotte da specifico nuclei dell’ipotalamo vengono riversate). Al contrario, l’attività di regolazione nei confronti dell’attività secernente della adenoipofisi è caratteristica particolare del Sistema ipotalamiconeuroparvicellulare (che, proprio per questo motivo, vedremo, è detto anche Sistema parvicellulare ipofisiotropico. Sistema ipotalamico-neuromagnocellulare. L’attenzione degli studiosi, in questo ambito, ritorna all’esame del lobo posteriore o neuroipofisi, che risulta essere collegato - da un punto di vista topografico - da un punto di vista embriologico alle strutture nervose sovrastanti. Ed ecco che, intorno agli anni ’50, ad opera degli coniugi Scherrer, viene elaborato il concetto di neurosecrezione: di attribuzione della capacità secretiva (oltre che della canonica capacità trasmittente dell’impulso nervoso) di sostanze specifiche di tipo ormonale alle cellule nervose. E quindi, gli ormoni allocati nella neuroipofisi (che erroneamente sono detti ormoni neuroipofisari) non provengono dalle sue costitutive cellule di nevroglia o cellule pitucitarie, ma dalle cellule nervose sovrastanti. Quindi, tali sostanze pervengono alla neuroipofisi attraverso i prolungamenti delle suddette cellule nervose, i neuriti o assoni, che, nel loro complesso, costituiscono la cosiddetta struttura peduncolare di rapporto fra la neuroipofisi e i corpi, i pirenofori delle cellule nervose stesse. E le sostanze prodotte sono 2: - Ossitocina. Che controlla la contrattilità della parete uterina durante l’espulsione del feto. - Adiuretina-vasopressina. Adiuretina perché rappresenta un freno inibitorio della eliminazione della urina. Vasopressina per l’azione vasocostrittrice-ipertensiva. Quindi, la neuroipofisi non è un locus di sintesi, bensì di accumulo. La produzione di queste sostanze avviene ad opera di 2 gruppi fondamentali di cellule nervose. Costituiscono 2 nuclei cellulari dell’ipotalamo (ove si intende per “nuclei”: raggruppamenti cellulari) e trattandosi di cellule nervose che presentano corpi cellulari, pirenofori di grandi dimensioni, vengono detti nuclei magnocellulari: 1) Nucleo sopraottico (N.S.O.). (Così detto perché allocato sopra il “chiasma ottico”). 2) Nucleo paraventricolare. (Così detto perché ai lati di una cavità tipica scavata nello spessore dell’ipotalamo, detta “terzo ventricolo”). (Vedi Figura 1). Si tratta di una sezione sagittale. Come si vede, è possibile individuare la lamina sovraottica e il chiasma ottico, al di sopra del quale individuiamo il nucleo sovraottico. Si ha anche il terzo ventricolo, ai lati del quale individuiamo il nucleo paraventricolare. Si individua, infine, il cosiddetto pavimento dell’ipotalamo, che prende specificatamente il nome di eminenza mediana. Dalla eminenza mediana si diparte il peduncolo che mette in comunicazione l’ipotalamo con il lobo posteriore. Analizzeremo successivamente la conformazione della eminenza mediana. Ecco che si parla di Sistema ipotalamico-neuromagnocellulare. Ed è questo un concetto che sta alla base della Neuroendocrinologia. Per evidenziare queste cellule del Nucleo sopraottico, ci si serve del cosiddetto “Metodo di Gomori”, una miscela di coloranti cromoematoxidina e filoxina, per tingere il citoplasma dei pirenofori dei nuclei. Oggi si utilizza un metodo più rivoluzionario: il metodo immunocitochimico (per cui si colorano in maniera selettiva i citoplasmi di alcuni citotipi, che sono maggiormente reattivi). Oggigiorno, si è visto che gli ormoni elaborati dal nucleo sopraottico e dal nucleo paraventricolare sono di più che i canonici 2: si tratta di ormoni di natura proteica. Essi sono stati caratterizzati chimicamente da Duignòn. (Vedi Figura 2). Come si vede, i nuclei paraventricolari sembrano ali di farfalla vicino alla cavità del terzo ventricolo. (Vedi Figura 3). Si tratta della conformazione del neurone muco-secernente. Si ha il pirenoforo, il corpo della cellula nervosa. Si vede il prolungamento, che prende il nome di neurite o assone. L’estremità termina nella rete vascolare che bagna la neuroipofisi. Si parla, allora, di via neuritica. Ed è, quindi, una via nervosa, non una via ematica. Il peduncolo ipofisario è costituito dagli assoni dei 2 nuclei. Ecco, allora, che si parla di Sistema ipotalamo-neuromagnocellulare. CARATTERIZZAZIONE FUNZIONALE DELL’ADH (AdiuretinaVasopressina). Da un punto di vista topografico, esplica la sua azione sui tubuli renali. Qui, la preurina è filtrata nel glomerulo, da cui successivamente imbocca le vie escretrici. Nella capsula di Bowman, ogni giorno viene filtrata una quantità enorme di liquido. Esso, tuttavia, si riduce in ultimo a 1 l- 1,5 l (e cioè, a confronto, ad una quantità davvero minimale). Questo si verifica perché in condizioni fisiologiche, avvengono 2 tipi di riassorbimento: 1) Assorbimento obbligatorio. Si tratta di un riassorbimento di ingenti quantità di acqua, che avviene nei tubuli renali, mediante un trasporto passivo che si verifica attraverso un gradiente osmotico. 2) Assorbimento facoltativo. Si ha verso la fine. Esso è consentito dall’azione antidiuretica già citata dell’ADH. Abbiamo già trattato come, la provenienza di questo ormone, in realtà non è ipofisaria, bensì ipotalamico-magnocellulare. Da un punto di vista della patologia, si deve notare che in caso di scombussolamento funzionale dell’ipotalamo, a causa di tumori o granulomatosi, si avrà una ripercussione su tale attività di riassorbimento, che verrà irrimediabilmente compromessa (in quanto non si avrà più produzione di ADH). E allora, il paziente può arrivare ad urinare fino a 20 l di liquido al giorno. Si avrà quella patologia impropriamente detta di diabete insipido (perché l’urina non ha più il caratteristico sapore dolciastro del diabete mellito). Da un punto di vista terapeutico, occorre intervenire tempestivamente con la somministrazione di ormoni ADH. CARATTERIZZAZIONE FUNZIONALE DELL’OSSITOCINA. Essa entra in azione al momento dell’espulsione del prodotto del concepimento e durante l’allattamento. E’ un importante stimolatore che si va a legare ai recettori di membrana delle cellule muscolari del corpo dell’utero gravido (e solo dell’utero gravido). Da un punto di vista della patologia, avremo le cosiddette discinesie, che si configurano come vere e proprie turbe della motilità. Alle volte, quando è necessario, il parto può essere addirittura indotto mediante somministrazione esterna di ossitocina. Sistema ipotalamo-neuroparvicellulare o Sistema parvicellulare ipofisiotropico. Abbiamo già discusso il significato della seconda attribuzione: tropismo spiccato ed attività di regolazione nei confronti della adenoipofisi, a differenza del Sistema ipotalamo-neuroparvicellulare nei confronti della neuroipofisi. Riguarda il meccanismo con cui l’ipotalamo regola la adenoipofisi. Il suo studio si è effettuato principalmente negli ultimi 15 anni. E’ proprio la ipofisi anteriore che riceve un meccanismo di regolazione dall’ipotalamo sovrastante. Nell’ipotalamo, pertanto, si identifica una serie più numerosa di cellule nervose. Esse elaborano i cosiddetti principi: increti di derivazione ipotalamica che regolano la liberazione dell tropine ipofisarie. Si ha, quindi, una regolazione nel senso della stimolazione ed inibizione. Così, inizialmente si parlò di realising and inibiting factors (fattori di rilascio e di inibizione). Ma, poiché, in seguito, si chiarì che agiscono per via ematica, li si caratterizzò specificatamente come ormoni. Ed ecco che si parla di Sistema parvicellulare. (Vedi Figura 1). Si individuano piccoli neuroni diffusi che elaborano i “realising and inibiting factors”: il cosiddetto “Sistema parvicellulare”. I corpi, i pirenofori dei citotipi nervosi secernenti sono molto più piccoli (ed è per questo che si parla di “Sistema parvicellulare”), e si identificano in 8-9 stazioni (non più soltanto 2) dai confini non molto netti. (Vedi Figura 2). Come si vede, è possibile individuare l’ipotalamo al di sotto della regione del Talamo (come lo stesso nome rende esplicito). E qui sono presenti varie formazioni nucleari (non solo le 2 formazioni nucleari del Sistema magnocellulare). Due di queste sono: - Nucleo ventromediale. - Nucleo arcuato. Ma, come detto, ne sono presento molti altri, essendo complessivamente presenti 8-9 nuclei di cellule. (Vedi Figura 3). In questo caso, la via di dismissione non è più solo neuronale. Si parla di via mista: in parte neuronale, nel primo segmento, e in parte ematica, nel secondo segmento. Il secreto è prodotto dal corpo della piccola cellula nervosa secernente e viene dismesso attraverso il suo prolungamento, neurite o assone. Il secreto è riversato in una prima via capillare. Si ha poi la vena porta inferiore. Si ha poi una seconda via capillare. E poi il passaggio delle sostanze ormonali di regolazione alle cellule anteipofisarie. Quindi, come si vede, la via di dismissione del secreto è mista: in parte per via neuronale e in parte per via ematica. In definitiva, si parla di Sistema portale-ipofisario. Conformazione strutturale della Eminenza mediana. Nella “Eminenza mediana”, come detto, individuiamo specificatamente 2 strati: 1) Zona interna o Strato interno. La parte più alta, che sottende immediatamente il recesso infundibolare. 2) Zona esterna o Strato esterno o Zona vascolarizzata. La parte più bassa, da cui si diparte il peduncolo dell’anteipofisi. (Vedi figura 4). Sulla base di un’analisi micronelettronica, è possibile distinguere la “zona interna”, che si caratterizza per un aspetto caratteristicamente elettron-opaco, dalla “zona esterna” che, al contrario, appare quasi traforata da spazi trasparenti al fascio elettronico e circondati da materiale puntiforme elettronopaco. I pirenofori dimensionalmente consistenti dei 2 nuclei magnocellulari emanano prolungamenti che si impacchettano nella zona interna della eminenza mediana, sciamando, ancora più in basso, per ricongiungersi nella costituzione di quel peduncolo di collegamento con la neuroipofisi. Al contrario, gli spazi trasparenti della “zona esterna” corrispondono ai lumi di un sistema di capillari: la prima rete capillare del “Sistema portale-ipofisaro”. Dunque, proprio in questa zona esterna della Eminenza mediana, si ha la confluenza dei prolungamenti delle cellule nervose (dai pirenofori dimensionalmente poco consistenti) dei nuclei parvicellulari. Tali prolungamenti scaricano nel lume dei capillari di questa “Prima via capillare” i loro “Realising factors” ed “Inhibiting factors”. Si ha, successivamente, il loro passaggio alla vena porta inferiore o vena ipofisaria, che costeggia il peduncolo della ipofsi. Ed infine, la dismissione di queste sostanze nella “Seconda via capillare”, di ingresso all’anteipofisi. (Vedi Figura 5). Come si vede, sono schematizzate alcune cellule facenti parte del Sistema parvicellulare, caratterizzate da pirenofori piccoli e da prolungamenti che si immettono nella Prima rete capillare del Sistema portale-ipofisario. Essa, come dice lo stesso termine, è costituita da tutta una serie di diramazioni che derivano, in prima istanza dalla cosiddetta Arteria ipofisaria superiore che, a sua volta, deriva dalla Arteria Carotide. Si ha poi il passaggio alla Vena porta inferiore, che costeggia parallelamente il peduncolo (che unisce l’ipotalamo alla neuroipofisi). Ed infine, la Vena porta inferiore si dirama in un ulteriore complesso di capillari: la Seconda rete capillare del Sistema portale-ipofisario. I “Fattori di rilascio” e i “Fattori di inibizione” possono essere così trasferiti, per via ematica, alle cellule secernenti della Adenoipofisi (che ne sono irrorate) ed esercitare, pertanto, quella fondamentale attività di regolazione e di controllo. Infine, i prodotti di secrezione della Adenoipofisi (secreti, appunto, sulla base della attività di regolazione dell’ipotalamo) entrano in circolo, attraverso la cosiddetta Vena Giugulare interna. NEUROPEPTIDI ORMONALI IPOTALAMICI. Va detto fin d’ora che è stato codificato un ben preciso simbolismo, che ci consente di siglare in maniera ottimale i vari prodotti di secrezione sulla base della loro principale attitudine funzionale. Troveremo, ad es., la sigla - “RF” per intendere “Realising factors”, e la sigla - “IF” per intendere “Inhibiting factors”. A dire il vero, però, ormai le suddette sigle sono sostituite dalle seguenti: - “RH” per intendere “Realising hormon”. - “IH” per intendere “Inhibiting hormon”. Simbolismo che, per quanto riguarda la specificazione del prodotto di secrezione consente una certa analogia fra i Neuropeptidi ormonali ipotalamici e i relativi prodotti di secrezione ipofisari. Va precisato che è, oggigiorno, possibile individuare con una selettività realmente sorprendente i citotipi che elaborano i singoli prodotti di secrezione sulla base di un Metodo immunoistochimico, mediante l’utilizzo di un “antisiero” tracciante radioattivo. A) Neurormoni del Sistema magnocellulare. ADH (ADIURETINA-VASOPRESSINA). OSSITOCINA. B) Neurormoni del Sistema parvicellulare-ipofisiotropico. Si suddividono a loro volta in: 1) Stimolanti il rilascio di ormoni adenoipofisari (REALISING FACTORS). CRH o CORTICOLIBERINA. Essa stimola, nell’Adenoipofisi, il rilascio di ACTH o ORMONE ADENOCORTICOTROPO. Esso agisce su una delle due porzioni della ghiandola surrenale: la corteccia del surrene o corticale del surrene. In questo senso, la porzione corticale della ghiandola surrenale è la ghiandolabersaglio dell’ACTH ipofisario. TRH o TIREOLIBERINA. Stimolante il rilascio del TSH o ORMONE TIREOSTIMOLANTE, per il suo spiccato tropismo nei confronti della tiroide. PRF o PROLATTOLIBERINA. ( In questo caso, si è mantenuta la sigla “RF”). Stimola il rilascio del PRL o PROLATTINA. GH-RF o GROWTH-HORMON o SOMATOLIBERINA. Stimolante il rilascio dell’ STH o ORMONE SOMATOTROPO. LH-RH o Gn-RH o GONADOLIBERINA. Stimolante il rilascio dell’ LH (ORMONE LUTEOSTIMOLANTE) e FSH (ORMONE FOLLICOLOSTIMOLANTE). In questo caso, quindi, un solo ormone ipotalamico stimola la produzione di 2 diverse tropine ipofisarie. MRF. Stimolante il rilascio di MSHo ORMONE MELANOCITOSTIMOLANTE. 2) Inibenti il rilascio di ormoni adenoipofisari (INHIBITING FACTORS). Si tratta nella stragrande maggioranza dei casi di ormoni corrispettivi ai precedenti. PIF o PROLATTOSTATINA. Inibenti il rilascio di PRL. GH-RIH o SOMATOSTATINA. Inibenti il rilascio di STH. MIF. Inibenti il rilascio di MSH. Da un punto di vista delle applicazioni mediche, va detto che, essendo il GH-RIH un ormone inibente il rilascio di ormone somatrotopo STH, e cioè l’ormone che regola lo “accrescimento”, in passato si è creduto che potesse essere fruttuosa una sua applicazione nell’arresto dell’attività proliferante di formazioni neoplastiche. In realtà, sebbene una sua somministrazione determina un’azione frenante, questa è assolutamente insufficiente (tanto più che è un prodotto già presente nell’organismo) nei confronti delle sdifferenziate e mostruose cellule tumorali. Quindi, riassumendo, possiamo dire che l’ipotalamo endocrino esplica la sua azione indiretta nei confronti di numerosi e disparati distretti corporei: - Tiroide (TRH). - Ovaio e testicolo (LH-RH). - Corteccia surrenale (CRH). - Ghiandola mammaria (PRF). - Ossa (GH-RH). - Cute (MRF). E, da un punto di vista delle ricadute patologiche, è ovvio che se non funziona bene l’ipotalamo, l’attività di dismissione delle tropine ormonali da parte dell’ipofisi sarà altrettanto turbata. CORRELAZIONI NEURORMONALI CHE SI ISTITUISCONO FRA CERVELLO, IPOFISI ED ORGANI EFFETTORI. Abbiamo già detto che l’ipofisi si trova in un vero e proprio rapporto di sudditanza topografica, morfologica e funzionale nei confronti dell’ipotalamo. Sotto questo punto di vista quella rivoluzione copernicana (che segna, ad opera degli Scherrer, il passaggio dall’Endocrinologia alla Neuroendocrinologia) per cui le stesse cellule nervose hanno la capacità di elaborare sostanze specifiche di carattere ormonale. Ed esse sono incluse nell’ambito della struttura classica dell’encefalo. Ma, perché il quadro sia completo, occorre precisare che lo stesso ipotalamo endocrino si trova in diretta comunicazione, attraverso le cosiddette sinapsi o giunzioni sinaptiche, con neuroni di regioni circostanti dell’encefalo, fino ad arrivare alla stessa corteccia. La corteccia è la sede più nobile di stimoli che provengono dall’esterno. Quindi, possiamo dire che: - Il rapporto di comunicazione tra le altre regioni dell’encefalo e l’ipotalamo avviene attraverso i neurotrasmettitori o neuromediatori (da non confondersi con i neurormoni). - Il rapporto di comunicazione tra l’ipotalamo e l’ipofisi avviene attraverso ormoni. Il fatto che vi sia questa correlazione è sperimentalmente provato. Ad es., sottoponendo la ratta da laboratorio a ingenti stress, possiamo, determinando un’azione inibitoria a monte, bloccare la stessa ovulazione. Perché andremo a bloccare tutte quelle sostanze che stimolano l’ovulazione stessa. (Vedi Figura 3). Come si vede, si ha una vera e propria regolazione a cascata che parte dai Centri nervosi encefalici extra-ipotalamici (fra cui, abbiamo detto, in primo luogo, la corteccia) e, attraverso i neuromediatori o neurotrasmettitori (ovvero, attraverso le giunzioni sinaptiche), giunge fino all’ipotalamo. Dall’ipotalamo, mediante i Fattori di rilascio e i Fattori di inibizione (e, in questo caso, si tratta di sostanze ormonali), si passa all’Anteipofisi o Adenoipofisi. Le Tropine da quest’ultima elaborate vanno a stimolare gli Organi endocrinibersaglio e, dunque, i vari Tessuti. Ad ogni modo, sono presenti svariati feedback di regolazione, che coinvolgono, con percorsi più o meno lunghi (ma il sangue bagna dappertutto), anche i più lontani promotori di questo processo a cascata, e cioè gli stessi Centri nervosi encefalici e lo stesso ipotalamo. Questo ha significative incidenze in ambito terapeutico e diagnostico. Un primo momento di guasto può essere individuato anche a livello degli stessi Centri nervosi encefalici (le cui ripercussioni si esplicano a livello endocrino). Ed ecco dunque che alcune malattie non vanno curate con ormoni, ma farmaci psicotropi che esplicano la loro azione curativa sui neuroni, a monte. La sindrome di Schian. Può anche causare la morte della puerpera (e cioè, della donna che ha appena espletato il parto). Il ginecologo deve attendere almeno 2 ore, dopo che il parto è stato espletato: il tempo necessario perché vi sia l’espulsione della placenta. In seguito, si formerà il cosiddetto lobo di sicurezza: l’utero si contrae fisiologicamente, assumendo una forma globulare, in maniera tale da otturare i vasi sangugni. Altrimenti, vi sarebbe una grave emorragia che può portare la puerpera anche in breve tempo alla morte. Ma non si avrà contrazione dell’utero, fino a formazione del lobo di sicurezza, se al suo interno permangono ancora frammenti di placenta, in seguito all’espulsione della placenta stessa. E allora, il ginecologo deve saggiare che la placenta espulsa sia integra e che, dunque, non siano rimasti frammenti di essa nell’utero (che altrimenti devono essere tempestivamente asportati. Anche manualmente). Ad ogni modo, da un punto di vista istologico, nel caso in cui si verifichi la emorragia, la perdita di sangue determinerà un aumento del volume dell’ipofisi, della sua stoffa endocrinopoietica, e il calo di pressione, che conseguentemente all’emorragia si verrà a determinare, impedirà un giusto apporto di sangue (ischemia). E allora, le cellule dell’ipofisi possono andare in necrosi: si avrà un panipopituarismo. Al contrario, se si supera l’emorragia, egualmente vi sarà un parziale danno per l’adenoipofisi: ipopituarismo. E un sintomo di questo danno è, ad es., la mancanza anormale di secrezione lattea. E questo per il danneggiamento delle cellule secernenti adenoipofisarie che producono le tropine che stimolano le ghiandole-bersaglio produttrici di prolattina. GHIANDOLA SURRENALE. La denominazione deriva dalla sua allocazione sul polo superiore del rene. E’ una ghiandola pari: ne abbiamo una per ogni rene. Ha forma vagamente piramidale ed è vascolarizzata. Si distingue in 2 parti: - Esterna Corteccia surrenale o corticale del surrene. - Interna Midolla surrenale o midollare del surrene. Differente origine embrionale delle due strutture. Le 2 strutture hanno una differente origine embrionale: - Corteccia Mesoderma. - Midolla Creste neurali (le formazioni che si addossano al tubo neurale). La midollare del surrene. CARATTERIZZAZIONE EMBRIO-FUNZIONALE. Le strutture costitutive della midollare si originano da quelle formazioni embrionali che soppannano il tubo neurale: le crete neurali. Sotto questo punto di vista, gli elementi costitutivi della midollare sono elementi di importazione. Inoltre, abbiamo visto come le strutture ghiandolari che originano dalle creste neurali hanno essenzialmente una caratterizzazione peptidergica, più che monoaminergica. Ma la midollare del surrene è un classico esempio di struttura monoamonergica, in quanto si ha elaborazione di catecolamine, (e le catecolamine sono, infatti, monoamine biogene) che vengono immesse nel circolo ematico. E allora ecco che assumono una caratterizzazione ormonale. E’ un tipico esempio di come una stessa sostanza in relazione alla modalità di dismissione assuma una differente caratterizzazione. Così, sono presenti altre strutture secernenti catecolamine ma che, non immetendole in circolo, non consentono che tali sostanze siano dette ormonali. CONFORMAZIONE MORFOLOGICA. Ad un’analisi microscopica si osserva come le cellule, nella porzione midollare del surrene, si dispongono in cordoni, distanziati da spazi lacunosi elettro-trasparenti (che corrispondono a capillari). Questi capillari che assumono una fisionomia dilatata, li ritroviamo nel corpo di molti organi (come, appunto, la midollare del surrene, ma anche il fegato e la milza). L’aspetto morfologico è assolutamente connesso alla caratterizzazione funzionale: questi capillari dilatati, che prendono il nome di sinusoidi si trovano nel corpo di organi le cui cellule, per particolari loro attività (come, ad es., l’attività secernente) necessitano larghe superfici di contatto con il torrente ematico. CELLULE PARAGANGLIARI-CROMOAFFINI. Le cellule che costituiscono la midollare del surrene vengono, proprio per la derivazione embriologica, dette cellule paragangliari. Questa denominazione è comune a diverse formazioni anatomiche, per lo più di piccole dimensioni, che sono dotate di cromoaffinità e caratterizzazione endocrina, e che hanno in comune l’origine embriologica, in quante derivano dalle stesse cellule embrionali da cui si differenziano le fibre nervose simpatiche, costituite dalle cellule gangliari vere e proprie. Disseminazioni di queste cellule paragangliari cromoaffini le ritroviamo in molti distretti dell’organismo: in piccoli cumuli in corrispondenza della biforcazione dell’aorta addominale, ad es.. Per quanto riguarda la cromoaffinità di queste cellule, va detto che questa particolare proprietà, di interessante rilievo nell’ambito della ricerca istologica, è stata originariamente individuata proprio nelle cellule paragangliari della midollare del surrene ed è poi stata estesa, con il progresso delle conoscenze scientifiche, alle cellule del Sistema neuroendocrino diffuso. LE CATECOLAMINE. Va detto che le catecolamine sono monoamine biogene. Ma si è visto che esse non vengono prodotte esclusivamente in questo distretto endocrino. Si è visto, infatti, che le catecolamine sono prodotte anche da: - Cellule nervose. - Cellule secernenti del Sistema Neuroendocrino Diffuso o Sistema APUD. E a seconda del differente distretto in cui tali catecolamine sono prodotte, esse assumono un ruolo funzionale differente: - Cellule nervose: neurotrasmettitori. - Sistema Neuroendocrino Diffuso: sostanze specifiche che stimolano o inibiscono la secrezione ormonale. - Midollare del surrene: neurormoni. Va ribadito il concetto già tante volte presentate: tutto dipende dalla modalità con cui tali sostanze sono dismesse dalle cellule secernenti: - Sistema Neuroendocrino Diffuso: sostanze paracrine. - Midollare del surrene: neurormoni. - Cellule nervose: prodotti neurocrini, cioè neurotrasmettitori. Essi agiscono non a distanza, come fanno i neurormoni. Possiamo dire che si tratta di una sorta di “dismissione paracrina” di cui sono specificatamente responsabili le cellule nervose. BIOSINTESI DELLE CATECOLAMINE. Quanto diremo a proposito delle cellule della Midollare del surrene, sarà ripetuto anche per le cellule nervose e per quelle del Sistema neuroendocrino diffuso, che egualmente presentano attività di biosintesi delle catecolamine. Un metodo di indagine istochimica di fondamentale importanza per l’individuazione e lo studio di cellule che presentano la suddetta attività è il cosiddetto metodo di Falck, del 1965, che si fonda sull’utilizzo del microscopio a fluorescenza. Ecco che, allora, lo si può impiegare con successo per le cellule della Midollare del surrene. (Vedi Figura 1). Va detto che, nella Midollare del surrene, a differenza di quanto avviene in alcuni altri distretti, si ha l’ulteriore elaborazione di noradrenalina in adrenalina. E questo avviene ad opera di specifiche sostanze enzimatiche: l’enzima PNMT (Fenilalaninametil-tranferasi). Nell’ambito della Midollare del surrene la noradrenalina è presente in proporzioni minoritarie rispetto all’adrenalina. In altri distretti, come nell’ambito delle cellule nervose, si ha, al contrario, la prevalenza di noradrenalina. Infatti, inizialmente si credeva che esse fossero capaci di secernere solo noradrenalina, ma, successivamente, in alcune di esse fu individuata la presenza dell’enzima PNMT che consente l’ulteriore elaborazione della noradrenalina in adrenalina. Ma non tutte le cellule nervose presentano l’enzima PNMT, per cui si ha la condizione speculare rispetto a quella delle cellule della Midollare del surrene: concentrazione di noradrenalina inferiore rispetto alla concentrazione dell’adrenalina. AZIONE FUNZIONALE DELLE CATECOLAMINE. Le catecolamine immesse in circolo hanno fondamentalmente un’azione eccitometabolica. Un’attività funzionale che torna utile al nostro organismo soprattutto in condizioni di stress di diversa natura: stress psichici e fisici, aggressioni microbiche e virali. Esplica un’azione ipetensiva-vasocostrittrice. Ed in effetti, vedremo quali sono le ricadute patologiche di questa loro particolare proprietà. RICADUTE PATOLOGICHE. L’azione benefica esercitata sui valori della pressione sanguigna dalle catecolamine, se presenti nei normali range di concentrazione, può rivelarsi un’arma a doppio taglio in condizioni di iper e ipoproduttività. E così, soprattutto in caso di una produzione eccessiva di catecolamine ad opera delle cellule della Midollare, è possibile raggiungere picchi pressori di addirittura 300 mmHg. Così, le formazioni neoplastiche che interessano la midollare del surrene, tanto maligne quanto benigne (i cosiddetti adenomi), prendono il nome di feocromocitomi. (Infatti, le cellule paragangliari sono dette feocromociti, per le 2 caratteristiche della cromoaffinità e della colorazione scura al fascio elettronico). Tali affezioni interessano soprattutto soggetti in giovane età. Si tratta di tumori iperfunzionanti (che accrescono il volume e il numero delle cellule della midollare, senza privarle delle loro caratteristiche ormonopoietiche) che esplicano un’azione fortemente ipertensiva, tanto che si possono raggiungere, come detto, livelli pressori di ben 300 mmHg. Come conseguenza ultima, vi sarà ovviamente il decesso in seguito a rottura delle pareti dei vasi e soprattutto in quei distretti di maggiore fragilità, come la regione cerebrale: il cosiddetto ictus. Differente natura chimica dei secreti prodotti. Si differiscono anche per la natura chimica dei secreti prodotti: - Corteccia Ormoni steroidei (di origine lipidica) genericamente. Adesso li caratterizzeremo meglio in funzione delle 3 regioni in cui si suddivide la corteccia: 1) Regione esterna, 2) Regione intermedia, 3) Regione interna. - Midolla Catecolamine (Adrenalina e Noradrenalina). REGIONI IN CUI SI SUDDIVIDE LA CORTECCIA SURRENALE. Abbiamo detto che nella zona corticale individuiamo 3 regioni, distinguibili fra di loro in funzione della diversa aggregazione delle cellule che le costituiscono: - Regione esterna Zona glomerulare. Qui, le cellule si dispongono in cordoni, in filiere, dando appunto vita a conformazioni ad ansa, glomerulari (Vedi Figura 2). - Regione intermedia Zona fascicolata. Qui, infatti, i cordoni hanno una conformazione rettilinea (Vedi Figura 3). - Regione interna Zona reticolare. Qui, le cellule si anastomizzano a rete, con un andamento più disordinato (Vedi Figura 4). Nella midollare, le cellule formano degli aggregati tondeggianti e cordoni curvilinei. I nuclei sono più visibili, perché il citoplasma è più chiaro. Prodotti di secrezione elaborati dalle 3 regioni della corteccia surrenale. Prodotti di secrezione elaborati dalle 3 regioni della corteccia surrenale: - Regione glomerulare mineralcorticoidi o mineralo-attivi (come l’aldosterone). Sono sostanze che influenzano il metabolismo idroelettrico, in quanto condizionano l’assorbimento di Na e acqua. - Regione fascicolata glicocorticoidi o glico-attivi (come il glicocortisolo). - Regione reticolare androgeni. Tanto che si parla di “terza gonade”. Se un soggetto femminile, in condizioni patologiche, presenta una attività secernente di queste cellule superiore alla normale, si individueranno anomali caratteri mascolinizzati. Azione dell’ACTH sulla regione fascicolata della corteccia surrenale. L’ACTH o ormone adenicorticotropo, prodotto dalla adenoipofisi, produce una iperplasia della regione fascicolate. Ha però anche un’azione trofica, in quanto consente un aumento della regione. Sulla regione glomerulare non si sente la sua influenza. L’ACTH è rilasciato sulla base del tasso ematico di cortisolo. LA TIROIDE. CARATTERIZZAZIONE MORFOLOGICA. Si tratta di un organo disposto fra la cartilagine laringea e la faccia anteriore della trachea. Espanso nelle sue porzioni laterali, i cosiddetti lobi della tiroide, trattenute da una regione centrale che prende il nome di istmo della tiroide. E’ abbondantemente sanguificata dai vasi arteriosi e venosi del collo. Ecco perché, da un punto di vista pratico, un intervento di tiroidectomia comporta in generale una grande accuratezza e precisione, a causa dell’elevato rischio di emorragia, se eseguito incautamente. E’ la classica ghiandola follicolare. Abbiamo precedentemente detto che le ghiandole della Costellazione neuroendocrina possono essere distinte sulla base dell’aspetto morfologico-topografico in: - Ghiandole follicolari. Ghiandole cordonali. Ghiandole interstiziali. Ghiandole a rete. Sotto questo punto di vista, appunto, la Tiroide rientra a pieno nel primo ambito. Infatti, le cellule che ne sono costitutive si dispongono caratteristicamente in modo da formare vescicole, e quindi strutture cavitate di aspetto tondeggiante. La struttura follicolare è costituita da un epitelio monostratificato di cellule prismatiche che limita una cavità riempita di una sostanza che prende il nome di colloide. Essa è facilmente evidenziabile istochimicamente mediante una semplice colorazione di Ematossina ed Ossidina. In passato, si considerava la colloide come il frutto dell’attività secernente delle cellule del follicolo. Oggi, così non è: si individua in essa la presenza di una proteina di deposito, di derivazione non tiroidea, la tireoglobulina, che, vedremo, si lega selettivamente agli ormoni tiroidei. Rapporto funzionale fra ipofisi e tiroide. Il follicolo è una struttura altamente dinamica che modifica la propria organizzazione cellulare in relazione all’azione regolatrice della ipofisi. E va precisato che il TSH o ormone tireostimolante (rilasciato dall’ipofisi su stimolo della TRH o tireoliberina ipotalamica) esercita un’azione sia tropica che trofica nei confronti della tiroide. La componente tropica di stimolo è stata già precedentemente analizzata. Per quanto riguarda, invece, la componente trofica, va detto che essa consiste essenzialmente nella potenzialità di aumento della massa stessa dell’organo tiroideo. Ed in effetti, da un punto di vista diagnostico, va precisato che l’ingrossamento del collo che, in alcuni pazienti affetti da un’eccessiva liberazione di TSH, si presenta in maniera abbastanza evidente, altro non è che il frutto di un aumento abnorme della struttura della tiroide. Ricadute patologiche. Da un punto di vista patologico, una disfunzione della tiroide si manifesta essenzialmente secondo 2 possibili modalità specularmente opposte: 1) Ipofunzionalità della tiroide. 2) Iperfunzionalità della tiroide. IPOFUNZIONALITA’ DELLA TIROIDE. (Vedi Figura 1). Come si vede dalla figura, in caso di tiroide ipofunzionante, - le cellule dell’epitelio monostratificato, da prismatiche che erano, divengono basse e appiattite. - Alla luce della microscopia elettronica si notano anche i contrassegni ultrastrutturali del torpore funzionale: una sostanziale povertà dei dispositivi del citoplasma che consentono l’attività secernente. - La colloide è abbondantemente presente. E questo non deve fare pensare ad un’iperproduttività. In realtà, i pochi ormoni tiroidei qui presenti sono abbondantemente trattenuti dalle tireoglobuline e, pertanto, non vengono dismessi nel circolo ematico. E ancora, da un punto di vista diagnostico, poiché gli ormoni tiroidei hanno fondamentalmente un’azione di stimolo metabolico, in soggetti affetti da una ipofunzionalità della tiroide, si possono riscontrare contrassegni parafisiologici come eccessive inattivita e anemia, e ancora torpore fisico e psichico. E ancora, dal momento che gli ormoni tiroidei stimolano il metabolismo dei GAG (abbondantemente presenti nei tessuti connettivali), si vede che in caso di una ipotiroidemia, un segno molto manifesto è quello per cui i soggetti che ne sono affetti hanno difficoltà nel parlare. Infatti, la lingua è un organo a caratterizzazione abbondantemente connettivale, e quindi un abnorme ristagno di GAG determina un suo ingrossamento, una macroglossia. Ecco perché si suole dire che “la diagnosi di ipofunzionalità tiroidea la si può quasi effettuare per telefono”. IPERFUNZIONALITA’ DELLA TIROIDE. (Vedi Figura 2). Come si vede, in questo caso, - le cellule di quel monostrato sono molto alte. - Il lume è più ristretto e quindi la colloide è più ridotta. - Si spezzano i legami fra gli ormoni tiroidei e la tireoglobulina. - Si hanno contrassegni ultrastrutturali speculari rispetto a quelli considerati per la ipofunzionalità tiroidea. Da un punto di vista diagnostico, la sintomatologia di un soggetto affetto da ipertiroidismo sono diametralmente opposti a quelli di un soggetto affetto da ipotiroidismo. Il sofferente, in genere, è ansioso, iperattivo… E, nelle manifestazioni più gravi, è possibile anche un esoftalmo: una proclusione del bulbo oculare che, nelle condizioni estreme dell’esoftalmo maligno, impedisce addirittura la chiusura delle palpebre, con conseguenti lacerazioni del bulbo oculare. Inoltre, l’inondazione smodata di ormoni tiroidei produce le cosiddette tireotossicosi. E cioè un malfunzionamento a danno dei parenchimi di molti organi, fra i quali il cuore, per cui si ha un aumento del ritmo di pulsazione: la fibrillazione. PANCREAS ENDOCRINO. Caratterizzazione morfologica e incidenze nella patologia. Volgarmente detto “organo traditore”, per la sua allocazione nella porzione profonda della cavità addominale. Per cui, coperto frontalmente dalla cavità gastrica, è difficilmente trattabile da un punto di vista diagnostico (è abbastanza frequente confondere un’affezione morbosa che riguarda il pancreas con altre patologie a carico della postposta cavità gastrica, come, ad es., un’ulcera. Quindi, il dolore non è un metodo sufficiente per condurre un’indagine diagnostica sull’organo pancreatico), e, dal momento che è costituito da tessuti molto delicati, un possibile intervento chirurgico condotto sulla cavità gastrica può produrre effetti indesiderati e nefasti sul pancreas stesso, come irritazione e lacerazioni, tanto che si parla di pancreatiti acute. Caratterizzazione funzionale. Il pancreas è una ghiandola mista. Si parla, infatti, di: - Pancreas endocrino. - Pancras esocrino. Il parenchima è costituito da ghiandole acinose sierose composte nel cui contesto sono scaglionate poche cellule endocrine. Per la particolare caratterizzazione delle ghiandole presenti nel Pancreas si ravvisa una forte corrispondenza con le ghiandole salivari e la parotide. In tutti e tre i casi, infatti, si parla di ghiandole acinose sierose. Tanto che, da un punto di vista della patologia, un’iniziale flogosi della ghiandola parotide (parotite) può sfociare, in un secondo momento, in una vera e propria pancreatite. E questo perché il virus della parotite ha uno spiccato tropismo proprio nei confronti delle ghiandole acinose sierose. PANCREAS ESOCRINO. Elabora sostanze enzimatiche ad attività proteolitica che vengono riversate nel lume del duodeno. Ecco perché in condizioni parafisiologiche di ultraproduttività, tali enzimi vanno ad attaccare gli altri organi della cavità addominale, disgregandoli. Ecco che, in breve tempo, ciò può portare a morte l’individuo. PANCREAS ENDOCRINO. Le cellule endocrine sono incastonate nell’ambito del parenchima pancreatico, nel contesto degli acini sierosi, sotto forma di isolotti: le cosiddette isole di Langherans. Quante sono le isole di Langherans? In realtà, poche rispetto all’estensione del Pancreas. Tuttavia, il loro numero si differenzia in base: - Alla specie animale. - Alla individualità intraspecifica. Pertanto, non esiste neppure una univocità di locazione. Ci sono informazioni classiche per cui il pancreas endocrino è costituito da 2 tipi di cellule, dette in passato: − α. − β. Ma riclassificate oggigiorno come: - Cellule A. - Cellule B. In realtà, oggigiorno, si è individuato un terzo citotipo: - Cellule D. Si stabilisce che le cellule A elaborano glucagone, un ormone antagonista all’insulina mentre le cellule B elaborano insulina e le cellule D elaborano somatostatina (che, quindi, non è prodotta solo dall’ipotalamo). L’attenzione degli studiosi si è maggiormente concentrata sulle cellule del tipo B, perché una disfunzione della insulinopoiesi comporta quella grave affezione che prende il nome di diabete mellito: un aumento abnorme del tasso di glucosio, in quanto non si ha più una sua assimilazione che è stimolata proprio dall’insulina. IL GLUCAGONE. Il glucagone è un antagonista dell’insulina, nel senso che ha un effetto iperglicemizzante: fa aumentare la concentrazione del glucosio nel sangue (glicemia), in quanto ne inibisce l’assunzione da parte dei vari citotipi, per un utilizzo a livello metabolico. L’INSULINA. Ovviamente, in termini opposti, l’insulina avrà un effetto ipoglicemizzante, di diminuzione del tasso ematico glicemico, svolgendo un’attività di stimolazione dell’assunzione da parte dei vari citotipi. LA SOMATOSTATINA. Abbiamo visto che l’ipotalamo produce il GH-RF o Growth-hormon o Somatoliberina, stimolante il rilascio dell’STH o Ormone somatrotopo ipofisario, che a sua volta, nell’ambito delle cellule D dell’isola di Langherans, stimola la produzione di somatostatina. Questo neuropeptide venne isolato ed identificato per la prima volta nell’ambito proprio del Pancreas endocrino. Studio del Pancreas mediante la tecnica di colorazione dell’Ematossilina ed Eosina. Già la semplice colorazione con Ematossilina ed Eosina è più che sufficiente per l’evidenziazione dell’isola di Langherans. (Vedi Figura 1). Come si vede, si distinguono le formazioni nucleari delle varie cellule e la presenza di sinusoidi (capillari dilatati). Ad ogni modo, mediante questo metodo di colorazione non è possibile individuare, nell’ambito dell’isola di Langherans, le rispettive componenti cellulari. I citotipi A, B e D. Per fare ciò occorre servirsi di un ulteriore metodo di indagine. Studio del Pancreas mediante la tecnica della Paraldeide-Fuxina. Si tratta pur sempre di una tecnica istochimica tradizionale che impiega una miscela di coloranti: la Paraldeide e Fuxina. Mediante tale tecnica è stato possibile identificare la popolazione di cellule B. E i dati consentirono di sancire che, nel citoplasma delle cellule B, l’insulina è racchiusa e concentrata all’interno di particolari granuli di deposito. Questa particolare caratterizzazione va poi estesa a buona parte del vasto panorama di cellule secernenti, fra cui, in particolare modo, di molte cellule del Sistema neuroendocrino diffuso. Questo consentì di stabilire il turn-over intracellulare del metabolismo insulinico. Il granulo di deposito rappresenta il frutto di una tappa terminale della sequenza di vicende ultrastrutturali che termina con la canonica exocitosi, attraverso cui l’insulina viene dismessa, mediante un processo che prende il nome di degranulazione. Analizzando, mediante un’analisi comparativa, una isola di Langherans prima e dopo l’emissione di insulina, mediante la tecnica della Paraldeide-Fuxina (che colora selettivamente le cellule B), è possibile ravvisare una maggiore colorazione nel primo caso ed una minore nel secondo: a dimostrazione sperimentale del fatto che tale emissione avviene proprio ad opera delle cellule B. Studio del Pancreas mediante l’applicazione di un metodo immunoistochimico. Oggigiorno, questa è la tecnica di maggiore utilizzo. Essa prevede l’utilizzo di un anti-siero: un siero in cui siano presenti anticorpi che agiscono in maniera specifica contro le sostanze delle quali si vuole identificare la sede. E allora, mediante questa tecnica, è stato possibile individuare, pur riaffermando che il numero e la dislocazione dei citotipi nell’isola di Langherans varia, in funzione della specie e in funzione del singolo individuo in una stessa specie, la locazione dei suddetti citotipi. (Vedi Figure 2 e 3). E allora, si vede: - (mediante siero anti-insulina) che le cellule insulino-poietiche sono tendenzialmente dislocate al centro dell’isola di Langherans. - (mediante siero anti-glucagone) che le cellule glucagone-poietiche sono tendezialmente dislocate alla periferia dell’isola di Langherans. (Vedi Figura 4). Poi, con la sofisticazione della tecnica, è stato possibile colorare in maniera discriminata le due differenti tipologie cellulari all’interno di uno stesso preparato istologico. Studio del Pancreas mediante l’applicazione della microscopia elettronica. I risultati sperimentali che si ottengono, sicuramente più precisi, non fanno altro che confermare, tuttavia, quelli già ravvisati mediante la tecnica della Paraldeide-Fuxina. Ricadute patologiche e “farmaci ipoglicemizzanti orali”. La principale manifestazione patologica che rivela una disfunzione delle cellule B dell’isola di Langherans è sicuramente, come detto, il diabete mellito. In questo senso, è possibile che si verifichi: - una carenza parziale di insulina. - Una carenza totale di insulina. CARENZA TOTALE DI INSULINA. Quando il citotipo B è colpito da cause esterne di varia natura e consistente gravità o se si ha una alterazione della sua caratterizzazione genetica, si distrugge e si ha, dunque, una produzione insulinica impossibilitata. La carenza insulinica è totale ed è dovuta ad una alterazione morfologica delle cellule B. CARENZA PARZIALE DI INSULINA. Nella maggioranza dei casi. La cellula B è apparentemente indenne da un punto di vista morfologico. Tuttavia, si avrà pur sempre una carenza insulinica: l’insulina prodotta non viene immessa nel circolo ematico. Viene meno il meccanismo di estrusione exocitotica e così si ha una carenza parziale di insulina. E’ come se la cellula si trovasse in uno stato di torpore funzionale. E allora, da un punto di vista terapeutico, quando la cellula B non è alterata morfologicamente ma solo funzionalmente (e si ha, quindi, una carenza parziale di insulina) la farmacologia sperimentale si è attivata nella ricerca di sostanze che stimolino, nella cellula B torpida, la produzione e l’estrusione di insulina. In questo caso, dunque, si corregge il metabolismo glicidico, stimolando la liberazione dei granuli di deposito: la degranulazione delle cellule B. La cosa curiosa è che i capostipiti di tali farmaci, detti farmaci ipoglicemizzanti orali, appartengono al gruppo dei Sulfaminici. I Sulfaminici, in origine, furono identificati come sostanze ad azione anti-batterica, che, quindi, manifestavano un’attività bloccante nei confronti della trasmissione di malattie infettive. Ma, successivamente, si evidenziò, da parte di alcune sostanze appartenenti alla classe dei Sulfaminici, un’azione stimolante della degranulazione delle cellule B. E allora si produsse una gamma di derivati di questi farmaci, in cui era stata esaltata l’azione degranulante. Essi, tutt’oggi, trovano larga applicazione nella terapia delle forme più blande di diabete mellito. Caratterizzazione dei granuli delle cellule A, B e D mediante l’utilizzo di tecniche di microscopia ottica. CELLULE B. (Vedi Figura 5). Come si vede, è possibile individuare, al di là del nucleo, la componentistica ultrastrutturale che, ovviamente, troverà una disposizione abbastanza caratterizzata, in conformità alle esigenze funzionali secretorie della cellula stessa. Nella regione più estrema, quasi al confine con la membrana plasmatica, è possibile individuare la presenza di granuli di deposito. Il loro contenuto appare denso al fascio elettronico, elettron-opaco, ma non omogeneamente. Infatti, l’ormone insulinico ha la possibilità di precipitare in forma microcristallinica, determinando così l’aspetto disomogeneo, “a scaglie”. CELLULE A. (Vedi Figura 6). In questo caso, il contenuto dei granuli appare omogeneamente elettron-opaco e discosto dalla membrana del granulo da un alone elettron-trasparente. CELLULE D. (Vedi Figura 7). Il contenuto dei granuli ha un aspetto finemente microgranulare, apparendo come un precipitato fioccoso. Sostanze elaborate dal Pancreas endocrino. Analizzando la varietà di sostanze prodotte dal Pancreas endocrino, si individua la presenza di una certa analogia con quelle prodotte in altri distretti dell’organismo: - Il sistema GEP. - Il sistema neuroendocrino diffuso. Ed in effetti, ciò non deve stupire più di tanto, dal momento che tutte le cellule secernenti endocrine, e quindi anche quelle della quota endocrina del Pancreas, originano da una stessa matrice staminale: le creste neurali. E così, in funzione della cosiddetta regolazione genica, da totipotenti anche in senso secretorio, il codice genetico delle singole cellule privilegia, all’atto pratico, in seguito a un processo di differenziamento, una specifica funzione ormono-poietica. Ed infatti, gli insulinomi (un particolare tipo di apudoma), i tumori specifici della cellula B ripristinano la totipotenza ormonopoietica iniziale, facendo sì che le cellule B, in maniera parafunzionale, cominciano a secernere anche altri ormoni non caratteristici delle cellule B. E ciò, in effetti, non deve stupire più di tanto, dal momento che, abbiamo visto, il processo evolutivo che caratterizza una cellula tumorale è quello anaplastico di sdifferenziamento (e cioè, si ripercorre all’indietro il processo evolutivo di normale differenziamento) fino al raggiungimento della facoltà secretoria totipotente delle cellule staminali da cui sono originate. Alcuni esempi sono. CELLULA - A. PRODOTTO - Glucagone, Endorfine, Colicistochinina. LOCALIZZAZIONE - Pancreas insulare. (Le Endorfine sono altresì dette morfine endogene o sostanze oppioidi: imitano l’azione analgesica della morfina. La seconda tipologia di morfine endogene elaborata dalle cellule del nostro organismo è quella delle Enkefaline). - B. - Insulina, e altre sostanze monoaminiche biogene, come la serotonina. - Pancreas insulare. - D. - Somatostatina, Gastrina. - Pancreas insulare. - D-1. - VIP (Peptide - Pancreas insulare. inibitore vasoattivo, che avevamo già analizzato nell’intestino). - PP (detta F). - PP (ormone polipeptide - Pancreas insulare, pancreatico). Ed extrainsulare (ma il fatto che possano esserci cellule a significato endocrino, anche nell’ambito di strutture esocrine non fa più scalpore). ATTIVITA’ MONOAMINERGICA DEL PANCREAS. Negli anni ’65, quando si cominciò ad utilizzare le tecniche immunoistochimiche, si utilizzò, per le cellule del Pancreas insulare, un anti-siero specifico contro enzimi che smaltiscono le monoamine biogene (e cioè, le catecolamine, la serotonina, l’adrenalina e la noradrenalina). Tale enzima è la MALO (monoammino-ossidasi). Quindi, una presenza di questo enzima rileva in maniera indiretta anche la presenza di monoamine biogene. Il fatto che si riscontrasse una delle forte positività nell’ambito cellule B, testimoniava la presenza di un’attività monoaminergica. Successivamente, nel ’66, come ulteriore riprova, si utilizzò la tecnica di Falk che, come detto, rileva specificatamente la presenza di monoamine biogene. Si evidenzia una forte fluorescenza giallo-verde. Ed in effetti, si evidenzia, in un preparato istologico, la presenza di fluorescenza anche in strutture filamentose prossime all’isola di Langherans: si tratta dei nervi. Ciò testimonia fondamentalmente 2 cose: 1) Il fatto che le strutture monoaminiche biogene sono caratteristiche tanto del Pancreas endocrino, quanto delle cellule nervose. 2) Il fatto che le strutture nervose esercitino sicuramente, mediante le proprie sostanze monoaminiche biogene, un’azione stimolante sulle cellule del Pancreas endocrino che, a loro volta, stimolano la produzione di monoamine biogene. Le catecolamine esercitano un’attività inibitoria nei confronti della liberazione di insulina. Da un punto di vista delle ricadute patologiche, quindi, in soggetti affetti da una concentrazione iperglicemica (che necessitano di insulina), si può intervenire mediante somministrazione di catecolamine. EPIFISI O GHIANDOLA PINEALE. Si tratta di una ghiandola a secrezione endocrina annessa all’encefalo. Caratteristica dell’epifisi è di rimanere particolarmente attiva fino al settimo anno di vita e di subire, poi, fino alla pubertà, una graduale involuzione. Ed infatti, vedremo che l’epifisi presenta, fra le altre, un’attività inibente nei confronti delle gonadi, tanto che, in caso di formazioni tumorali di essa caratteristiche (come i pinealomi), e che non a caso colpiscono proprio nell’attività infantile, in seguito alla conseguente disfunzione, si avrà la presenza di una precoce maturità sessuale. Essa è collocata nella zona speculare rispetto all’ipofisi (e da questo deriva la caratteristica denominazione), nella zona caudale del terzo ventricolo, e quindi nella zona opposta rispetto all’asse ipotalamico-ipofisario. Presenta una innervazione ricchissima e si parla di innervazione serotoninergica, in quanto riceve un apporto neurotrasmettitoriale da parte delle cellule di tali formazioni nervose. Vediamo, adesso, di analizzare schematicamente le sue principali caratteristiche. Anatomia. Unica: nei mammiferi (fra cui l’uomo), negli uccelli e negli anfibi. Duplice: nei vertebrati inferiori (lucertole). Lunghezza di 8 mm. Peso di 100-200 mg. Struttura istologica. Cellule parenchimali secernenti a disposizione cordonale. Si evidenzia la porpora arenecea (detta anche “sabbia cerebrale”). Funzione. Elaborazione di 2 ormoni: 1) Glomerulotropine: che rivela il suo tropismo nei confronti della regione glomurulare della corteccia surrenale, stimolando la produzione di aldosterone cortico-surrenale (che controlla il metabolismo idro-salino). 2) Melatonina: oggigiorno molto usata, ma spesso impropriamente. In questo caso, si ha, da parte dell’epifisi, un ritmo di elaborazione particolare, per cui si parla di cronologia nicto-emerale. L’ormone viene secreto più di giorno che di notte. E così viene somministrato in tutte quelle condizioni di “stress da fuso orario” per limitare lo scombussolamento provocato da uno squilibrio della normale cronologia di rilascio. Essa, però, in dosi massive determina una carenza della libido (ed in effetti, abbiamo già detto che, mediante i suoi ormoni, l’epifisi determina un controllo dell’attività gonadica). La melatonina si ottiene mediante elaborazione, ad opera di specifici enzimi come l’HIMT (idrossiindolometil-transferasi) della serotonina. Da un punto di vista delle principali attività funzionali, riscontriamo: - Determina una chiarificazione della pelle (in opposizione all’attività della melanina) negli anfibi. - Blocca l’ovulazione (indotta con intense sorgenti luminose) nella ratta. - Stimola l’aldosterone e quindi controlla il metabolismo idro-salino. - Agisce sull’attività gonadica dell’ipofisi. EPITELI SENSORIALI. Classificazione e rapporto con gli elementi nervosi. Il criterio della differenziazione morfofunzionale per questo tipo di epiteli, rispetto alle altre tipologie epiteliali, è molto più spinto, molto più esaltato, molto più sofisticato. Si tratta di tessuti epiteliali costituiti da cellule specializzate per la ricezione delle impressioni di senso, denominate cellule sensitive secondarie, e da cellule epiteliali con funzione di sostegno nei confronti della prima. Questa particolare differenziazione le accomuna, per molti versi, con alcuni tipi di cellule nervose. Ma va precisato che si tratta di un accostamento che si basa unicamente sulla capacità recettiva, sulla capacità di essere sensibilizzate da stimoli esterni. In realtà, vedremo, sono più le differenze che le analogie. E così, parliamo anche di cellule sensitive primarie da cui le cellule sensitive secondarie vanno distinte. In questo caso, si tratta, infatti, di vere e proprie cellule di natura nervosa e non di natura epiteliale che costituiscono una speciale classe di neuroni sensitivi di cui fanno parte anche le cosiddette cellule gangliari. Ad ogni modo, destiniamo la qualifica di cellule sensitive primarie ad una categoria molto ristretta di cellule nervose, che compendia solo 2 citotipi: - Cellule sensitive primarie olfattive. - Cellule sensitive primarie visive (facenti parte del bulbo oculare). E quindi, la maggior parte di elementi nervosi funziona recependo stimoli di senso. Esistono varie classi di cellule nervose stimolate da forme di energia esterne: esse vengono definite, abbiamo detto, neuroni sensitivi. Ed occorre effettuare una ulteriore differenziazione dei neuroni sensitivi in 2 grandi classi: - Cellule sensitive primarie (già analizzate). - Cellule o neuroni gangliari. Criteri di differenziazione dei neuroni sensitivi. Fondamentalmente, esistono 2 ordini di differenza: 1) Topografica. 2) Embrionale. DIFFERENZIAZIONE TOPOGRAFICA. - Le cellule nervose sensitive primarie sono disposte alla periferia corporea, nel contesto di organi di senso periferici. - Al contrario, le cellule gangliari non sono situate all’estrema periferia corporea, ma “a metà strada” fra la periferia e gli organi del sistema nervose centrale (cioè, dal cosiddetto neurasse). Diremo, pertanto, che si tratta di cellule che fanno parte del cosiddetto sistema nervoso periferico. Si costituiscono i gangli cerebrospinali, che si dispongono ai lati del neurasse, ma nella zona più vicina al neurasse che alla periferia corporea. DIFFERENZIAZIONE EMBRIONALE. - Le cellule nervose sensitive primarie nascono e si sviluppano nel contesto di quegli organi di senso periferici. Esse si formano assieme ad altre cellule che costituiscono l’organo della vista e dell’olfatto (costituito, infatti, anche da cellule non sensitive) in speciali abbozzi: i placoidi, per cui si parla di 1) placoide ottico e 2) placoide olfattivo. - Si ha una differente origine embrionale per le cellule gangliari, non placoidale. Esse derivano da un territorio embrionale che è la cosiddetta neurocresta, una regione di cellule potenziali staminali da cui originano vari citotipi, fra cui, appunto, le cellule gangliari e le cellule neuroendocrine. E allora, riassumendo, è possibile individuare fondamentalmente 3 possibili distretti di origine per le cellule nervose: 1) I placoidi per le cellule sensitive primarie ottiche ed olfattive. 2) La neurocresta per le cellule gangliari. 3) Le pareti del tubo neurale per le cellule di tutte le rimanenti strutture nervose (si tratta dell’abbozzo embrionale da cui origina il sistema nervoso centrale). Ed in effetti, non a caso individuiamo topograficamente le cellule gangliari in prossimità del neurasse. Esse, infatti, originano dalla neurocresta che è abbarbicata sul tubo neurale (da cui deriva, appunto, il neurasse). Così, anche in epoca post-embrionale, per le cellule gangliari, è possibile individuare questa caratteristica locazione (che non è ravvisabile, ad es., per le cellule neuroendocrine che, pur condividendo l’origine embrionale) migrano nelle zone più disparate dell’organismo. Motivo di accostamento delle cellule sensitive primarie e secondarie: la recezione dello stimolo. E’ questo il fondamentale motivo funzionale che consente di mettere in comparazione cellule di natura prettamente epiteliale, come le cellule sensitive secondarie, e cellule di natura più propriamente nervosa, come le cellule sensitive primarie. In realtà, tuttavia, se entrambi i citotipi sono in grado di accumulare gli stimoli di senso, solo il secondo è in grado di trasmetterlo autonomamente. Eppure, si potrebbe obiettare, le impressioni di senso accumulate dalle cellule nervose secondarie vengono egualmente recepite, in ultima istanza, dallo stesso encefalo. E quindi, occorre potere spiegare come si configura tale modalità di trasmissione. Vedremo che si ha l’intervento di un particolare dispositivo (che non fa parte della organizzazione della cellula epiteliale sensoriale) che fa pervenire lo stimolo ai centri del Sistema nervoso centrale. Le 3 tipologie di cellule sensitive. Riassumendo, abbiamo visto che esistono 2 grandi classi di cellule sensitive: 1) Neuroni sensitivi. 2) Cellule epiteliali sensoriali. E, nel primo caso, si differenzia ulteriormente in: - Cellule sensitive primarie. - Cellule gangliari. Nel secondo, invece, si parla specificatamente di: - Cellule sensitive secondarie. CARATTERIZZAZIONE MORFOLOGICA DELLE CELLULE SENSITIVE PRIMARIE. (Vedi Figura 1). Come si vede, è possibile ravvisare 3 contrassegni morfostrutturali: - Una porzione apicale, in cui sono presenti ulteriori prolungamenti che favoriscono la ricezione dello stimolo. - Una zona espansa centrale in cui individuiamo il nucleo. - Un prolungamento terminale che fa parte integrante della cellula (e che rappresenta un contrassegno strutturale caratteristico delle cellule nervose). I vari prolungamenti di cellule vicine si impacchettano nella costituzione del cosiddetto tronco nervoso. CARATTERIZZAZIONE MORFOLOGICA DELLE CELLULE SENSITIVE SECONDARIE. (Vedi Figura 2). Sono qui rappresentate le 3 tipologie di cellule sensitive secondarie: - C. s. s. gustative. - C. s. s. acustiche. - C s. s. vestibolari. Come si vede, si ha un denominatore strutturale che le accomuna tutte. Si potrebbe erroneamente pensare che siano strutturalmente ripartite come le precedenti cellule sensitive primarie: - Settore apicale. - Zona centrale espansa. - Prolungamento terminale. Ma proprio in quest’ultimo dispositivo si ha la differenza sostanziale. Infatti, se ben si osserva, alla base, la cellula è chiusa, come è consono ad una cellula di natura epiteliale. Questo prolungamento terminale, in realtà, è costituito da una giustapposizione “esterna” alla cellula stessa, che ora impareremo a meglio caratterizzare. Si ha, con questo prolungamento un rapporto di contiguità, e non di continuità. Questa espansione terminale deve appartenere ad un elemento di natura diversa, che è in grado di prelevare e soprattutto trasmettere gli stimoli di senso ai centri nervosi. Si parla, allora, di giunzione citoneurale (altresì impropriamente detta giunzione neurosensoriale o, in maniera assolutamente errata giunzione sinaptica). E’ corretta la prima dizione in quanto dà il senso della trasmissione dell’impulso di senso: dalla cellula alle strutture nervose. Per certi aspetti, per il motivo suddetto, fuorviante la seconda. Ed infine, assolutamente errata la terza: le giunzioni sinaptiche sono, infatti, specificatamente interneuroniche, e non quindi fra cellule di natura epiteliale e cellule di natura nervosa. Si tratta, in definitiva, di un prolungamento proveniente da una vicina cellula nervosa che consente la trasmissione dell’impulso dalla cellula sensoriale secondaria alla cellula nervosa stessa (e poi, alle varie altre cellule nervose fino ad arrivare al neurasse). E’, quindi, questo il meccanismo con cui una cellula non autonomamente in grado di trasmettere uno stimolo, come una cellula epiteliale, consente egualmente la trasmissione dello stimolo stesso. La direzione dello stimolo, dal prolungamento al centro della cellula nervosa, si dice che è una direzione centripeta. E ancora, poiché l’impulso afferisce al centro della cellula nervosa si parlerà di impulso afferente. E allora, ci si può chiedere: ma che tipo di neurone è quest’ultimo? Sarà sicuramente un neurone gangliare. E il perché è abbastanza evidente. Trattandosi, infatti, di un neurone sensoriale, poiché non può certo essere un neurone sensoriale primario (per le tipologie di neuroni sensoriali primari esistenti), sarà sicuramente un neurone gangliare. Si può dire, in termini generali, che i prolungamenti di una piccola quantità di cellule gangliari terminerà sulla zona basale delle cellule sensitive secondarie, consentendo la trasmissione dei particolari stimoli suddetti. Nella maggior parte dei casi, invece, i prolungamenti termineranno nella quota connettivale (derma) della periferia corporea cutanea. E consentiranno la ricezione 3 possibili stimoli sensoriali: - Tattile. - Termico. - Dolorifico. Organizzazione strutturale comune delle cellule sensitive secondarie. Presenza di una zona basale o della giunzione citoneurale (per il trasferimento dell’impulso). Zona perinucleare più o meno espansa. Zona energetica: settore apicale riempito di mitocondri (e d’altronde, ciò è comprensibile perché l’accumulo dello stimolo richiede energia). Zona cuticolare o recettiva: quella sensibile. Caratteristiche morfofunzionali delle cellule sensitive secondarie. Sono in grado di recepire un impulso, ma non di trasmetterlo. Possiedono una base strutturale comune, che consente di effettuare la quadripartizione in settori sopra esposta. Le cellule sensitive secondarie sono: - Cellule gustative. - Cellule acustiche. - Cellule vestibolari. Gli epiteli sensoriali. In relazione a quanto detto, gli epiteli sensoriali sono: 1) Epitelio gustativo: costituito da cellule chemiorecettrici o chemioaccettrici (sensibili a stimoli chimici). 2) Epitelio acustico: costituito da cellule fonorecettrici (sensibili a stimoli sonori). 3) Epitelio vestibolare: costituito da cellule statocinetiche (sensibili agli stimoli che contribuiscono a realizzare l’equilibrio corporeo: che riguardano sia la statica che la deambulazione). L’epitelio gustativo. A) Cellule gustative. Si trovano sulla superficie dorsale della mucosa linguale, nel contesto di particolari strutture di forma ovoidale, i calici gustativi o botticelli gustativi. Questi ultimi, a loro volta, non sono sparsi, ma riuniti in rilevatezze della mucosa linguale: le papille gustative. Esse possono essere di 3 tipi: 1) papille fungiformi, 2) papille foliate, 3) papille circumvallate. E le possiamo ritrovare anche nella mucosa della orofaringe. Sono dette chemiorecettrici, per la loro particolare capacità di recepire lo stimolo chimico. Nel calice gustativo è possibile individuare: 1) una lamina basale, e 2) il poro gustativo. Ed è possibile distinguere le seguenti cellule: 1) Cellule gustative. Da 4 a 20, per calice. Il cui polo apicale presenta numerosi microvilli con funzione di percezione. 2) Cellule di sostegno. Distinte in cellule a pilastro (più esterne) e cellule a bastoncello (più interne). 3) Cellule basali. (Vedi Figura 3). Si tratta della lingua. Come si vede, è possibile distinguere la generica allocazione delle 3 classi di papille gustative e quali sensazioni di sapore corrispondono le varie porzioni della lingua stessa. (Vedi Figura 4). Si tratta della sommaria struttura di una papilla gustativa. (Vedi Figura 5). Si tratta della sommaria struttura di un calice gustativo. EPITELIO GUSTATIVO. Risulta essere costituito dalle cosiddette cellule gustative. Esse si trovano sulla superficie dorsale della mucosa linguale, nel contesto di particolari strutture di forma ovoidale, i calici gustativi o botticelli gustativi. Questi ultimi a loro volta non sono dispersi, ma riuniti in rilevatezze della mucosa linguale e della orofaringe: le papille gustative. Esistono 3 tipi di papille gustative: 1) Papille gustative fungiformi. 2) Papille gustative foliate. 3) Papille gustative circumvallate. Abbiamo già classificato, inoltre, le cellule dell’epitelio gustativo come cellule chemiorecettrici o chemioaccettrici: cellule sensibili agli stimoli chimici. Più precisamente, nel calice gustativo è possibile distinguere 3 categorie di cellule: 1) Cellule gustative (da 4 a 20 per ogni calice). Il cui polo apicale presenta numerosi microvilli con funzione di percezione, detti, alla luce della microscopia elettronica, peli gustativi. 2) Cellule di sostegno. Ulteriormente distinte in: cellule a pilastro (più esterne) cellule a bastoncello (più interne). 3) Cellule basali. DISLOCAZIONE DELLE 3 TIPOLOGIE PAPILLARI NELL’AMBITO DELLA MUCOSA LINGUALE. (Vedi Figura 1). Come si vede, è possibile individuare: - Nella zona più profonda e nella orofaringe, le papille circumvallate. - Nella zona centrale, le papille fungiformi. - Nelle zone laterali, le papille foliate. (Vedi Figura 2). Si ha qui la schematica rappresentazione di una generica papilla circumvallata, nei cui bordi è possibile individuare i diversi calici gustativi. (Vedi Figura 3). Si ha qui la schematica rappresentazione di un generico calice gustativo, nel quale è possibile distinguere le 3 diverse categorie cellulari: cellule gustative, cellule di sostegno, cellule basali. CELLULE ACUSTICHE. Si trovano nell’organo spirale interno del Corti (che fa parte del labirinto membranoso dell’orecchio interno) e sono dette cellule fonorecettrici, in quanto in grado di recepire gli stimoli sonori. (Vedi Figura 4). Come si vede, da questa figura molto schematica, è possibile individuare il padiglione auricolare, da cui si diparte il meato acustico. Quest’ultimo termina nella chiocciola o scala timpanica, all’interno della quale è possibile individuare l’organo del Corti. Le cellule fonorecettrici si dividono in: 1) Cellule acustiche esterne. ~15000, disposte in 3-5 file. Nella zona apicale recettrice, vi sono 50-100 stereociglia disposte a diversa altezza con una conformazione a V (che, nella Istologia classica, caratteristicamente, venivano definite peli acustici). (Per stereociglio si intende un ciglio fisso, non vibratile). 2) Cellule acustiche interne. ~3500, disposte in un’unica fila. Nella zona apicale recettrice, vi sono ~20 stereociglia più spesse di quelle delle cellule acustiche esterne. (Vedi Figura 5). Si ha una formazione membranosa che prende il nome di membrana tettoria. In corrispondenza di quest’ultima impattano gli stimoli sonori e si trasmettono, successivamente, ai cosiddetti peli acustici delle cellule acustiche esterne sottostanti. E’ possibile notare, sempre dall’analisi della stessa figura, in corrispondenza della porzione basale i terminali assonici di neuroni di senso che, compattandosi e riunendosi, costituiscono un vero e proprio tronco nervoso. I suddetti neuroni di senso vengono a costituire i gangli cocleari o gangli acustici, che, a loro volta, costituiscono il nervo cocleare o nervo acustico (attraverso cui lo stimolo è trasmesso al sistema nervoso centrale). Il nervo cocleare insieme al nervo vestibolare viene a costituire il cosiddetto nervo acustico. Sono presenti nella struttura dell’orecchio interno anche altre cellule che non hanno funzione sensoriale, ma unicamente plastico-strutturale: i pilastri timpanici. (Vedi Figura 6). Si tratta della rappresentazione molto schematica di una cellula acustica esterna, condotta sulla base della SEM. Nella porzione apicale è facile individuare, anche sulla base della microscopia ottica, il contrassegno ultrastrutturale delle stereociglia a scalare, con la caratteristica conformazione a V. Nella porzione basale, è possibile individuare il terminale assonico di un neurone gangliare di senso. Esso si incarica di recepire lo stimolo e di trasferirlo per via afferente, in senso centripeto: dalla cellula acustica al corpo della cellula gangliare. Si parla, allora, di componente afferente. Ma è possibile individuare anche un’altra terminazione che è percorsa da un impulso che decorre in senso inverso rispetto al verso di percorrenza del terminale assonico sensitivo: terminazione motrice o terminazione motoria. Essa si incarica di inviare impulsi che regolano la funzionalità ricettiva delle cellule acustiche per via efferente, in senso centrifugo: dal corpo della cellula gangliare alla cellula acustica. Si tratta di una terminazione nervosa mista, caratterizzata da: - una componente sensitiva - una componente motrice. TERMINAZIONI DI I e II TIPO. Quindi, riassumendo quanto detto, entrambi i tipi cellulari (cellule acustiche esterne ed interne) sono in rapporto, nel loro polo basale, con 2 tipologie di giunzioni citoneurali di tipo sinaptoide: 1) Terminazioni di I tipo. Sono piccole e presentano vescicole sinaptiche. Abbiamo già detto che si tratta di terminazioni afferenti di tipo sensoriale: riconducono lo stimolo dalla periferia al centro della cellula nervosa, con decorso centripeto. 2) Terminazioni di II tipo. Appaiono più grandi. In questo caso, si tratta di terminazioni efferenti di tipo motorio. CELLULE VESTIBOLARI. Le cellule vestibolari si trovano: - in zone differenziate dette macule. Si parla, allora, di macula dell’utricolo e macula del sacculo. Le macule rappresentano dilatazioni del labirinto membranoso; - nelle 3 creste ampollari, porzioni dilatate a forma di ampolla di terminazione dei 3 canali semicircolari. Per la notevole lunghezza delle chinociglia (per chinociglio si intende uno stereociglio particolarmente lungo) e delle stereociglia, le cellule vestibolari ampollari sono dette anche cellule capellute. (Vedi Figura 7). Dalla figura è possibile distinguere, nella parte sinistra, la chiocciola o scala timpanica e, nella parte destra, l’organo vestibolare. Qui, è possibile distinguere una zona espansa e dei canali semicircolari che terminano con delle porzioni dilatate, le creste ampollari. E’ possibile individuare anche altre 2 formazioni estroflesse del labirinto: le macule. CLASSIFICAZIONE FUNZIONALE. C. v. delle macule utricolare e sacculare: si tratta di cellule recettrici delle sollecitazioni statiche gravitazionali e cinetiche delle accelerazioni lineari. C. v. delle creste ampollari: si tratta di cellule recettrici delle sollecitazioni cinetiche delle accelerazioni rotatorie. CLASSIFICAZIONE MORFOLOGICA. In questo caso, si distingue in: C. v. di I tipo: a forma di fiasco. C. v. di II tipo: di forma cilindrica. RISVOLTO PATOLOGICO. Un esempio abbastanza caratteristico delle affezioni che riguardano l’organo vestibolare, le cosiddette sindromi vertiginose, è sicuramente la sindrome di Menier. Essa, riguardando le sollecitazioni cinetiche, interessa preminentemente le cellule vestibolari delle creste ampollari. Ad ogni modo, va detto che è possibile ricollegare ad un particolare danno vestibolare le varie patologie vertiginose in relazione alla caratteristica disfunzione che si viene a determinare. In ogni caso, è possibile distinguere in: - Lesioni estrinseche. Se determinate, ad es., da formazioni tumorali che interessano le strutture encefaliche circostanti, che possono determinare compressioni e quindi più o meno parziale danneggiamento alla stessa struttura vestibolare. - Lesioni intrinseche. Nel caso in cui interessano direttamente la struttura vestibolare. Da un punto di vista diagnostico, pertanto, si interviene con i cosiddetti test o prove funzionali dell’apparato vestibolare. (Vedi Figura 8). Come si vede, è possibile individuare 2 citotipi sensoriali vestibolari, sulla base di una classificazione morfologica: - Cellule a fiasco. - Cellule a cilindro. Come ulteriore è più fine notazione ultrastrutturale, va detto che i terminali che interessano la cellula a fiasco ne abbracciano il corpo interno, lasciandole libere unicamente le chinociglia e le stereociglia. Al contrario, nel caso delle cellule cilindriche, i terminali nervosi si limitano canonicamente alla regione basale. Inoltre, va precisato che si tratta anche in questo caso, come per le cellule sensoriali acustiche, di terminazione mista, che presenti: - una componente sensoriale afferente-centripeta; - una componente motoria efferente-centrifuga. IL TESSUTO NERVOSO. Cenni introduttivi. Lo studio delle cellule del tessuto nervoso ha subito una vera e propria evoluzione interpretativa, da parte degli ambienti scientifici, che ha trovato un suo perfezionamento solo in tempi relativamente recenti. L’ANALISI PURAMENTE MORFOLOGICA. Le prime acquisizioni concettuali le si è ottenute con l’impiego della microscopia ottica e mediante l’impiego di un particolare metodo di colorazione, messo a punto da Camillo Golgi e Ramòn y Kajal Santiago, che, peraltro, ottennero il primo nobel assegnato per questo genere di studi. Il metodo di colorazione in questione (ancora oggi largamente usato, per scopi analitici puramente morfologici) consiste nell’utilizzo di sali di Ag, di Cr e di altri metalli pesanti. Esso ha incontrato una tale fortuna per la sua capacità di selezionare pochi elementi neuronali, ignoriamo ancora oggi perché, fra la moltitudine altrimenti presente nel preparato (si tratta, dunque, di un vero e proprio artefatto di tecnica) in maniera tale da condurre in maniera più agevole e discriminata l’indagine morfologica. Quindi, sulla base dell’utilizzo del microscopio ottico e dei suddetti coloranti, ci muoviamo ancora nell’ambito di una analisi morfologica di tipo strutturale. Successivamente, con il progresso della tecnica, si poté impiegare anche il microscopio elettronico. Anche in questo caso, ad ogni modo, ci si limitava ad una analisi morfologica benché di tipo ultrastrutturale. Di conseguenza, siamo ancora immersi nel campo della Istologia classica, che basa la propria indagine su una pura e semplice analisi di tipo strutturale-morfologico. E fino a questo momento, la potenzialità recettiva e quella trasmittente dei citotipi in questione apparivano come le uniche possibili estrapolazioni funzionali deducibili. LA RIVOLUZIONE DEI CONIUGI SCHERRER. In corrispondenza dello sviluppo degli studi istochimici e del loro costante perfezionamento, ci si rende conto che un’analisi come quella precedentemente proposta risultava essere grossolanamente limitante. Fu grande, infatti, lo scandalo quando i due coniugi Scherrer riuscirono a dimostrare, nei primi anni ’50, in maniera assolutamente inconfutabile, che, in realtà, le cellule nervose tradizionalmente reputate in grado di percepire e trasmettere gli stimoli, in realtà presentano anche una potenzialità secretoria di sostanze specifiche a significato incretivo-ormonale, per cui si passò dalla riduttiva dizione di Endocrinologia a quella ben più estensiva di Neuroendocrinologia, e si parla di neurosecrezione. Gli studi, in questo senso, vennero inizialmente condotti sul cosiddetto Sistema ipotalamico-magnocellulare e, successivamente, sul Sistema ipotalamicoparvicellulare, ma venne poi esteso ad altre strutture nervose diffuse. L’ANALISI MORFOFUNZIONALE DELL’ISTOCHIMICA E DELL’ISTOLOGIA MODERNA. La rivoluzione apportata dai coniugi Scherrer ebbe il merito di aprire nuovi orizzonti a questo tipo di ricerche sul tessuto nervoso, che analizzavano più in particolare l’aspetto funzionale della questione, prima tenuto in scarsa considerazione. Con l’utilizzo di più sofisticate tecniche di indagine istochimica, come la cosiddetta tecnica di Falk, ci si rese conto, ad es., che un numero di neuroni molto più elevato rispetto a quello delle cellule nervose che elaborano sostanze specifiche a significato incretivo-ormonale è capace di elaborare sostanze specifiche di natura non ormonale: i neurotrasmettitori. Viene, quindi, esteso ed ampliato il concetto di neurosecrezione introdotto dagli Scherrer. Così si riesce a capire definitivamente come, a livello delle giunzioni sinaptiche intraneuronali, avvenga la comunicazione dell’impulso. I neurotrasmettitori a cui si rivolge la tecnica di Falk sono monoamine biogene e specificatamente: - le catecolamine (adrenalina e noradrenalina); - la serotonina. E poi, con le indagini immunoistochimiche, il concetto di neurosecrezione è stato ancor di più ampliato, alla luce del fatto che si ha, per scopi neurotrasmettitoriali, anche l’elaborazione di sostanze peptidergiche. LA NEUROSECREZIONE. Ma è opportuno precisare che si ha a che fare fondamentalmente con 2 generici tipi di neurosecrezione: - Neurormonopoiesi. - Neurocrinia o paracrinia neuronale. E, ad ogni modo, è frequente che una stessa sostanza assuma una differente caratterizzazione funzionale, in relazione alla differente modalità di dismissione. Classificazione del Sistema nervoso. (Vedi Figura 1). In termini generali, va detto che, come è ovvio, si ha a che fare con differenti tipologie di Sistema nervoso, in relazione al differente tipo di organismo vivente (ed al posto da esso occupato nella scala evolutiva) in questione, per cui via via che si passa dallo studio di organismi molto semplici (come i vermi e, in genere, gli insetti) allo studio di organismi molto evoluti (come l’uomo) la questione si va complicando. In altri termini, si assiste a una progressiva centralizzazione delle strutture nervose dai tessuti periferici all’asse corporeo. (1) E’ qui presentata la schematizzazione di una delle più semplici tipologie di Sistema nervoso. Come si vede, le cellule neuronali sono direttamente immesse nell’ambito dei tessuti periferici, da cui ricevono gli impulsi che si incaricano di trasmettere ai principali Centri nervosi, con cui sono immediatamente in comunicazione. (2) E’ qui presentata la schematizzazione di una più evoluta, ma sempre piuttosto semplice, tipologia di Sistema nervoso. In questo caso, i neuroni sono sempre direttamente immessi nell’ambito dei tessuti periferici, ma la comunicazione dell’impulso ai Centri nervosi non avviene per via diretta, ma può avvenire mediante giunzioni sinaptiche interneuronali. (3) E’ qui presentata la schematizzazione di una particolarmente evoluta tipolgia di Sistema nervoso. In questo caso, i neuroni sono comunicanti mediante giunzioni sinaptiche e non si ha quasi assolutamente la presenza di neuroni sui vari tessuti periferici, che, al contrario, sono raggiunti mediante le terminazioni neuroniche. Ed è importante sottolineare che, negli organismi superiori (come l’Uomo), il processo di centralizzazione si compie già a livello dello stesso tubo neurale, ad opera delle cellule nervose ancora non particolarmente differenziate che lo costituiscono: i neuroblasti, anticipando così la futura organizzazione strutturale dell’adulto. E vedremo quanto grande, in questo senso, sarà la funzione di “guida” esplicata dalle cellule di nevroglia nei confronti dei neuroblasti migranti. Ad ogni modo, è bene, già fin d’ora, sottolineare l’estrema importanza di un tale fisiologico processo di sviluppo embrio-fetale per la conseguente costitutività morfologica e strutturale dell’adulto. CLASSIFICAZIONE MORFOLOGICA DEL SISTEMA NERVOSO. Nell’ambito di questa generica premessa iniziale, abbiamo più volte fatto riferimento al cosiddetto Sistema nervoso. Adesso, vediamo di meglio caratterizzarlo da un punto di vista morfologico. In questo senso, è possibile distinguere in: 1) Sistema nervoso centrale (SNC) o Neurasse o Asse cerebro-spinale: costituito dall’encefalo e dal midollo spinale. 2) Sistema nervoso periferico (SNP) o paraneurassiale (per la allocazione in prossimità del neurasse) o extraneurassiale: costituito dalle cellule gangliari e dai nervi. Le cellule gangliari, che vengono a costituire i gangli cerebro-spinali, originano, come si è visto in Embriologia, dalle cosiddette neurocreste: strutture ectodermali e a forma di semiluna, disposte al di sopra del tubo neurale. E dalle cellule delle neurocreste (che, per il loro rapporto di parentela topografica con il tubo neurale, vengono chiamate paraneuroni), che sono cellule staminali, originano, appunto, le cellule gangliari, che si collocano ai lati del neurasse e le cellule del Sistema Neuroendocrino Diffuso. E allora, si stabilisce un certo grado di affinità fra le cellule del Sistema Neuroendocrino Diffuso e i neuroni propriamente detti in termini di metaboliti istochimici presenti in entrambi i citotipi, rivelando dunque la comune origine filogenetica. E poi, è possibile distinguere una terza tipologia di strutture nervose: 3) Le cellule sensitive primarie olfattive e visive, che, derivanti embriologicamente dagli abbozzi placodiali, nel contesto di quegli organi in cui funzionano, rappresentano, per la loro diretta dislocazione nell’ambito dei tessuti periferici (normalmente, abbiamo visto, raggiunti mediante le terminazioni nervose) un residuo vestigiale filogenetico ancestrale dei più antichi antenati dell’uomo. CLASSIFICAZIONE FUNZIONALE DEL SISTEMA NERVOSO. Sulla base di una classificazione funzionale, è possibile distinguere in: - Sistema nervoso volontario (o della vita di relazione). - Sistema nervoso involontario o autonomo (o della vita vegetativa). Quest’ultimo, in particolare, sfugge ai nostri controlli volitivi. Ad es., si incarica di regolare le 2 principali funzioni dell’apparato gastro-enterico: la secrezione e la motilità. Per cui, il Sistema nervoso enterico è un tipo di Sistema nervoso autonomo. IL PARENCHIMA E LO STROMA DEGLI ORGANI NERVOSI. Trattandosi di strutture organiche, e quindi pluritissutali, anche in questo caso è possibile individuare un parenchima e uno stroma. Il parenchima degli organi nervosi è il cosiddetto tessuto nervoso propriamente detto. Al contrario, lo stroma è il cosiddetto tessuto di nevroglia. A tal proposito, va detto che impropriamente, in passato, si ritenne che lo stroma avesse, nei confronti del nobile parenchima, un ruolo satellitare, subordinato e che si limitasse all’esecuzione del supporto meccanico e dell’apporto trofico. In realtà, si tratta di un tessuto altamente attivo, che si incarica dell’adempimento anche di funzioni “nobili”, come: - la secrezione; - la trasmissione dell’impulso. Tant’è vero che, oggigiorno, si preferisce parlare di unità neurone-glia (dove il suffisso “glia” è un’abbreviazione di nevroglia). Concezione morfologica del neurone. CENNI INTRODUTTIVI. I molti ricercatori dell’ultima metà del diciannovesimo secolo e della prima metà del ventesimo, attraverso le tecniche di microscopia ottica prima e con il beneficio della microscopia elettronica successivamente, si limitarono alla pura e semplice analisi morfologica delle cellule del tessuto nervoso, producendo inizialmente dati che si soffermarono sulla struttura generale e in un secondo momento su una fine analisi strutturale, ultrastrutturale e macromolecolare. Ma niente venne fatto in merito alla componente funzionale. Perché vi fosse un corretto approccio funzionale fu necessario il contributo della Istochimica, che consentì, ad es., di rilevare la presenza, all’interno delle cellule nervose, di sostanze specifiche elaborate dalle cellule nervose stesse che, pertanto, acquisiscono una significativa potenzialità secretoria che sostanzia la funzionalità conduttrice di quello che chiameremo impulso nervoso. E’ stato sperimentalmente dimostrato, infatti, che, se private della capacità di elaborazione di specifiche sostanze che facilitano la trasmissione di messaggi chimici fra un neurone e l’altro (neurotrasmettitori), le cellule nervose perdono pure la capacità neurotrasmettitoriale. E quindi, la funzione trasmittente dell’impulso nervoso soggiace alla suddetta produzione di sostanze specifiche di natura chimica che facilitano l’operazione e che, pertanto, chiamiamo neurotrasmettitori. Una più precisa analisi della caratterizzazione funzionale dei neuroni, tuttavia, presuppone una più approfondita conoscenza dell’aspetto morfologico che caratterizza le cellule nervose. Anzi, a tal proposito, è bene sottolineare che non c’è un rapporto di sinonimia fra neurone e cellula nervosa: il neurone, come dimostreremo, è un qualcosa di più “esteso” strutturalmente e funzionalmente parlando rispetto alla più semplice cellula nervosa. (Vedi Figura 1). Il concetto di cellula nervosa, infatti, terminologicamente, si ferma a livello di quel primo, sottilissimo prolungamento che si diparte dal pirenoforo, e che chiamiamo neurite o prolungamento nervoso. Esso, tuttavia, si continua con tutta una serie di guaine e rivestimenti (che consedereremo successivamente), tanto da fare del neurite un corpo assile centrale che prende il nome di assone o cilindrasse. Il soma o pirenoforo o corpo del neurone. (Il termine “pirenoforo”, di reminiscenza aristotelica, sta ad indicare etimologicamente la struttura neuronale da cui scaturisce, come una fiamma, l’impulso nervoso). (Vedi Figura 1). Esso rappresenta il centro trofico dell’intero neurone. E’ qui possibile distinguere un nucleo molto distinto e disposto nella porzione centrale. Da esso si dipartono, inoltre, altri prolungamenti di diverso aspetto (che successivamente analizzeremo più approfonditamente): - Prolungamenti protoplasmatici o dendriti: si tratta di prolungamenti tozzi, corti e grossolani che si dipartono a breve distanza lungo il pirenoforo della cellula nervosa, ramificandosi successivamente e conferendole il caratteristico aspetto arborescente (Vedi Figura 1). - Neurite o prolungamento nervoso: esso si diparte da una struttura caratteristica del pirenoforo, che prende il nome di cono d’emergenza. Si tratta di un singolo prolungamento molto più sottile rispetto a un comune prolungamento dendritico, che si porta ad una certa distanza dal corpo cellulare, divenendo successivamente assone o cilindrasse, allorché da “nudo” che era, si riveste da tutta una serie di guaine ed involucri caratteristici, che andranno a costituire la cosiddetta fibra nervosa. Si viene, con la trasformazione del prolungamento neuritico in assone, il sostanziale passaggio dalla cellula nervosa al neurone. La fibra nervosa si apre alle terminazioni nervose ed è, quindi, il prolungamento del neurite rivestito da guaine ed involucri di varia natura tissutale (vedremo, successivamente, e nevrogliare e connettivale). Si suole spesso ma erroneamente dire che, nel pirenoforo, sono contenuti elementi caratteristici della cellula nervosa. In realtà, dimostreremo, tali componenti sono caratteristici di ogni possibile citotipo, ma proprio nelle cellule nervose assumono una particolare rilevanza, che non assumono in altre cellule, tanto da far credere, in passato, erroneamente ad una esclusività di possesso da parte dei neuroni. Analizzeremo, adesso, più nello specifico ognuna di tali componenti, ma fin d’ora possiamo dire che esse sono fondamentalmente 3: - Neuroplasma con pigmenti. - Sostanza tigroide o Sostanza cromofila di Nissl o Zolle di Nissl. - Neurofibrille. NEUROPLASMA CON PIGMENTI. Innanzitutto, è ovvio che il neuroplasma altro non sia che una particolare forma di citoplasma, specifica delle cellule nervose. Inoltre, è possibile rilevare qui una caratteristica pigmentazione che, tuttavia, è errato considerare componente esclusiva delle cellule nervose. Il fatto è, però, che proprio nelle cellule nervose si ha una assai maggiore rilevanza quantitativa. Esistono, sotto questo punto di vista, differenti forme di pigmenti, come i pigmenti di Melanina, di colore particolarmente scuro e caratteristici delle aree neuronali del mesencefalo; o ancora, pigmenti lipidici, dal caratteristico colore giallastro etc. SOSTANZA TIGROIDE O SOSTANZA CROMOFILA DI NISSL O ZOLLE DI NISSL. (Vedi Figura 2). Si sa oramai che quella sostanza tigroide, presente all’interno del neuroplasma in forma di zolle (da cui la denominazione di zolle di Nissl) o di granuli paranucleari, altamente reattiva a sali di metalli pesanti come il Cr (da cui la denominazione di sostanza cromofila di Nissl), altro non è, alla luce della microscopia ottica e soprattutto della microscopia elettronica, che ergastoplasma. L’ergastoplasma, che già di per sé per definizione possiede una caratterizzazione di intensa attività funzionale, in realtà nei neuroni si trova in uno stato di ulteriore esaltazione. Essa rispecchia una spiccata potenzialità protidosintetica, da parte delle cellule nervose, che è spiegabile alla luce delle seguenti considerazioni: - la cellula nervosa è direttamente coinvolta nella sintesi dei neurotrasmettitori che, fino ad una decina di anni fa, erano considerati di esclusiva costitutività proteica; - la cellula nervosa perde assai precocemente la capacità divisionale moltiplicativa. Si è sempre supposto, infatti, che quanto precocemente il neurone subisce un processo differenziativo altrettanto precocemente perde la capacità moltiplicativa divisionale, al punto che, si è pensato, i neuroni di un individuo adulto sono esattamente gli stessi che il medesimo possiede alla nascita. Ecco, allora, che, per adeguare la propria struttura al territorio di innervazione in accrescimento (secondo un’attività compendiata dalla legge di Levi, e non da quella delle “dimensioni cellulari costanti” di Driesch), le cellule nervose aumentano il proprio volume e la propria massa proporzionalmente alla struttura del soma. E per fare ciò, è necessaria un’intensissima attività sintetica di produzione della principale loro stoffa costitutiva: le proteine. Quest’ultimo aspetto, tuttavia, potrebbe, come è accaduto in passato, far erroneamente pensare ad una sostanziale staticità evolutiva della cellula nervosa. E’ stato sperimentalmente dimostrato, però, che un tale convincimento non trova fondamento nella realtà istologica. Lo si può assai facilmente osservare praticando, ad es., un’assonomia sperimentale, resecando il prolungamento neuritico che si diparte dal pirenoforo (per cui, alla luce di quanto detto prima circa la differenza fra neurite e assone, una tale denominazione non è molto precisa). La cellula nervosa risponde, tendendo a ripristinare la propria struttura, impegnando in maniera massiva la capacità protidosintetica della sostanza tigroide che, pertanto, si rarefà nel citoplasma, dando vita al caratteristico processo di tigrolisi. Quindi, a differenza di quanto erroneamente si pensava in passato, la tigrolisi non rappresenta uno stato di sofferenza del neurone, bensì un’operazione di ristrutturazione. E allora, si dà un significato funzionale differente al concetto di tigrolisi, che rappresenterebbe la prontezza del neurone nel ristabilire le porzioni perdute. Ed allora, in tempi relativamente recenti, è stato introdotto il concetto di neuroplasticità neuronale, a dispetto delle teorie di Kajal Santiago che riteneva il neurone come un citotipo altamente cristalizzato da un punto di vista della risposta a possibili stimoli esterni, intesi come modificazioni della sua struttura. Così, in risposta a vari stimoli (farmacologici, indotti, spontanei etc.), il neurone reagisce un riadattamento e rimodellamento della sua struttura. (Vedi Figura 3). Allo stesso modo, se alteriamo la sinapsi si ha una naturale e spontanea tendenza ad un suo ristabilimento, attraverso un processo di neosinaptogenesi, che contraddice ulteriormente il concetto cristalizzazione neuronale. La neuroplasticità apre, inoltre, una grande finestra sulla prospettiva di riorganizzare un territorio nervoso, anche se esso va in preda a fenomeni di necrosi. Ciò, ad es., può essere importante nell’ambito della cosiddetta patologia vascolare dell’encefalo, nel caso in cui non vi sia un sufficiente apporto di sangue. Si ha la possibilità di intervenire nel focolaio apoplettico e ischemico direttamente, attraverso stimoli terapeutici che inducono la neuroplasticità delle cellule nervose. Quindi, in termini più espliciti, per neuroplasticità si intende: la capacità di adattamento morfofunzionale dei neuroni, di modificazione a breve, a medio e a lungo termine delle loro attività funzionali (metabolismo, eccitabilità…), delle loro caratteristiche morfologiche (ristrutturazione delle sinapsi e del citoscheletro), in seguito a sollecitazioni di varia natura (livello di neurotrasmettitori, di ormoni, di cambiamenti ambientali…). Esistono, quindi, fondamentalmente 2 tipi di neuroplasticità: - neuroplasticità spontanea; - neuroplasticità indotta. LE NEUROFIBRILLE. Anche questa, struttura erroneamente ritenuta esclusiva dell’elemento nervoso. L’equivoco sorge alla luce del cosiddetto metodo neurofibrillare della microscopia ottica, attraverso cui è possibile evidenziare all’interno del pirenoforo, una serie di filamenti che si incrociano in un’immagine reticolare. E’ importante l’intuizione del ruolo funzionale di trasmissione che esse svolgerebbero, che avvenne inizialmente in un contesto in cui tale assunzione non poteva ancora essere dimostrata. In realtà, tuttavia, non si tratta di una struttura reale, bensì il frutto di un vero e proprio artefatto di tecnica: il prodotto della conglutinazione, dell’appaiamento, a causa dei fissativi utilizzati, delle 2 subunità citoscheletriche costitutive di ogni citotipo: i neurotubuli e i neurofilamenti. Di conseguenza, la neurofibrilla non ha un reale substrato molecolare. E’, però, egualmente vera la teoria per cui risiede nei neurotubuli e nei neurofilamenti, come vedremo, il segreto della trasmissione dell’impulso nervoso. Le spine dendritiche. (Vedi Figura 4). Come si può facilmente riscontrare, osservando un opportuno preparato istologico, il decorso dei prolungamenti dendritici non è lineare, uniforme, regolare. Al contrario, è come se essi fossero armati di tutta una serie di emanazioni spigolari: le spine dendritiche. Esse divengono dei dispositivi sinaptici di interconnessione fra un neurone e l’altro. Quindi, lungo i prolungamenti dendritici vi sono molti collegamenti sinaptici. E’ possibile rilevare la presenza di neuroni con dendriti ad elevatissima densità di spine dendritiche in specifiche regioni dell’encefalo coinvolte nei processi dell’apprendimento e della memoria, quale la regione setto-ippocampica. Dimostrazione abbastanza palese di ciò la si ha considerando che, nel senile, si ha una progressiva diminuzione e della capacità di apprendimento e della memoria, e ciò corrisponde ad una altrettanto progressiva diminuzione nel numero delle spine dendritiche lungo tutto il decorso dei prolungamenti dendritici dei neuroni, ad es., nella regione setto-ippocampica, in cui i neuroni piramidali dell’Ippocampo comunicano con i neuroni colinergici della Regione Settale, proprio mediante particolari giunzioni sinaptiche da esse assicurate. Pertanto, si può sicuramente dire che le spine dendritiche costituiscono l’equivalente strutturale dei processi cognitivi. Recenti evidenze sperimentali dimostrano che la somministrazione di fosfatidilserina, un fosfolipide insaturo essenziale, determina in un ratto vecchio il ripristino, in seguito a fenomeni di neuroplasticità, delle spine dendritiche. La fibra nervosa. OLIGODENDROCITI E CELLULE DI SCHWANN. Abbiamo già in precedenza introdotto il concetto di fibra nervosa: prolungamento del neurite, rivestito da guaine. Di conseguenza, è bene sottolineare che la fibra nervosa non nasce dal pirenoforo della cellula nervosa, ma nasce dopo un certo tratto sul decorso del neurite, inizialmente molto esile e nudo, trasformandolo di conseguenza nel terminale assonico o cilindrasse (che assume una tale denominazione, abbiamo detto, proprio perché si ritrova ad essere assialmente al centro di tutta una serie guaine e fibre di varia natura istologica). La cosa interessante, inoltre, è che le neurofibrille si estendono a livello del prolungamento neuritico, e non solo nel neuroplasma. (Vedi Figura 1). Come si vede, il manicotto esterno di rivestimento non ha un andamento regolare, ma subisce strozzamenti ad intervalli regolari: strozzamenti anulari del Ranvier o nodi del Ranvier. Si tratta di restringimenti in corrispondenza dei quali la guaina mielinica sembra interrompersi. Tuttavia, non si ha alcuna reale discontinuazione, ma un semplice restringimento, una diminuzione dello spessore ad intervalli regolari. Il tratto di fibra compreso fra due successivi strozzamenti prende il nome di segmento interanulare o segmento internodale. A questo punto, dunque, è necessario chiedersi da dove provenga la guaina mielinica. A tal proposito va detto che la struttura assonica centrale è sicuramente di derivazione neuronale e rappresenta una particolare emanazione della cellula nervosa. Ma, tutto quello che rimane addossato all’assone e che compone parte delle guaine e degli involucri della fibra nervosa non è di pertinenza del tessuto nervoso. Si tratta, invece, di strutture extra-neuronali. La guaina mielinica (il rivestimento più interno. Essa, nei comuni preparati istologici, si perde, divenendo trasparente, poiché gli alcoli, utilizzati nell’allestimento del preparato, la sciolgono, essendo quest’ultima fondamentalmente di natura lipidica) cosiddetta, nel processo formativo della mielinogenesi, è di derivazione nevrogliare. Oggi sappiamo che, a differenza di quanto si pensava precedentemente e cioè che è solo uno il citotipo funzionalmente deputato al processo della mielinogenesi, ci sono 2 precisi citotipi che si incaricano di fabbricare la guaina mielinica in sedi differenti del tessuto nervoso: - Oligodendrociti a livello delle fibre e degli organi del SNC, ove costituiscono la cosiddetta oligodendroglia. - Cellule di Schwann a livello delle fibre e degli organi del SNP, ove costituiscono la cosiddetta nevroglia periferica. Si ha quindi una vera e propria condivisione funzionale fra oligodendrociti e cellule di Schwann. IL PROCESSO DI MIELINIZZAZIONE. Il processo di mielinizzazione avviene in epoca embrio-fetale allorché il neurite, inizialmente nudo, inizia a ricoprirsi di involucri, il primo dei quali è appunto la guaina mielinica. Ed è, dunque, ovvio che tanto gli oligodendrociti quanto le cellule di Schwann debbono trovarsi, nel corso dello sviluppo, strettamente associate al neurite nudo. Cerchiamo di analizzare le tappe fondamentali di questo evento altamente transeunte. (Vedi Figura 2). Avviene che le cellule di nevroglia, inizialmente associate al neurite nudo (I), cominciano ad abbracciare, per così dire, il neurite posto al centro del futuro cilindrasse della fibra nervosa (II). Si tratta di un processo assolutamente sequenziale. Il manicotto mielinico si forma a spese di quella che erroneamente in passato era considerata l’unica cellula con potenzialità mielinogenetiche. Tuttavia, nella realtà istologica, lo schema è da riferirsi ad entrambe le cellule di nevroglia. Essa ha un suo nucleo e una certa espansione citoplasmatica. I 2 lembi periferici cominciano ad avvolgere uniformemente ed estesamente l’assone (III). Si formano due vere e proprie propaggini citoplasmatiche che si avvicinano da distanti che erano e, successivamente, un si insinua al di sotto dell’altra a ridosso dell’assone (IV). Questo primo prolungamento è detto mesoassone. Si verranno a formare successivamente varie volute di lembi citoplasmatici che si sovrappongono, in volute, le une alle altre (V). Si origina, pertanto, un movimenti di spiralizzazione di lembi citoplasmatici che si avvolgono intorno al neurite, che diviene assone. Quindi, i vari lembi sono costituiti dalla membrana plasmatica e dal citoplasma delle cellule di nevroglia, che progressivamente si assottigliano e si impoveriscono. Sicché a mielinizzazione completata, attorno all’assone si sono disposti parecchi strati concentrici e spiralizzati del primitivo citoplasma. La cellula di nevroglia rimane, con un sottile lembo citoplasmatico al cui centro ritroviamo il nucleo, addossata al di sopra di quel costituente che essa stessa ha formato (e cioè a dire la guaina mielinica). Così, riassumendo, la si costituisce la guaina mielinica, che qui rispetta un’evoluzione fisiologica normale. E le cellule di nevroglia rimangono stratificate al di sopra della guaina mielinica che esse stesse hanno prodotto a guisa di rivestimento foliaceo. Nel loro insieme, queste oramai sottilissime cellule di nevroglia costituiscono una guaina molto sottile che (per il fatto che si credeva, inizialmente, che a svolgere il processo della mielinogenesi fossero unicamente le cellule di Schwann) prende il nome di guaina di Schwann. (Vedi Figura 1). Oggigiorno, preferiamo utilizzare la denominazione alternativa di nevrilemma. E quindi, in sostanza, il nevrilemma è la seconda guaina di natura nevroglica che si sovrappone alla guaina mielinica. Questo è il processo di mielinizzazione fisiologico. Tuttavia, all’atto pratico, possono venire a determinarsi processi di mielinizzazione abnormi che si arrestano a stadi troppo precoci. E allora, se il processo di mielinizzazione si ferma, si forma una guaina mielinica ridotta nel suo spessore a cui fa riscontro una cellula nevroglica di spessore ragguardevole, poiché la minima parte del citoplasma ha costituito la guaina mielinica. E allora, si suole dire che a sviluppo ultimato lo spessore della guaina mielinica è inversamente proporzionale a quello della cellula di nevroglia da cui origina. Queste fibre che hanno subito errori nel processo embrio-fetale della mielinogenesi sono dette fibre amieliniche. L’etimologia è fuorviante in quanto potrebbe fare supporre che si tratti di una fibra completamente priva di guaine mieliniche, mentre in realtà vi sarà pur sempre almeno una ridottissima mielinizzazione, almeno il mesoassone che avvolge il neurite. Per cui, in teoria, sarebbe più corretto parlare di fibre nervose con scarsa mielina. Inoltre, benché la diversità di allocazione, il processo mielinogenetico è sostanzialmente lo stesso tanto per una c. di Schwann quanto per un oligodendrocita: la differenza è puramente quantitativa. Infatti, in condizioni di normalità, una c. di Schwann si limita ad abbracciare un solo neurite, mentre un oligodendrocita può mettersi contemporaneamente in comunicazione con diversi neuriti (tanto che, nel suo aspetto tridimensionale, una c. di oligodendroglia appare munita di molti prolungamente citoplasmatici peraltro abbastanza evidenti, attraverso cui avvolgerà più neuriti e di un citoplasma abbastanza ragguardevole). E attorno a ciascun assone che la c. di oligodendroglia mielinizza, essa formerà una guaina mielinica completa. In verità, può accadere che anche una c. di Schwann si metta in rapporto con più neuriti contemporaneamente. Tuttavia, essa non presenta sufficienti prolungamenti citoplasmatici e sufficiente citoplasma, per cui ogni neurite con cui viene a contatto riceve un contributo relativamente scarso di mielinizzazione (dal momento che il citoplasma viene distribuito in maniera proporzionalmente uguale a ciascuno degli assoni). Ne consegue una guaina mielinica incompleta, a differenza di quanto avverrebbe, in condizioni di normalità, con un oligodendrocita. SEZIONE TRASVERSALE E SEZIONE LONGITUDINALE DI UNA FIBRA NERVOSA. (Vedi Figura 3). Di conseguenza, alla luce di quanto detto finora, se osserviamo una sezione trasversale di una fibra nervosa, possiamo scorgere degli involucri e dei rivestimenti del prolungamento neuritico, assolutamente costitutivi. Come si vede, il manicotto mielinico appare fortemente elettron-opaco al fascio elettronico. E questo perché l’osmio (che è il più comune fissativo impiegato nella microscopia elettronica) si fissa sui fosfolipidi delle volute delle membrane del plasmalemma, che costituiscono quell’insieme di avvolgimenti concentrici che comunemente chiamiamo guaina mielinica (proprio perché la mielina è il fosfolipide principale che in essa ritroviamo). Si tratta di un manicotto di spessore, di norma, ragguardevole. All’interno ritroviamo l’assone, di cui scorgiamo una struttura apparentemente omogenea, che è il neuroplasma (che deriva dal neuroplasma contenuto all’interno del pirenoforo). E, dispersi nel neuroplasma, ritroviamo fondamentalmente 2 tipi di costituenti: - strutture circolari piene; - strutture circolari cave. Si tratta di quei 2 elementi citoscheletrici che, in termini di microscopia ottica, abbiamo visto, danno vita a quell’artefatto di tecnica che è la neurofibrilla. In realtà, in questo caso, poiché ci stiamo servendo di indagini di microscopia elettronica, si ha un potere risolutivo sufficientemente elevato per cogliere nella loro singolarità i neurotubuli (formazioni cave) e i neurofilamenti (formazioni piene). Si tratta, quindi, di quel sostrato ultrastrutturale tipico dell’assone per cui si suole dire che l’assone ha uno struttura neurofibrillare. E, poi, possibile scorgere il sottilissimo strato di Schwann o, meglio, nevrilemma. Ed infine (ma ne parleremo più approfonditamente successivamente), non sempre ma solo se la fibra nervosa entra a far parte di quell’organo che è il tronco nervoso, alla estrema periferia, al di sopra del nevrilemma, è possibile scorgere un ultimo caratteristico rivestimento, che qui ci limitiamo a citare e che prende il nome di endonevrio. (Vedi Figura 1). Per quanto riguarda, invece, la sezione longitudinale della medesima fibra nervosa, va detto che sarà possibile scorgere la medesima caratterizzazione di involucri: - guaina mielinica; - nevrilemma (costituito dallo scarso citoplasma delle c. di Schwann o degli oligodendrociti, a guisa di ulteriore rivestimento di spessore foliaceo); - (in alcuni casi) endonevrio. Il tronco nervoso. GENERALITA’ SUL TRONCO NERVOSO. (Vedi Figura 1). Alcune volte è presente ulteriore involucro, al di sopra del nevrilemma, già citato e che nel disegno schematico appare tratteggiato e sottile. Esso, tuttavia, è localizzato unicamente nelle fibre del SNP, allorché le fibre nervose si impacchettano in quegli organi (in quanto, entità pluritissutali) che chiamiamo tronchi nervosi. Si tratta di nervi periferici, che, per lo spessore ragguardevole, è possibile scorgere anche ad occhio nudo in operazioni quali la dissezione di un cadavere, con l’aspetto caratteristico di un cordoncino di colore biancastro. Esso è costituito da un insieme di fibre nervose. Ma cosa organizza strutturalmente un tronco nervoso? In questo senso, è bene precisare che si tratta di un tessuto di natura non nervosa. Al contrario, è il tessuto connettivo direttamente responsabile dell’organizzazione strutturale del tronco nervoso e della suddivisione delle fibre nervose in veri e propri singoli fasci nervosi (intesi come raggruppamenti di varie fibre nervose). Tuttavia, si hanno diverse segmentazioni del suddetto tessuto connettivo. Infatti, si tratta di un’unica tipologia di connettivo che subisce varie stratificazioni e differenziazioni specifiche. L’ultimo e più periferico involucro, (Vedi Figura 4). quello che, avvolge il nevrilemma, prende il nome di guaina endonevrale o guaina endonervale o endoverio. Si tratta, però, di un tessuto connettivo molto sottile e fine, costituito da esili filamenti che (vedremo, trattando del tessuto connettivo) prendono il nome di fibre reticolari. Ecco, allora, che si parla di tessuto connettivo reticolare. Nel disegno, inoltre, è possibile scorgere una cellula tipica del connettivo: il fibrocita. Si tratta di una cellula secernente che si stratifica, insieme al metaplasma, del quale le fibre reticolari, immediatamente al di sopra del nevrilemma, vengono comunemente considerate la componente strutturata. Occorre, però, ricordare che tutto ciò avviene unicamente a livello delle fibre nervose del SNP. E si ha, così, il completamento della fibra nervosa. L’IMPORTANZA DELLA G. MIELINICA E LA SCLEROSI A PLACCHE. L’attenzione degli studiosi, inoltre, da un punto di vista funzionale, nel corso degli anni, si è principalmente appuntata sulla costituzione della guaina mielinica e sul processo della mielinogenesi, dal momento che la guaina mielinica serve a conferire un certo isolamento di conduzione di quello che, in termini elettronfisiologici, si chiama impulso nervoso, ma che, in termini più specificatamente istochimici, definiamo flusso o traffico intrassonico di neurotrasmettitori. Esistono, infatti, malattie in cui si determina un errore nel processo mielinogenetico. O ancora, vicende parafisiologiche in cui la guaina mielinica si danneggia, determinando processi di demilienizzazione della fibra nervosa e che confluiscono in quell’evento morboso che chiamiamo Sclerosi a placche. Infatti, la continuità del manicotto mielinico può essere interrotta, e allora si ha questo caratteristico aspetto a placche. In verità, si è cercato di fare molto, da un punto di vista terapeutico, cercando di sfruttare i processi di neuroplasticità (di cui, si è visto, si caratterizza la cellula nervosa), ma ad oggi essa rappresenta una malattia quantomeno invalidante per quanto riguarda il processo di conduzione attraverso la fibra nervosa, con deficit negli impulsi di tipo motorio e sensitivo. Si tratta di una patologia giovanile assai difficile da diagnosticare. Oggi, tuttavia, ci vengono in aiuto sofisticate tecniche di laboratorio, quali la TAC o Tomografia Assiale Computerizzata, e ancora la Tomografia Assiale con Emissione Positronica. Da un punto di vista puramente clinico, il primo caratteristico effetto che si scorge è la parestesia: perdita di sensibilità alle estremità corporee. COME E’ FATTO UN TRONCO NERVOSO. (Vedi Figura 5). Si tratta dell’immagine abbastanza schematica della sezione di un tronco nervoso. Come si vede, esso risulta essere costituito da raggruppamenti di fibre nervose, che abbiamo definito fasci nervosi, circondati da tessuto connettivo di vario tipo. Nei comuni preparati istologici, il tessuto connettivo assume una caratteristica colorazione rosso-mattone. Il connettivo, in sostanza, rappresenta lo stroma del tronco nervoso. All’estremità più esterna, è possibile scorgere un rivestimento relativamente spesso, che si chiama epinevrio: un t. connettivo capsulare, fibroso, denso e spesso, che costituisce la guaina grossolana che riveste il tronco nervoso. A riunire in fasci le singole fibre nervose, è il t. connettivo che emana dalla faccia profonda dell’epinevrio, sicché ognuno dei fasci è costitutivamente formato da un’altra guaina avvolgente che emana dalla faccia profonda dell’epinevrio, e che prende il nome di perinevrio. Infine, giungendo all’esame di ogni singolo fascio, si nota che, dalla faccia profonda del perinevrio, emana il connettivo si addentra in ciascuno dei fasci, assai sottile e delicato, che va ad avvolgere le singole fibre al di sopra del nevrilemma, e che abbiamo già chiamato endonevrio. Alla luce di quanto detto, dunque, ne deduciamo che il tronco nervoso è, in effetti, un’entità pluritissutale: esso è l’organo caratteristico del t. nervoso periferico. La sinapsi. GENERALITA’. La includiamo nella trattazione della componentistica morfologica, poiché è proprio questo dispositivo di comunicazione interassonica che crea la possibilità di un passaggio di un qualche cosa che sappiamo essere un “messaggio chimico”, e non, come solitamente si dice, un “messaggio elettrico” (in realtà, quello che avviene da un punto di vista elettronfisiologico, è, nell’Uomo, la conseguenza del passaggio di sostanza chimiche specifiche. Nell’Uomo, infatti, la trasmissione si basa fondamentalmente su eventi di tipo chimico). Il dispositivo sinaptico è, quindi, un componente strutturato ed ultrastrutturato, che ha il suo substrato funzionale nella presenza di sostanze chimiche. E’ bene sottolineare, però, che la regione della sinapsi non è affatto l’unico componente del neurone a livello del quale si concretizzano fenomeni chimici indirizzati alla trasmissione dell’impulso nervoso. Al contrario, la sinapsi è il dispositivo della cellula nervosa e del neurone a livello del quale si concludono tali eventi chimici ed istochimici, e non quello in cui iniziano, come erroneamente si credeva in passato. Tale processo, vedremo, inizia in altri ambiti della cellula nervosa, a cominciare dal pienoforo. Il turn-over, il ciclo metabolico dei neurotrasmettitori, invece, a livello della sinapsi si conclude. E anzi, a dire il vero, ancora oltre, a livello di quello che definiamo spazio o intervallo sinaptico (facendo intendere con questa espressione che la sinapsi è un dispositivo di giunzione fra cellule nervose, che stabilisce un rapporto di contiguità fra un neurone e l’altro, e non un rapporto di continuità, come si credeva). Si ha un accostamento fra due componenti neuronali a livello della regione sinaptica, ma c’è pur sempre un intervallo che definiamo intervallo sinaptico e che sigla, contrassegna l’individualità di ogni cellula nervosa. E allora, i neuroni non rappresentano una rete continua, così come aveva erroneamente pensato Golgi (teoria della rete nervosa diffusa), ma, come giustamente aveva pensato il suo condivisore del premio nobel, Ramòn y Kajal, sono presenti spazi interposti. E allora, il commento della sinapsi completa i corollari della cosiddetta Dottrina del neurone, che si concretizza nella formulazione di principi che stanno alla base del funzionamento della cellula neuronale. I 2 corollari fondamentali sono: 1) Il neurone è indipendente ed autonomo. Infatti, fra i neuroni esiste un rapporto di indipendenza che, abbiamo detto, è compendiato dall’interruzione di contiguità che si stabilisce a livello dei cosiddetti intervalli sinaptici. 2) Questo secondo corollario viene comunemente ricordato anche con la denominazione di Legge della polarizzazione dinamica del neurone, che impone una direzione obbligata all’impulso che percorre tutti i suoi componenti. Questo aspetto, vedremo, è consentito in massima misura proprio dalla caratterizzazione morfofunzionale dei dispositivi sinaptici. E allora, si stabilisce che nei dendriti l’impulso ha un decorso centripeto (che si avvicina al pirenoforo dalla periferia), e definiamo tale impulso: impulso di natura sensitiva, poiché gli impulsi vengono raccolti nei più disparati distretti della periferia corporea e smistati in corrispondenza del pirenoforo. Nell’assone la direzione dell’impulso è speculare: in senso centrifugo (dal pirenoforo al terminale neuritico), secondo una direttiva che segna la natura dell’impulso di natura motoria. Ecco per quale motivo si pala di polarizzazione dinamica del neurone, secondo cui la direzione dell’impulso è univoca. LE 3 PRINCIPALI FORME DI GIUNZIONI SINAPTICHE. Le qualifiche che, negli anni, sono state date ai vari dispositivi sinaptici rispecchiano gli assunti fondamentali di tale legge, per cui è possibile parlare di: - Sinapsi asso-somatica. (E non somato-assonica, alla luce di quanto abbiamo detto a proposito della legge della polarizzazione dinamica). Essa si stabilisce a livello del corpo della cellula nervosa (benché più tradizionalmente la sinapsi sia raffigurata all’estremo terminale di un prolungamento del neurone). Infatti, lungo tutto il contorno neuronale possono intrattenersi svariati rapporti sinaptici: fra il terminale assonico di un altro neurone e il corpo del neurone che è oggetto di studio. - Sinapsi asso-dendritica. Fra il terminale assonico di un neurone che si congiunge con il dendrite di un secondo neurone, in ottemperanza alla legge di polarizzazione dinamica. - Sinapsi asso-assonica. E’ quella tipologia di giunzione sinaptica che ha suscitato più diatribe. Sembrerebbe contraddire la legge della polarizzazione dinamica, dal momento che, abbiamo detto, lungo l’assone l’impulso decorre solo in senso centrifugo, facendo sì che, se davvero si stabilisse una giunzione sinaptica fra due elementi assonici contigui, necessariamente perché vi sia trasmissione dell’impulso, in uno dei due casi, esso debba decorrere in maniera anomala in senso centrifugo. (Vedi Figura 6). In realtà, una tale rappresentazione della sinapsi asso-assonica è totalmente sbagliata. Al contrario, essa deve essere concepita secondo la seguente modalità: (Vedi Figura 7). Il terminale di un assone che si inserisce sul decorso di un altro assone, che stabilisce un rapporto sinaptico secondo le 2 possibilità precedentemente descritte con un terzo assone. Pertanto, l’impulso si inocula in senso latero-laterale, per dirla con termini chirurgici, senza quindi contraddire la legge di polarizzazione dinamica. Di sinapsi asso-assoniche è pieno il territorio dell’Ipotalamo, con i suoi neuroni endocrini, trasmettitoriali etc. CARATTERIZZAZIONE ULTRASTRUTTURALE DELLA REGIONE SINAPTICA. (Vedi Figura 8). La regione sinaptica si può pienamente configurare, a livello di microscopia elettronica. Servendoci della meno sofisticata microscopia ottica, infatti, concepiamo la regione sinaptica come un puro e semplice ispessimento fra due differenti terminali assonici o fra il terminale assonico di un neurone e il soma o il dendrite di un altro. E allora, in sostanza, si avranno fondamentalmente sempre 2 componenti: quella del neurone trasmittente (sempre di natura assonica) e quella del neurone che subisce la trasmissione (di varia natura). Possiamo, quindi, distinguere fondamentalmente 2 regioni caratteristiche: - Regione o elemento pre-sinaptico. - Regione o elemento post-sinaptico. Ma fra le due regioni è presente un intervallo sinaptico che la microscopia elettronica considera dell’ordine dei 200 angstroms, e che stabilisce la sostanziale indipendenza ed autonomia dei due neuroni. Quindi, i due neuroni non sono caratterizzati da un rapporto di continuità. E il problema, vedremo, sarà proprio quello di capire come, nonostante manchi un rapporto di continuità fra i due neuroni, possa avvenire il passaggio del messaggio chimico. Nella regione post-sinaptica non vi è nulla che richiami l’esistenza di una componentistica ultrastrutturale, cosa che, al contrario, accade nella regione presinaptica. In quest’ultima, infatti, è rilevabile la presenza di mitocondri, ad es., e di piccole strutture vescicolari e tondeggianti, e della porzione terminale degli apparati citoscheletrici, neurofibrille e neurofilamenti. E fu proprio l’individuazione delle suddette vescicole sinaptiche a far erroneamente pensare, in passato, che proprio in corrispondenza della sinapsi avvenissero gli eventi biochimici caratteristici della trasmissione dell’impulso nervoso (che, abbiamo visto, è frutto di un lavorio metabolico che si colloca più a monte, in corrispondenza del pirenoforo). Sequenze endo- ed extraneuronali della trasmissione chimica dell’impulso nervoso. (Vedi Figura 1). Abbiamo già descritto la sinapsi come: dispositivo interneuronico che assume diverse qualifiche in relazioni ai componenti che vengono in giunzione fra di loro (rispettando pur sempre la Legge della Polarizzazione Dinamica). E, alla luce di tale concetto, abbiamo anche distinto, nella realtà istologica, fondamentalmente 3 tipi di giunzioni sinaptiche: - Sinapsi asso-assonica. - Sinapsi asso-dendritica. - Sinapsi asso-somatica. Abbiamo anche sfatato l’erroneo convincimento che nella sinapsi nascessero e si attuassero gli eventi biochimici ed istochimici che consentono la trasmissione dell’impulso nervoso, alla luce della constatazione, oramai inconfutabilmente accettata, che l’intero neurone, nelle sue diverse componenti, partecipa al turnover di neurotrasmettitori. E così, a livello della sinapsi si ha una pura e semplice conclusione degli eventi biochimici ed istochimici che soggiacciono alla trasmissione dell’impulso nervoso. Al contrario, è il pirenoforo o corpo cellulare o soma del neurone ad essere identificato come il compartimento neuronale a partire dal quale scaturiscono tali eventi, eventi che si concretizzano nel confezionamento e nella biosintesi dei neurotrasmettitori. Quindi, volendo (ovviamente per puri scopi illustrativi, poiché si tratta di eventi tanto complessi ed articolati e tanto intimamente legati che un’analisi di questo tipo non può che essere una consistente generalizzazione) analizzare le varie e successive tappe del turnover metabolico endo- ed extraneuronale dei neurotrasmettitori, considereremo: I TAPPA: CAPTAZIONE PRECURSORI. Essa si esplica a livello del pirenoforo. Si tratta di una vera e propria captazione, assunzione attiva, ad opera della membrana plasmatica del pirenoforo, dei precursori delle varie sostanze neurotrasmettitoriali. Ovviamente, tali precursori avranno una natura chimica differente a seconda della specifica natura chimica del neurotrasmettitore che dovrà essere elaborato, ma che, nella maggior parte dei casi, sono materiali di natura glicoproteica (e quindi, proteine neuronali o neuropeptidi). Tuttavia, il discorso è ben più complesso. Sono stati scoperti, infatti, ad es., anche altri neurotrasmettitori di natura non proteica. II TAPPA: BIOSINTESI DEI NEUROTRASMETTITORI. Questa seconda tappa è, evidentemente, endoneuronale. Si ha un primo confezionamento, già completato a livello del pirenoforo, ad opera dei cosiddetti dispositivi membranosi che, presenti fisiologicamente in quasi tutte le cellule, qui assumono una particolare esaltazione funzionale, in relazione allo stato di esaltazione che la cellula nervosa mostra nei confronti di questi processi di sintesi. Tali dispositivi sono: - Ergastoplasma o Sostanza tigroide o Sostanza cromofila di Nissl. - Apparato del Golgi. - Lisosomi. Essi, in questa particolare sede citotipica, cooperano, al punto che è stato coniato un acronimo che indica questo stato di sinergia funzionale: GERL complex (vedi “I lisosomi”). III TAPPA: TRASPORTO DEI NEUROTRASMETTITORI. Dopo il loro confezionamento, tali sostanze devono essere trasferite a quell’altra caratteristica struttura neuronale (che, nella figura è, nella parte presinaptica, rappresentata come una sorta di espansione bottonuta) che chiamiamo sinapsi, seguendo l’indirizzo e la direttiva del cosiddetto flusso assonico (che si verifica nel contesto del neurite che, sotto questo punto di vista, ne è l’equivalente macromolecolare). Il flusso assonico deve imboccare determinate microvie di scorrimento, alle volte di entità addirittura macromolecolare (che rientrano nella strutturazione di alcune componenti del citoscheletro del neurone). E, la via di scorrimento principale (perché, vedremo, esiste pure una via di scorrimento secondaria, che procede in direzione opposta) viene a costituire il flusso assonico anterogrado (e cioè, dal pirenoforo verso la sinapsi e i terminali assonici). Le ultrastrutture citoscheletriche implicate, in questo senso, sono i microtubuli, che, nell’ambito della cellula nervosa, acquisiscono la denominazione suppletiva di neurotubuli. Si tratta di ultrastrutture cave, che si impacchettano nell’ambito del prolungamento nervoso, e che costituiscono appunto le microvie di scorrimento dei neurotrasmettitori, dal pirenoforo alla regione della sinapsi. A questo punto, è bene effettuare di specificazioni di scopo chiarificatore: 1) Che i microtubuli siano implicati nel processo di trasmissione, e 2) Che il processo di neurosecrezione abbia inizio a livello del corpo della cellula nervosa (e non a livello della terminazione sinaptica, come si credeva prima), sono oramai dati di fatto, facilmente dimostrabili attraverso l’utilizzo di una particolare sostanza chimica che si chiama colchicina. Quest’ultima è stata tradizionalmente impiegata, per scopi farmacologici, nella terapia di una malattia congenita del metabolismo proteico, che è la gotta, e poi nella terapia antimitotica delle manifestazioni tumorali, perché è risaputo che la colchicina rappresenta un vero e proprio veleno fusoriale, interferendo con quella rappresentazione strutturale che, nelle cellule in mitosi, è il fuso mitotico acromatico. Infatti, il fuso viene a costituirsi per polimerizzazione di proteine, le tubuline, che vengono inattivate dalla colchicina. E allora, deponendo sperimentalmente questa sostanza su un prolungamento assonico, si realizzano molto caratteristicamente delle evidenze che ci portano ad affermare inconfutabilmente che i neurotrasmettitori sono sintetizzati a livello del pirenoforo e che i neurotubuli sono le vie di scorrimento elettive dei medesimi. Infatti, si nota una concentrazione massiva di neurotrasmettitori a livello del pirenoforo e una loro quasi totale deficienza a livello della sinapsi (in corrispondenza delle vescicole presinaptiche), proprio perché le tubuline costitutive dei neurotubuli sono inattivate dalla colchicina e, allora, non si verifica la trasmissione attraverso di questi. Segno della veridicità inconfutabile delle due premesse fatte inizialmente. Tutto questo venne ad essere dimostrato allorché si speculava sul meccanismo di propagazione del flusso assonico anterogrado. Oggi, sappiamo molto di più sulla natura del flusso assonico e sappiamo anche che i neurotubuli (i microtubuli della cellula nervosa) rappresentano, in realtà, strutture citoscheletriche implicate non in fenomeni dinamici, bensì statici, con la precisazione che, in alcune cellule (come la cellula nervosa), sono anche più o meno direttamente implicati in fenomeni di natura dinamica. Vedremo, ad es., che le ultrastrutture di quelle appendici mobili e vibratili che sono le ciglia vibratili e della coda flagellare dello spermatozoo, hanno una caratterizzazione microtubulare. Tuttavia, è bene precisare che a far acquisire il carattere dinamico, in alcuni citotipi, ai microtubuli, non sono tanto le tubuline (abbiamo detto le prncipali proteine costitutive dei microtubuli), quanto le cosiddette proteine MAP o proteine associate ai microtubuli, allocate sulla corteccia di ciascun microtubulo. (Vedi Figura 2). Qui è rappresentato molto schematicamente un neurotubulo. Come si vede, esso è costituito dall’associazione di microcavità determinate dall’associazione di questa proteina dimerica, che è la tubulina. E appunto, a determinare il carattere dinamico non è tanto la tubulina quanto le MAP. E queste proteine che si associano alla corteccia di ciascun microtbulo (e quindi, anche il neurotubulo) sono differenti a seconda della sede citotipica che stiamo analizzando, e quindi a seconda dello specifico destino funzionale a cui sono devolute. Ad es., nel neurotubulo, le proteine implicate nella propagazione dinamica del flusso assonico, sia anterogrado che retrogrado, sono le cosiddette cinesine (esclusive della struttura neurotubulare) e la dineina citoplasmatica (a cui si attribuisce anche la qualifica topografica, poiché la dineina entra a far parte integrante anche degli apparati ciliari, per cui, per distinguere selettivamente la dineina del neurotubuolo, si parla di dineina citoplasmatica). Ed è interessante notare come le stesse derivazioni etimologiche ci portino ad apprezzare le funzionalità cinetiche e dinamiche di queste proteine. E quindi, è proprio grazie alla modificazione della particolare configurazione spaziale di queste proteine che si conferisce al neurotubulo la funzione trasmittente di scorrimento sia anterogrado che retrogrado. E poi, come sottospecifica del flusso assonico anterogrado, in funzione della velocità di propagazione, distinguiamo: - flusso assonico anterogrado rapido; - flusso asonico anterogrado lento. Il flusso assonico anterogrado è quello prescelto dai neurotrasmettitori. Al contrario, un es. di quello retrogrado è dato da una particolare evidenza sperimentale, consentita da una particolare sostanza, la perossidasi del rafano, utilizzata in istochimica, nell’ambito di alcune miscele di colorazione istochimica, che, per le particolari proprietà della perossidasi, vengono raccolte nella regione sinaptica e risalgono fino al pirenoforo, mediante flusso assonico anterogrado. E questo è molto utile per le applicazioni pratiche che ne derivano. Infatti, l’andamento dei terminali assonici, nella realtà istologica ed anatomica, non è così semplicistico come gli schemi didattici che frequentemente si utilizzano per puri scopi illustrativi potrebbero fare credere (sia per la consistente lunghezza che raggiungono i terminali assonici sia per il rapporto molto intricato che contraggono vicendevolmente). E così, nell’ambito di particolari applicazioni di laboratorio, in cui si vuole seguire con precisione l’andamento di un terminale assonico dalla regione sinaptica o di innervazione fino al corpo cellulare, attraverso un vero e proprio mappaggio topografico, giova l’impiego di questa particolare tecnica istochimica che si fonda sull’utilizzo della Perossidasi del rafano, per ricostruire le vie nervose (odologia). Un es. di flusso retrogrado è dato anche dalla patologia spontanea con il virus della Rabbia. La Rabbia è appunto una malattia spesso mortale veicolata da questo virus neurotropo, che presenta una spiccata affinità per certe regioni encefaliche, come l’Ippocampo e il Corno di Ammone. Esso risale per via retrograda dalle terminazioni sinaptiche fino ai pirenofori che distrugge, costituendo quelle caratteristiche formazioni istopatologiche denominate corpi del Negri, che rappresentano l’effetto dell’effetto citopatogeno esplicato dal virus. In questo senso, molto dipende dal luogo in cui avviene il morso dell’animale infetto: si hanno maggiori probabilità di immunizzazione farmacologica se localizzato a livello di terminazioni organiche periferiche, come gli arti; è quasi certamente mortale, invece, se localizzato in prossimità dell’encefalo, come nel volto. A questo proposito, per puri scopi descrittivi, è opportuno fare riferimento almeno sommariamente anche all’altra componente citoscheletrica che poi, conglutinata con il neurotubulo, dà vita all’artefatto neurofibrillare: il neurofilamento. Si può dire che appartengono alla categoria dei neurofilamenti (strutture piene che appartengono alla cellula nervosa, impegnate nel mantenimento della struttura statica del neurone e dello spessore dello stesso prolungamento nervoso, tanto che, in condizioni patologiche di eccessivo accumulo di neurofilamenti, si ha un ispessimento cospicuo del prolungamento assonico, che dà vita al gruppo delle cosiddette Malattie degli assoni giganti) filamenti intermedi presenti nel pirenoforo e nei prolungamenti dendritici e assonico dei neuroni centrali e periferici. La costitutività chimica è essenzialmente proteica, e - per i neuroni centrali, si parla di tripletta neurofilamentosa, costituita dall’associazione e dalla polimerizzazione di tre diverse proteine (rispettivamente di 68000, 145000 e 200000 Da); - per i neuroni periferici (cioè, nelle cellule degli organi nervosi periferici: nelle cellule gangliari), si parla di una sola proteina, che chiamiamo proteina NF-L o periferina. Ed è bene sottolineare che tutto ciò interessa e la fisiologia e la patologia, a causa delle turbe nell’assemblaggio di queste strutture macromolecolari, che si chiamano Patologie molecolari del neurone. Per cui, distinguiamo in: 1) Patologia molecolare dei neurofilamenti dei neuroni centrali. Essa interessa sia l’età giovanile che senile. Oggi è oggetto di intense indagini da parte dei ricercatori, data la loro incidenza nella pratica clinica. Da un punto di vista del substrato istopatologico comune, si riscontra un esagerato accumulo intraneuronale ed endoassonico di neurofilamenti, responsabili dell’alterata dinamica del citoscheletro (infatti, pur essendo i neurofilamenti determinanti per la statica, esercitano, per riflesso, grande importanza anche nell’ambito della dinamica). Le forme cliniche più gravi sono: - Malattia di Alzheimer. In questo caso, si parla di neurofibrillary tangles: ingrossamente neurofibrillare, in senso lato. Oggi sappiamo, in maniera più precisa, che è la componente neurofilamentosa ad essere interessata, e non genericamente la componente neurofibrillare. Come risultato clinico, si ha una compromissione delle performance cognitive, con situazioni demenziali. - Demenze senili. - Panencefaliti. Si tratta di infiammazioni acute e croniche degli organi del nevrasse. - Malattie degli assoni giganti. Si tratta di una polineuropatia: vengono colpite le ramificazioni periferiche con manifestazioni algiche notevolissime. - Neuropatie tossiche accidentali e sperimentali. Da un punto di vista della patogenesi biochimica comune, invece, si evidenziano disturbi della fosforilazione ossidativa che causa modificazioni dello stato di polimerizzazione delle proteine neurofilamentose. Le strutture citoscheletriche non hanno carattere di stabilità identificativa. Non è che non siano presenti in tutte le cellule, anzi sono presenti in tutte le cellule, solo che alle volte sono visibili e altre volte no, secondo una vera e propria evanescenza visiva. In condizioni patologiche, si ha un abnorme irrigidimento del citoscheletro, uno stato di polimerizzazione delle proteine stabile e permanente, a differenza dell’assemblaggio e disassemblaggio mutevole. Ed ecco che, allora, si crea questa alterazione dinamica del citoscheletro. E viene meno anche quell’aspetto di plasticità dell’aspetto formale del neurone (che, abbiamo visto, in condizioni fisiologiche è altamente plastico). 2) Patologia molecolare dei neurofilamenti di periferia. Si tratta dei filamenti intermedi della cellula nervosa, costituiti dalla proteina neurofilamentosa NF-L o periferina. Gli es. più significativi sono: - Sclerosi laterale amiotrofica. Che provoca l’alterazione della sensibilità e della motilità in alcuni distretti corporei. E’ la struttura muscolare che viene a soffrire per la mancanza di impulsi che non percorrono più le terminazioni nervose periferiche che terminano a livello della muscolatura striata. Quando si viene a determinare qualcosa di anormale in corrispondenza delle terminazioni nervose motrici che confluiscono sulla muscolatura volontaria si ha una mancata risposta del muscolo. - Carcinomi neuroendocrini. Stranamente. Essi, infatti, riguardano le cellule che fanno parte del Sistema Neuroendocrino Diffuso, che originano dalla cresta neurale e che, sciamando, occupano i diversi distretti periferici. Così, quando nelle cellule tumorali della cute, ritroviamo la presenza di filamenti di periferina (che è una struttura precipua delle cellule nervose periferiche e non delle cellule epiteliali o di quelle connettivali), comprendiamo che si trattava originariamente, prima di imboccare l’esito neoplastico, di una cellule del Sistema APUD, che, come è caratteristico delle cellule tumorali, ha percorso all’indietro il processo di differenziamento e ha riacquisito le potenzialità caratteristiche della cellula neurocrestale (e cioè, in particolare, quella di dare origine a una cellula gangliare con tutto il suo corredo biochimico caratteristico, tra cui anche i neurofilamenti). In questo caso, quindi, la presenza dei neurofilamenti rappresenta un espediente di marcatura e di identificazione di queste particolari forme tumorali. IV TAPPA: ACCUMULO. Si tratta di un accumulo di neurotrasmettitori a livello di quei “fortilizi” che sono le vescicole sinaptiche. Nella regione della sinapsi, vengono identificati anche mitocondri, a cui spettano funzioni di donazione energetica. Nella sinapsi, infatti, avvengono attività operative che comportano grande dispendio di energia, come: lo spostamento delle vescicole presinaptiche fino alla membrana presinaptica, la fusione della membrana della vescicola presinaptica con quella presinaptica, il meccanismo di rilascio etc. V TAPPA: RILASCIO. Nell’ambito di questa quinta tappa, siamo usciti dallo spazio neuronale e siamo entrati nello spazio interneuronale dell’ampiezza di 200 A, che contraddistingue l’individualità dei singoli neuroni. E’ bene notare che sulla membrana plasmatica del secondo neurone, sono presenti aree chimiche specifiche (prima si riteneva unicamente costituite da glicoproteine, oggi si sa molto più varie) che captano i relativi neurotrasmettitori. Ed è corretto dire i “relativi”, perché si ha un rapporto di affinità molto stretta e specifica fra i vari neurotrasmettitori e le corrispondenti aree recettoriali. E allora, in funzione di questo ancoraggio, si stabilisce il meccanismo di trasduzione molecolare interna del segnale chimico, che si compie nel contesto del secondo neurone. Si tratta di un meccanismo che comporta delle variazioni di potenziale della membrana post-sinaptica e l’apertura di particolari porte chimiche, che chiamiamo canali, attraverso cui, in breve, fluisce Ca, che entra all’interno del secondo neurone (in sostanza, questi canali sono aperti, nel secondo neurone, dall’interazione neurotrasmettitore-recettore) e che va ad attivare determinate proteine. Si attivano, quindi, i messaggeri intracellulari del secondo neurone che, stimolando a loro volta determinati sistemi enzimatici, ne scatenano la risposta. Sta qui, di conseguenza, il meccanismo attraverso cui, mediante la produzione di neurotrasmettitori, un neurone risponde alla stimolo di un altro neurone. E, in questo senso, va precisato che la trasmissione dell’impulso è inizialmente su base chimica, mentre i “fenomeni elettrici” non ne sono che corollari conseguenti. In termini generali, si può intendere una cellula nervosa come una sorta di pila in miniatura con l’interno caricato negativamente e l’esterno positivamente. E proprio come tra i due elettrodi di una pila, tra l’esterno e l’interno delle cellule, si stabilisce una d.d.p., detta potenziale di riposo, pari a ~ -60mV. Esso si mantiene inalterato finché la cellula non viene stimolata (attraverso segnali di natura chimica): in tal caso i canali della membrana si aprono ed il Na+ (che era maggiore all’esterno) diffonde all’esterno, mentre il K+ (che era maggiore all’interno) diffonde all’esterno. Poiché il Na+ diffonde più velocemente del K+, l’interno tende a divenire positivo rispetto all’esterno e si crea un potenziale d’azione, pari a ~ +30mV. Tale impulso si sposta lungo la fibra con una velocità di 100m\s. Nel frattempo, il K+ che esce dalla cellula compensa il Na+ che entra, finché non si ristabiliscono le condizioni iniziali. VI TAPPA: INATTIVAZIONE ENZIMATICA (COMT, AchE…). Una volta che ha innescato il meccanismo di trasduzione interna chimica del segnale, il neurotrasmettitore si sgancia dal suo recettore, secondo un meccanismo che è stato paragonato al rapporto fra una chiave e la sua serratura o, con una simbologia ancora più azzeccata, in quanto esprime la plasticità e la fluidità dell’evento molecolare in questione, al rapporto di un dito con il suo guanto. Per un certo intervallo di tempo, il neurotrasmettitore sganciato permane nello spazio sinaptico. Qui (ovviamente, in funzione della specifica natura biochimica del neurotrasmettitore, vi sarà un cambiamento negli enzimi preposti all’adempimento di tale operazione) i neurotrasmettitori subiscono una inattivazione metabolica. A proposito dell’inattivazione metabolica nei confronti dei neurotrasmettitori, ad opera di particolari enzimi, si ha un rilievo di grande importanza pratica, e non esclusivamente eruditiva. Alla luce di queste conoscenze, infatti, la Farmacologia terapeutica ha inventato un vasto gruppo di farmaci che agiscono ai vari livelli della neurotrasmissione. Fra questi, i più importanti sono sicuramente i cosiddetti Farmaci bloccanti i recettori. Essi impediscono l’ancoraggio dei neurotrasmettitori allre specifiche aree chimiche di ricezione, inattivando o rallentando la trasmissione nervosa. Si tratta di farmaci andati molto “di moda” nell’ultimo decennio. Ne esistono di diversi tipi (ad es., quelli che bloccano la trasmissione adrenergica impediscono l’ancoraggio delle monoamine, e così via…), ma spesso determinano effetti controproducenti, sebbene prevedibilissimi. Si consideri, ad es., che i recettori non sono localizzati esclusivamente a livello del cervello, ma anche a livello di vari altri organi dell’organismo, per cui un loro utilizzo massivo potrebbe provocare inopportuni “effetti collaterali”. Abbiamo visto a questo proposito, ad es., come uno dei recettori caratteristici della cellula cloridropoietica delomorfa sia il Recettore H-2, a cui si aggancia l’istamina. Per impedire farmacologicamente la produzione istamina, possiamo somministrare farmaci anti-istaminici. Ma si è visto che, come effetto collaterale, si ha un blocco dell’aggancio dell’istamina anche per le cellule gonadali maschili, che sono ricche di Recettori H-2, e un conseguente arresto della libido. VII TAPPA: RICAPTAZIONE E RIUTILIZZO DEI NEUROTRASMETTITORI. I neurotrasmettitori che sfuggono all’inattivazione metabolica degli specifici enzimi preposti rientrano nella regione della sinapsi. Questa tappa è assai importante per l’economia del metabolismo della cellula nervosa: si ha, infatti, un riciclaggio e recupero attivo esplicato dalla membrana presinaptica, una ritesaurizzazione. Si tratta, quindi, di un espediente fisiologico di recupero di una quota attiva che sfugge all’inattivazione extra-sinaptica. E, per alcuni neurotrasmettitori, come i neurotrasmettitori monoaminici (le monoamine biogene), in seguito alla ricaptazione, prima del rientro nel “fortilizio” protettivo della membrana della vescicola presinaptica, si ha un’ulteriore inattivazione, ad opera di altri enzimi specifici, come le MAO (Mono-Amino Ossidasi). Quindi, la quota che, al termine dei due processi disattivanti, si recupera, è veramente molto ridotta. Deroga al principio di Dale. I concetti fin qui analizzati hanno una particolare importanza non esclusivamente sul piano squisitamente eruditivo, ma anche per quanto riguarda i risvolti pratici nell’ambito delle applicazioni cliniche conseguentemente possibili, attraverso l’impiego di particolari farmaci. Attraverso questi farmaci possiamo intervenire nella regolazione del turnover metabolico delle cellule nervose. Essi, tuttavia, sono stati prodotti sinteticamente sulla base concettuale di un vero e proprio corollario della Neuroistologia che, con il tempo, è andato sempre più disgregandosi e perdendo in vali dità pratica: il postulato di Dale. Sulla base di quest’ultimo, nel corso delle neuroscienze, si credeva che ogni neurone elaborasse un solo neurotrasmettitore, convincimento questo assolutamente infondato che, nel corso degli anni, ha subito tutta una seri di “eresie”, per cui solitamente si parla di deroga al principio di Dale. La prima constatazione è che (e lo si è potuto appurare inconfutabilmente in Istochimica) nel neurone possono esistere diverse sostanze impiegate per scopi neurotrasmettitoriali. Si parla, allora, di colocalizzazione. Ciò, ovviamente, comporta ulteriori complicanze al già complesso metabolismo neurotrasmettitoriale, per cui è necessario parlare, almeno, di tre differenti categorie di sostanze che possono essere colocalizzate all’interno di uno stesso neurone (cosa impensabile alla luce del postulato di Dale): 1) Neurotrasmettitore primario (ad es., monoaminico, colinergico etc.). 2) Cotrasmettitore (che coadiuva il Neurotrasmettitore primario). 3) Modulatore allosterico (che agisce sui Recettori vicini a quello fondamentale sui cui agisce il Neurotrasmettitore primario). Inoltre, per quanto riguarda la seconda constatazione, va detto che fino a qualche decennio fa, si pensava che nella membrana post-sinaptica e solo nella membrana post-sinaptica fossero presenti i Recettori per i neurotrasmettitori. Successivamente, tuttavia, si è avuta l’identificazione di Recettori non solo nella membrana post-sinaptica, ma anche in quella pre-sinaptica, che ampia il corredo di aree chimiche a cui si possono legare i neurotrasmettitori. Per cui, si parla di Recettore presinaptico o Prerecettore o Autorecettore. Sono, così, modulabili anche i processi che avvengono nella regione presinaptica, mediante l’emissione neurotrasmettitoriale di altri neuroni, come ad es.: - ricaptazione; - riutilizzo; - espulsione dei neurotrasmettitori; - parziale disattivazione; - etc. Ed esiste una gamma di Autorecettori tanto vasta quanto quella dei post-Recettori classicamente intesi, di cui i seguenti non sono altro che qualche sparuto esempio: - Autorecettori per i n. noradrenergici. Autorecettori per i n. dopaminergici. Autorecettori per i n. serotoninergici. Autorecettori per i n. colinergici. Autorecettori per i n. glutammatergici. Autorecettori per i n. GABAminergici. Infine, la terza constatazione riguarda la complessità strutturale del Recettore. E’ importante, quindi, una conoscenza dettagliata dell’area recettoriale. (Vedi Figura 3). Se, ad es., si esamina il recettore per il GABA (GABA: acido−γ−β− −γ−β−idrossibutirrico) −γ−β− che è un mediatore inibente della trasmissione intersinaptica, si nota abbastanza facilmente che non si tratta di una singola proteina con un singolo sito attivo recettoriale, ma di un complesso di proteine con più siti attivi recettoriali. Infatti, si ha anche un sito recettoriale detto sito BDZ: sito delle benzodiazedine. Si tratta di farmaci che esplicano un’azione antidepressiva (prima non si capiva perché, oggi si, alla luce delle considerazioni che faremo). E ancora, si ha un sito detto sito BARB: sito di ancoraggio dei farmaci barbiturici, che esplicano un’azione ipnogena che può indurre anche al sonno, tanto che sono stati utilizzati per scopi anestetici. Ed infine si ha un sito Cl: sito per il Cloro. Prima, come detto, non si capiva perché la somministrazione di tali farmaci esercitasse tali caratteristici effetti. Oggi, si è finalmente compreso che essi, legandosi a specifici siti di ancoraggio del recettore GABA, ne mimano l’attitudine funzionale: quella di inibizione della trasmissione nervosa, con i relativi effetti pratici che ne derivano (e che, quindi, possono essere sfruttati in campo farmacologico). Altre sono le interessantissime applicazioni pratiche che ne derivano. Esistono tecniche, infatti, diagnostiche moderne, soprattutto per quanto riguarda il territorio dell’Encefalo, che servono ad identificare i siti recettoriali funzionanti e non funzionanti. Una di queste è una forma più evoluta di TAC: la PET (Tomografia ad Emissione Positronica), che impiega determinate sostanze che vanno a legare ben determinati recettori, evidenziando l’aspetto e la conformazione delle ben determinate aree cerebrali a cui vanno a legarsi e quindi possibili anormalità. Fattori di crescita del t. nervoso (NGF: Nerve Growth Factor). Il Nerve Growth Factor è una proteina così definita poiché la sua azione precipua, anche se non unica, è l’indurre la crescita di fibre nervose nella cellula bersaglio. Venne inizialmente identificata da Beuker, con un esperimento, tuttavia, mal interpretato. Egli trapiantò in embrioni di pollo un sarcoma di topo, ed osservò che, dopo appena 4-5 giorni, si aveva un accrescimento veramente notevole delle fibre nervose. Allora, interpreto erroneamente l’esperimento, deducendone che le cellule tumorali fornivano un terreno di accrescimento ottimale per le fibre nervose. La giusta interpretazione venne prospettata alcuni anni più tardi da R. LeviMontalcini, che ritenne giustamente che, in realtà, l’esperimento di Beuker era tanto importante in quanto stabiliva l’esistenza di certe “sostanze”, secrete in grandissime quantità dalle cellule tumorali e che inducevano un accrescimento sostanziale delle fibre nervose. Era stato scoperto il Nerve Growth Factor, che quindi esplicherebbe nei confronti della fibra nervosa, un’azione tropica, trofica e differenziativa. . Classificazione morfologica dei neuroni. Alla luce di quanto finora detto, è facilmente intuibile che una classificazione puramente morfologica dei neuroni non ha grande valore informativo. Ed infatti, oggigiorno, si preferisce porre l’accento soprattutto sull’aspetto istofunzionale. Ad ogni modo, poiché per molti decenni ci si concentrò esclusivamente sulla descrizione morfologica dei neuroni, è opportuno farvi almeno sommariamente riferimento. METODI DI INDAGINE. Abbiamo già descritto le principali tecniche di microscopia ottica che ci consentono lo studio del neurone come entità morfologica, prima che come entità citochimica. E’ preferibile, tuttavia, farvi ancora una volta riferimento. Va ricordato, innanzitutto, il metodo di impregnazione argentica di Golgi, ancora oggi usato per la caratteristica potenzialità di identificare in un determinato campione di tessuto, soltanto un numero assai limitato do neuroni (5%), per ragioni ancora oggi oscure. Sicuramente, però, consente una notevole facilità di osservazione dei preparati istologici. Sulla stessa scia si colloca il metodo fotografico all’Ag ridotto di Kajal. Lo studio della morfologia del neurone ha ricevuto nuovo impulso dall’avvento della microscopia elettronica. Essa ha fornito dati di estremo interesse nella chiarificazione dettagliata dell’organizzazione strutturale del neurone, e in particolare modo degli equivalenti ultrastrutturali. La tecnica istochimica, infine, ha consentito di vagliare più approfonditamente l’aspetto istofunzionale del neurone. Fra le principali tecniche istochimiche, va ricordato il metodo di Falck e Hillarp, il quale rileva in maniera specifica la presenza endoneuronale di neurotrasmettitori monoaminici (catecolamine, serotonina). Attraverso di esso, è stato possibile precisare non soltanto gli aspetti morfoistochimici statici del neurone monoaminergico, ma anche quelli dinamici. Ed ha fornito anche un interessantissimo metodo di valutazione semiquantitativa. Un altro metodo abbastanza caratteristico è il metodo di Gomori alla cromoematossilina-floxina, che ha consentito di individuare i neuroni del Sistema magnocellulare. La tecnica autoistoradiografica permette di seguire la traversata interneuronale di sostanze marcate con isotopi radioattivi e di identificare, quindi, particolari categorie neuronali (neuroni noradreninergici, neuroni GABAergici etc.). Le tecniche istoenzimatiche si fondano sull’identificazione indiretta dei neuroni, sulla base dell’analisi delle sostanze che producono, per cui si avranno una tecnica istoenzimatica per la MAO, tecnica istoenzimatica per la AchE (acetilcolinaesterasi) etc. Ed infine, con le tecniche immunoistochimiche, si è riuscito ad effettuare l’identificazione strutturale ed ultrastrutturale di un gran numero di neuroni implicati nell’elaborazione di svariati neuropeptidi. IL NEURONE COME ENTITA’ MORFOLOGICA. Al di là della già citata teoria della rete continua di Golgi e della più corretta teoria del neurone autonomo di Kajàl, va detto che, un po’ erroneamente (vedi il concetto di Neuroplasticità), secondo la qualifica di Bizzozero, i neuroni vennero sempre identificati come elementi perenni, che si differenziano abbastanza precocemente nella vita embrionale ma altrettanto precocemente arrestano il loro ritmo mitotico, in maniera che il loro numero rimane pressoché costante nell’organismo adulto, da cui la formulazione della legge di Levi in contrapposizione alla legge delle grandezze cellulari costanti di Driesch. Sul piano morfologico esistono differenti modi di classificare un neurone, dei quali considereremo i principali: 1) In base alla individualità formale del neurite. Per cui si distingue in: - Neuroni di I tipo di Golgi: se si distingue e si individualizza sempre il neurite, nonostante il groviglio di fibre nervose. - Neuroni di II tipo di Golgi: se il neurite perde la sua individualità formale nel groviglio di fibre nervose. 2) In base al puro e semplice aspetto formale. In questo senso, potrebbero essere farti molti es., di cui ne considereremo solo alcuni: - Cellule piramidali della Corteccia cerebrale. - Cellule a ventaglio o a spalliera di Purkinje. - Cellule mitrali del bulbo olfattivo. - Cellule stellate. - Cellule sferiche. - Etc. 3) In base alla modalità di ramificazione dei prolungamenti e al loro numero. Questa classificazione si avvicina di più all’aspetto funzionale, perché è come se classificasse i neuroni in base alla Legge della polarizzazione dinamina: - Neuroni unipolari: se provvisti di un solo tipo di prolungamenti (e non di un solo prolungamento: o dendrite o neurite). Esempi abbastanza caratteristici sono i neuroni embrionali e i neuroni sensitivi primari visivi e olfattivi nell’adulto. - Neuroni bipolari: se provvisti di entrambi i tipi di prolungamenti. Sono es. abbastanza caratteristici i neuroni gangliari o neuroni pseudounipolari o neuroni a T, le cellule bipolari della retina e le cellule di Purkinje (costituite da un neurite e un dendrite che si ramifica ulteriormente). (Vedi Figura 1). La caratteristica conformazione a T è la risultante di un processo abbastanza Caratteristico, che avviene nello sviluppo formativo di questa cellula. (Vedi Figura 2). Poiché si tratta di una cellula gangliare, iniziamo la nostra descrizione dalle creste neurali. Inizialmente, questa cellula neuroblastica ha 2 prolungamenti distinti, posti ai poli opposti del pirenoforo (ed infatti, assume la caratteristica denominazione di cellula opposito-polare). Poi, avviene un accrescimento eccentrico del pirenoforo, che comporta l’avvicinamento del due prolungamenti in posizione opposito-polare, fino a far assumere alla cellula la caratteristica conformazione a T. (Un ganglio è un organo del SNP. I secondi organi del SNP sono i nervi o tronchi nervosi. I gangli sono, appunto, costituiti dalle cellule nervose di senso, che chiamiamo cell. Gangliari o neuroni gangliari o neuroni pseudounipolari o cellule a T). - Neuroni multipolari: in questo caso, entra in gioco anche il numero dei prolungamenti, oltre che la loro polarità. Si tratta dei neuroni con due tipi di prolungamenti e con più dendriti. Si annoverano in questo gruppo anche gli ex neuroni di I e II tipo di Golgi. 4) In base alla allocazione topografica. E allora, si distingue in: - Neuroni intranevrassiali: situati nel contesto dell’asse cerebro-spinale. - Neuroni extranevrassiali: situati al di fuori del nevrasse. Il neurone come entità citochimica. Come già detto, gli studi di Neuroistochimica hanno consentito di identificare, in maniera più pregnante, il neurone come vera e propria entità citochimica, coinvolta nell’elaborazione di sostanze specifiche coinvolte o nel meccanismo di trasmissione dell’impulso nervoso (neurotrasmettitori) o in un meccanismo di significato endocrino (neurormoni). Successivamente, però, quando le conoscenze sui due diversi ambiti si sono accresciute, una differenziazione netta è sembrata piuttosto aleatoria (al punto che moltissimi neurormoni possono essere additati come putative transmitters, e viceversa). E così, entrambi convergono nell’ambito di quel concetto che, dai tempi di Scherrer, prende il nome di neurosecrezione. Nell’ambito della classificazione che segue, inoltre, si ricordino le varie deroghe al principio di Dale, per cui occorre tenere presente che ci si basa unicamente ed arbitrariamente sul Neurotrasmettitore primario, ma ogni classe di neuroni può produrre differenti sostanze. Da un punto di vista della Neurosecrezione è possibile classificare i neuroni fondamentalmente in 4 grandi famiglie: A) Neuroni aminergici. B) Neuroni purinergici. C) Neuroni peptidergici. D) Neuroni nitrossidergici. I neuroni aminergici. Essi comprendono 3 grandi classificazioni che, a loro volta, implicano altre sottoclassificazioni: 1) Neuroni monoaminergici (se sfruttano come neurotrasmettitori le monoamine). - Neuroni Dopaminergici. - Neuroni Noradreninergici. - Neuroni Adreninergici. - Neuroni Serotoninergici. 2) Neuroni colinergici (se sfruttano come neurotrasmettitori l’acetilcolina). 3) Neuroni aminacidergici (se sfruttano come neurotrasmettitori gli aa). - Neuroni GABAergici. - Neuroni Glicinergici. - Neuroni Taurinergici. - Neuroni Glutammatergici. - Neuroni Aspartatergici. I NEURONI COLINERGICI. Si tratta del primo gruppo di neuroni, caratterizzati dalla produzione e dall’utilizzo, come neurotrasmettitore, delle amine. In effetti, l’era che segna l’utilizzo di questa classificazione, però, inizia con l’identificazione dei Neuroni colinergici (che utilizzano, come neurotrasmettitore, l’acetilcolina), per aggiunta non a livello del SNC, ma delle giunzioni mioneurali periferiche. E tutto questo grazie all’impiego di tecniche di rilevazione istochimica indirizzate nei confronti dell’enzima che inattiva l’acetilcolina: l’AchE o acetilcolina-esterasi. Successivamente, con lo stesso metodo, è stata rilevata la loro presenza anche in ambito cerebrale. Da un punto di vista del turnover metabolico neurotrasmettitoriale, infine, si ha quella sequenza di processi precedentemente analizzata. (Vedi Figura 3). E’ questo lo schema di un neurone colinergico. Esso è perifericamente agganciato alla struttura muscolare, in corrispondenza della cosiddetta regione sinaptoide, così chiamata in quanto costituita fra un neurone e una struttura muscolare, per cui è altresì indicata come giunzione mioneurale o placca motrice, in cui il prolungamento assonico colinergico si inoscula nella regione tissutale muscolare. E’ interessante sottolineare che nella identificazione del neurone colinergico non concorse tanto l’identificazione dell’ACH (acetilcolina), quanto del suo enzima demolente: l’AchE (aceticolina-esterasi). I NEURONI MONOAMINERGICI. Benché scoperti, cronologicamente, successivamente rispetto ai Neuroni colinergici, sono quelli più largamente studiati, per le facili possibilità applicative, come il metodo di Falck e Hillarp (’64). Essi si incaricano di produrre le cosiddette monoamine biogene: la serotonina e le catecolamine (adrenalina e noradrenalina). Ed in base al prodotto di sintesi neurotrasmettitoriale specifico, abbiamo visto, esistono svariate classificazioni. Per quanto riguarda la dislocazione topografica, va precisato che essi si trovano sia a livello del SNC che del SNP. Ad es., si pensava che i gangli cerebrospinali, non facendo parte del SNC, fossero unicamente costituiti da Neuroni colinergici. Poi, si è dimostrato che così non è. E quindi, la cellula a T, che si ritenne per lungo tempo esclusivamente colinergica in base al principio di Dale, può anche essere una cellula monoaminergica. Ci se ne può rendere facilmente conto osservando un opportuno preparato istologico, mediante metodo di Falck. Tuttavia, non fu facile tale acquisizione, poiché il metodo di Falck presuppone l’utilizzo della tecnica del freeze-drying (vedi), e quindi di macchinari piuttosto sofisticati. Si riuscì, tuttavia, infine, a stabilire che le cellule gangliari elaborano non solo ACH, ma anche monoamine biogene. (Vedi Figura 4). Le monoamine si depositano, in forma caratteristica, in forma minutamente granulare, in piccoli rigonfiamenti distribuiti lungo i terminali assonici, a forma di coroncine di rosario, in corrispondenza delle componenti terminali. Ed infatti, i Neuroni di tipo monoaminergico assumono un caratteristico colorito verdastro a livello delle terminazioni assoniche, in conseguenza della presenza di monoamine neurotrasmettitoriali. E, ovviamente, si individua una maggiore fluorescenza in corrispondenza dei terminali assonici, piuttosto che nel prolungamento assonico, poiché quest’ultimo è un prolungamento di trasmissione continua e quindi non si avrà alcun ristagno, a differenza di quanto avvenga nei terminali assonici, ove si individuano caratteristici rigonfiamenti che prendono il nome di varicosità assoniche. E ciascuna di queste varicosità potrebbe essere il corrispettivo di una spina dendritica. Infatti, queste zone di rigonfiamento, a causa della massiva presenza di neurotrasmettitori, divengono zone di innesto sinaptico. Biosintesi delle Catecolamine. Abbiamo già analizzato la biosintesi delle catecolamine a proposito della medulla surrenale. (Vedi Figura 5). Va detto, inoltre, che, a differenza delle cellule della midollare del Surrene, che presentano ingenti quantità di enzima PNMT (fenilalaninmetil-transferasi), capace di trasformare ulteriormente la Noradrenalina in Adrenalina, le cellule nervose sono caratterizzate dalla presenza di bassissime concentrazioni di PNMT (e quindi, di molta Noradrenalina e poca Adrenalina), con il risultato che per molto tempo si pensò erroneamente che fossero in grado di produrre sono Noradrenalina. Biosintesi della Serotonina. Anche in questo caso, si ha un preciso processo biosintetico, con la differenza che il precursore non è la Tirosina, bensì il Triptofano. (Vedi Figura 6). La serotonina è stata frequentemente impiegata in farmacologia, nella terapia delle cefalee o crisi cefalalgiche. Essa è la stessa sostanza che Vialli ed Espamer ritrovarono in cellule dell’apparato gastro-enterico, tanto che la chiamarono Enteramina. Da un punto di vista delle applicazioni pratiche in campo farmacologico, va ricordata l’esistenza di farmaci inibenti la MAO (e cioè, inattivanti l’enzima inattivante mitocondriale) che, quindi, fanno aumentare la concentrazione monoaminica, che, quindi, sono utilizzati come antidepressivi. Infatti, la depressione clinica, riduttivamente e semplicisticamente (poiché nel processo di neurotrasmissione, abbiamo visto, non è interessato solo il Neurotrasmettitore primario), era considerata come frutto di un decremento endoneuronale di neurotrasmettitori, e viceversa l’ansietà clinica, come frutto di un aumento endoneuronale di neurotrasmettitori. Un’altra classe di farmaci è la COMT (catecolamine-o-metil transferasi): enzima inattivante extrasinaptico. Esistono anche farmaci bloccanti i recettori, che occupano i recettori a cui si legano, impedendo il legame dei relativi neurotrasmettitori. NEURONI AMINACIDERGICI. Sono così definiti perché impiegano aa o frammenti di aa come neurotrasmettitori. Gli es. più costitutivi sono sicuramente: - Neuroni GABAergici (acido−γ −γ-amino-β− β−idrossibutirrico). −γ β− Si tratta di classici neurotrasmettitori di tipo inibitorio. Essi contraggono rapporti con alcune cellule di Nevroglia, gli Astrociti e gli Oligodendrociti, che, a quanto pare, svolgerebbero la funzione di serbatoio di neurotrasmettitori, accostate come sono al terminale sinaptico. Così, il GABA in parte ritorna alla regione presinaptica e in parte viene deviato e fa tesaurizzazione nell’Astrocita, che quindi diviene serbatoio succedaneo in particolari situazioni emergenziali. Al contrario, gli Oligodendrociti sono produttori strani ed insoliti di steroidi, di ormoni sessuali femminili derivati del Progesterone, che vengono definiti neurosteroidi. Essi vengono smistati al neurone GABAergico, del quale divengono cotrasmettitori o neurotrasmettitori succedanei, determinando un caratteristico effetto di sedazione, in analogia a quella che è la funzione primigenia del neurone GABAergico. Ed ecco che, proprio per questo motivo, tale idrossi-progesterone viene spesso impiegato come anestetico. Il rapporto che gli Oligodendrociti e gli Astrociti possono contrarre con i neuroni (così come, vedremo, il rapporto che gli Astrociti possono contrarre con Neuroni glutammatergici) dimostrano abbastanza significativamente che la cellula di Nevroglia non è affatto un partner silenzioso, così come erroneamente si credeva in passato. - Neuroni Glutammatergici. L’acido glutammico, che sigla l’esistenza dei neuroni glutammatergici, è il contraltare funzionale e farmacologico del GABA, e cioè con potenzialità attivante. Si capisce quanto sia importante, se si considera che ogni neurone del nostro Sistema Nervoso riceve almeno una sinapsi di tipo glutammatergico. In condizioni patologiche di mancato apporto di sangue al cervello e quindi di ossigeno, come a causa di ischemie cerebrali, l’ac. glutammico ha un eccesso di produzione e si ha quindi un assorbimento di glutammato da parte dei neuroni dell’area ischemica. E allora, si parla di azione eccito-tossica del glutammato nell’area ipossiemia, poiché si ha una estensione ulteriore della necrosi nel soggetto colpito da ictus. E allora, si è iniziato ad impiegare, nel recente passato, farmaci che bloccano la sintesi di acido glutammico, per limitare l’estensione della zona necrotica. Infine, come già detto, in condizioni fisiologiche e in condizioni patologiche di eccesso di produzione di glutammato, il Neurone glutammatergico può contrarre rapporto con le cellule di Nevroglia astrocitarie, che svolgono la funzione di serbatoi succedanei. Neuroni purinergici. Si tratta di una categoria molto ristretta, che sfrutta come base di trasmissione neurotrasmettitoriale le basi puriniche. Sono gruppi di neuroni limitati a quelle emanazioni del nostro Sistema Nervoso, costituite da cellule gangliari, comprese nello spessore delle tonache muscolare e sottomucosa dell’apparato gastro-enterico: Sistema neuroenterico. Una quota sparuta di neuroni, in questa sede, sono proprio neuroni di natura purinergica. I neuroni peptidergici. Etimologicamente, significa: “neuroni che elaborano peptidi”. Occorre puntualizzare, tuttavia, che, quando fu inizialmente coniato, il termine di neurone peptidergico indicava sì la possibilità di certi neuroni di elaborare peptidi, ma tali peptidi erano già stati studiati ed analizzati dagli Scherrer (che, intanto, avevano scoperto il Sistema ipotalamico magno cellulare-neuroipofisario), in qualità di peptidi con funzione ormonale. Per cui, quando fu inizialmente coniato, con il termine “neurone peptidergico”, ci si limitava ad indicare neuroni con potenzialità secretive ormonali, e quindi capaci di elaborare sostanze specifiche immesse nel circolo ematico. Ed, in effetti, siamo a conoscenza del fatto che gli ormoni smistati dalla Neuroipofisi non sono, in realtà, di derivazione ipofisaria, ma prodotti da cellule nervose della regione diencefalica, successivamente raccolti nella Neuroipofisi, ed infine smistati nel circolo ematico. L’elemento rivoluzionario consiste nel fatto che, oggi, con la qualifica di “neurone peptidergico”, non ci limitiamo ad indicare neuroni che elaborano peptidi utilizzati per scopi ormonali, ma anche per scopi neurotrasmettitoriali. E allora, per completezza di esposizione, includiamo nel novero dei neuroni classificati su base funzionale di elaborazione neurotrasmettitoriale anche la famiglia dei “Neuroni peptidergici”. Essi sono ulteriormente classificabili in tre grandi raggruppamenti: 1) N. peptidergici del sistema ipotalamico magnocellulare-neuroipofisario. - Neuroni elaboranti ossitocina. - Neuroni elaboranti adiuretina-vasopressina (ADH). 2) N. peptidergici del sistema parvicellulare-ipofisiotropico. - Neuroni elaboranti TRH. - Neuroni elaboranti LRH. - Neuroni elaboranti CRH. - Neuroni elaboranti MIP. - Neuroni elaboranti SRF. - Etc. (vedi Ipofisi). 3) N. peptidergici extraipotalamici centrali e periferici (si tratta di peptidi che, nella maggior parte dei casi, sono stati isolati in altri territori endocrini del Sistema Neuroendocrino Diffuso). - Neuroni elaboranti Sostanza P. - Neuroni elaboranti colecistochinina (CCK). - Neuroni elaboranti neurotensina. - Neuroni elaboranti VIP. - Neuroni elaboranti angiotensina. - Neuroni elaboranti Endorfine. - Neuroni elaboranti Enkefaline. - Etc. (sono più di 210, ed è un raggruppamento in continuo accrescimento). SCHERRER, PADRE DELLA NEUROSECREZIONE PEPTIDERGICA. Alla luce di quanto detto, Scherrer fu giustamente definito “padre” della Neurosecrezione peptidergica, caratterizzata inizialmente unicamente da peptidi di natura ormonale e, solo successivamente, anche con funzione neurotrasmettitoriale. Per quanto riguarda la Neurosecrezione endocrina, si concepisce il neurone caratterizzato dalle presenza di granuli, che non sono vescicole presinaptiche, perché non hanno niente a che fare con il contatto interneuronico. E allora, si parlò di vescicole neurosecretorie, perché contengono sostanze che non partecipano alla neurotrasmissione, ma che vengono riversate dal neurone nel circolo ematico, divenendo quindi ormoni. Quando, al contrario, il neuropeptide, invece che nel sangue, viene riversato con un rapporto di contiguità su un neurone adiacente, esso diviene un prodotto neurotrasmettitoriale. I neuroni nitrossidergici (impropriamente chiamati, in passato, neuroni nitrinergici). Si distinguono fondamentalmente due categorie: 1) Neuroni nitrossidergici del SNC. 2) Neuroni nitrossidergici del Sistema Nervoso Autonomo (NSE). Tre studiosi americani, di recente, hanno vinto il Nobel per lo studio di questa particolarissima famiglia di neuroni. Essi hanno concentrato la loro attenzione sullo studio della sostanza specifica elaborata da questi neuroni. E, in questo senso, è assolutamente suggestivo che il Nitrossido (NO2), che è una delle più piccole molecole esistenti, e che abbiamo sempre considerato un inquinante atmosferico e sostanza nociva per l’organismo, presente nei gas di combustione delle automobili e nel fumo delle sigarette, distruttore dell’ozono, in realtà è, in condizioni fisiologiche, il frutto della potenzialità elaborativa di alcuni citotipi. Le prime cellule produttrici di nitrossido studiate (siamo nell’ ’87), sono state le cellule dell’endotelio vascolare, e qui il nitrossido esplica essenzialmente la funzione di vasodilatazione. E allora, si parlò di Nitrovasodilatatore endogeno (e così venne denominato per la prima volta). Dopo il ’91, si effettua la scoperta fondamentale che, nelle cellule nervose, è presente l’enzima Nitrossido-sintetasi, in grado di sintetizzare Nitrossido. E i tre autori suddetti inventarono un interessante metodo istochimico per il rilevamento della NOS endoneuronale. E si appurò, finalmente, che alcuni neuroni sono in grado di elaborare Nitrossido. Esso è una sostanza assai strana, ambigua e bizzarra: come Dr. Jekyll e Mr. Hyde, perché, in condizioni fisiologiche, rappresenta un neurotrasmettitore benefico per il nostro organismo, ma, in condizioni patologiche, diviene un killer, una sostanza citotossica responsabile di moltissime malattie (esso, si è scoperto, interviene in quasi tutti i processi patologici: polmonari, gastro-enterici, nervosi, gonadali- il famoso VIAGRA, ad es., è il risultato degli studi condotti a livello gonadale sul Nitrossido). E allora, inizialmente (oggi si contano più di 15000 voci bibliografiche), tali neuroni vennero identificati con la denominazione alquanto impropria di neuroni nitrinergici, impropria perché etimologicamente inconsistente. Sicché venne successivamente ad essere sostituita con la più calzante: neuroni nitrossidergici. I neuroni nitrossidergici sono allocati a livello del SNC e del SNP. Le terminazioni nervose periferiche. Prima di trattare più specificatamente delle Terminazioni nervose periferiche, è bene effettuare qualche interessante puntualizzazione. Da un punto di vista strettamente fisiologico, i neuroni possono essere suddivisi in 3 grandi categorie, in funzione della natura degli impulsi che esprimono (e quindi, in relazione alla direzione di propagazione dell’impulso e alla Legge della polarizzazione dinamica): 1) Neuroni motori o efferenti. Si tratta di quei neuroni che inviano, alla periferia, impulsi di significato motorio o afferente. 2) Neuroni sensitivi o afferenti. Si tratta di quei neuroni che prelevano impressioni di senso, sotto forma di stimoli di diversa natura sensoriale, alla periferia corporea e, tramite le loro fibre nervose, le trasferiscono ai pirenofori e da qui smistato alle diverse zone del Sistema Nervoso . 3) Neuroni intercalari. Così chiamati, perché topograficamente interposti fra i neuroni motori e i neuroni sensitivi. Quindi l’impulso viene inizialmente captato dai neuroni sensitivi, poi trasmesso ai neuroni intercalari che, a loro volta, lo smistano ai neuroni motori (che possono rispondere con impulsi di tipo efferente, indirizzati verso i tessuti periferici). Abbiamo detto, occorre fare questa premessa per comprendere le modalità con cui terminano le fibre nervose, sicché, per quanto riguarda le Terminazioni nervose periferiche, distinguiamo: - Espansioni delle fibre dei neuroni efferenti o motori. - Espansioni delle fibre dei neuroni afferenti o sensitivi. A) Espansioni delle fibre dei neuroni afferenti o sensitivi. Ne esistono fondamentalmente 3 possibili modalità: 1) Espansioni libere. In questo caso, la fibra nervosa di senso si sfiocca alla periferia senza nessuna complicanza strutturale, e si perde, si innesta, si inocula sia nell’ambito dei tessuti epiteliali sia nell’ambito dei connettivi. Ma poiché ci troviamo sulla superficie corporea, e qui si trova quell’organo di copertura del nostro soma che è la cute, costituita da uno strato superficiale di natura epiteliale, detto epidermide, e da uno strato connettivale sottoepiteliale, il derma, distinguiamo ulteriormente in: - E. libere intraepiteliali. - E. libere intraconnettivali. In questo senso, si osserva come, a livello della cute, in sede intraepiteliale, si venga a costituire una rete di terminazioni molto esili ed eleganti, fini e fitte, detta rete di Langherans. 2) Espansioni corpuscolate. In questo caso, il terminale della fibra nervosa si affonda nei tessuti, che sono quasi tutti di natura connettivale. E, una volta che si inoscula nel connettivo di svariati distretti corporei, questa espansione viene circondata dalle zone connettivo circostante (che, pertanto, modifica i suoi aspetti strutturali ed istologici). E allora, si costituiscono attorno al terminale della fibra nervosa di senso, delle capsule, degli involucri costituiti dal connettivo in cui la fibra si è addentrata, che realizzano un tutt’uno con l’espansione terminale, la quale viene ad occupare il centro di questa nuova formazione, che in genere è proprio una formazione corpuscolata. Si formano i cosiddetti corpuscoli terminali: ecco perché questa seconda modalità espansiva della fibra nervosa è detta Espansione corpuscolata. I corpuscoli sono formazioni interconnettivali, pluritissutali (organelli), perché costituiti al centro da una rappresentanza nervosa (che è la fibra nervosa, affondata nel connettivo) e attorno da una stratificazione (differente a seconda del particolare tipo di corpuscolo. E, vedremo, ne esistono molti) del tessuto connettivo circostante. Il connettivo, abbiamo detto, può essere di varia natura, a seconda della precisa sede organica in cui ci troviamo. Per cui, volendo fare qualche esempio, distinguiamo: a) Il derma: dove, abbiamo visto, terminano anche espansioni in forma libera. b) Le tonache o lamine proprie delle membrane mucose. c) Il connettivo periarticolare: che circonda le strutture articolari. d) Il connettivo intermuscolare: fra i fasci muscolari, nella muscolatura volontaria somatica striata, che costituisce i muscoli. e) Il connettivo tendineo: e cioè dell’estremità terminale di un muscolo, che lo fissa allo scheletro. In queste diverse sedi, che sono sempre di natura connettivale, si possono approntare e costituire, appunto, delle Espansioni corpuscolate di fibre di neuroni sensitivi. PIANO DI ORGANIZZAZIONE COMUNE DELLE ESPANSIONI CORPUSCOLATE. Va detto che ai corpuscoli terminali, si diede inizialmente anche la denominazione piuttosto equivoca di Recettori periferici (equivoca perché il termine Recettore è comunemente attribuito a quelle aree attive periferiche plasmalemmatiche che ancorano sostanze di diversa natura: neurormoni e neurotrasmettitori. Quindi, oggigiorno, il termine “Recettore” è ascritto esclusivamente a quel complesso macromolecolare glicoproteico che costituisce le varie aree di ancoraggio per farmaci o induttori endogeni di vario tipo). Sicuramente, però, i corpuscoli terminali sono organelli che recepiscono impressioni di senso, e proprio in questo senso si spiega il significato funzionale del termine “recettore” altrimenti attribuito loro. Allora, cerchiamo di capire come è fatto un recettore e perché esistono differenti tipi di recettori, con diverse qualifiche. Una prima risposta è: questa varietà è determinata dal fatto che diverse sono le forme di energia recepibili alla periferia corporea: variazioni termiche, pressorie, sensazioni dolorifiche, sensazioni tattili, sensazioni di stiramento (che contribuiscono a mantenere il “tono muscolare”), etc. Però, nell’ambito di questa varietà di fine dettaglio, vi è una base, un piano di organizzazione comune che vale per tutti i corpuscoli: il corpuscolo terminale è un organo neuroconnettivale costituito da un’espansione nervosa di vario tipo che, quando si affonda nei tessuti connettivi periferici, caratteristicamente perde la guaina mielinica e si risolve al solo neurite, che però viene circondato da un involucro di connettivo capsulare (perché forma una vera e propria capsula), ma che è sostanzialmente modificato nel suo comportamento microscopico. E allora, distinguiamo: - Corpuscoli del Pacini. I più studiati. Sensibili a stimoli di natura pressoria, tanto da essere anche definiti pressocettori (da notare la terminologia affine a quelle cellule epiteliali sensoriali che abbiamo definito chemiorecettrici o chemioaccettrici, fonorecettrici e statocinetiche). Analizzandoli morfologicamente si ribadisce quel piano di organizzazione comune precedentemente esposto. E’ possibile distinguere le cellule connettivali appiattite che si dispongono intorno al prolungamento neuritico privo di guaine, assumendo la caratteristica fisionomia icasticamente paragonata alla buccia di una cipolla. - Corpuscoli del Meissner. Formato morfologicamente da un avvolgimento connettivale imbutiforme, mentre al centro la fibra si risolve in tante spire sovrapposte, dando vita ad un vero e proprio viticcio di espansioni semplici di natura nervosa. Essi sono sensibili alle sensazioni tattili: tattocettori. - Corpuscoli di Merkel. Sensibili alle sensazioni meccaniche: meccanocettori. - Dischi tattili di Pinkus. Anch’essi sensibili alle sensazioni tattili. - Corpuscoli di Golgi-Mazzoni e Clave di Krause. Caratterizzate morfologicamente da uno sdoppiamento della fibra nervosa, che conferisce alla conformazione corpuscolata un aspetto bilobato. - Corpuscoli di Ruffini. Di aspetto più delicato, nel senso che le espansioni nervose che si ramificano molto sottilmente terminano con una fisionomia bottonuta, e vi è un esile strato connettivale di rivestimento. Ed è possibile individuare, ancora, altre 2 formazioni corpuscolate, che hanno un significato un po’ più complesso, da un punto di vista del loro funzionamento, poiché acquisiscono attitudini anche di tipo motorio, oltre che sensitivo: - Organi muscolo-tendinei di Golgi. Espansioni corpuscolate disposte in corrispondenza del connettivo intermuscolare e tendineo soprattutto, responsabili, essendo sensibili alla cosiddetta tensione muscolare, del cosiddetto tono muscolare, che è lo stato di permanenza contrattile basale di ogni fibra muscolare contrattile striata volontaria somatica. - Fibre neuromuscolari. Sensibili all’allungamento muscolare. 3) Espansioni formanti un giunzione cito-neurale. Modalità limitata solo a 3 distretti periferici. Non si realizza più né con un epitelio né con un connettivo, ma (limitatamente a 3 distretti corporei), con una particolare classe di cellule epiteliali: la cellula sensitiva secondaria: - cellule acustiche; - cellule vestibolari; - cellule gustative. Si tratta, ad ogni modo, di distretti di natura epiteliale e non nervosa, se no si stabilirebbe con le espansioni terminative dei neuroni afferenti una giunzione sinaptica, e invece si tratta di una giunzione sinaptoide. B) Espansioni delle fibre di neuroni efferenti o motori. Se ne distinguono fondamentalmente due tipologie: 1) Espansioni somatomotrici. Localizzate nel tessuto muscolare striato, il tessuto muscolare somatico contrattile per eccellenza, e quindi sui muscoli volontari. La fibra motrice affondandosi, ma non perforando, nella struttura muscolare, costituisce un dispositivo che prende il nome di placca motrice: il punto di giunzione fra un neurone di tipo motore con la struttura muscolare striata. E’ bene fare questa precisazione perché esiste un’altra varietà di tessuto muscolare striato, che è quello che costituisce il miocardio, la tunica contrattile del cuore. Quindi, è bene distinguere fra tessuto muscolare striato scheletrico e tessuto muscolare contrattile striato cardiaco. Ma qual è la differenza? Perché si effettua questa duplicità di discriminazione? Non soltanto per la sede: l’uno costituente la muscolatura somatica, l’altro costituente la muscolatura cardiaca. Occorre affrontare il problema da un punto di vista istologico. La fibra muscolare scheletrica è un simplasma, non è una cellula, ma una massa protoplasmatica plurinucleata di vasta entità, priva di confini precisi. E il componente fondamentale della muscolatura striata cardiaca è, invece, una cellula che si chiama miocellula o cardiocita. Quindi, la distinzione va fatta perché si fa riferimento ad una organizzazione strutturale completamente differente. Esistono prove sperimentali per affermare che il miocardio ha una costitutività cellulare e le fibre muscolari scheletriche una costitutività simplastica. Tuttavia, nel primo caso, da un punto di vista funzionale, la individualità cellulare non regge nei confronti dell’esito funzionale finale, che è contrattile, perché, pur essendo costituita da miocellule distinte, la muscolatura cardiaca, da un punto di vista istofunzionale, è un sincizio: cioè, le cellule si contraggono alla stessa maniera, uniformemente, come se il tessuto fosse un continuum e non contrassegnato, come è, da singole individualità cellulari. E allora, si suole dire che da un punto funzionale, il miocardio si comporta come un sincizio, affermazione questa praticamente corretta, ma che, se non concettualmente sostanziata dalle precisazioni fatte, può indurre in gravi miscomprensioni. Inizialmente, tuttavia, si pensò che il miocardio avesse un’organizzazione sinciziale. Ma, come si fece a dimostrare sperimentalmente che si ha a che fare con cellule distinte? Occorre tenere presente che già al m.o., senza neppure ricorrere a sofisticatissime tecniche di colorazione, è possibile appurare ciò, attraverso l’analisi di particolari contrassegni morfologici. In termini generali, per individuare l’individualità di una cellula, oltre che il nucleo, occorre individuare la membrana plasmatica, che funge da delimitazione periferica. Ma, come si fa a distinguere la membrana plasmatica? Infatti, in genere, al m.o., la membrana plasmatica delle singole cellule è difficilmente distinguibile. E allora, ci deve essere qualcosa di aggiuntivo da un punto di vista della identificazione cromatica, rispetto alle altre cellule, per potere dire che già al m.o. ci sono dati strutturali, possibilmente confermati successivamente dalla m.e., che ci portano ad affermare che si tratta di singole cellule. Al m.o., in realtà, le singole membrane non sono visibili. E allora, qual è il segreto che ci può fare dedurre ciò? Le gap-junctions o nexus riguardano le membrane plasmatiche sì, ma vengono identificate alla luce della m.e.: i dispositivi di giunzione sono differenziazioni ultrastrutturali fornite dai plasmalemmi delle diverse cellule. Ma tutto questo, lo si può affermare soltanto alla luce della m.e. E invece, i rilievi strutturali che ci consentono di asserire che con buona probabilità che si ha la presenza di singole membrane plasmatiche e singole cellule, quali sono? Nel miocardio si rilevano dei tratti che sono maggiormente colorati, ispessiti, con un andamento a gradino, scalare: i tratti scalariformi o strie intercalari. Queste strutture si colgono molto bene all’esame ottico. Rappresentano i punti in cui i versanti citoplasmatici sono a contatto fra di loro e si ha questo ispessimento, visibile anche al m.o., grazie, come rivela la m.e., alla presenza di due versanti citoplasmatici uniti mediante gap-junctions o giunzioni serrate. 2) Espansioni visceromotrici. Non si stabiliscono dispositivi di giunzione così netti e dettagliati, come nel caso della placca motrice, ma è il tessuto muscolare liscio, che è quello che costituisce le tonache viscerali, che si mette in contatto con le fibre nervose, senza ulteriori complicanze strutturali. Si trovano nei visceri e negli adenomeri delle ghiandole (dove le espansioni motorie hanno il compito di regolare l’attività di sintesi del prodotto di secrezione e la sua espulsione). IL TESSUTO DI NEVROGLIA O GLIA (Virchow, 1846). Generalità. E’ il tessuto di sostegno degli organi nervosi, tradizionalmente considerato, con funzioni anche trofiche. In una parola, la quota stromale, il “connettivo” degli organi nervosi. E anche alla luce di ciò, si può spiegare la denominazione che gli si attribuisce solitamente: Nevroglia o Glia, (da γλια), in funzione del suo ruolo di connessione fra gli elementi “nobili” del tessuto nervoso. La caratteristica istologica saliente della Nevroglia è rappresentata dal polimorfismo tipologico dei suoi elementi costitutivi, che ben si accorda a una altrettanto pleiomorfa funzione, a un’eterogeneità di origine embriologica e a una ben distinta discriminazione topografica. L’elemento cellulare caratteristico del tessuto di Nevroglia è la cellula gliale o gliocito. La sua funzione nei confronti del tessuto nervoso è essenzialmente trofomeccanica, ma ciò non deve far pensare a un ruolo di subordinazione funzionale. - Si è già precisato, ad es., che le cellule di Nevroglia partecipano ai fenomeni di neurosecrezione, rappresentando un serbatoio di neurotrasmettitori che, in tempi successivi, possono essere smistati ai neuroni propriamente detti. - Le cellule di Nevroglia possono, inoltre, sintetizzare ed elaborare fattori di crescita neuronale. - E poi, elaborano neurosteroidi, che svengono smistati a particolari tipi di neuroni. - E infine, se non ci fosse la Nevroglia non ci potrebbe essere una collocazione esatta fra gli elementi nervosi che definiscono la struttura di un organo nervoso, per cui si attribuisce alle cellule di Nevroglia la funzione di guida. E questi sono soltanto alcuni dei caratteristici aspetti di correlazione fra cellule neuronali propriamente dette e cellule di Nevroglia, tant’è che, da un punto di vista istofunzionale, si parla di unità neurone-glia. E ciò ha ricadute anche in senso patologico, nel senso che, ad es., quando parliamo di neoplasie dell’encefalo, generalmente parliamo di neoplasie che non si svolgono a carico dei neuroni (sono assai rare queste forme tumorali, dette neuroblastomi), ma a carico delle cellule della Nevroglia. Quindi, ci sono dati sia della Fisiologia sia della Patologia, che autorizzano a pensare che la Nevroglia non sia un partner “silenzioso”. In più, esaminando la classificazione della cell. di Nevroglia si può ravvisare uno spiccato polimorfismo, che è già di per sé, espressivo di funzioni ben discriminate e complesse. Classificazione della Nevroglia. Esistono modalità classificative differenti che mettono in evidenza differenti rilievi, che sono essenzialmente di tipo embriologico e di topografia. In base a tali rilievi, in parte embriologici e in parte topografici, è possibile distinguere: - Nevroglia o Glia radiale o prenatale. - Nevroglia (dell’adulto) del SNC. - Nevroglia (dell’adulto) del SNP. Cerchiamo di classificarle più approfonditamente. Si tenga presente, tuttavia, che, nell’ambito di queste classificazioni, includiamo svariate tipologie di tessuto (e non di cellule) di natura nevrogliare. E, a parte le cellule che fanno parte delle singole forme di tessuto di Nevroglia, vedremo, esistono cellule isolate di Nevroglia che sono sparse nei vari distretti organici. Nevroglia o Glia radiale o prenatale. Appartiene alla vita intrauterina. Infatti, le cellule di Nevroglia che ne sono costitutive, evidenziate abbastanza caratteristicamente attraverso la m.e., sono tipiche della vita embrio-fetale e fanno parte del neuroepitelio, l’epitelio colonnario o batipismatico che costituisce la parete del tubo neurale. E si estendono per tutta la superficie del tubo neurale, dalla superficie interna (che è fatta, vedremo, di cellule ependimali) fino alla superficie esterna. Ricostruzioni tridimensionali al m.e. rivelano che i neuroni immaturi, i neuroblasti, che compiono una migrazione intraparietale nello spessore del tubo neurale, si affiancano a queste cellule radiate, munite di minutissimi prolungamenti che compenetrano nello spessore del tubo neurale. E allora, i neuroblasti, che non hanno prolungamenti (tant’è che si parla di neuroblasti apolari), ma che riescono a muoversi, scivolano lungo questi prolungamenti e si portano alle loro sedi di assetto definitivo. Ed proprio questa la funzione guida delle cellule della Glia radiale, compiuta la quale nei confronti dei neuroblasti apolari, scompaiono e si pensa che trasformino in Astrociti. Senza queste cellule, quindi, non si stabilisce l’assetto definitivo dei neuroni, che caratterizza gli organi nervosi. Senza di esse, quindi, si avrebbero manifestazioni patologiche molto gravi, delle distopie neuronali: difetti di posizionamento topografico che causano embrio-fetopatie di diversa natura. Nevroglia (dell’adulto) del SNC. Prima di soffermarci più approfonditamente sulle varie forme di Nevroglia a livello del SNC, è bene, almeno sommariamente, fare riferimento ai citotipi che ne sono caratteristici. CITOTIPI CARATTERISTICI DELLA GLIA DEL SNC. (Nonostante la trattazione che segue, tuttavia, occorre sempre tenere presente che non è assolutamente imprescindibile che i citotipi seguenti si riuniscano nella costituzione di un’entità tissutale: potrebbero, infatti, essere presenti cellule di Nevroglia disperse in forma isolata sia a livello del SNC che a livello del SNP). - Ependmocita. Costituisce, nel suo associarsi, l’Ependima. E vedremo come ne esistano due forme: 1) Ependimocita tipico ed 2) Ependimocita atipico o tanocita. - Macrogliocita o Astrocita (fibroso e protoplasmatico). E’ la cellula costitutiva, nel suo associarsi, della Macroglia o Nevroglia propriamente detta. E, vedremo più approfonditamente, si distinguono due forme diverse di cellula astrocitaria, che occupano differenti distretti dell’SNC. - Oligodendrocita. Costitutivo, nel suo associarsi, della Oligodendroglia. - Microgliocita o cellule di Del Rio-Hortega. Caratteristico della Microglia. Ed, infine, sono stati isolati altri due citotipi di natura gliale, specifici del SNC, che sono: - Pituicita. Costitutivo della Adenoipofisi. - Cellula di Muller. Allocata nella retina. Si tratta di una grossissima cellula di Nevroglia, che offre un supporto meccanico, di sostegno, ma non soltanto, poiché è stato osservato che è capace di sintetizzare sostanze speciali, che possono costituire alcuni putativi neurotrasmettitori (soprattutto nelle classi viventi inferiori). Si tratterebbe quindi, nonostante la natura gliale, di una cellula caratterizzata dalla “nobile” attività peptidergica, un tempo attribuita impropriamente solo ai neuroni. - Gliociti di Bergmann. Che si trova in forma isolata nella regione del Cervelletto. I TESSUTI DI NEVROGLIA DEL SNC. E’ possibile distinguerne varie forme: - Ependima. Di origine ectodermica. E’ costituito da specifiche cellule di Nevroglia, dette ependimociti. Si tratta di cellule di rivestimento (εµενδυµα: rivestimento, κυτοσ: cellula) che fanno parte del neuroepitelio del tubo neurale. E, così come esistono, vedremo, due classi di ependimociti, distinguiamo anche due classi di Ependima: 1) Ependima tipico. Quello tradizionale. Costituisce un epitelio monostratificato, semplice o cubico, che riveste la superficie interna del canale centrale del midollo spinale e dei ventricoli centrali (o cavità ventricolari cerebrali, ovvero cavità scavate nello spessore dell’encefalo e che rappresentano i punti di espansione della cavità del primitivo tubo neurale). E’ importante puntualizzare le caratteristiche strutturali ed ultrastrutturali degli ependimociti tipici ed atipici, poiché esse rappresentano un importantissimo elemento di differenziazione fra i due citotipi. Da un punto di vista ultrastrutturale, il bordo apicale (che è quello che prospetta sul versante endoventricolare o sulla cavità del canale centrale del tubo neurale) degli ependimociti tipici è munito di numerose ciglia vibratili, e c’è anche qualche raro microvillo, ma sostanzialmente si hanno solo ciglia vibratili. I versanti plasmalemmatici laterali, di contatto fra un ependimocita e l’altro, posseggono dispositivi di tipo nexus o gap-junctions, ma non ci sono giunzioni più classiche di tipo occludente. E’ bene fare questa puntualizzazione perché negli ependimociti atipici troveremo un risvolto speculare a tali caratterizzazioni. E poi, infine, è possibile rilevare un corredo enzimatico (del metabolismo energetico ossidativo) di tipo sedativo (e quindi, potenzialmente analgesico) deputato al movimento ciliare. Inoltre, gli ependimociti tipici, avendo ciglia vibratili, debbono possedere un corredo proteico dinamico, che metta in moto la struttura, altrimenti immota, tubulinica dei microtubuli delle ciglia vibratili. 2) Ependima atipico. Così chiamato perché non mostra i contrassegni strutturali ed ultrastrutturali, caratteristici della quota più grande di ependima: l’ependima tipico. Abita zone circoscritte della superficie delle cavità endoventricolari, e precisamente in corrispondenza dei cosiddetti plessi corioidei (gettoni vasculoconnettivali che sono rivestiti da ependim di natura tanicitaria) e in corrispondenza del pavimento e recesso infundibulare del terzo ventricolo (una cavità sostanzialmente scavata nello spessore del territorio ipotalamico, in rapporto con la cosiddetta area ipofisiotropica dell’ipotalamo). Si tratta di una cellula cubica, fornita di un grosso nucleo. E’ costituito da ependimociti profondamente modificati, detti tanociti o ependimociti atipici. Essi presentano un aspetto morfologico speculare rispetto a quello degli ependimociti tipici: superficie esterna ricca di microvilli e, nei versanti laterali, compaiono giunzioni occludenti (e non gap-junctions). E la giunzione occludente è il dispositivo di membrana plasmalemmatica che impermeabilizza gli accessi intercellulari: si chiude il passaggio intercellulare, all’interfaccia, di grosse molecole. Essi svolgono funzione di secrezione: secernono 1\2 litro\die di quel Caratteristico liquido contenuto nella cavità ventricolari e del canale midollare: il liquido cefalorachidiano, un mezzo veramente importantissimo. Va detto che, inoltre, i tanociti dei recessi infundibulari del terzo ventricolo presentano caratteristiche ultrastrutturali che mancano nei tanociti dei plessi corioidei: alla base della cellula si crea un prolungamento che si affonda nel contesto della eminenza mediana. Tali prolungamenti possono contrarre rapporti con i capillari del Sistema Portale. Questo rapporto ci dice molto circa la funzione di questo tanocita, a proposito del riversamento di sostanze specifiche, che lo stesso ependimocita atipico può elaborare o assumere dal liquido cefalorachidiano (in cui sono presenti sostanze speciali e ci possono essere anche principi ormonali, riversati dai neuroni peptidergici adiacenti al rivestimento ependimale di questa zona della superficie paraventricolare. E allora, si capisce che esistono vie alternative di smistamento degli ormoni ipotalamici, da parte dei neuroni peptidergici che riversano il loro prodotto di secrezione nella cavità del terzo ventricolo, da cui sono captati attraverso tanociti che, a loro volta, li smistano nella prima via capillare del Sistema Portale, in alternativa alla via neuro-emale precedentemente considerata (i neuriti che sboccano direttamente nella via capillare). - Macroglia. Di origine ectodermica. E’ la forma di Nevroglia più estesamente rappresentata nel nostro organismo. L’Astrocita, che ne è caratteristico, è una cellula stellata, con prolungamenti protoplasmatici che ne definiscono il caratteristico aspetto aracniforme. Si tratta di cellule con un corpo cellulare e prolungamenti che, da un lato, si possono mettere in contatto con il rivestimento delle membrane sierose che attorniano l’encefalo, le meningi, di cui è caratteristica la pia madre, e dall’altro si possono mettere in contatto con la parete dei vasi sanguigni da cui traggono principi nutritizi che smistano poi ai neuroni con cui tali cellule entrano in rapporto. Essi, quindi, suggono sostanze dai vasi, e c’è in questo senso il riferimento alla Istologia classica circa i rigonfiamenti bottonuti di queste cellule in corrispondenza dei vasi sanguigni, come se fossero dei piccoli apparati succhiatori, tanto che furono chiamati piedi vascolari o apparati succhiatori del Kajal. Sono distinguibili fondamentalmente due forme astrocitarie: - Astrociti a lunghi raggi o fibrosi. - Astrociti a corti raggi o protoplasmatici. Le due forme occupano sedi differenti del Sistema Nervoso, nel senso che l’Astrocita fibroso occupa la cosiddetta Sostanza bianca (sede delle fibre nervose dei neuroni) dell’Encefalo, a differenza di quello protoplasmatico che occupa la cosiddetta Sostanza grigia (sede dei pirenofori dei neuroni). Da un punto di vista delle ultrastrutture, sono caratteristici degli Astrociti fibrosi i microtubuli e soprattutto i filamenti intermedi o gliofilamenti. E vi è una proteina caratteristica del gliofilamento che è la GPA o Proteina Acida Gliofibrillare, che è utilizzata, in campo istochimico, come substrato di evidenziazione di tali cellule di Nevroglia (che, con metodologie classiche sono assai difficili da individuare), mediante marcatura indiretta. Va aggiunto, a proposito della proteina GPA, che essa si ritrova anche in alcune cellule di Nevroglia localizzate nel Sistema Nervoso Enterico, assieme a cellule gangliari presenti nello spessore del tubo gastro-enterico, per cui si parla di cellule astrocitosimili. Ed ancora, è presente un’altra sostanza proteica, la suppletiva proteina S-100, presente sia nelle cellule gliali del Sistema Nervoso Enterico assieme alla GPA, sia nelle cellule elettive che abitano la Nevroglia periferica e che, vedremo, sono le cellule di Schwann. Anche la marcatura di quest’ultima proteina può rappresentare un interessantissimo metodo di individuazione delle cellule di natura gliale, sia a livello del SNC sia a livello del SNP. Gli Astrociti protoplasmatici, come elementi di differenziazione dagli Astrociti fibrosi, presentano una diversa dimensionalità sia dei gliofilamenti che dei microtubuli. Ad ogni modo, anche negli Astrociti protoplasmatici sono presenti gliofilamenti (a differenza di quanto accadrà per altre cellule di Nevroglia, che non possiedono gliofilamenti). Poiché contraggono rapporti e con i capillari e con i neuroni, si tratta delle tipiche cellule di Nevroglia con funzioni trofiche. C’è la possibilità, inoltre, da parte degli Astrociti di elaborare neurosteroidi, per cui si parla di funzione della neurosteroidogenesi. Quindi, riassumendo, le principali funzioni sono: - di sostegno; - trofica; - cicatriziale. E non va trascurata neppure quest’ultima funzione esplicata dalle poliedriche cellule astrocitarie, condivisa con le cellule di Microglia. O meglio, mentre gli Astrociti sono cellule di Macroglia implicate, con le loro attività cicatriziali, nella costruzione di una “cicatrice”, che rappresenta l’esito del rimaneggiamento di una zona nervosa lesa, la cellula di Microglia, vedremo, si incarica di esplicare un’attività fagocitaria nei confronti dei detriti neuronali. - Oligodendroglia. Anch’essa di origine ectodermica. La cellula che ne è caratteristico, abbiamo detto, è l’Oligodendrocita. Non ci sono gliofilamenti, ma ci sono microtubuli. Esiste una classificazione degli oligodendrociti, in funzione della loro sede (attraverso Mori e Leblond): - Oligodendrociti satelliti perineuronali (10µ). - Oligodendrociti interfascicolari (20µ). Nel primo caso, si ha a che fare con oligodendrociti molto piccoli, confinati nell’ambito della cosiddetta Sostanza grigia, e cioè in corrispondenza dei pirenofori delle cellule nervose (dove si trovano anche gli Astrociti protoplasmatici). La loro funzione è chiaramente nutritizia. E poi, vi è il secondo gruppo di oligodendrociti, caratterizzata da una dimensionalità doppia rispetto ai primi, allocati nelle fibre nervose del SNC, ed implicati nel processo della mielinogenesi (e quindi, nella formazione della cosiddetta Sostanza bianca). Quindi, il fatto che le dimensioni degli oligodendrociti interfascicolari siano doppie rispetto a quelle degli oligodendrociti satelliti è assolutamente logico: essi devono fornire, attraverso i propri prolungamenti, una maggiore quantità di stoffa citoplasmatica per costituire la guaina mielinica ed esplicano, al tempo stesso, un ruolo nutritizio di trasferimento di sostanze tra vasi e corpi cellulari. Infine, occorre tenere presente che, a differenza di quanto, vedremo, accade in condizioni fisiologiche per la cellula di Schwann, si ha una mielinizzazione plurineuritica. - Microglia. L’unica forma di Glia, a livello dell’SNP, di origine mesodermica. Abbiamo definito la cellula che ne è caratteristica Microgliocita o cellula di Del Rio-Hortega. Si tratta di cellule, come fa intuire lo stesso nome, con un corpo caratterizzato da uno scarsissimo citoplasma, caratterizzate da un corpo molto ristretto e da propaggini spinose che lo fanno assimilare al fibroblasto (e del resto, ciò è assolutamente plausibile, alla luce della medesima derivazione istogenetica mesodermale). La loro funzione primigenia è quella fagocitaria. E allora, spesso, dopo avere esplicato il loro principale ufficio funzionale, assumono un corpo più globoso e caratteristici residui citoplasmatici, denominati corpuscoli granulari. NEVROGLIA ECTODERMICA E NEVROGLIA MESODERMICA. In relazione a quanto detto, si capisce che, analizzando queste differenti forme di Nevroglia del SNC (Nevroglia dell’Adulto), è possibile riconoscere differenti stipiti di origine di sviluppo embriogenetico. Ovviamente, vi saranno precipue cellule staminali. E allora, è possibile distinguere fondamentalmente una Nevroglia ectodermica e una Nevroglia mesodermica. Dalla prima, originano cellule staminali definite Spongioblasti, che quindi sono progenitrici delle varie forme prima considerate di Nevroglia ectodermica (Ependima, Macroglia, Oligodendroglia). Al contrario, l’unica forma di Nevroglia di origine mesodermica è la Microglia, che quindi, è una sorta di “Nevroglia d’importazione”, negli organi del SNC. I Microgliociti penetrano nell’abbozzo cefalico assieme a vasi caratteristici, gli zampilli di Nevroglia, caratterizzati ovviamente da cellule di natura mesodermica. E anche la funzione risponde all’origine, perché la Microglia è il tessuto di Nevroglia che, essendo derivante dal Mesoderma, può acquisire anche particolari funzioni di cellule di derivazione mesodermica classicamente note, che sono le cellule dei tessuti trofomeccanici. Molte delle funzioni de tessuti trofomeccanici, vedremo, come ad es. quella fagocitante e di endocitosi in genere, sono appunto precipue delle cellule di Microglia che, pertanto, sono anche dette cellule di spazzatura. Ed esplicano la loro particolarissima attività nei confronti dei detriti neuronali: ad es., i neuroni possono morire a causa di insulti ischemici e le cellule di Microglia si preoccupano dell’operazione di ripulitura della zona neuronale che è stata interessata dall’insulto ischemico. Nevroglia (dell’adulto) del SNP. In questo caso, è sufficiente passare direttamente all’analisi dei citotipi che ne sono caratteristici: - Cellule capsulari o satelliti. Allocate nei gangli cerebrospinali (che, quindi, sono veri e propri organi, per la presenza del tessuto gliare e del connettivo propriamente detto). Le cellule gliari si incaricano di costruire attorno al pirenoforo delle cellule gangliari una sorta di capsula, mediante i loro prolungamenti. E da questo, la caratteristica denominazione. Per cui, si dà vita a un processo che prende il nome di satellitosi perineuronale. - Cellule di Schwann o lemnociti. La loro primigenia funzione, si è detto, è la costituzione della guaina mielinica, in corrispondenza dei neuriti dei neuroni del SNP. Si tratta di cellule particolarissime, originariamente molto espanse, ma che, successivamente, si assottigliano per il contributo graduale alla formazione della guaina mielinica, sicché il loro spessore è inversamente proporzionale a quello della guaina mielinica. Ed ecco che ogni cellula di Schwann, nella fibra nervosa, occupa quello spazio che abbiamo definito segmento interanulare. Quindi, parecchie cellule di Schwann, messe le une accanto alle altre, hanno una porzione periferica più assottigliata rispetto alla porzione centrale dove si trova il nucleo, ed ecco perché si formano quei restringimenti che abbiamo definito nodi del Ranvier: si tratta dei limiti periferici di due cellule di Schwann contigue che si toccano. Esistono poi altri due citotipi, non appartenenti, tuttavia, alla specie umana: - Cellule lemmali. - Cellule di teloglia. Interazione neurofunzionale fra neurone e glia: unità neurone-glia. Le moderne tecniche di allestimento di una coltura di Astrociti in vitro hanno messo in evidenza che, nei mezzi di coltura, si accumulano sostanze neurotrofiche a basso PM di natura non proteica, necessarie per la sopravvivenza dei neuroni sia del SNC che del SNP. Tali sostanze neuroattive, prodotte dagli Astrociti, potrebbero rifornire la cellula nervosa di fattori trofici, metabolici e di difesa anti-perossidi. Per questo motivo, si è coniata la definizione di unità neurone-glia, nel senso che non si ha una condizione di subordinazione della cellula di Nevroglia nei confronti del neurone, ma semmai un rapporto di sostentamento e collaborazione funzionali. ECCEZIONI DELLA DOTTRINA CELLULARE\SIMPLASMA. In base alla dottrina cellulare, tutti gli organismi viventi sono costituiti da una (se unicellulari) o più cellule (se pluricellulari). Abbiamo anche dato una definizione più o meno generica di cellula: “unità elementare di sostanza vivente dell’ordine di grandezza microscopico”. Le cellule, in generale, dispongono di alcune caratterizzazioni comuni e di caratteri morfologici similari, come, ad es., la presenza di membrana plasmatica, che limita e protegge l’ambiente cellulare, e di nucleo. Esistono, però, “entità biologiche” che sicuramente non possono essere definite cellulari in senso stretto, in quanto non presentano caratterizzazioni come le suddette e che, di conseguenza, presentano pareti plasmatiche non definite e formazioni polinucleiche. Formazioni di questo tipo prendono ad es. la denominazioni di simplasmi. Si definiscono come simplasma: “Vasta entità protoplasmatica (vasta, ad es., rispetto all’estensione del protoplasma di una singola cellula tipo), polinucleata e a limiti indistinti”. Il meccanismo istogenetico di formazione del simplasma è duplice, nel senso che i 2 possibili effetti spesso si assomigliano anche e soprattutto morfologicamente, ma la derivazione istogenetica e quindi il meccanismo di produzione è nettamente differente: 1) Sincizio. 2) Plasmodio. SINCIZIO. Simplasma che si costituisce per la confluenza casuale (che avviene per modalità che ancora oggi non precisiamo), di formazioni cellulari primitivamente ben distribuite che perdono il protolemma e danno vita a un’unica formazione di dimensioni molto più vistose rispetto ai costituenti cellulari. La formazione di un sincizio, pertanto, prevede la conflusione dei singoli protoplasmi, cosicché di determinare la formazione di un’unica massa protoplasmatica, polinucleata e a limiti indistinti geometricamente parlando (proprio la fenomenologia caratteristica di un simplasma!). Il sincizio ricorre in condizioni fisiopatologiche per tessuti anormali che si possono impiantare nel nostro organismo. Ad es., il tessuto tubercolare. Infatti, quando il bacillo di Kock esplica la sua azione si ha la formazione di un tessuto di granulazione: si tratta di cellule sinciziali che non a caso il patologo definisce cellule giganti di Langans, con una definizione alquanto imprecisa dal momento che le formazioni sinciziali non sono assimilabili alla struttura cellulare. In un soggetto affetto da bacillo di Kock, quindi, basta effettuare una broncoscopia per evidenziare cellule sinciziali. Un altro esempio, potrebbe essere il cosiddetto linfogranuloma maligno, in cui, egualmente, si instaura un tessuto simplasmico sinciziale (cellule di Stemberg). Plasmodio. Si tratta di un’entità biologica poliplasmatica e polinucleata, proprio come il sincizio. Si ha in questo caso, tuttavia, un iter istogenetico completamente diverso. Si parte, infatti, da un’unica cellula che commette errori nelle fasi riproduttive. Normalmente, infatti, alla citodieresi dovrebbe seguire la cariodieresi. In caso di plasmodio, invece, si realizza una cariodieresi non seguita da una normale citodiersi. E si perviene anche, in questo caso, a una massa citoplasmatica polinucleata, mediante a un accrescimento protoplasmatico. E’ interessante notare che è facile incontrare identità tissutali costituite non da cellule, ma da plasmodi (ad es., nel tessuto muscolare-scheletrico). Ora, sebbene esistano varie tipologie di tessuti muscolari contrattili, a differenza del tessuto muscolare liscio involontario (costituito da cellule ben definite, le miocellule), il tessuto muscolare scheletrico è costituito da plasmodi e non da cellule. E infatti, si parlerà di fibre muscolari e non di cellule muscolari. FORMA DELLA CELLULA. - Eterogeneità. E’ evidente che nella edificazione delle nostre moli somatiche sono necessari diversi citotipi. La forma cellulare, pertanto, è caratterizzata da un pleiomorfismo, condizionato da 2 fattori fondamentali: 1) Fattore meccanico. Esso è costituito da forze pressorie che possono agire nell’interno delle cellule o fra le varie cellule allorché sono a diretto contatto fra di loro. Il fattore meccanico è regolato dalle cosiddette leggi della citomorfogenesi di Lewis, ostiche e farraginose, che spiegano il perché delle forme assunte dalle varie cellule. In particolare, fattori pressori endocellulari determinano, ad es., un aspetto delle cellule di tipo sferoidale. Abbiamo visto che la cellula uovo, ad es., è costituita al suo interno da una sostanza nutritizia chiamata vitello e che ne determina la forma sferoidale. Allo stesso modo, le cellule del tessuto adiposo contengono al loro interno una gocciolina di grasso che egualmente ne determina la forma sferoidale. In entrambi i casi, infatti, il liquido interno esercita una pressione omogenea e uniforme sulla superficie interna della membrana plasmatica tale da determinare la caratteristica forma sferoidale. Al contrario, forse pressorie intercellulari, che si esercitano fra le varie cellule le cui superfici esterne si trovano a contatto, condizionano l’aspetto prismatico, che tuttavia è caratterizzato da una gran “plasticità”, ovvero una capacità di modificare la loro struttura, compatibilmente con le condizioni fisiologiche normali, in concomitanza della modificazione dei valori pressori intercellulari. 2) Fattore funzionale. Nella maggior parte dei casi, la forma delle cellule è determinata da un fattore più prettamente funzionale. Essa, infatti, assume quella forma che le è utile per esplicare ben determinate funzioni. Ad es., le cellule nervose assumono un aspetto ramificato per proiettarsi verso i diversi distretti corporei. E in merito a questo fattore funzionale, un embriologo del passato, di nome Ruffini, scrisse alcuni importanti corollari, che adesso esamineremo. E’ necessario che si abbia l’aspetto formale più adatto alla esplicazione dell’ambito più squisitamente funzionale. Intuizione fondamentale di Ruffini, nel trattato Fisiogenia, risiede nella convinzione che nella cellula uovo vi sia già un quid che condizionerà la forma futura della cellula: “… l’uovo è una Forma individuale in potenza…”. Ne abbiamo già discusso trattando del concetto di totipotenza dello zigote e delle cellule staminali. Questo fatto, venne intuito in un’epoca molto nebulosa in cui si era vessati da tecniche di microscopia alquanto imperfette. Egli correla questa Forma in potenza a “un complesso di funzioni succedentisi in ordine regolare”. Di conseguenza, “l’uovo è un sistema di funzioni in potenza”. Nella nostra epoca, non siamo andati molto avanti, tutto sommato, nel capire quali sono le motivazioni particolari e scientifiche di questo processo di citodifferenziazione e soprattutto i meccanismi che ne stanno alla base: perché, in altri termini, da una cellula uovo si produca in alcuni casi una cellula epiteliale, in altri una cellula nervosa… Evidentemente, sarà un problema connesso al fattore genetico, ma non sono stati ancora esplicitamente identificati i geni che determinano ciò. Il progresso in questo campo, tuttavia, si è fatto egualmente sentire. Ad es., nell’utilizzo di tecniche di microscopia elettronica a scansione e a trasmissione (TEM), che consentono di percepire visivamente la tridimensionalità degli elementi oggetto d’indagine. Spesso, ci si serve anche di alcuni espedienti come la colorazione, che serve ad evidenziare visivamente le varie strutture. La varietà morfolofica (pleiotropismo) è, sotto questo punto di vista, a dir poco sorprendente. Abbiamo visto che esistono ben circa 200 tipi differenti di cellule che costituiscono il nostro soma. Esse presentano le più svariate forme, in adempimento delle più svariate funzioni che esplicano. E adesso, cercheremo di fare qualche esempio pratico che renda più esplicita la strettissima correlazione che sussiste tra la forma di una cellula e le funzioni che la caratterizzano. - “Cellule avventiziali”. Si tratta di cellule solitamente abbarbicate alla parte esterna del vaso sanguigno, determinandone conseguentemente una compressione, e che hanno il compito di regolare il flusso ematico con i suoi prolungamenti. - “Cellule nervose”. Anch’esse dotate di prolungamenti, le cui funzioni strutturali abbiamo già introdotto. - Cellule della mucosa della tuba, dotate anch’esse di prolungamenti (ciglia vibratili) che consentono un movimento di propulsione dell’uovo dall’ovaio alla cavità uterina. - Globulo rosso. Esso è caratterizzato da un aspetto sicuramente molto mutevole, benché entro i limiti fisiologici a causa delle modificazioni del calibro dei vasi che li contengono e alle variazioni pressorie del flusso ematico a cui tali cellule devono soggiacere. Da un punto di vista strutturale, si tratta di un disco biconcavo schiacciato al centro da entrambe le facce. E una modificazione anche minima della forma determina tutta una serie di gravi patologie, a carattere endemico nel nostro territorio, che prendono il nome di anemie emolitiche. Esse consistono in una prematura distruzione del globulo rosso in seguito al processo di emolisi, ovvero della proteina emoglobina in esso contenuta. Il solo riscontro microscopico può fornire un interessante metodo di indagine. Si parlerà pertanto di poichilocitosi: presenza di aspetti diversi e anormali della forma globulare. Occorre, però, non fare confusione con normale e fisiologico adattamento del globulo alle variazioni di forma del lume vasale e alle conseguenti variazioni pressorie. Al contrario, propaggini, prolungamenti, grinzosità e, in genere, bizzarria di forma, determinano tutta una serie di patologie. - Globulo bianco. E’ un particolare tipo di linfociti. Caratterizzato da aspetto definitamente sferico, con una superficie munita di minutissime estroflessioni, che aumentano di grandezza, si prolungano e si restringono, quando il linfocita si cimenta in attività difensive nei confronti di altre cellule. La forma di questa struttura è espressione di contatto con corpi esterni e con intenti distruttivi. Si instaurano certe interazioni. Essi hanno spesso una funzione efficacissima, ad es., nei confronti di molte cellule batteriche, mentre la loro efficacia è del tutto assente nei confronti delle ben più grandi e mostruose cellule tumorali. - Possiamo addirittura estendere il discorso al paradosso, affermando che la stessa evoluzione amitotica e anaplastica delle cellule tumorali, ha, in termini di espressione formale, la corretta manifestazione dei nefasti effetti che essa esercita. Si perde, infatti, la normale caratterizzazione formale. E’ grande, mostruosa. Priva di ordine. E si potrà facilmente osservare, in seguito ad esame istologico, l’intensissima attività riproduttiva a carattere tumultuoso e afinalistico, proprio insomma delle cellule di tipo tumorale. - Propaggini filamentose differenti rispetto alle ciglia vibratili sono proprie anche di 4 tipi di cellule degli apici. Si tratta di cellule sensitive che si allocano nel fondo delle nostre cavità nasali e che sono dotate di recettori chimici che consentono loro di esplicare la loro attività sul senso dell’olfatto. - Infine, ad es., se consideriamo l’effetto dell’attacco del virus dell’epatite alle cellule epatiche, si vede come il primo effetto citopatogeno si realizza sulla superficie di contatto, sulle membrane. Esplica un’azione parassitante, perché sopravvive a spese delle cellule epatiche. Ne cambia la forma e di conseguenza ne modifica irreparabilmente e dannosamente la struttura.
Scarica