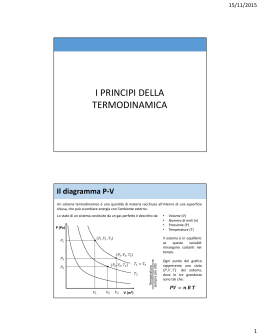
ENTROPIA: calcolo e applicazioni Antonio Ballarin Denti [email protected] CALCOLO DELL’ENTROPIA ( definito per trasformazioni ideali reversibili ma si applica anche a trasformazioni reali ) ESEMPIO: fluido incompressibile (liquido) dV = 0 δQ = cV dT cV costante VARIAZIONE DI ENTROPIA NELLE TRASFORMAZIONI REALI TEOREMA VI (disuguaglianza di Clausius) In una trasformazione reale la variazione di entropia è sempre ≥ all’integrale di Clausius (*) Dim: P I A I = trasformazione irreversibile da A a B B R V Per il Teorema I Per il Teorema III ossia ll SISTEMI ISOLATI Corollario In un sistema isolato, per definizione, non ci possono essere scambi di calore con l’esterno (sorgenti), cioè δQ = 0 Allora la disuguaglianza di Clausius (teorema III) diviene S(B) ≥ S(A) conseguenze - Le trasformazioni in un sistema isolato sono irreversibili - Se l’Universo è un sistema isolato la sua entropia non può che aumentare - Quando un sistema isolato raggiunge lo stato di entropia massima non può subire ulteriori trasformazioni (stato di equilibrio stabile) Esempio : PASSAGGI DI CALORE T1 >T2 T1 T2 Per conservazione dell’energia: Q1 = Q2 = Q Ad ogni passaggio di calore l’entropia del sistema aumenta finché T1 = T2 e ΔS = 0 con S al suo valore massimo. APPLICAZIONE A UN GAS PERFETTO P A (V1, T1) P1 B (V2, T1) P2 C (V2, T2) V1 V2 V dU = n CV dT LUNGO L’ISOTERMA AB: Essendo: dU = 0 dQ = dW LUNGO L’ISOCORA BC: dW = 0 dQ = dE = ncV dT La variazione totale di entropia Nel caso dell’espansione di un gas perfetto nel vuoto oltre a dQ = 0 avremo T1 = T2 Applicazione I ESPANSIONE ADIABATICA DI UN GAS NEL VUOTO Sia il gas perfetto e il sistema isolato L’espansione sarà isoterma. Nel caso reale Q = 0 ed L = 0 In una configurazione reversibile contrasto l’espansione con una contropressione simile e ottengo un lavoro Poiché il processo è isotermico, dovrò fornire un calore Q = L Applicazione II DIFFUSIONE DI DUE FLUIDI DIVERSI L’UNO NELL’ALTRO a) b) 1 T1=T2 x 2 a) Aprendo la valvola i gas si miscelano senza scambio di calore b) Immaginiamo una trasformazione analoga, ma reversibile, con 2 membrane semipermeabili ai rispettivi gas. Si sospingano i contenitori uno nell’altro. I gas si mescolano in modo reversibile. Il V finale è ½ del V iniziale. devo far espandere la miscela dei 2 gas compiendo del lavoro verso l’esterno. Poiché dQ = 0, il gas si raffredda. Per variare T devo riscaldare e si ha: δQ = calore fornito per tenere T costante
Scarica