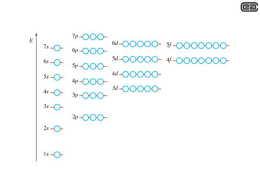
CONFIGURAZIONE ELETTRONICA E PROPRIETA’ PERIODICHE DEGLI ELEMENTI OGNI ORBITALE E’ INDIVIDUATO DALLA TERNA DEI NUMERI QUANTICI n, l, m Il principio di esclusione di Pauli. Esiste un ulteriore numero quantico definito numero quantico di spin ms, che può assumere valori di -1/2 o +1/2 (per elettrone). Nessuna coppia di elettroni può avere gli stessi 4 numeri quantici e quindi un orbitale può “ospitare” solo 2 elettroni. Questa regola non ha eccezioni. Wolfgang Pauli +1/2 -1/2 ENERGIA 2px 2s 1s 2pY 2pz Principio dell’Aufbau (riempimento) Distribuzione energetica reale dei livelli energetici atomici Schema semplificato dei livelli energetici atomici 7p Schema empirico da adottare per il corretto riempimento degli orbitali atomici 4f elettrane Configurazioni elettroniche Z= 6 tre regole si applicano per predire la configurazione elettronica nello stato fondamentale di un atomo: Il principio di esclusione di Pauli. Esiste un ulteriore numero quantico definito numero quantico di spin ms, che può assumere valori di -1/2 o +1/2 (per elettrone). Nessuna coppia di elettroni può avere gli stessi 4 numeri quantici e quindi un orbitale può “ospitare” solo 2 elettroni. Questa regola non ha eccezioni. Il principio dell’aufbau (riempimento). Le configurazioni elettroniche sono costruite riempendo per primi gli orbitali ad energia più bassa (quando le differenze di energia sono significative). Questa regola permette di ottenere le configurazioni elettroniche nello stato fondamentale. Altre configurazioni eccitate che non violino il principio di Pauli sono possibili. Regola di Hund. Laddove gli orbitali hanno la stessa energia (degenerati) o quasi, questi vengono riempiti ciascuno con un elettrone, con spin paralleli, prima che inizi l’accoppiamento. Altre configurazioni rappresentano stati eccitati (non sono vietate). Configurazione elettronica corretta Elementi disposti in ordine crescente di massa atomica Altre configurazioni periodiche degli elementi Lantanidi Attinidi Note that elements 113, 115, and 117 are not known, but are included in the table to show their expected positions. There are unconfirmed reports for the observation of elements 114 (ununquadium), 116 (ununhexium), and 118 (ununoctium) and so these elements are also included. RIGO o PERIODO I periodi sono individuati da numeri COLONNA o GRUPPO I gruppi sono individuati da numeri romani e dalle lettere A o B LA POSIZIONE CHE UN ELEMENTO OCCUPA NELLA TABELLA PERIODICA E’ UN RIFLESSO DELLA SUA CONFIGURAZIONE ELETTRONICA Come apparirebbe realmente la tavola periodica secondo la organizzazione in gruppi orbitalici 2 He Classificazione mediante sublivelli f p d d p p s 1 s s p s s s 2 3 4 5 6 Schema empirico da adottare per il corretto riempimento degli orbitali atomici 4f Il tipo di orbitale più esternamente occupato da uno o più elettroni, condiziona le proprietà chimiche dell’elemento e la sua posizione nella tabella PERIODO elettroni in comune su orbitali col numero quantico principale più alto 3 12 17 Mg Cl d d s 1 s 2 p p s f d p d s 1s22s22p63s2 3 s 4 1 s 2 p p s p s 1s22s22p63s23p5 3 4 f VIA Gruppo: identica configurazione elettronica più esterna 8 34 O Se d d s 1 s 2 p p s f d p d s 1s22s22p4 3 s 4 1 s 2 p p s f p s 1s22s22p63s23p64s23d104p4 3 4 Metalli di transizione Elementi in cui gli elettroni occupano progressivamente orbitali d (ma l’orbitale s con numero quantico superiore è già stato riempito) f p d d p p s 1 s s p s s s 2 3 4 5 6 Metalli di transizione Interna: Lantanidi attinidi Elementi in cui gli elettroni occupano progressivamente orbitali f (ma gli orbitali s e p con numero quantico superiore sono già stati riempiti) f p d d p p s 1 s s p s s s 2 3 4 5 6 Quanti e quali “ingredienti” elementari sono necessari per fare un organismo vivente ? He Ne Ar Kr Xe Rn Composizione chimica dell’universo, della crosta terrestre e del corpo umano Principio antropico ? Se analizziamo attentamente le leggi fisiche che descrivono i fenomeni naturali ci convinciamo facilmente che queste leggi non potrebbero essere molto diverse da quelle che sono, senza che peraltro ne siano sconvolti i delicati equilibri presenti nell'Universo. La forza di gravità ad esempio è molto debole, soprattutto se paragonata alla forza forte, quella che agisce fra i quark e fra i protoni e i neutroni presenti nel nucleo atomico. Se la forza gravitazionale fosse stata solo un poco più forte di quello che è, l'Universo sarebbe stato molto più piccolo e soggetto ad una evoluzione molto rapida; le stelle avrebbero consumato il loro combustibile in tempi molto brevi, la vita non avrebbe avuto il tempo per svilupparsi e l'umanità non esisterebbe. Se viceversa la forza di gravità fosse stata, anche di poco, più debole di com'è, la materia non si sarebbe condensata in stelle e galassie e l'Universo sarebbe freddo e rarefatto. Lo stesso discorso vale per altre grandezze fisiche. Se ad esempio la forza forte fosse solo un po' più debole di quanto è in realtà, l'unico elemento stabile nel nostro Universo sarebbe l'idrogeno e non esisterebbero tutti gli altri, compreso il carbonio che è quello fondamentale per la vita. Se d'altra parte la forza forte fosse leggermente più forte rispetto alle altre che agiscono sulla materia diverrebbe stabile il diprotone, cioè un nucleo atomico formato di due protoni: l'idrogeno allora non potrebbe esistere e di conseguenza non si potrebbero formare nemmeno le stelle e le galassie. Potrebbero in realtà esistere, insieme al nostro, moltissimi altri Universi, tutti differenti fra loro e indipendenti l'uno dall'altro, ognuno dei quali con proprie leggi e propri parametri fisici. Non esistono infatti ragioni a priori per cui le leggi fisiche che regolano il comportamento della materia nel nostro Universo debbano essere necessariamente quelle che sono. Leggi diverse da quelle che sperimentiamo giornalmente potrebbero benissimo esistere, ma darebbero luogo a Universi diversi, e comunque senza vita (almeno per come intendiamo noi la vita). La vita, e in particolare la vita intelligente, si può infatti sviluppare solo se le leggi fisiche rispondono a requisiti precisi ed appropriati. Esisterebbero quindi tanti Universi di cui però uno solo osservabile: ovvero solo nel nostro Universo esisterebbe qualcuno in grado di compiere osservazioni. Come nel caso della meccanica quantistica abbiamo fatto osservare che per descrivere un fenomeno è indispensabile interagire con esso, per cui non ha senso parlare di fenomeni dei quali non sia possibile cogliere la misura, allo stesso modo possiamo affermare che i fenomeni che si realizzano nell'Universo non avrebbero senso (cioè, in pratica, non esisterebbero) se non vi fossero gli uomini ad osservarli. Non è detto che fra i tanti Universi possibili non ve ne possa essere qualcuno identico al nostro, nel quale si sarebbero realizzate le condizioni che hanno portato alla nascita della vita intelligente. Potrebbero esistere in teoria tanti altri Universi come il nostro, ma sarebbe come se non ci fossero in quanto risulterebbe comunque impossibile mettersi in contatto con essi. Sappiamo infatti che qualsiasi messaggio non può uscire dal luogo in cui viene prodotto: così ad esempio la luce, che è il segnale più veloce che esista, si incurva lungo il percorso a causa della presenza della materia, ragion per cui nemmeno essa potrà mai uscire dall'Universo nel quale è stata generata. I limiti del principio antropico sono evidenti. Secondo alcuni esso non spiegherebbe nulla trattandosi di semplice tautologia: "Il mondo in cui viviamo è il mondo in cui viviamo". Per altri non avrebbe senso parlare di altri Universi, diversi o anche uguali al nostro, se poi tutti questi Universi, per definizione, non sono osservabili. Infine, da un punto di vista strettamente scientifico, il principio antropico deve essere respinto semplicemente perché non vi è modo di sottoporlo a verifica. Di esso, in altre parole, non saremo mai in grado di dimostrare sperimentalmente né che sia giusto, né che sia sbagliato. Alcune proprietà degli elementi mostrano variazioni graduali procedendo attraverso un periodo o un gruppo Conoscere queste tendenze permette di comprendere le proprietà chimiche Le tendenze che prenderemo in considerazione per gli elementi rappresentativi sono: dimensioni atomiche energia di prima ionizzazione affinità elettronica raggio ionico elettronegatività dimensioni atomiche energia di prima ionizzazione affinità elettronica raggio ionico elettronegatività Variazione del raggio atomico in funzione del numero atomico Aumentando il numero di elettroni nello stesso guscio orbitalico aumenta l’attrazione con i protoni nucleari causando una contrazione Si occupa un guscio orbitalico con numero quantico principale n maggiore e quindi più voluminoso dimensioni atomiche energia di prima ionizzazione affinità elettronica raggio ionico elettronegatività POTENZIALE DI IONIZZAZIONE enrgia necessaria a strappare l’elettrone più debolmente legato all’atomo isolato (allo stato gassoso) e portarlo a distanza infinita dal nucleo A + Energia ---------> A+ + e- diminuisce aumenta dimensioni atomiche energia di prima ionizzazione affinità elettronica raggio ionico elettronegatività AFFINITA’ ELETTRONICA energia liberata per acquisire un elettrone da parte di un atomo neutro A + e- ----------> A- + Energia varia poco aumenta dimensioni atomiche energia di prima ionizzazione affinità elettronica raggio ionico elettronegatività RAGGI IONICI + catione - e- - + e- atomo neutro anione
Scarica