14. Gli Acidi e le Basi
• Reazioni degli Acidi e delle Basi
- gli acidi e le basi in soluzione acquosa
- la neutralizzazione
• Gli acidi e le basi di Lewis
• Gli acidi e le basi
- gli acidi e le basi di Brønsted – Lowry
- lo scambio di protoni tra le molecole di acqua
- la scala del pH
- il pOH delle soluzioni
• Gli acidi e le basi deboli
- gli equilibri di trasferimento dei protoni
- l’altalena coniugata
- previsione della forza degli acidi
• Il pH delle soluzioni degli acidi e delle basi deboli
- le soluzioni degli acidi deboli
- le soluzioni delle basi deboli
- gli acidi e le basi poliprotici
L’Acqua
Qualsiasi studio che riguardi la chimica della
vita deve contemplare un’analisi dell’acqua
(circa il 70% della massa del corpo umano è
costituita d’acqua).
O
H
104.5 °
0.958 Å
H
1.Quasi tutte le molecole biologiche assumono
la forma che è loro peculiare (e quindi la loro
funzione) in risposta alle proprietà fisiche e
chimiche dell’acqua.
2.L’acqua è il mezzo in cui avviene la maggior
parte delle reazioni biochimiche.
3.L’acqua partecipa attivamente a molti tipi di
rezioni chimiche che sostengono la vita.
d- -0.66e
•Interazione ione-dipolo
•Interazione dipolo-dipolo
•Legame a idrogeno
d+ +0.33e
Acidi e Basi
Def. Definiamo ACIDO, secondo Arrhenius, un elettrolita che in acqua
cede ioni H+, formando lo ione IDRONIO H3O+.
HCl(aq) H2O(l) H3O (aq) Cl (aq)
Def. Definiamo BASE, secondo Arrhenius, un elettrolita che in acqua cede
ioni OH-, ioni OSSIDRILE.
NaOH(aq) H2O(l) Na (aq) OH (aq)
NH3 (aq) H2O(l) NH (aq) OH (aq)
4
ELETTROLITI
ACIDI
BASI
FORTI
DEBOLI
FORTI
DEBOLI
HCl
CH3COOH
NaOH
NH3
La Neutralizzazione
La REAZIONE DI NEUTRALIZZAZIONE è quella nel corso
della quale un ACIDO reagisce con una BASE producendo
un SALE e ACQUA
Acido Base Sale Acqua
Composto Ionico che si forma
dalla NEUTRALIZZAZIONE di un
ACIDO con una BASE
HCl(aq) NaOH(aq) NaCl(aq) H2O(l)
EQUAZIONE IONICA COMPLETA
H (aq) Cl (aq) Na (aq) OH (aq) Na (aq) Cl (aq) H2O(l)
H 2O
EQUAZIONE IONICA NETTA
H3O (aq) OH (aq) 2H2O(l)
Ossidi Acidi (anidridi) e Ossidi Basici
Ossidi Acidi (anidridi) e Ossidi Basici
Ossidi dei Metalli
CaO(s) H2O(l) Ca 2 (aq) 2OH (aq)
Ossidi dei Non Metalli
CO2 (g) H2O(l) H2CO3 (aq)
SO2 (g) H2O(l) H2 SO3 (aq)
P4O10 (s) 6H2O(l) 4H3PO 4 (aq)
Composti Anfoteri
Al2O3 (s) 6HCl(aq) 2 AlCl3 (aq) 3H2O(l)
2NaOH(aq) Al2O3 (s) 3H2O(l) 2NaAlOH4 (aq)
NEUTRALIZZAZIONE
ACIDO + BASE
ACIDO + OSSIDO BASICO
ANIDRIDE + BASE
ANIDRIDE + OSSIDO BASICO
MgO(s) 2HCl(aq) MgCl2 (aq) H2O(l)
2NaOH(aq) CO2 (g) Na 2CO3 (aq) 2H2O(l)
Gli Acidi e le Basi di Lewis
Def. Definiamo ACIDO, secondo Arrhenius, un elettrolita che in acqua
cede ioni H+, formando lo ione IDRONIO H3O+.
Def. Definiamo BASE, secondo Arrhenius, un elettrolita che in acqua cede
ioni OH-, ioni OSSIDRILE.
L’atomo di B non raggiunge l’ottetto
1. Condivisione di altri elettroni di uno degli
atomi di F.
+1
-1
L’OTTETTO DELL’ATOMO DI BORO PUÒ COMPLETARSI SE A
COSTITUIRE UN LEGAME IN PIÙ È UN ALTRO ATOMO O IONE.
con fluoruro metallico
con ammoniaca
Gli Acidi e le Basi di Lewis
Def. Definiamo LEGAMI COVALENTI COORDINATI i legami nei quali gli
elettroni provengono da uno solo dei due atomi legati.
Def. Definiamo ACIDO DI LEWIS un composto in grado di accettare un
doppietto elettronico.
Def. Definiamo BASE DI LEWIS un composto in grado di donare un
doppietto elettronico.
Acido + :Base → Complesso
H 3O +
H 2O
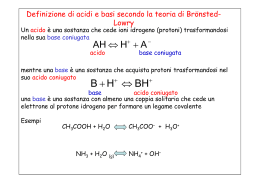
Gli Acidi e le Basi di Brønsted – Lowry
Def. Definiamo ACIDO, secondo Arrhenius, un elettrolita che in acqua
cede ioni H+, formando lo ione IDRONIO H3O+. Definiamo BASE, secondo
Arrhenius, un elettrolita che in acqua cede ioni OH-, ioni OSSIDRILE.
Def. Definiamo ACIDO DI Lewis un composto in grado di accettare un
doppietto elettronico. Definiamo BASE DI Lewis un composto in grado di
donare un doppietto elettronico.
base
H+
acido
Def. Definiamo ACIDO, secondo Brønsted – Lowry, un datore di protoni,
H+. Definiamo BASE, secondo Brønsted – Lowry, un accettore di protoni.
Acidi e Basi Coniugate
CH3 COOH(aq) H2 O(l) CH3 COO (aq) H3 O (aq)
ACIDO→cede un protone
H+, formando uno ione
idronio, H3O+.
cede H
Acido
Base Coniugata
CH3 COO (aq) H3 O (aq) CH3 COOH(aq) H2 O(l)
BASE
NH3 (aq) H2 O(l) NH4 (aq) OH (aq)
BASE→ acquista un protone
H+, formando uno ione
ossidrile, OH-.
Base Acido Coniugato
NH4 (aq) OH (l) NH3 (aq) H2 O(aq)
ACIDO
accetta H
Lo Scambio di H+ tra le Molecole di H2O
HCl(aq) H2 O(l) H3 O (aq) Cl (aq) NH3 (aq) H2 O(l) NH4 (aq) OH (aq)
BASE
ACIDO
L’ACQUA HA NATURA ANFIPROTICA (il prefisso anfi- significa entrambi)
EQUILIBRIO DI AUTOPROTOLISI
2H2O(l)
H3O+(aq) + OH-(aq)
[H3 O ][ OH ]
KC
[H2 O ]2
COSTANTE DI
AUTOPROTOLISI
K w [H3 O ][ OH ]
La Scala del pH e del pOH
Log x
[H3O+]
104
105
106
pH = - Log [H3O+]
103
-4
-3
-2
-1
10-1
10-2
10-3
10-4
0 101
1
1
102
2
3
4
5
6
x
ACQUA PURA, T=25 °C
[H3O+] = 1 x 10-7
pH = 7
pOH = - Log [OH-]
pKw = - Log (Kw)
ACQUA PURA, T=25 °C
[OH-] = 1 x 10-7
pOH = 7
Kw = [H3O+][OH-] = 10-7∙10-7 = 1 x 10-14
-Log (Kw) = -Log {[H3O+][OH-]}
= -Log [H3O+] - Log [OH-]
pKw = pH + pOH = 14
La Scala del pH e del pOH
Gli Equilibri di Trasferimento dei Protoni
CH3COOH(aq) + H2O(l)
[CH3COO ][H3O ]
KC
[CH3COOH][H2O]
CH3COO-(aq) + H3O+(aq)
[CH3COO ][H3O ]
Ka
[CH3COOH]
COSTANTE DI IONIZZAZIONE
ACIDA o COSTANTE DI ACIDITÀ
NH3(aq) + H2O(l)
[NH4 ][ OH ]
KC
[NH3 ][H2 O ]
NH4+(aq) + OH-(aq)
[NH4 ][ OH ]
Kb
[NH3 ]
COSTANTE DI IONIZZAZIONE
BASICA o COSTANTE DI BASICITÀ
Gli Equilibri di Trasferimento dei Protoni
[CH3COO ][H3O ]
Ka
[CH3COOH]
[NH4 ][ OH ]
Kb
[NH3 ]
pKa = - Log (Ka)
pKb = - Log (Kb)
T = 25 °C
Ka = 1.8x10-5
pKa = 4.75
T = 25 °C
Kb = 1.8x10-5
pKb = 4.75
L’Altalena Coniugata
HA(aq) + H2O(l)
A-(aq)
+ H2O(l)
A-(aq) + H3O+(aq)
[ A ][H3O ]
Ka
[HA ]
OH-(aq)
[HA ][OH ]
Kb
[A ]
HA(aq) +
B(aq) + H2O(l)
BH+(aq) + H2O(l)
BH+(aq) + OH-(aq)
B(aq) + H3O+(aq)
[BH ][OH ]
Kb
[B]
[B][H3O ]
Ka
[BH ]
[ A ][H3O ] [HA ][OH ]
K a Kb
Kw
[HA ]
[A ]
[BH ][OH ] [B][H3O ]
Kb K a
Kw
[B]
[BH ]
L’Altalena Coniugata
K a Kb K w
pK a pK b pK w
Struttura e Forza degli Acidi
H–A
H–A
FORZA DEL LEGAME H – A
H 2O
H–A
FORZA DEL LEGAME
A IDROGENO TRA H2O E HA
HF
DHB(H – F) = 543 kJ∙mol-1
Ka =
H 2O – H + + A -
3.5x10-4
Dc 1.8
Struttura e Forza degli Acidi
Le Soluzioni degli Acidi e delle Basi Deboli
Cl-(aq) + H3O+(aq)
HCl(aq) + H2O(l)
NaOH(aq) + H2O(l)
Ka >>1
pH = -Log [H3O+]
Na+(aq) + OH-(aq) Kb >>1
pOH = -Log [OH-]
HA(aq) + H2O(l)
A-(aq) + H3O+(aq)
Specie
1° Tempo. Concentrazione molare iniziale.
HA
H 3 O+
A-
Ca
0
0
2° Tempo. Variazione della concentrazione
-x
+x
+x
molare.
La stechiometria della reazione implica che se la concentrazione di HA diminuisce di x,
quelle di A- e H3O+ aumentano di x.
3° Tempo. Concentrazione molare di
Ca – x
+x
+x
equilibrio.
Questi valori individuano la somma delle concentrazioni iniziali, 1° tempo, e le variazioni
di concentrazione causate dalla reazione, 2° tempo.
[ A ][H3 O ]
xx
Ka
[HA]
Ca x
K a 10 4 C a x C a
x K a Ca
2
x [H3 O ] K a C a
pH
1
1
pK a pCa
2
2
Le Soluzioni degli Acidi e delle Basi Deboli
B(aq) + H2O(l)
BH+(aq) + OH-(aq)
Specie
1° Tempo. Concentrazione molare iniziale.
B
BH+
OH-
Cb
0
0
2° Tempo. Variazione della concentrazione
-x
+x
+x
molare.
La stechiometria della reazione implica che se la concentrazione di B diminuisce di x,
quelle di BH+ e OH- aumentano di x.
3° Tempo. Concentrazione molare di
Cb – x
+x
+x
equilibrio.
Questi valori individuano la somma delle concentrazioni iniziali, 1° tempo, e le variazioni
di concentrazione causate dalla reazione, 2° tempo.
x [OH ] K b Cb
[BH ][OH ]
xx
Kb
[B]
Cb x
K b 10 4 Cb x Cb
x 2 K b Cb
pOH
1
1
pK b pCb
2
2
pH 14 pOH
Gli Acidi e le Basi Poliprotiche
Def. Definiamo ACIDO POLIPROTICO, secondo Brønsted – Lowry, un
acido in grado di cedere più di un protone, H+. Definiamo BASE
POLIPROTICA, secondo Brønsted – Lowry, una base in grado di accettare
più di un protone.
[
HCO
][
H
O
]
3
3
K a1
H2 CO3 (aq) H2 O(l)
HCO3 (aq) H3 O (aq)
[H2 CO3 ]
2
[
CO
][
H
O
]
3
3
K a2
CO23 (aq) H3 O (aq)
HCO3 (aq) H2 O(l)
[HCO3 ]
H2 CO3 (aq) 2H2 O(l)
CO23 (aq) 2H3 O (aq)
K a K a1 K a 2
Scarica




![[H 3 O + ] [OH](http://s2.diazilla.com/store/data/000110729_1-59fff7ef192b8d3731bd20759a135a5f-260x520.png)
