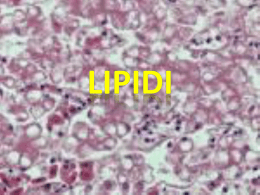
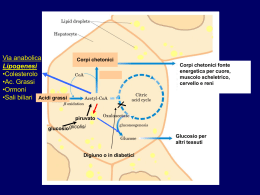
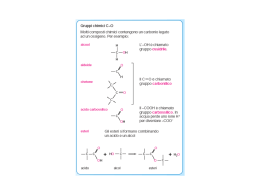
Gli Acidi Grassi ω–3 ed ω–6: dalla biochimica all’applicazione clinica Prof. Marcello Ciaccio, M.D. Cattedra di Biochimica Clinica – Facoltà di Medicina e Chirurgia – Università degli Studi di Palermo Introduzione Gli acidi grassi sono il componente più importante e comune di tutte le classi di lipidi e come tali sono ampiamente rappresentati negli organismi viventi nei quali svolgono funzioni strutturali, energetiche e metaboliche. Chimicamente sono catene acidiche lineari, monocarboniose, di lunghezza variabile; contengono generalmente un numero pari di atomi di carbonio, sebbene acidi a catena dispari siano presenti in natura. Possono essere saturi (nessun doppio legame) o presentare uno o più doppi legami (insaturi). Essi sono raramente presenti sotto forma di acidi grassi liberi; si trovano più frequentemente incorporati con legame esterico o amidico nelle varie classi lipidiche (principalmente trigliceridi, fosfolipidi, esteri del colesterolo, sfingolipidi, cere, alcoli alifatici, ecc.) che si formano nel metabolismo lipidico. Nel sangue come frazione libera (FFA) si ritrovano in concentrazione assai esigua (circa l’1,5% di tutti i lipidi circolanti). Biochimica degli Acidi Grassi Gli acidi grassi presenti nell’organismo dei mammiferi in parte derivano dalla dieta, cioè dalle sostanze grasse, in prevalenza trigliceridi, che introduciamo con gli alimenti (olio, burro, carni, formaggi, ecc.) e in parte vengono sintetizzati dall’organismo. La biosintesi avviene principalmente a livello del tessuto epatico e, in misura minore, in alcuni tessuti extraepatici (sistema nervoso centrale, piastrine, neutrofili, miociti). La classificazione in base alla lunghezza ed al grado di insaturazione sembra essere la più utile per schematizzare la relativa funzione biologica nell’ambito dell’organismo. Si distinguono: (a) acidi grassi a corta catena (SCFA) fino a 4 atomi di carbonio di cui il principale è l’acido butirrico (4:0) il cui ruolo trofico e protettivo a livello della mucosa del colon è di rilevante importanza; (b) acidi grassi a catena media (MCFA) fino a 12 atomi di carbonio con funzione metabolica ed energetica (acido caproico 6:0, acido caprilico 8:0, acido caprico 10:0, acido laurico 12:0); (c) acidi grassi a lunga catena (LCFA) fino a 18 atomi di carbonio con un ruolo energetico, metabolico e strutturale a loro volta classificabili in: (c1) LCFA saturi (acido miristico 14:0, acido palmitico 16:0, acido stearico 18:0) di cui fanno parte sia i trigliceridi di deposito sia i componenti strutturali di membrana; (c2) LCFA monoinsaturi (acido oleico 18:1 ω-9) con funzione ipocolesterolemizzante; (c3) LCFA polinsaturi che sono essenziali (acido linoleico 18:2 ω-6 e acido linolenico 18:3 ω-3); (d) acidi grassi a catena molto lunga (VLCFA) da 20 atomi di carbonio in poi (ω-3, ω-6, ω-9) e loro derivati prostaglandine, trombossani e leucotrieni. Gli acidi grassi saturi possono derivare dalla dieta o essere di origine endogena, sintetizzati per aggiunta di unità di malonil-CoA a partire da una molecola di acetil-CoA: sono, quindi, composti non essenziali. Nei lipidi animali gli acidi grassi saturi più abbondanti sono l’acido palmitico (16:0) e l’acido stearico (18:0). Acidi grassi a catena più breve (14:0, 12:0) così come a catena più lunga (20:0, 28:0) sono presenti in quantità minori. Gli acidi grassi monoinsaturi hanno uno scheletro carbonioso simile agli acidi grassi saturi da cui spesso derivano; i più abbondanti nel mondo animale sono l’acido oleico (18:1 ω9) e l’acido palmitoleico (16:1 ω-7) che derivano rispettivamente dall’acido stearico e dall’acido palmitico per opera dell’enzima ∆-9-desaturasi. Ulteriori doppi legami possono essere inseriti in un acido grasso monoinsaturo ad opera di altre desaturasi che sono in genere presenti nel mondo animale. Gli animali, tuttavia, a differenza dei vegetali non posseggono desaturasi che possono inserire doppi legami oltre il nono-decimo atomo di carbonio degli acidi grassi, per cui ne consegue che acidi grassi polinsaturi -1- possono essere prodotti dall’organismo ma con struttura tale che tutti i doppi legami sono situati nella porzione carbossilica della molecola. Si tratta, dunque, di acidi grassi polinsaturi non essenziali di cui l’acido eicosatrienoico (20:3 ω-9) è il composto più significativo che viene sintetizzato in condizioni di carenza di acidi grassi essenziali. Gli acidi grassi essenziali sono generalmente suddivisi in due classi, ω-3 ed ω-6, a seconda della posizione del loro primo doppio legame nella porzione metilica della molecola. Gli acidi grassi capostipite dei due gruppi sono l’acido α-linolenico (18:3 ω-3) e l’acido linoleico (18:2 ω-6) entrambi di origine vegetale. I microsomi epatici e cerebrali posseggono la capacità di allungare e desaturare ulteriormente gli acidi grassi capostipite forniti con la dieta, formando attraverso una serie alternata di desaturazioni ed allungamenti gli acidi grassi polinsaturi a catena lunga da cui si formano gli eicosanoidi e i mattoni costituenti le membrane cellulari e mitocondriali. Caratteristiche biochimiche, biochimico-cliniche ed azioni biologiche degli Acidi grassi ω-3 ed ω-6 L’acido linoleico e l’acido α-linolenico, rispettivamente precursori degli acidi grassi ω-6 ed ω-3, sono acidi grassi essenziali, in quanto l’organismo umano non è in grado di sintetizzarli da altri acidi grassi. Gli acidi grassi ω-6 ed ω-3 sono componenti fondamentali delle membrane plasmatiche; inoltre, la loro trasformazione metabolica dà origine agli eicosanoidi, che sono importanti mediatori di numerose reazioni cellulari. Prostaglandine, trombossani e leucotrieni derivano tutti dal metabolismo degli acidi grassi ω-6 ed ω-3 attraverso reazioni catalizzate dagli enzimi ciclossigenasi e lipossigenasi. Un’altra caratteristica fondamentale degli acidi grassi ω-6 ed ω-3 è il fatto che il loro metabolismo segue vie totalmente distinte, in quanto un acido grasso ω-3 non può essere trasformato in un acido grasso ω-6 e viceversa. Tuttavia, gli acidi grassi di entrambi i tipi possono essere allungati (aumento del numero di atomi di carbonio) e desaturati (aumento del numero di doppi legami) attraverso processi catalizzati dagli stessi enzimi. Pertanto, le due famiglie di acidi grassi polinsaturi competono per lo stesso sistema enzimatico. L’enzima ∆-6-desaturasi rappresenta una barriera per ambedue le serie ω-6 ed ω-3 trasformando l’acido cis-linoleico in acido γ-linolenico e l’acido α-linolenico in acido stearidonico (C18:4 ω-3). L’attività catalitica dell’enzima è inibita o bloccata da: grassi saturi, acidi grassi trans derivati dalla trasformazione degli oli vegetali, l’iperglicemia, l’alcool, l’invecchiamento, l’adrenalina (azione mediata da β-recettori), i glucocorticoidi, una dieta ipoproteica, i virus oncogeni, le radiazioni ionizzanti. Gli acidi grassi della serie ω-3 sono normalmente presenti negli alimenti marini, in alcune piante ed, anche, in taluni prodotti animali quali pollo, tacchino ed uova. L’acido grasso ω-3 maggiormente presente nel mondo vegetale è l’acido α-linolenico (presente soprattutto nei vegetali a foglia verde, nei legumi, nella frutta secca, nelle noci, in alcuni oli come quelli di lino e di soia, nell’estratto di colza o ravizzone) che deve essere trasformato in EPA e DHA per esercitare gli effetti biologici determinanti per l’ottimale funzionamento del cervello, della retina e delle gonadi e che esplicano una azione protettiva nei confronti del processo aterosclerotico e dell’insorgenza di malattie cardio-vascolari. L’acido αlinolenico può essere ottenuto nelle piante più elevate dal linoleico attraverso sintesi nelle membrane dei cloroplasti, sintesi non possibile nel mondo animale. EPA e DHA sono presenti nel fitoplancton e sono concentrati in particolare in alcune specie ittiche (pesci che vivono nelle acque fredde). L’acido grasso α-linolenico ω-3 è un acido grasso essenziale che va introdotto con la dieta. Nell’organismo può essere metabolizzato in acidi grassi a catena più lunga della stessa serie grazie all’attività di due sistemi enzimatici detti desaturasi (inserisce un doppio legame al posto di uno saturo in punti precisi della catena dell’acido grasso) ed elongasi (aggiunge atomi di carbonio ad un acido grasso allungandone la catena). Questi due interventi metabolici hanno la proprietà di modificare la struttura dell’acido grasso sul quale sono intervenuti attribuendogli proprietà specifiche sia funzionali che strutturali. Gli acidi grassi ω-3 più comuni sono: l’acido α-linolenico (18:3 ω-3), l’acido stearidonico (18:4 ω-3), l’acido eicosatetraenoico (20:4 ω-3) l’acido eicosapentaenoico o EPA (20:5 ω-3), l’acido docosapentaenoico (22:5 ω-3), l’acido docosaesaenoico o DHA (22:6 ω-3). EPA e DHA sono i più importanti acidi grassi a lunga catena della serie ω-3 e svolgono nell’organismo umano funzioni strutturali e funzionali. -2- Il DHA ha prevalentemente una funzione strutturale; infatti, è maggiormente presente nei fosfolipidi dei sinaptosomi cerebrali, nella retina e nei fosfolipidi dei canali intramembrana del sodio. Esso ha, quindi, un ruolo importante nello sviluppo e nella maturazione cerebrale, dell’apparato riproduttivo e del tessuto retinico. L’EPA è il principale precursore delle prostaglandine della serie 3, le quali posseggono una importante attività antiaggregante piastrinica. L’attività biologica degli acidi grassi ω-3 (antiaterogena, antinfiammatoria, antitrombotica) dipende dal prevalere dei fattori protettivi su quelli inducenti rischio. L’assunzione di acidi grassi ω-3 incrementa: la formazione di prostaglandine PGI3; la produzione di leucotrieni B5 (molto meno infiammatori rispetto ai leucotrieni B4), di interleuchina 2, dell’EDRF (Endothelial Derived Relaxing Factor); l’attività fibrinolitica; la deformazione degli eritrociti; l’aumento delle HDL. Una diminuzione o assenza di acidi grassi ω-3 comporta una maggiore produzione di acido arachidonico, un aumento dell’aggregazione piastrinica e la formazione di trombossani, un aumento dell’attività dei macrofagi, una aumentata formazione di interleuchina 1, di leucotrieni 4, del PAF (Platelet Activating Factor) e del PDGF (Platelet Derived Growth Factor), un incremento delle LDL, delle VLDL, dei trigliceridi e della viscosità ematica. Gli acidi grassi più importanti della serie ω-6 sono l’acido linoleico (18:2 ω-6), l’acido γ-linolenico (18:3 ω6), l’acido diomo-γ-linolenico (20:3 ω-6), l’acido arachidonico (20:4 ω-6). Il più diffuso è l’acido linoleico che è presente negli oli di semi; l’acido arachidonico è tipico del mondo animale essendo un prodotto di conversione dell’acido linoleico. L’acido γ-linolenico è il primo intermedio nella conversione dell’acido linoleico ad acido arachidonico; l’acido diomo-γ-linolenico ha un rapido turnover metabolico in quanto è rapidamente convertito a prostaglandine della serie 1. Gli acidi grassi polinsaturi a lunga catena ω-6 hanno, anch’essi, un ruolo strutturale e funzionale. L’acido arachidonico è presente nei fosfolipidi di membrana ed è importante, opportunamente bilanciato con il DHA, nello sviluppo embrionale e nell’accrescimento del bambino, produce le prostaglandine della serie 2 (attraverso la via ciclossigenasica) dando luogo alla formazione di intermedi metabolici ad attività proinfiammatoria e aggregante piastrinica (trombossano A2). Dall’acido arachidonico tramite la via lipossigenasica si formano i leucotrieni, che hanno una azione broncocostrittrice (ruolo importante nell’anafilassi insieme alle SRSA – Slow Reacting Substance of Anaphylaxis). Gli effetti biologici degli acidi grassi della serie ω-6 e della serie ω-3 pur avendo come siti della loro azione gli stessi elementi cellulari (mastociti, neutrofili, eosinofili, macrofagi, trombociti, endotelio vasale) sono spesso di tipo opposto: infatti, gli acidi grassi ω-6 (acido arachidonico) dando origine a prostaglandine della serie 2 e leucotrieni della serie 4 hanno come effetto finale vasocostrizione, broncocostrizione attivazione dei poliformonucleati e aumento della permeabilità, gli acidi grassi ω-3 (EPA) formano prostaglandine della serie 3 e leucotrieni della serie 5 riducono i processi infiammatori, provocano vasodilatazione e riducono la broncocostrizione. Il fabbisogno giornaliero degli acidi grassi ω-3 EPA e DHA è di 1 g al giorno (circa lo 0,5% delle calorie totali) mentre per l’acido γ-linoleico ω-6 è di 560 mg al giorno (circa lo 0,25% delle calorie totali). In condizioni di alterato assorbimento è consigliabile raddoppiare le dosi. Acidi grassi ω-3 ed ω-6 nella prevenzione e nella terapia Il rapporto ottimale tra acidi grassi polinsaturi a lunga catena ω-3 / ω-6 per svolgere in modo adeguato le loro funzioni è di circa 1:10. Negli ultimi 100 anni questo rapporto ideale si è notevolmente sbilanciato a favore degli ω-6 per ragioni diverse fra cui l’aumentato consumo di oli vegetali (mais, girasole, arachidi ricchi di ω-6 come l’acido linoleico) per il controllo dell’aterosclerosi, il limitato consumo di pesce e la minor presenza di ω-3 nel pesce di allevamento rispetto a quello pescato che si nutre di fitoplancton, le minime quantità di acido linolenico nelle carni provenienti dai bovini domestici che sono alimentati con prodotti molto poveri di acidi grassi ω-3, la produzione di vegetali a foglia verde contenenti acidi grassi ω-3 in misura minore. Una diminuzione di acidi grassi ω-6 comporta lesioni della cute, anemia, aumento dell’aggregazio-ne piastrinica, trombocitopenia, steatosi epatica, ritardata cicatrizzazione delle ferite, una aumentata suscettibilità alle infezioni, diarrea e ritardo di crescita nell’età evolutiva. -3- Una diminuzione di acidi grassi ω-3 è caratterizzata da sintomi neurologici, ridotta acuità visiva, lesioni cutanee, ritardi di crescita, riduzione della capacità di apprendimento, elettroretinogramma anormale. Il mantenimento di un ottimale rapporto di ω-3 / ω-6 è di rilevante importanza nella prevenzione di alcune condizioni patologiche e nella terapia sia di forme patologiche ad eziopatogenesi immunoallergica sia di particolari forme patologiche legate ad errori del metabolismo lipidico. In particolare: (1) prevenzione di malattie cardio-vascolari e dei fattori di rischio per l’aterosclerosi; (2) prevenzione e terapia di patologie immunoallergiche e cutanee; (3) patologie congenite del metabolismo quali l’Adrenoleucodistrofia e la Fenilchetonuria. Studi recenti indicano che regimi dietetici ricchi di acido α-linolenico determinino una riduzione della mortalità cardio-vascolare, in particolare della morte improvvisa (effetto antiartmico dell’acido αlinolenico) e delle recidive di infarto miocardico, senza influenzare colesterolemia e pressione arteriosa, fattori classici di rischio coronarico. Nella dermatite atopica soprattutto nell’età infantile si è visto che vi è una significativa diminuzione di acido arachidonico ed un aumento di acido linoleico e che la sintomatologia (prurito, segni di flogosi ed eczema) migliora con la somministrazione di acido γ-linolenico. Altre patologie nelle quali recenti ricerche di base e cliniche hanno dimostrato l’importanza degli acidi grassi insaturi ω-3 e ω-6 sono le neoplasie della mammella, del colon, della prostata, artriti, disturbi mentali, disturbi della vista, patologie autoimmuni. Acidi grassi ω-3 ed ω-6 e nutrizione artificiale Studi sulla cinetica metabolica degli acidi grassi ω-3 ha evidenziato che esistono profonde differenze tra la somministrazione orale e quella parenterale. Infatti, la somministrazione orale porta alla incorporazione degli acidi grassi ω-3 nelle membrane cellulari solo dopo una dieta di parecchie settimane, mentre la somministrazione parenterale porta a questo risultato entro pochi giorni. Un apporto di acidi grassi essenziali ω-3 ed ω-6 è particolarmente indicata nei prematuri e nei neonati di basso peso alla nascita, in considerazione che l’organismo ha a disposizione solo scarse risorse endogene ed esiste una notevole necessità di acidi grassi essenziali nei tessuti neoformati per la rapida crescita in peso. Inoltre, nel periodo perinatale la capacità di sintetizzare acidi grassi insaturi a catena lunga dai loro precursori è ridotta. L’arricchimento della alimentazione con acidi grassi insaturi ω-3 ed ω-6 porta ad una normalizzazione della concentrazione di acidi grassi nei fosfolipidi e si correla con un migliore sviluppo cerebrale e delle funzioni visive. I pazienti con malattie caratterizzate da una componente infiammatoria sembra che traggano buoni benefici dalla somministrazione di acidi grassi ω-3, grazie agli effetti antinfiammatori ed immunomodulatori oltre all’effetto antiaggregante e vasodilatatore con aumento della perfusione microvascolare con riduzione del rischio trombotico. I pazienti che possono, dunque, beneficiare della somministrazione parenterale di acidi grassi ω-3 sono oltre ai (1) post-traumatizzati e post-chirurgici quelli con: (2) sepsi e Sindrome di Risposta Infiammatoria Sistemica (SIRS); (3) rischio di processi infiammatori intensi; (4) funzione immunitaria compromessa; (5) malattie infiammatorie dell’intestino (colite ulcerosa e morbo di Crohn); (6) funzione polmonare compromessa (scompenso polmonare acuto o cronico); (7) trapianto renale; (8) patologie cutanee infiammatorie (psoriasi, eczema atopico); (9) patologia caratterizzata da grave stress metabolico. Gli acidi grassi ω-3 ed ω-6 presentano nella loro struttura doppi legami con tendenza ad autoossidarsi sia durante la conservazione che nell’organismo; l’ossidazione può essere prevenuta efficacemente aggiungendo un antiossidante come la vitamina E. Conclusioni Le migliori conoscenze della biochimica e della fisiologia degli acidi grassi ω-3 ed ω-6 unite alla possibilità di identificazione degli stessi nei fluidi biologici e nei tessuti con metodiche affidabili per sensibilità e specificità (gas-cromatografia) ha portato ad una loro utilizzazione in varie condizioni patologiche oltre che in situazioni che sono al confine tra fisiologia e patologia. -4- Bibliografia 1) Agostoni C, Bruzzese MG: Gli acidi grassi: classificazione biochimica e funzionale. Ped. Med. Chir. 1992; 14: 473-479. 2) Agostoni C, Riva E, Biasucci G: Acidi grassi nella prevenzione e nella terapia in pediatria. Ped. Med. Chir. 1992; 14: 489-494. 3) Allert CM, HennekensCH, O’Donnel CJ: Fish consumption and risk of sudden cardiac death. JAMA 1998; 279: 23-28. 4) Ascherio A, Rimm EB, Stampfer JM: Dietary intake of marine ω-3 fatty acids, fish intake and the risk of coronary disease among men. N. Engl. J. Med. 1995; 332: 978-982. 5) Bittiner SB, Tucker WFG, Cartwright SS, Bleehan SS: A double-blind randomised placebo-controlled trial af fish oil in psoriasia. Lancet i 1988; 378-380. 6) Britich Nutrition Foundation: Unsatured fatty acids. Nutritional and physiological significant. Chapman & Hall Pubb. London, 1992. 7) Carnielli VP, van Goudoever JB: Gli acidi grassi essenziali: fabbisogni ed utilizzazione. Prospettive in Pediatria 1992; 22: 289-304. 8) Calder PC: Dietary fatty acids and the immune system. Nutr. Rew. 1998; 56: 570-583. 9) De Deckere EA: Possible beneficial effect of fish and fish ω-3 polyunsaturated fatty acids in breast and colorectal cancer. Eur. J. Cancer Prev. 1999; 8: 213-221. 10) Dyerberg J, Bang HO, Stoffersen B, Moncada S, Vane JR: Eicosapentaenaic acid and prevention of thrombosis and atheroscleroris? Lancet ii 1978: 117-119. 11) Hibleln JK: Essential fatty acids predict biomarkers of aggression and depression. PUFA Newsletter 1997; 1: 2-3. 12) Kremer JM, Jubiz W, Michalet A: Fish oil fatty acid supplementation in active rheumatoid arthritis. Ann. Intern. Med. 1987; 106: 497-503. 13) Layne KS, Goh YK, Jumpsen JA: Normal subjects consumingphysiological levels of 18:3 and 20:5 ω-3 from flaxseed or fish oil have characteristic differences in plasm lipid and lipoprotein fatty acids levels. J. Nutr. 1996; 129: 2130-2140. 14) Livelli di assunzione raccomandati di energia e nutrienti per la popolazione italiana (LARN) 1996; 63-67. 15) Lifkowith JB, Klabr S: Polyunsaturated fatty acids on renal disease. Proc. Soc. Exp. Biol. & Med. 1996; 213: 1223. 16) Rose DP, Connolly JM: Omega-3 fatty acids as cancer chemopreventive agents. Pharmacol. Ther. 1999; 83: 217244. 17) Willett WC: Specific fatty acids and risk of breast and prostate cancer: dietary intake. Am. J. Clin. Nutr. 1997; 66: 1557-1563. -5-
Scarica