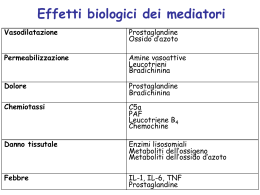
PROTEINE RICOMBINANTI: ASSORBIMENTO Via di somministrazione preferenziale è generalmente parenterale (i.v., i.m., i.p., s.c.) La diversa via parenterale può variare l’attività terapeutica (irrorazione sanguigna, passaggio nel sistema linfatico, ecc.) PROTEINE RICOMBINANTI: ASSORBIMENTO Via di somministrazione orale non valida se richiesta una elevata biodisponibilità (degradazione e scarsa permeabilità nel tratto G.I.) Via “accessibile” per vaccini orali (placche del Payer) PROTEINE RICOMBINANTI: ASSORBIMENTO Vie alternative di somministrazione: naso, polmoni, retto, cavità orale, pelle Problema scarsa biodisponibilità a cui si tenta di ovviare aumentando l’assorbimento senza dare tossicità PROTEINE RICOMBINANTI: ASSORBIMENTO Aumento permeabilità barriere: acidi grassi, sali biliari, saponine; liposomi. Riduzione attività peptidasica: inibitori delle proteasi, modificazione struttura. Aumento tempo di esposizione: nanoparticelle (PEG, liposomi). Effetto del glicocolato su biodisponibilità: somministrazione nasale Molecola AA Biodisponibilità % senza con Glucagone 29 <1 70-90 calcitonina 32 <1 15-20 insulina 51 <1 10-30 PROTEINE RICOMBINANTI: BIODISPONIBILITA’ Targeting specifico: particolato colloidale (liposomi, microsfere di albumina, LDL ecc.). Liposomi sono i più usati per bassa tossicità, flessibilità, ampio “core” acquoso) PROTEINE RICOMBINANTI: BIODISPONIBILITA’ Targeting “passivo”: fegato e milza Targeting “attivo”: veicolazione con ab specifici Prolungamento emivita: pegilazione (< att. biologica) PROTEINE RICOMBINANTI: DISTRIBUZIONE Il volume di distribuzione è generalmente modesto (scarsa penetrazione nel tessuto o specificità di distribuzione tissutale) > è la permanenza nell’organismo, > è la distribuzione, ma non sempre (es. IL2-PEG) PROTEINE RICOMBINANTI: LEGAME A PROTEINE Provato per IGF-I, t-PA, hGH, Dnasi Per le molecole tradizionali solo il farmaco libero svolge attività farmacologica Per proteine ricombinanti, il legame a proteine plasmatiche può favorire l’attività (es IGF-I) PROTEINE RICOMBINANTI: METABOLISMO-ELIMINAZIONE Metabolismo non presenta rischio di tossicità Principali organi di eliminazione: rene (via principale per proteine di piccole dimensioni) fegato (endopeptidasi, esopeptidasi) altri PROTEINE RICOMBINANTI: VARIAZIONI FARMACOCINETICHE -modificazioni della sequenza aminoacidica -pegilazione (ridotta vel. di eliminazione) -variazioni nella glicosilazione (variano interazioni recettoriali o attacchi enzimatici) PROTEINE RICOMBINANTI: IMMUNOGENICITA’ Produzione di anticorpi più frequente per proteine estranee all’ospite Dimostrata per varie prot. ricombinanti (insulina, interferoni, ab monocl., EPO, hGH ecc.). PROTEINE RICOMBINANTI: IMMUNOGENICITA’ - CAUSE Fattori associati al prodotto: presenza di impurezze/contaminanti, via di somministrazione, conservazione, variazioni di seq. aacidica/glicosilazione Fattori genetici associati al paziente: delezioni o mutazioni della proteina endogena aplotipo del complesso maggiore di istocompatibilità (MHC) PROTEINE RICOMBINANTI: IMMUNOGENICITA’ Le conseguenze di una prod. anticorpale sono diverse a seconda della regione della proteina a cui si legano: - nessun effetto (hGH) - variazione di parametri farmacocinetici (insulina) - neutralizzazione (NAB) dell’attività biologica (IFNa) PROTEINE RICOMBINANTI: IMMUNOGENICITA’ CASO ERITROPOIETINA (EPREX): - fino al 1998 rari casi di prod. NAB (conseguenza aplasia eritrocitaria) -circa 200 casi dal 1998 al 2003 Dal 1998 HSA sostituita da polisorbato 80, venduta in siringhe pre-riempite (rilascio di sostanze dalla siringa?). Modifiche dei materiali della siringa e di conservazione (riduzione dei casi di NAB) PROTEINE RICOMBINANTI: “INFUSIONAL REACTION” Definibile come reazione “anafilattoide”, mima una reazione anafilattica (IgE mediata) ma non ha coinvolg. anticorpale Manifest. frequenti: brividi, instabilità emodinamica, dispnea Si osserva durante la prima infusione o poche ore dopo, rara alle infusioni successive Fattore importante: velocità di infusione CITOCHINE - FATTORI DI CRESCITA EMATOPOIETICI Regolano ematopoiesi (proliferazione, differenziazione, maturazione) e attività funzionale di cellule mature sono glicoproteine con ponti disolfuro tra gruppi cisteinici spesso essenziali per l’attività biologica CITOCHINE - FATTORI DI CRESCITA EMATOPOIETICI Colony-stimulating factors per granulociti (G-CSF), granulocitimacrofagi (GM-CSF), macrofagi (MCSF), eritropioetina (EPO), IL-3, ecc. G-CSF e GM-CSF sono prodotti in forma sia glicosilata (CHO) sia non glicosilata (E. coli), EPO in CHO CITOCHINE - FATTORI DI CRESCITA EMATOPOIETICI Impieghi clinici: G-CSF neutropenie, trapianto di midollo, pazienti con HIV in terapia con mielosoppressori GM-CSF neutropenia, trapianto di midollo, pazienti con HIV in terapia con antivirali EPO anemia associata a insufficienza renale cronica o chemioterapia CITOCHINE - FATTORI DI CRESCITA EMATOPOIETICI Tossicità: G-CSF, GM-CSF perdita di appetito, febbre, mal di testa GM-CSF effetto indesiderato più grave è la capillary-leak syndrome con elevati dosaggi, reazione di prima dose (tachicardia, ipotensione, vomito ecc), prod. di anticorpi EPO ipertensione/trombosi in soggetti predisposti, aplasia eritrocitaria da NAB CITOCHINE INTERLEUCHINE-INTERFERONI Sono glicoproteine che svolgono un ruolo di comunicazione tra cellule dei sistemi immunologico, ematologico, neurologico. Interleuchine deriva da inter-leucociti interferone dall’abilità di interferire con infezioni virali CITOCHINE INTERLEUCHINE (IL) IL-1 mediatore della risposta a infezioni, infiammazione IL-2 prodotta da cellule TH1 stimola crescita, differenziazione, attivazione di cellule T, B, NK IL-3 fattore di crescita ematopoietico IL-4 …………..IL-17 CITOCHINE INTERLEUCHINA -2 La proteina ricombinante è disponibile commercialmente come Proleukin, è prodotta in E. coli ed ha due modificazioni aminoacidiche rispetto alla proteina naturale indicazione terapeutica: cancro renale metastatico, melanoma CITOCHINE INTERLEUCHINA -2 Tossicologia: la terapia approvata dalla FDA è ad alte dosi; somm. i.v.: tox frequente, spesso seria, a volte fatale; capillary-leak syndrome che causa ipotensione con ridotta perfusione degli organi; effetti cardiaci e cardiovascolari quali aritmia, ischemia (s.c. effetti meno gravi) CITOCHINE INTERFERONI (IFN) Identificate tre classi a, b, g prodotte da vari tipi cellulari (rispettivamente leucociti, fibroblasti, T linfociti) Gli effetti antivirali degli interferoni sono causati da più meccanismi vengono prodotte forme ricombinanti di tutte e tre le classi CITOCHINE IFN a Identificati 14 sottotipi prodotti singoli sottotipi ricombinanti in E. coli: IFNa-2a (Roferon-A), IFNa-2b (Intron A) anche pegilati; disponibili miscele purificate da leucociti umani: IFNa-n3 (Alfero-N), IFNa-ni (Wellferon). Indicazioni terapeutiche: tumori (linfoma non Hodgkin, ter. aggiuntiva cancro rettale, etc.), epatite B e C, infezioni da Papilloma virus CITOCHINE IFN a Tossicità: sindrome influenza-simile iniziale, alterazioni della visione, diarrea, vomito, affaticamento anemia, cardiotossicità (aritmia atriale) leucopenia, trombocitopenia prod. di anticorpi neutralizzanti per i non glicosilati CITOCHINE IFN b Tre prodotti sul mercato: IFN b-1b (Betaseron/Betaferon s.c.) prodotto in E. coli con modificazione aminoacidica IFN b-1a (Avonex i.m. e Rebif s.c.) prodotti nelle CHO indicazioni terapeutiche: sclerosi multipla recidivante-intermittente CITOCHINE IFN b Tossicità: -sindrome influenza-simile -reazioni in sede di iniezione -confusione, depressione, ansia -anticorpi neutralizzanti con tutti i composti (in particolare con Betaseron) CITOCHINE IFN g Presenti due forme con la stessa sequenza aminoacidica, ma diversa glicosilazione Prodotto ricombinante: IFN g -1b (Actimmune, i.m. e s.c.) in E. coli indicazione terapeutica: granulomatosi cronica CITOCHINE IFN g Tossicità: - sindrome influenza-simile - leucopenia, ipotensione, neurotossicità, trombocitopenia - nessuna rilevazione di anticorpi neutralizzanti ANTICORPI MONOCLONALI terapia con immunoglobuline nota da due secoli produzione anticorpi monoclonali dal ‘75 1986: OKT3 approvato per prevenire rigetto dopo trapianto vari anticorpi oggi in uso per terapia o diagnostica ANTICORPI MONOCLONALI Problema dell’uso di anticorpi monoclonali murini: immunogenicità sviluppo di anticorpi ricombinanti con regioni variabili murine e costanti umane - chimerici (-xi-) sviluppo di anticorpi umanizzati (-zu-) EVOLUTION OF ANTIBODY TECHNOLOGY ANTICORPI MONOCLONALI OKT3 Muromonab CD-3 Ab monoclonale murino specifico per CD3 umano su cellule T è un potente immunosoppressore uso per prevenzione di rigetto dopo trapianto di rene, cuore, fegato unica terapia efficace in casi di rigetto steroidi resistenti ANTICORPI MONOCLONALI OKT3 Muromonab CD-3 Effetti indesiderati: immunogenicità (prod. di “versioni” umanizzate, es HuOKT3 g1(AlaAla)) aumento incidenza infezioni sindrome da rilascio di citochine ANTICORPI MONOCLONALI Abciximab (REOPRO) Anti-integrine (molecole di adesione) Antiglicoproteina IIb/IIIa Monoclonale chimerico per la prevenzione della riocclusione coronarica dopo angioplastica Rituximab monoclonale chimerico che lega l’antigene CD20 su linfociti normali e maligni, Linfoma NH ANTICORPO CHIMERICO (anti CD-20) ANTICORPI MONOCLONALI Trastuzumab (Herceptin, Genentech) anticorpo umanizzato anti HER2 (epidermal growth factor receptor 2) approvato per cancro metastatico alla mammella con sovraespressione di HER2 ANTICORPI MONOCLONALI Trastuzumab (Herceptin, Genentech) effetti indesiderati: flu-like syndrome, nausea, vomito, insonnia, suscettibilità ad infezioni; in combinazione con chemioterapici può dare cardiotossicità, leucopenia, anemie SINDROME DA CITOCHINE CYTOKINE SYNDROME Sindrome acuta a carattere febbrile, che si verifica dopo una o poche somministrazioni di citochine impiegate nella terapia di varie patologie CYTOKINE SYNDROME - MECCANISMO E MANIFESTAZIONI CLINICHE I Le citochine agiscono da “superantigene” attivando una frazione elevata di cellule T periferiche Ondate successive di citochine sono prodotte, con un ruolo centrale per TNFa Sintomi lievi: a carattere influenzale con leggera febbre nelle prime 2-3 ore dalla somministrazione Di media severità: Lieve broncospasmo e/o ipotensione con liberazione periferica di citochine (misurabili) CYTOKINE SYNDROME - MECCANISMO E MANIFESTAZIONI CLINICHE II Sintomi di elevata gravità Grave febbre, broncospasmo, collasso Manifestazioni biochimiche aumento di creatinina, azotemia e bilirubina, TNF, IL6 e recettori solubili IL2, CD25, LPB; Aumento periferico di cellule NK e linfocitosi Nel caso di trattamenti anti-CD3 (muromonab) produzione di anticorpi anti-murini SINDROME DA CITOCHINE: ESPRESSIONE DIPENDENTE DA T LINFOCITI Espressione da parte di mononucleati Tipo 1 (Th1): aumento di IL-2, TNFa-b, IFN-g, immunità cellulo-mediata ed effetti protettivi fagocitodipendenti Tipo 2 (Th2): aumento IL-4,-5,-10,-13: produzione di anticorpi, attivazione di eosinofili, inibizione di attività macrofagica (effetti fagocitoindipendenti) Sindrome da citochine - I meccanismi Meccanismo molecolare Attivazione da parte di IFNg + TNFa della iNOsintasi (iNOs) Potenziamento di stress ossidativi endocellulari, inibizione del metabolismo energetico, citotossicità. In vitro a livello cardiaco iNOs aumenta liberazione di CPK (creatinfosfochinasi) Aggiunta di L-NMMA al medium di cultura blocca iNOS e riduce la tossicità da TNFa +IFNg ESPERIENZA CLINICA DI TOSSICITA’ DI CITOCHINA -I OKT3 umanizzato (hOKT3g4) (Richards et al, Cancer Res 59: 2096, 1999) Umanizzazione di muromonab-CD3 impiegato nel rigetto di trapianto (limiti per la formazione di anticorpi) OKT3g4 è modificato per Igg4HC e Ig light chain per sede antigenica simile ad OKT3 murino ESPERIENZA CLINICA DI TOSSICITA’ DI CITOCHINA -II Fase I: infusione i.v. 10 min ogni 2 settimane da 50 a 1600 g per iniezione, 6 per gruppo Aumento progressivo di febbre, max 8001600 g Aumento di recettori solubili IL2 (max 1600) e concentrazioni di IL6 (max 1600) CYTOKINE SYNDROME -FEVER AFTER hOKT3g4 CYTOKINE SYNDROME - Increased soluble IL-2 R after hOKT3g4 CYTOKINE SYNDROME Increased IL-6 after hOKT3g4 CYTOKINE SYNDROME - hOKT3 100 g - leggera febbre e cefalea in un paziente; nessuna tossicità 200-400 g - febbre, cefalea, nausea e rigidità 800 g - tutti febbre e nausea variabile; 3 rigidità ; 1 dispnea con richiesta di O2 1600 g (5 pazienti) - 2 gravi episodi di dispnea, 1 con rigidità e grave cefalea massima dose tollerata 800 g CYTOKINE SYNDROME POSSIBILITA’ DI TRATTAMENTO Sintomatica: Difenidramina e/o paracetamolo Mannitolo, antiossidante Pentoxifillina: teofillinico ad azione vasodilatatrice ed antagonista delle citochine, sopprime trascrizione di TNF SINDROME DA CITOCHINE DA PERFUSIONE CON rTNFa E MELFALAN Perfusione di arto con rhTNF-a melfalan: trattamento di sarcomi e Nel 12-29% dei casi sindrome da citochine con ipotensione e aumento circolante di IL-1, IL-6 e lipopolysaccharide binding protein (LPB) Protocollo di trattamento contemporaneo con pentossifillina 7.5 mg/kg/h Ohemberg et al, Ann Surg Oncol 10, 562, 2003 TRATTAMENTO DI S. DA CITOCHINE CON PENTOSSIFILLINA Ohemberg et al, Ann Surg Oncol 10, 562, 2003 TRATTAMENTO DI S. DA CITOCHINE CON PENTOSSIFILLINA TRATTAMENTO DI S. DA CITOCHINE CON PENTOSSIFILLINA Ohemberg et al, Ann Surg Oncol 10, 562, 2003
Scarica