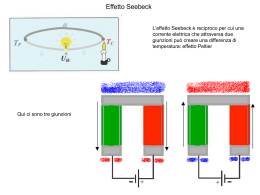
Gruppo eme in rosso Mioglobina di capodoglio 153 aa 8 segmenti ad alfa-elica indicati con le lettere da AaH Catena beta dell’emoglobina Mioglobina 146 aa 153aa 1,3,5,8 metil 2,4 vinil 6,7 propionato Sostituenti sui carboni degli anelli pirrolici nella protoporfirina IX Protoporfirina IX + ferro = eme (ferroprotoeme) Istidina prossimale (Istidina F8) La chimica dei composti di coordinazione, è la branca della chimica che studia gli ioni complessi, cioè delle molecole in cui un catione metallico è coordinato (cioè legato con un particolare legame chimico) ad atomi, ioni o molecole con un numero di legami superiore il suo numero di ossidazione. Uno ione complesso è costituito da un atomo metallico centrale, con carica positiva, che coordina attorno a sé, secondo definite geometrie, un numero definito di molecole polari o di anioni (leganti). I composti di coordinazione sono quei composti in cui un atomo centrale forma un numero di legami (sigma) maggiore del suo numero di ossidazione ; tali composti presentano un atomo o uno ione metallico come atomo centrale. I termini complesso metallico o complesso vengono talvolta impiegati come sinonimi di composto di coordinazione ma dovrebbero essere usati solo per indicare l’insieme (messo tra parentesi quadre) costituito dall’atomo metallico centrale e dalle molecole o ioni a lui coordinati. Ad esempio lo [Ni (NH3)6]2+ è il complesso mentre [Ni (NH3)6]Cl2 è il composto di coordinazione. Nel complesso si possono individuare due componenti distinte, l’atomo centrale (metallo) e gli atomi con i gruppi a cui appartengono legati ad esso. Gli atomi che si legano all’atomo centrale si dicono atomi donatori: le molecole o gli ioni a cui appartengono gli atomi donatori si dicono leganti. I legami covalenti in cui la coppia di elettroni condivisa è fornita da un solo atomo si chiamano legami covalenti coordinativi o legami dativi Istidina prossimale (Istidina F8) Nell'emoglobina deossigenata il ferro è penta-coordinato con i quattro azoti pirrolici della porfirina e l'azoto imidazolico dell'istidina prossimale. Gli orbitali d del ferro non sono energicamente equivalenti a causa della loro diversa orientazione rispetto agli orbitali degli atomi del complesso. I cinque orbitali d si separano su due livelli energetici indicati con eg e t2g. Per la deossiemoglobina la differenza di energia che separa tali livelli (∆0) è inferiore a quella necessaria per accoppiare gli elettroni, quindi i primi cinque elettroni occupano, con spin parallelo, i cinque orbitali d e solo il sesto elettrone è forzato ad appaiarsi (configurazione ad alto spin). Nella ossiemoglobina il ferro è esa-coordinato e il legame addizionale di una molecola di ossigeno provoca un aumento di ∆0 e di conseguenza i sei elettroni d si appaiano ai tre livelli inferiori (configurazione a basso spin). L'ossigenazione dell'emoglobina comporta quindi un passaggio del ferro da alto a basso spin con variazione delle caratteristiche spettrali e paramagnetiche Carbon monoxide consists of one carbon atom and one oxygen atom, connected by a triple bond which consists of two covalent bonds as well as one dative covalent bond. Resonance structures of carbon monoxide In biology, carbon monoxide is naturally produced by the action of heme oxygenase 1 and 2 on the heme from hemoglobin breakdown. This process produces a certain amount of carboxyhemoglobin in normal persons, even if they do not breathe any carbon monoxide. Following the first report that carbon monoxide is a normal neurotransmitter in 1993, as well as one of three gases that naturally modulate inflammatory responses in the body (the other two being nitric oxide and hydrogen sulfide), carbon monoxide has received a great deal of clinical attention as a biological regulator. In many tissues, all three gases are known to act as anti-inflammatories, vasodilators and promoters of neovascular growth deossiemoglobina ossiemoglobina Y145 deossiemoglobina Forma T ossiemoglobina Forma R Y145 The effect of replacing the proximal histidine in hemoglobin with a glycine residue and adding a noncovalently bonded imidazole. Adapted from D. Barrick et al., Nature Struct. Biol. (1997) 4:78-83.
Scarica