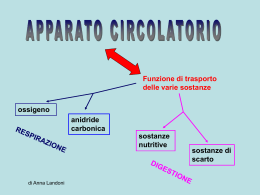
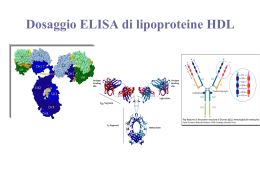
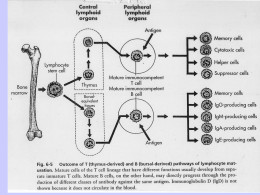
Immunologia Reazione Antigene-Anticorpo Immunocomplesso: reazione dell’antigene con il corrispondente anticorpo con formazione di un complesso tenuto insieme da legame chimico , non covalente che si forma tra i residui amminoacidici dell’Ag (antigene) e quelli del sito combinato dell’anticorpo. Tipi di legame : o Legame idrogeno : atomo di idrogeno è condiviso da due atomi elettronegativi o Legame elettrostatici : attrazione di carice elettriche di segno opposto o Forze di Van der Waals : movimento degli elettroni di una molecola che la inducono a comportarsi in maniera temporanea come un dipolo , attraendole molecole vicine o Legami idrofobici : determinati quando una molecola idrofobica si trova in acqua. Le molecole idrofobiche si aggregano per evitare il solvente. Reazione Antigene-Anticorpo Fattori che influenzano l’immunocomplesso: • Ph del mezzo • forza ionica • concentrazione dei due reagenti Affinita : somma algebrica delle forze attrattive e repulsive tra antigene ed anticorpo Avidità : insieme delle forze d’interazione tra i singoli siti combinatori dell’anticorpo e l’antigene Immunoprecipitazione Rappresenta la formazione di un complesso tridimensionale detto lattice che determina un precipitato visibile. Può essere utilizzata sia in modo qualitativo che quantitativo Precipitazione quantitativa Si ottiene facendo reagire quantità costanti di anticorpo con quantità crescenti d’antigene. La precipitazione è dovuta alla formazione di un reticolo di molecole antigene-anticorpo. Se riportiamo su coordinate cartesiane la quantità di precipitato in funzione della concentrazione crescente d’antigene, otterremo un curva in cui è possibile individuare tre zone : 1. zona d’eccesso dell’anticorpo : qui è inibita la precipitazione si ha un eccesso di anticorpo nel solvente 2. zona di equivalenza : qui la precipitazione è massima 3. zona d’eccesso dell’antigene : qui si ha l’inibizione della precipitazione si ha un eccesso di antigene nel solvente Reazione di precipitazione Le reazioni di precipitazione sono utilizzate per evidenziare la presenza dell’antigene oppure dell’anticorpo. Vengono utilizzati reazioni in mezzi semisolidi (agar) : Immunodiffusione doppia Metodo di Ouchterlony : viene utilizzato per la determinazione qualitativa tra gli antigeni, ossia se essi sono identici o se hanno in comune alcuni epitopi od al contrario se sono diversi . Il metodo consiste : 1. Si stratifica l’agar in capsule petri 2. Si praticano un determinato numero di pozzetti rotondi ad una determinata distanza gli uni dagli altri 3. Si aggiungono nei pozzetti adiacenti l’antigene o l’anticorpo e si lasciano diffondere l’uno verso l’altro 4. Si effettua la lettura Immunodiffusione doppia • Se gli antigeni sono identici : si forma una linea continua del precipitato • Se gli antigeni sono diversi : si hanno due linee di precipitato che si incrociano • Se l’antigene A possiede degli epitopi in comune con l’antigene B : si forma una linea di precipitato non continua Immunodiffusione radiale Viene detto anche metodo di Mancini . Usato per la determinazione quantitativa dei livelli delle immunoglobuline e dei componenti del complemento presenti sia nel siero che in altri liquidi. Il metodo consiste : • Stratificare l’agar in cui è stato aggiunto un antisiero specifico in piastre di petri • Si effettuano dei pozzetti • Si aggiunge l’antigene • L’antigene diffondendo dà origine ad un alone di precipitazione • Il diametro dell’alone è proporzionale alla concentrazione dell’antigene Immunoelettroforesi Metodo utilizzato per l’analisi delle proteine del siero . Essa si basa su una reazione di precipitazione preceduta da una migrazione elettroforetica del siero. Il metodo si basa : • Si stratifica l’agar su un vetrino porta oggetto • Si crea un pozzetto in cui si pone il siero da esaminare • Si applica un campo elettrico • Le proteine migreranno secondo la loro carica elettrica e la loro mobilità • Separate le proteine si pratica un altro pozzetto parallelo al senso di migrazione e vi si aggiunge l’antisiero • Si lascia diffondere l’antisiero • Nella zona di incontro tra antigene ed anticorpo si forma la banda di precipitazione Western Blot ( Immunoblot ) Questo metodo viene utilizzato per identificare e caratterizzare gli Ag sia nella ricerca sia nella clinica. Il metodo consiste nel : • Separare gli antigeni attraverso l’utilizzo di un gel di poliacrilammide • Trasferire il gel su una membrana di nitrocellulosa • Aggiungere un anticorpo specifico per l’Ag ricercato marcato con un marcatore enzimatico • L’anticorpo si collocherà solo dove la reazione sarà avvenuta permettendo di analizzare con facilità la quantità e la presenza dell’Ag • In alternativa può essere utilizzato un anticorpo marcato con un tracciante radioattivo. Western Blot ( Immunoblot ) Agglutinazione L’interazione tra un anticorpo e un antigene corpuscolato ( presente su batteri, eritrociti, leucociti, ecc) determina la formazione di aggregati visibili, definita agglutinazione. L’anticorpi in questo caso prenderanno il nome di agglutinine. Possiamo distinguere : • agglutinazione batterica : per individuare la presenza nel siero di anticorpi specifici contro i batteri • agglutinazione passiva :per individuare anticorpi specifici contro antigeni solubili ( proteici, polisaccaridi , apteni ) adsorbiti a biglie di lattice ,usate come matrici per la reazione di agglutinazione • titolo anticorpale del siero : serve a valutare la quantità di anticorpo presente in un antisiero Titolo anticorpale del siero Modalità di esecuzione : • si aggiunge ad una serie di provette un ugual volume di d’anticorpo a diluizione crescente • si aggiunge una quantità costante di antigene corpuscolato • si lascia incubare e si attende l’agglutinazione • l’ultima reazione in cui avviene l’agglutinazione viene chiamata titolo del siero • nella prima fase l’anticorpo si lega agli antigeni situati nella membrana delle cellule • nella seconda le cellule rivestite dall’anticorpo si legano l’una con l’altra formando aggregati tridimensionali. Inibizione dell’agglutinazione E’ un saggio altamente sensibile per evidenziare piccole quantità di Ag ( es. droghe) oppure per determinare se un soggetto è stato esposto ad alcuni virus che causano l’agglutinazione dei globuli rossi ( es. rosolia , influenza, ecc) In pratica se nel siero del paziente sono presenti Ab contro un virus , essi reagiranno con questo, quindi il virus non sarà più in grado di agglutinare i globuli rossi aggiunti in un secondo momento Le reazioni d’agglutinazione sono utilizzate anche per determinare i gruppi sanguigni di un paziente (emoagglutinazione) oppure per ricercare un anticorpo legato ad un antigene ( test di Coombs). Emoagglutinazione Viene utilizzata per determinare il gruppo sanguigno utilizzando anticorpi anti-A, anti-B, anti-AB Test di Coombs Si basa sull’utilizzo del siero di Coombs, ossia l’utilizzo di gammaglobuline eterologhe (anti-immunoglobuline) ottenute immunizzando un coniglio o una capra con immunoglobuline umane. Si possono distinguere : • Test diretto : si esegue per evidenziare gli anticorpi incompleti legati alle emazie del soggetto ,presenti in seguito a : • malattie emolitiche nel neonato • anemia emolitica autoimmune • reazioni trasfusionali • sensibilizzazione a farmaci • Test indiretto : si esegue per la determinazione degli autoanticorpi anti-IgG nel siero del paziente in esame. Si ricercano in particolare le eventuali emolisine nel sangue materno in caso di gravidanza a rischio (per malattia emolitica nel neonato). Test di Coombs diretto • I globuli rossi del paziente vengono lavati per allontanare le IgG non legate alla membrana • I globuli rossi vengono posti direttamente a contatto con il siero di Coombs • Si stabilisce cosi se i globuli rossi sono stati ricoperti in vivo da IgG , come accade nelle malattie emolitiche autoimmuni • Test positivo : le emazie agglutinano , significa che gli Ab del coniglio si sono legati agli Ab adesi sulla membrana degli eritrociti . Test di Coombs indiretto • Gli eritrociti vengono lavati per rimuovere le IgG non legate alle membrane . • Si incubano i globuli rossi del paziente o degli eritrociti compatibili con il siero del paziente e successivamente con il siero di Coombs. • Il test viene detto indiretto perche il siero del paziente è incubato con eritrociti normali per far aderire gli eventuali anticorpi anti-eritrocitari. • Test positivo : i globuli rossi agglutinano , quindi nel siero testato vi è la presenza di Ab. Immunoflorescenza Permette di legare ad alcuni anticorpi delle sostanze fluorescenti , senza alterarne la capacità di legarsi agli antigeni Le sostanze fluorescenti in questione sono : • La fluorosceina • La rodamina Le sostanze fluorescenti coniugate agli anticorpi possono evidenziare al microscopio a fluorescenza la presenza di : • Antigeni di superficie di cellule viventi in sospensione • Antigeni presenti nel citoplasma • Antigeni presenti nei nuclei Il metodo viene utilizzato per identificare : • • • • • • fenotipi cellulari i componenti del complemento antigeni tissutali antigeni tumorali batterici virali Immunoflorescenza diretta ed indiretta Esistono due metodi : • Metodo diretto : l’anticorpo specifico coniugato al fluorocromo si fa direttamente aderire agli antigeni cellulari • Metodo indiretto : l’anticorpo specifico ( anticorpo primario) non coniugato si fa aderire agli antigeni cellulari , in una seconda fase , si aggiunge un anticorpo anti- anticorpo primario, coniugato con il fluorocromo. FACS ( fluorescence- activated cell sorter ) Si basa sul principio della citometria a flusso . Viene utilizzato un raggio laser e un rivelatore di luce per contare le cellule FACS ( fluorescence- activated cell sorter ) La citometria a flusso si basa sul seguente principio: • Un campione, contenente le cellule,è incubato con un Ab monoclonale marcato con un fluorocromo • Le cellule che hanno legato ai loro antigeni di membrana l’Ab fluorescinato vengono eccitati dal raggio laser ed emettono la luce • Il rilevatore della luce misura sia la grandezza sia il numero delle cellule che hanno legato l’Ab marcato • Un computer analizza questi parametri e crea un diagramma in cui sono riportate il numero delle cellule e la loro tipologia RIA ( saggio radioimmunologico) E’ una tecnica molto sensibile che può rivelare la presenza di un antigene o di un anticorpo a concentrazioni inferiori a 0,001 pg/ml. Il test RIA si basa sulla competizione tra un antigene radio marcato ed uno non marcato per un anticorpo specifico ad alta affinità. L’antigene è marcato generalmente con piccole quantità di un isotopo radioattivo ( per es. I251 ) che emette raggi gamma ( g ) RIA ( saggio radioimmunologico) • Se si vuole determinare la concentrazione di un antigene X , presente nel siero , lo si purifica e lo si marca con I 251 • Si allestiscono una serie di provette contenenti una quantità costante d’antigene X radiomarcato e di anticorpi anti-antigene X • Si aggiunge una quantità crescente del siero in esame , in cui è presente l’antigene da testare. • L’anticorpo si può legare sia all’antigene marcato sia all’antigene non marcato, quindi i due tipi d’antigene competono per legare l’anticorpo. • Si misura con un contatore gamma la quantità d’antigene marcato rimasto in soluzione e quindi per differenza si può determinare la concentrazione di antigene non marcato. ELISA ( enzyme-linked immunosorbent assay) E’ una tecnica simile al RIA ma è più sicuro è meno costoso Viene utilizzata per evidenziare la reazione antigene -anticorpo Si utilizza un marcatore enzimatico contrariamente al RIA in cui si utilizza un marcatore radioattivo Sono impiegati vari enzimi tra cui : • la b-galattosidasi •La fosfatasi alcalina •La perossidasi di rafano Il test si basa sul fatto che un enzima coniugato ad un anticorpo reagisce con un substrato incolore, detto substarto cromatogenico, e dà origine a un prodotto di reazione colorato. L’intensità del colore è proporzionale alla quantità d’anticorpo marcato che si lega all’antigene. ELISA (metodo indiretto) Viene utilizzato per determinare la quantità di anticorpi. Si basa sul seguente procedimento: • In un micropozzetto ricoperto d’antigene si aggiunge il campione da analizzare ( siero o un altro campione , in cui è presente l’anticorpo da testare, detto Ab primario e lo si lascia reagire con l’antigene. • Si aggiunge un anticorpo secondario anti-Ab primario, coniugato ad un enzima. • Si lava via l’Ab secondario libero e si aggiunge il substrato per l’enzima. • La quantità di prodotto di reazione colorato, che si forma , viene valutata mediante speciali lettori spettrofotometrici • I lettori spettrofotometrici possono misurare l’assorbanza di una piastra a 96 pozzetti . ELISA (metodo indiretto) Il test ELISA è utilizzato anche per determinare la presenza di anticorpi sierici diretti contro il virus dell’immunodeficienza umana ( HIV), antigene eziologico dell’ AIDS. In questo caso le proteine ricombinanti dell’involucro e del core dell’HIV (Ag) vengono adsorbite nei micropozzetti. E’ possibile evidenziare la presenza di anticorpi sierici diretti contro l’HIV, mediante l’ELISA indiretto , entro 6 settimane dall’infezione ELISA (a sandwich) Viene utilizzato per determinare la quantità dell’antigene. ELISA sandwich : • il micropozzetto è ricoperto con l’anticorpo primario • Viene aggiunto il campione contenente l’antigene da misurare • Dopo un periodo di incubazione si aggiunge un anticorpo specifico per l’antigene coniugato con un enzima. • Si lava via l’Ab secondario libero e si aggiunge il substrato dell’enzima. • L’intensità del colore è proporzionale alla quantità di anticorpo secondario marcato che si lega all’antigene, e quindi alla concentrazione dell’Ag. ELISA (competitivo) ELISA competitivo : • E’ un test di inibizione la concentrazione dell’Ag è inversamente proporzionale al colore sviluppato. • Si incuba l’anticorpo primario con il campione contenente l’Ag da misurare • Si aggiunge la miscela Ag-Ab formatasi ai micropozzetti contenenti l’Ag. • Maggiore è la quantità di Ag, presente nel campione , minore sarà la quantità di anticorpo primario libero. • Si aggiunge l’anticorpo secondario, specifico per l’Ab primario, coniugato con un enzima. • Dopo aver lavato via l’Ab secondario si aggiunge il relativo substrato e si misura il prodotto di reazione colorato Complemento • E’ formato da un complesso sistema multifattoriale, costituito da oltre 20 proteine sieriche , che ha la funzione di distruggere i batteri tramite la lisi o la fagocitosi. • Soggetti affetti da deficit quantitativo o funzionale del complemento pur avendo livelli normali di Ig, sono particolarmente esposti a ripetute infezioni. • Le molecole del complemento si trovano nel sangue o nei liquidi biologici, in forma inattiva finche non sono attivati da microrganismi o altri fattori. • Il meccanismo di attivazione è un meccanismo a cascata, in cui il primo elemento agisce sul successivo , rendendolo attivo e quindi capace di agire sull’elemento successivo. • L’attività è localizzata nella zona d’innesco con una emivita degli elementi di un millesimo di secondo. • Le molecole del complemento sono indicate con una numerazione , che va da C1 al C9 , oppure con le lettere maiuscole (B,D,P). • I frammenti derivati dalla molecola che ha subito l’azione enzimatica dell’elemento che lo precede nella cascata, sono indicati con le lettere minuscole (es. C5a, C5b) . • Il meccanismo terminale dell’azione del complemento è la formazione di un “complesso litico”, detto complesso d’attacco alla membrana (MAC), costituito dai fattori che vanno dal C5 al C9. Complemento Il sistema del complemento può essere attivato , nelle sue fasi iniziali fino al fattore centrale C3 , mediante 3 vie : • Via classica : viene attivata dall’interazione fra l’ immunocomplesso ( formato da antigeni ed anticorpi delle classi IgG ed IgM ), oppure fra complessi formati da Ig aggregate o denaturate, e il primo componente , il C1q. • Via alternativa o properdinica : viene attivata dalla presenza di particolari prodotti d’origine batterica o virale, che interagiscono con il componente C3 . Viene innescata in assenza di anticorpi. • Via lectinica : attivata dall’interazione tra una proteina della fase acuta (lectina legante il mannosio, MBL) e i residui di mannosio, presenti nelle glicoproteine o carboidrati della superficie dei microrganismi. Complemento I fattori del complemento svolgono molteplici funzionalità biologiche : • La capacità di lisi : delle membrane cellulari , batteriche e dell’involucro lipoproteico di alcuni virus per azione del complesso litico (C5b-C9) • La capacità della risposta infiammatoria : mediante liberazione di sostanze ad azione anafilattica (vasoattiva) e chemiotattica, che favoriscono il richiamo locale di cellule fagocitanti (C3a, C5a) • L’opsonizzazione : delle cellule capaci di fagocitosi (C3b,C4b) • La rimozione degli immunocomplessi : avviene tramite il legame tra un frammento del complemento (C3b) e i recettori presenti su alcune cellule. Via classica • Il primo fattore attivato è C1 . • Il fattore C1 è costituito da un complesso tri-molecolare di 750 kDa legato in maniera non covalente , C1q, C1r, C1s , in un rapporto molare di 1/2/2 (C1qr2s2). • C1q è una proteina complessa, ricca in idrossiprolina, idrossilisina e glicina che per le sue caratteristiche elettroforetiche presenta delle analogie con le Ig, mentre per la sua struttura amminoacidica ricorda le proteine del collagene. • La molecola C1q è costituita da 6 unità ognuna costituita da tre distinte subunità A,B,C • E’ possibile distinguere una parte centrale compatta , che lega C1r e C1 s , ed una struttura più esterna che termina con una forma a calice. • La struttura a calice svolge la funzione di riconoscere e legare particolari siti presenti nelle Ig, i quali si evidenziano durante la formazione dell’immunocomplesso. • La sub-unità C1q si deve legare ai domini CH2 di almeno due anticorpi IgG adiacenti . • La sub-unità C1q si può legare ad un solo anticorpo IgM perche dotato di molti domini CH3. • Esistono 4 sottoclassi di IgG nell’uomo ciascuna delle quali ha una differente affinità per C1q. La più affine è IgG3 , seguita dall’IgG1 e IgG2 mentre l’IgG4 non attiva il complemento. Via classica •C1s inattivo ha un peso molecolare intorno a 90 kDa ed è costituito da una sola catena polipeptidica •L’attivazione di C1s comporta la formazione di due catene una più grande (a) ed una più piccola (b) , in cui si trova il sito enzimatico necessario per l’attivazione dei componenti successivi . • L’attività enzimatica è di tipo serino-esterasi, ed agisce su due substrati C4 e C2 che vengono scissi rispettivamente in C4a e C4b , e in C2a e C2b dando origine al complesso C4b2a, denominato C3 convertasi che ha la capacità di attivare il fattore C3. Via classica meccanismi di controllo Le reazioni che caratterizzano la via classica sono soggette al controllo di diverse proteine solubili quali : • C1 inibitore ( C1 INH ) : questo fattore agisce su C1, bloccando l’attività enzimatica di C1s ( edema angioneurotico , dipende dall’assenza di questo fattore) • C4bp ( C4 binding protein) : questo fattore si lega al C4b, bloccando la formazione del complesso C4b2a e permettendo , cosi, il legame del fattore H, capace a sua volta di inattivare , oltre che il C3b, anche il C4b. • Fattore I : questo fattore inattiva il C3b, formando il C3b inattivo (iC3b). Questi meccanismi sono necessari per mantenere gli effetti dell’innesco della cascata del complemento solamente a livello del sito d’attivazione. Via alternativa • La via alternativa differisce dalla via classica essenzialmente per due motivi: • viene attivata in assenza di anticorpi • inizia dal componente C3 • Costituisce un meccanismo di difesa anti-infettiva aspecifico ed immediato • Può essere innescata da diverse sostanze : • lipolisaccaride (LPS) dei batteri gram-negativi • endotossine batteriche • particelle virali • Va tenuta in considerazione che il componente C3 và in contro ad una lenta scissione spontanea perche presenta al suo interno un legame molto instabile , un legame tioestere. • Il C3 formatosi , alla presenza dei fattori d’iniziazione lega la proteina B, e forma il complesso C3bB. • Se C3b non si lega alle strutture estranee viene trasformato in una molecola inattiva, il iC3b, importante per l’ opsonizzazione. Via alternativa • La proteina (fattore) B, una volta inserita nel complesso, è scissa dalla proteina D in Bb e Ba. • Il complesso attivo C3bBb ( C3 convertasi della via alternativa) , potenziato dalla properdina (P) , è capace di scindere il C3 in C3a e C3b. • C3b può rientrare nel ciclo, generando un meccanismo d’amplificazione del sistema , oppure legarsi al complesso precedente e dare origine, cosi , alla C5 convertasi della via alternativa (C3bBbC3b) • La via alternativa è regolata dall’azione di due proteine solubili: • la proteina H: fattore di controllo anche nella via classica . Si lega al C3b della C3 convertasi occupando il posto di Bb, bloccando , cosi, la successiva attivazione della cascata complementare. • il fattore I : cliva il C3b, legato al fattore H, in iC3b, C3c e C3d. Via lectinica •Viene attivata in assenza di Ab . •E’ un meccanismo di difesa aspecifico •Viene indicata come MBL , ossia la via della lectina legante il mannosio •La sua attivazione dipende dal riconoscimento non specifico di sostanze estranee (carboidrati). •Presenta analogie strutturali alla via classica. •La MBL è simile al C1q, infatti dopo che si è legata ad un microrganismo si unisce, per formare un complesso attivo , ad un enzima , detto MASP (MBL-associated serineprotease) , che è simile al C1r e al C1s della via classica. •Il complesso MBL-MASP cliva il C4 e il C2 e porta alla formazione di una C3 convertasi che ha come conseguenza la formazione della C5 convertasi. Formazione del complesso d’attacco alla membrana ( MAC ) La C5 convertasi provoca la scissione del C5 in C5a e C5b. La C5a liberato contribuisce con le sue capacità anafilattiche e chemiotattiche alla risposta infiammatoria locale La C5b si lega al C6 e al C7 per formare il complesso C5b-7, che presentano la capacità di legarsi alle membrane biologiche. Il complesso C5b-7 lega una molecola del fattore C8 e circa 10 molecole di C9, formando il complesso d’attacco alla membrana (MAC), il C5b-9. Il complesso d’attacco alla membrana (MAC) ha attività litica sulle membrane, causando la formazione di pori di circa 10 nm di diametro Attraverso i pori avviene il passaggio d’acqua e di Sali che portano alla lisi osmotica della cellula o del microrganismo. La proteina S si lega al complesso C5b-9, la quale blocca l’attività di lisi e quindi regola l’attività biologica del MAC. Fattori regolatori Esistono molecole di membrana ad attività regolatoria tra cui: • fattore accellerante il decadimento ( DAF) e la proteina cofattore di membrana (MCP), che agiscono sulla C3 convertasi della via classia e della via alternativa. • fattore di restrizione omologa (HRF) e l’ inibitore di membrana della reazione di lisi (MIRL/CD59), che lega il complesso C5b-8 e blocca il legame del C9 alle cellule autologhe.
Scarica