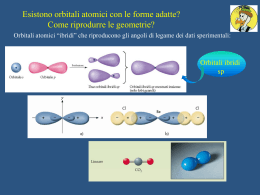
Cenni sul Metodo V.B. Stefano Vecchio Università “La Sapienza” di Roma E-mail: [email protected] Premessa La struttura delle molecole è nota a priori, perché è determinata sperimentalmente Il metodo VB è collegato al concetto di accoppiamento elettronico, con ogni coppia di elettroni che lega i due nuclei Quando due atomi si avvicinano per formare un legame l’energia elettronica si modifica ed entrano in gioco forze elettrostatiche: attrazione e-p e repulsione p-p Un incremento della densità di carica elettronica, nella regione internucleare, favorisce la formazione del legame Il metodo VB Nel metodo VB ciascuna funzione d’onda che rappresenta l’atomo centrale è costituita da una combinazione lineare di orbitali atomici (OA) detti orbitali ibridi (OI) Gli OA non sono adeguati a descrivere la realtà di questi aggregati di atomi in quanto descrivono il comportamento dei singoli atomi isolati La difficoltà di rappresentare la molecola reale attraverso un modello costituito da un’unica struttura con legami convenzionali è risolta con l’introduzione del concetto di risonanza La molecola è rappresentata con una funzione ottenuta con una combinazione lineare delle che rappresentano tutte le strutture ipotizzabili Ibridazione Sperimentalmente si osserva che : i) CO2 ha una struttura lineare (con angoli di legame OCO di 180°) ii) H2CO3 ha una struttura planare (con angoli di legame OCO di 120°) iii) CH4 ha una struttura tetraedrica (con angoli di legame HCH di circa 109°) Lo stato fondamentale degli elettroni di legame dell' atomo di C è rappresentato dalla configurazione esterna 2s22p2. 2s e 2p sono orbitali che rappresentano due soluzioni matematiche dell' equazione di Schrödinger. Combinazioni lineari di soluzioni di una equazione differenziale possono rappresentare soluzioni della stessa equazione. Ibridazione CO2 ha una struttura lineare (con angoli di legame OCO di 180°) Ibridazione CO2 ha una struttura lineare (con angoli di legame OCO di 180°) Al posto dello stato fondamentale si considera uno stato eccitato nel quale tutti gli elettroni sono spaiati: Ibridazione CO2 ha una struttura lineare (con angoli di legame OCO di 180°) Al posto dello stato fondamentale si considera uno stato eccitato nel quale tutti gli elettroni sono spaiati: E da questo si considerano 2 OA per ottenere 2 OI (sp): Ibridazione H2CO3 ha una struttura planare (con angoli di legame OCO di 120°) Ibridazione H2CO3 ha una struttura planare (con angoli di legame OCO di 120°) Al posto dello stato fondamentale si considera uno stato eccitato nel quale tutti gli elettroni sono spaiati: Ibridazione H2CO3 ha una struttura planare (con angoli di legame OCO di 120°) Al posto dello stato fondamentale si considera uno stato eccitato nel quale tutti gli elettroni sono spaiati: E da questo si considerano 3 OA per ottenere 3 OI (sp2): Ibridazione CH4 ha una struttura tetraedrica (con angoli di legame HCH di circa 109°) Ibridazione CH4 ha una struttura tetraedrica (con angoli di legame HCH di circa 109°) Al posto dello stato fondamentale si considera uno stato eccitato nel quale tutti gli elettroni sono spaiati: Ibridazione CH4 ha una struttura tetraedrica (con angoli di legame HCH di circa 109°) Al posto dello stato fondamentale si considera uno stato eccitato nel quale tutti gli elettroni sono spaiati: E da questo si considerano 4 OA per ottenere 4 OI (sp3): Esempi NH3 con il metodo VB Esempi NH3 con il metodo VB Si parte dallo stato fondamentale di N: Esempi NH3 con il metodo VB Si parte dallo stato fondamentale di N: Si utilizzano tutti gli OA per ottenere altrettanti OI 4 OI sp3 3 elettroni spaiati su 3 OI Per 3 legami s Esempi HNO3 con il metodo VB Esempi HNO3 con il metodo VB Si parte dallo stato fondamentale di N: Esempi HNO3 con il metodo VB Si parte dallo stato fondamentale di N: N non può formare 5 legami perché gli orbitali d non possono essere usati dagli elementi del secondo periodo E’ necessario ipotizzare la cessione di un elettrone da parte di N ad uno degli O, che diventa O– La configurazione di N+ sarà utilizzata per ottenere 3 orbitali ibridi sp2: E’ necessario ipotizzare la cessione di un elettrone da parte di N ad uno degli O, che diventa O– La configurazione di N+ sarà utilizzata per ottenere 3 orbitali ibridi sp2: N+ 3 elettroni spaiati daranno 3 legami s e il quarto che giace su un orbitale non ibrido darà luogo al legame p (vedi figura a sinistra). Esempi H2SO4 con il metodo VB: Esempi H2SO4 con il metodo VB: S 4 ibridi sp3 Esempi H2SO4 con il metodo VB: S 4 ibridi sp3 I 2 elettroni su orbitali non ibridi sono impiegati per i 2 legami p. Provate a re-interpretare le seguenti strutture con il metodo VB (indicando l’ibridazione dell’atomo centrale) H2S (sapendo che S è al centro di un tetraedro distorto e che S ha 2 coppie solitarie) BeH2 (sapendo che si tratta di una molecola lineare) BCl3 (sapendo che il B è al centro di un triangolo equilatero) PCl5 (sapendo che P è al centro di una bipiramide a base triangolare) SF6 (sapendo che S è al centro di un ottaedro, cioè di una bipiramide a base quadrata)
Scarica