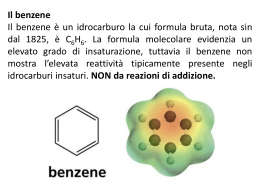
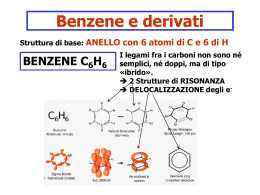
Benzene C6H6: il sogno di A. Kekulé (fu davvero un sogno ?) ENTALPIA DI IDROGENAZIONE La completa delocalizzazione dei sei elettroni in un unico orbitale contenente sei elettroni è rappresentato graficamente con un anello interno all’esagono nei cui vertici sono collocati i sei atomi di carbonio. H H H H H a H b Il benzene risuona fra le due forme limite. Il passaggio dall’una forma all’altra si verifica per semplice spostamento di cariche elettriche. H H H H H H H H H H H H Il benzene non può essere considerato come se fosse un cicloesatriene a doppi legami coniugati. Se così fosse, si potrebbe calcolare con buona precisione l’energia scambiata durante il processo di riduzione a cicloesano (o di ossidazione a CO2 e acqua). Il calcolo invece dà un risultato che è di molto superiore al valore che si può sperimentalmente misurare. La differenza fra l’energia calcolata e quella misurata è dovuta alla particolare forma di risonanza che viene indicata con il termine di aromaticità. Orbitali molecolari ottenuti dalla “combinazione” dei 6 orbitali p non ibridi dei carboni benzenizi OM di antilegame OM di legame Composti aromatici policiclici benzene naftalene antracene fenantrene Nel benzene tutti gli atomi di carbonio hanno ibridazione sp2 degli orbitali di valenza. I sei orbitali pz paralleli non ibridati di ciascuno dei sei atomi di carbonio contengono un elettrone H H H H H H I 10 carboni del naftalene sono tutti ibridati sp2 e ciascuno di essi contribuisce con 1 elettrone alla aromaticità dell’idrocarburo FULLERENI A dispetto del fatto che gli atomi di carbonio sono tutti ibridati sp2 i fullereni non si comportano come sostanze aromatiche. I cicli a 6 termini non sono molecole realmente planari, vi sono tensioni strutturali, dovute alla particolare geometria spaziale. I fullereni danno reazioni di addizione non di sostituzione elettrofila. ETEROCICLICI AROMATICI furano piridina Benzene + Pirrolo tiofene pirrolo indolo imidazolo Pirimidina + Imidazolo purina Regola di Huckel per prevedere il comportamento aromatico di composti ciclici e-p = 4n + 2 n = serie dei numeri naturali (comprendendo lo 0) n 1 2 3 4 . . e-p 2 6 1 14 16 Esempi di composti non aromatici ciclooctatetraene ciclobutadiene ANNULENI (strani composti) Non aromatico Non aromatico pur obbedendo alla regola di Huckel e stabilizzato da una certa energia di risonanza La tendenza a preservare l’aromaticità o a guadagnarla è una caratteristica dei composti ciclici che permette di comprendere molte delle loro proprietà chimiche Il benzene ed in generale i composti aromatici danno reazioni di SOSTITUZIONE ELETTROFILA AROMATICA Meccanismo generale di sostituzione elettrofila aromatica addizione elettrofila eliminazione Carbocatione arilico stabilizzato per risonanza Perché un composto aromatico da reazioni di sostituzione e non di addizione come negli alcheni ? Nu- addizione En. di risonanza 4 Kcal/mole sostituzione Il nucleofilo si comporta da base En. di risonanza 36 Kcal/mole Esempi di reazioni di sostituzione elettrofila aromatica Nitrazione del benzene Meccanismo di nitrazione Formazione della particella elettrofila nitrobenzene Solfonazione del benzene Alogenazione del benzene Acido di Lewis Alchilazione del benzene (reazione di Friedel-Crafts) + HCl Acilazione del benzene (reazione di Friedel-Crafts) ione acilio + HCl Nel caso in cui il benzene è “sostituito”, qual è l’effetto del sostituente sulla reattività dell’anello aromatico? La reattività aumenta o diminuisce? La posizione occupata dal sostituente E2 è casuale? Effetti del sostituente I principali effetti “elettronici” che un sostituente può esercitare sull’anello aromatico sono di due tipi: MESOMERICO (o di risonanza) – si esercita attraverso gli elettroni p e può essere rappresentato da strutture di risonanza. • + m: quando il sostituente può trasferire elettroni p verso l’anello aromatico. • - m: quando il sostituente può estrarre elettroni p dall’anello aromatico. INDUTTIVO – si esercita attraverso elettroni s ed è causato dalle caratteristiche relative di elettronegatività. • + i: quando il sostituente può spingere elettroni s verso l’anello aromatico. • - i : quando il sostituente può attrarre elettroni s dall’anello aromatico. Effetto mesomerico +m -m L’ossidrile fenolico esercita effetto elettron-attrattore sull’anello ma, per l’effetto mesomerico, le posizioni meno impoverite di elettroni sono le posizioni orto e para. OH OH OH OH Il doppietto elettronico dell’azoto del gruppo amminico è delocalizzato nell’anello. Ciò produce due effetti: 1. le ammine aromatiche sono meno basiche delle ammine alifatiche, 2. La densità elettronica è maggiore nelle posizioni 2, 4 e 6 dell’anello che nelle posizioni 3 e 5. NH2 NH2 NH2 NH2 L’effetto elettron-attrattore e l’effetto mesomerico impoveriscono di elettroni sopratutto le posizioni 2,4 e 6 dell’anello aromatico. O N O O N O O N O O N O I gruppi alchilici legati al benzene aumentano la disponibilità di cariche elettriche negative delocalizzate nell’anello aromatico H H C H CH3 Effetto induttivo +i -i
Scarica