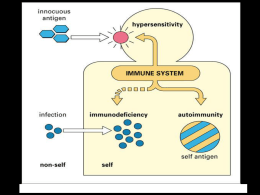
Malattie autoimmuni Le malattie autoimmuni sono forme morbose legate ad una disregolazione dei meccanismi di controllo della tolleranza nei confronti del self. Le risposte autoimmuni sono del tutto simili alle risposte ai patogeni ma in questo caso l’antigene che le attiva è un antigene self o autoantigene Quando sono attivate reazioni verso il self e non sono correttamente regolate possono causare una varietà di sindromi croniche chiamate malattie autoimmuni L’autoimmunità era stata chiamata da Paul Ehrlich horror autotoxicus L’incidenza delle malattie occidentali è del 5-7% autoimmuni nelle popolazioni Reazioni autoimmuni si possono verificare durante le normali risposte del sistema immunitario alle infezioni, tuttavia l’autoimmunità diventa malattia autoimmune quando porta a danni tissutali per l’organismo che ospita il processo. L’autoimmunità è una normale conseguenza riconoscimento MHC-ristretto del sistema immunitario del Una bassa rappresentanza di linfociti autoreattivi e di autoanticorpi è presente nell’organismo e può svolgere importanti funzioni fisiologiche Ad esempio il FATTORE REUMATOIDE (RF) riconosce immunoglobuline di classe G (IgG) aiuta la rimozione dal circolo di immunocomplessi potenzialmente pericolosi Gli anticorpi anti-idiotipo sono utili per la regolazione di risposte immunitarie eccessive Le malattie autoimmuni sono tradizionalmente suddivise in base ai bersagli dell’attacco del sistema immunitario. Se sono coinvolti antigeni espressi a livello di un particolare organo o ghiandola si parla di autoimmunità organo-specifica, come nel caso del Diabete Mellito, della Miastenia Grave, della Cheratite Erpetica Stromale. Se al contrario l’autoimmunità, non è limitata ad un singolo organo si parla di autoimmunità sistemica, come nel caso, del Lupus Eritematoso Sistemico e della Artrite Reumatoide. Figure 13-1 Molte malattie autoimmuni mostrano una certa frequenza tra i membri della stessa famiglia, questo suggerisce che la suscettibilità a tali malattie possa avere una base genetica Come i diversi geni contribuiscano allo sviluppo delle malattie autoimmuni non è noto. In genere sono coinvolti molteplici loci genici diversi In genere i diversi geni coinvolti hanno una penetranza bassa (non è infrequente trovare individui malati che non hanno le mutazioni o i polimorfismi genici associati con la malattia) quindi nessun gene può essere utilizzato come marker predittivo L’associazione di un dato allele con la malattia autoimmune si esprime in termini di RISCHIO RELATIVO IL rischio relativo misura l’incremento di frequenza di presentazione di una malattia negli individui con un determinato allele rispetto a quelli senza l’allele stesso In generale un rischio relativo maggiore di 1 indica l’associazione tra l’allele e la malattia.Più alto è il rischio relativo maggiore è l’associazione Spondilite anchilosante: Patologia infiammatoria che colpisce il sistema articolare della colonna vertebrale La patologia autoimmune può essere caratterizzata da: 1) produzione di anticorpi che reagiscono contro i tessuti dell’ospite; 2) produzione di cellule T effettrici che hanno reattività contro antigeni “self” dell’ospite. PATOGENESI DELLE MALATTIE AUTOIMMUNI Sia cellule che anticorpi possono mediare il danno tissutale I linfociti T possono funzionare da effettori direttamente responsabili del danno tissutale o come helper per la produzione di anticorpi Gli anticorpi possono attaccare i tessuti e gli organi bersaglio direttamente e attivare il complemento oppure possono formare immunocomplessi che precipitano nei piccoli vasi Nelle malattie sistemiche o non-tessuto specifiche è operante il meccanismo patologico anticorpo-mediato basato sulla formazione di complessi immuni Nelle malattie organo specifiche si osservano meccanismi patogenetici anticorpo- o cellulo-mediati diretti verso specifici antigeni espressi in specifici organi Il processo patologico comporta non solo una fase di riconoscimento specifico ma anche l’attivazione di funzioni effettrici verso il tessuto bersaglio esattamente come verso temibili patogeni estranei all’organismo In autoimmune diseases attributed to autoantibodies: Disease processes and tissue damage are due to Type II and Type III hypersensitivity reactions. In autoimmune diseases that have an autoreactive T cell component: Disease process and tissue damage due to Type IV hypersensitivity reactions. Type II Hypersensitivity Autoimmunity Autoimmune Diseases due to Type II Hypersensitivity Type III Hypersensitivity Autoimmunity Autoimmune Diseases due to Type III Hypersensitivity Type IV Hypersensitivity Autoimmune Diseases due to Type IV Hypersensitivity LUPUS ERITEMATOSO SISTEMICO La causa della malattia non è nota, più del 95% dei pazienti hanno alti titoli di Ig dirette contro componenti nucleari (anticorpi anti-nucleo, ANA) La deposizione dei complessi immuni a livello delle giunzioni dermoepidermiche provoca infiammazioni cutanee causate dall’attivazione del complemento Ipersensibilità di tipo III a livello di vari organi: reni, cuore, giunzioni articolari Eruzioni fotosensibili Artrite Reumatoide Malattia infiammatoria cronica con manifestazioni sistemiche ma che riguarda principalmente la sinovia articolare Ipersensibilità di tipo III Reattività dei linfociti CD4 Presenza di autoanticorpi denominati RF, anticorpi specifici per la porzione costante delle IgG SCLEROSI MULTIPLA Placche nel tessuto nervoso e nel midollo spinale, perdita di mielina. Il danno assonale interferisce con la trasmissione degli impulsi nervosi: perdita delle funzioni motrici, sensoriali, urinarie e gastrointestinali Attacco T-mediato del tessuto nervoso Figure 13-3 Figure 13-3 part 1 of 3 Miastenia Grave Una delle poche malattie autoimmunidi cui è noto l’autoantigene. E’ data dalla presenza di anticorpi che riconoscono il recettore per l’acetilcolina a livello della giunzione neuromuscolare. Bloccano il legame Ach-AchR e impediscono la trasmissione del segnale nervoso. Debolezza del movimento delle palpebre e nell’espressività facciale Debolezza degli arti e della muscolatura Il 60% dei casi mostra iperplasia del timo e il 10% timomi Etiologia ignota Forte associazione con HLA-D3, HLA-DQ2, HLAB8 Diabete Mellito Insulino-Dipendente Infiltrazione linfocitaria delle isole di Langerhans:insulite Molti gli autoantigeni Forte correlazione con alcuni HLA Causa ignota Tiroidite di Hashimoto Patologia infiammatoria caratterizzata dalla presenza del gozzo con o senza una diminuita produzione di ormoni tiroidei L’infiammazione è provocata da cellule Th1 con progressiva distruzione delle cellule follicolari tiroidee Un decremento della produzione degli ormoni tiroidei porta ad un aumento della produzione dell’ormone stimolante la tiroide (TSH) che stimola la proliferazione cellulare tiroidea (gozzo) Citochine, linfociti T citotossici e FAS-FASL sono tra le cause (non note)della distruzione della ghiandola Malattia di Graves Si instaura un ipertiroidismo e un gozzo dovuto a autoanticorpi stimolatori che si legano al TSHR Sono Ab IgG che legandosi ai recettori stimolano la crescita delle cellule folicolari tiroidee e incrementano la produzione di ormoni Proposed Mechanisms of Autoimmunity The cryptic bystander activation (C) describes theofnonspecific activation of self-reactive Th1 cells. The antigen modelmodel describes the initiation the autoimmune response by differential Activation of 2) and (1) theinterferons up-regulation of immune functions throughout processing of virus-specific self-peptides. Th1 Aftercells viral(1, infection to (IFNs) are secreted both by the tissue (3, 4) results in the increased infiltration of T cells to the site of infection and the activated virus-specific TH1 cells (2, 3) and virus-infected cells (4). This up-regulates the immune activationofofAPCs self-reactive Th1 cells by T-cell receptor (TCR)-dependent and TCR-independent functions (5) and can lead to APC engulfing self-peptides (6) (triangle). Cytokine activation mechanisms (5). Self-reactive T cells activated in this manner can then mediate self-tissue of APC can induce increased protease production and different processing of captured self-damage and further perpetuate the autoimmune (6). The presentation of these "cryptic" epitopes epitopes (triangle) resulting in "cryptic" response epitopes (star). can activate self-reactive Th1 cells (7) and lead to self-tissue destruction (8, 9). Of course, the abovedisplayed mechanisms are not mutually exclusive and the dotted arrows indicate some of the mechanistic intersection points that are possible. Molecular mimicry (A) describes the activation of cross-reactive TH1 cells that recognize both the In viral the epitope model (B), persistent viral infection (1) results in the activation ofin virus-specific epitopespread and the self-epitope (1). Activation of the cross-reactive T cells results the release of Th1 cells (2, 3), which mediate self-tissue damage (4) resulting in the release of self-peptides (5), which cytokines and chemokines (2) that recruit and activate resident and peripheral aremonocyte/macrophage engulfed by APCs and cells presented to self-reactive T-helper cells (sTH1) Continual damage and of that can mediate self-tissue damage (3).(6). The subsequent release release of self-peptides in theuptake spread of self-reactive immune response to multiple self- the self-tissue antigens results and their bytheantigen-presenting cells (APCs) perpetuates epitopes (6). autoimmune disease (4). Molecular Mimicry Herpes Stromal Keratitis La Cheratite Erpetica Stromale (HSK) una malattia autoimm une dellΥocchio che ha come organo bersaglio la cornea (Streilein et al., 1997 ). La cornea il tessuto trasparente presente nella parte frontale dellΥocchio primariamente responsabile della messa a fuoco delle imm agini sulla retina. Questo tessuto comprende tre strati: un epitelio fatto da cellule non cheratinizza nti, uno stroma contenente cheratociti (fibroblasti) imm ersi in una matrice di tessuto connettivo e infine un endotelio contenente cellule che regolano il contenuto di acqua nello stroma. LΥHSK si sviluppa in seguito allΥinfezione della parte superficiale dellΥocchio con il virus dellΥHerpes di tipo 1 (HSV -1), u na malattia infiamm atoria recidivante, spesso estesa a entrambi gli occhi, nella quale le principali complicazioni sono rappresentate dal glaucoma e da una irreversibile compromi ssione del tessuto corneale frequentemente conducente a cecit . Le cellule T sono le principali responsabili della distruzione del tessuto corneale. LΥHSK la principale causa di cecit nei paesi industrializzati (Metcalf and Kaufman, 1976) . Nel topo lΥHSK indotta in maniera riproducibile 8-14 g iorni dopo lΥinoculazione di HSV-1 a livello della cornea, ammesso che il topo sia imm unocompetente. La malattia non pu, infatti, essere indotta nei topi scid o nude, totalmente imm unocompromessi. Inoltre la suscettibilitalla malattia determinata in maniera unigenica dominante dal locus delle imm unoglobuline (Igh). Quindi ceppi di topi inbred che hanno le varianti alleliche e/dΣ del locus Igh sono altamente suscettibili, ceppi di topi che hanno la variante allelica aΣ del locus Igh sono parzialmente suscettibili mentre i ceppi che hanno la variante allelica Σ sono resistenti Igh e/d: altamente suscettibili Igh a: mediamente suscettibili Igh b: resistenti lΥHSK indotta dal ceppo KOS dellΥHSV-1 mediata da cloni T CD4 + specifici per un antigene corneale e che cross-riconoscono anche un peptide nella regione CH3 dellΥimm unoglobulina IgG2a b (peptide 292-308, Bpep ). Inoltre stato anche dimostrato che un meccanismo di molecular mimi cry che coinvolge un sistema a triplo riconoscimento, in cui cloni T CD4 + riconoscono la proteina del capside virale UL-6, il peptide Bpep e un peptide corneale, essenziale per lΥinduzione della malattia (Zhao et al., 1998). Secondo quanto emerso da questi studi le cellule T CD4 + sopra descritte (che riconoscono lΥantigene corneale, il Bpep e il peptide di UL-6), si attivano in seguito al riconoscimento della proteina UL-6 del capside di HSV -1 (KOS) e distruggono le cellule della cornea. Topi transgenici per il TCR che riconosce il peptide 292-308 (Bpep) dellΥIgG2ab (C1 -6 TCR ) e che cross-riconosce anche il peptide UL-6 sono stati prodotti e sono risultati altamente suscettibili a HSK Da queste osservazioni si deduce, quindi, che, nei topi suscettibili, le cellule T cheratogeniche circolanti e presenti nei tessuti linfoidi periferici, sono attivate in seguito allΥinfezione virale e alla presenza della proteina UL-6, per cui possono raggiungere la cornea e iniziare il processo autoimm une. Tali cellule non sono rese tolleranti dalle proteine della cornea perch , essendo essa un organo imm unoprivilegiato, queste proteine non sono accessibili. Viceversa nei topi resistenti le cellule T cheratogeniche sono rese tolleranti dalla presenza della proteina self IgG2a b
Scarica