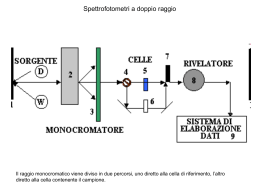
Scuole secondarie di secondo grado SPETTROSCOPIA 22 aprile 2013 Anyone who is not shocked by quantum theory has not understood it. Niels Bohr LA VISIONE “CLASSICA” DEL MONDO il quadro concettuale verso la fine dell’800 Lo spazio in cui viviamo è tridimensionale; il movimento è scandito dal tempo. Gli intervalli spaziali e temporali sono invarianti rispetto al sistema di riferimento in cui vengono misurati. L’universo e’ omogeneo e isotropo; il tempo è omogeneo. I sistemi fisici elementari vengono descritti attraverso il formalismo delle particelle o delle onde. Le variabili che descrivono i sistemi sono continue. LA VISIONE “CLASSICA” DEL MONDO il quadro concettuale verso la fine dell’800 MECCANICA CLASSICA descrive il movimento dei corpi materiali come determinato dalle forze che agiscono su di essi, che si manifestano quali attrazioni o repulsioni mutue tra particelle: -caduta dei gravi -moto dei pianeti -processi termici e i moti disordinati dei costituenti della materia. MAXWELL GALILEO NEWTON BOLTZMANN ELETTROMAGNETISMO descrive i fenomeni elettrici e magnetici basandosi sul concetto di campo elettromagnetico: -fenomeni elettrici e magnetici -luce. IL CROLLO DELLA VISIONE “CLASSICA” DEL MONDO Fase “prequantistica”: 1900-1925 Alcune evidenze sperimentali difficili da interpretare nei termini della fisica classica portarono ad una riformulazione delle teorie consolidate. La radiazione emessa da un corpo caldo contraddice le previsioni dell’elettromagnetismo classico La luce può avere proprietà difficili da spiegare col modello ondulatorio Gli atomi sono stabili ed emettono luce solo a determinate lunghezze d’onda Le particelle possono avere proprietà difficili da spiegare col modello corpuscolare SPETTRO DEL CORPO NERO (PLANCK, 1900) EFFETTO FOTOELETTRICO (EINSTEIN, 1905) STUTTURA DELL’ATOMO e SPETTRI ATOMICI (BOHR, 1913) ONDE DI MATERIA (DE BROGLIE, 1924) LA NATURA DELLA LUCE Dibattito storico: la luce è fatta di onde o di particelle? - XVII secolo: Newton particelle - XIX secolo: Fresnel, Maxwell... onde - ~ 1900: Planck, Einstein particelle - ~ 1920: Meccanica quantistica ? - ~ 1950: Elettrodinamica quantistica ? - ~ 1960: Ottica quantistica ? TEORIA ONDULATORIA XIX secolo Young (~1800): interferenza, le onde di luce possono essere sommate o sottratte onda sinusoidale Fresnel (1814-20): teoria matematica di diffrazione e interferenza onda scalare Fresnel-Arago (1820-30): polarizzazione onda vettoriale trasversa Faraday-Maxwell (1850-64): la luce è un’onda elettromagnetica con E 0 cos t k r e E0 k LE ONDE ELETTROMAGNETICHE ln = c le onde elettromagnetiche trasportano energia sotto forma di un campo elettromagnetico propagante variazione del campo elettrico l = lunghezza d’onda n = frequenza variazione del campo magnetico un’onda elettromagnetica a singola frequenza mostra una variazione sinusoidale nello spazio dei campi elettrico e magnetico c = velocità di propagazione nel vuoto c ≈ 3 108 m/s LO SPETTRO DEL CORPO NERO Irraggiamento termico: ogni corpo all’equilibrio termico ad una temperatura T>0 emette radiazione elettromagnetica a tutte le frequenze. Contemporaneamente assorbe parte della radiazione incidente Corpo nero: assorbitore perfetto: corpo che assorbe tutta la radiazione incidente su di esso. Ben rappresentato da un foro in una cavità (la radiazione che entra non esce più) Interpretazione classica: la materia è composta da particelle cariche in moto accelerato a causa dell’agitazione termica. Le particelle cariche irraggiano: più l’oggetto è caldo, più la vibrazione è veloce e quindi la frequenza è alta LO SPETTRO DEL CORPO NERO Osservazioni sperimentali: lo spettro del corpo nero, ovvero l’intensità della radiazione emessa (potenza per unità di superficie) al variare della frequenza o della lunghezza d’onda, ha un andamento indipendente dalla forma dal tipo di materiale della cavità (Kirchhoff) e soddisfa le seguenti leggi: Legge di Stefan-Boltzmann (1879-1884): l’intensità totale dipende dalla temperatura I T 4 8 W ~ 5.7 10 m 2K Legge di Wien (1893): il picco dello spettro di emissione è a lmax 2.9 m T /1000 K 4 Ipotesi classica (Rayleigh-Jeans): il corpo nero è un insieme di oscillatori che possono assumere qualsiasi frequenza. Legge di Rayleigh-Jeans (1900-1905): kT dI 8 c B 4 dl l lo spettro diverge al diminuire di l: catastrofe ultravioletta. Ipotesi quantistica (Planck, 1900): il corpo irraggiante emette e assorbe energia elettromagnetica in pacchetti di energia, quantità discrete dette quanti ; l’energia di un quanto è proporzionale alla frequenza della radiazione E = hn. Legge di Planck: dI 8c hc dl l 5 e hc lkBT 1 riproduce i dati sperimentali per h ~ 6.626 10-34 J·s = 4.136 10-15 eV·s Il calcolo classico di Rayleigh-Jeans è accurato nel limite l » 1 o h « 1 dI 8 c hc 5 hc lkBT dl l e 1 l o h 0 8c l5 kBT hc 8 c 4 hc lkBT l APPARATO SPERIMENTALE Misuriamo I (l) per una lampada ad incandescenza al variare della temperatura utilizzando un prisma, un sensore di luce e un sensore di rotazione. n l 2 1 3 2 sin 2 4 3 n l A l2 B A 2 1 3 2 sin B 2 4 3 A, B dipendono dal materiale del prisma T T0 1 R T 1 V 1 T 1 0 0 R0 IR 0 0 0 dipende dal materiale del filamento R0 e’ la resistenza alla temperatura T0 Luce solare a mezzogiorno : T = 5400 K lMAX = 537 nm Luce d' ambiente in pieno giorno (luce diurna) : mediamente T ~ 6500 K lMAX = 446 nm Luce del cielo nuvoloso : T ~ 7000 K lMAX = 414 nm Luce del cielo parzialmente nuvoloso : T ~ 8000 - 10000 K lMAX = 362 – 290 nm Luce del cielo sereno : T ~ 10000 - 18000 K lMAX = 161 - 362 nm (il valore è più elevato per il cielo di colore azzurro intenso a nord) Luce di una candela : T ~ 1000 K lMAX = 2898 nm Lampada domestica a incandescenza da 40 W : T = 2650 K lMAX = 1093 nm Lampada domestica a incandescenza da 75 W : T = 2820 K lMAX = 1028 nm Lampada domestica a incandescenza da 200 W : T = 2980 K lMAX = 972 nm Lampada Photoflood da 500 W per uso fotografico : T = 3400 K lMAX = 852 nm Lampada fluorescente extracalda : T = 2700 K lMAX = 1073 nm (la luce appare di colore giallo molto gradevole e riposante) Lampada fluorescente warm white (bianco caldo) : T = 3000 K lMAX = 966 nm (la luce appare di colore bianco - giallastro) Lampada fluorescente white (bianco neutro) : T = 3500 K lMAX = 928 nm (la luce appare di colore bianco tendente, in modo molto lieve, al bianco sporco verdastro) Lampada fluorescente cool white (bianco freddo) : T = 4000 K lMAX = 724 nm (la luce appare di colore bianchissimo) Lampada fluorescente luce normalizzata (D50) : T = 5000 K lMAX = 580 nm (la luce madantoria per i processi di stampa e pre - stampa) Lampada fluorescente daylight (diurna) : T = 6500 K lMAX = 446 nm (la luce appare di colore bianco argenteo intensissimo) Lampada fluorescente skywhite (superdiurna) : T = 8000 K lMAX = 362 nm (la luce appare di colore argenteo quasi azzurrino) Bianco caldo tra i 3000 e i 3500 K, bianco neutro tra i 3500 e i 4500 K, bianco freddo tra i 4500 e i 7000 K. Si ritiene, inoltre, che il bianco puro sia collocato intorno ai 6000 K. LA STRUTTURA DELLA MATERIA Alla fine del ‘800, l’idea che la materia fosse costituita da atomi era utilizzata in fisica e chimica ma non ancora universalmente accettata (critiche di Mach e Ostwald). Non c’era nessuna indicazione sperimentale, per cui era considerata solo come un modello interpretativo, specialmente per le reazioni chimiche (Leggi di Dalton). Conferme definitive: Moto browniano (Einstein, 1905): moto erratico e casuale di particelle di polline in sospensione in un liquido (Brown, 1827) causato dai continui urti della particella con gli atomi del liquido in agitazione termica. Le osservazioni suggerivano atomi con un raggio dell’ordine di 10-10 m. Scoperta dell’elettrone (Thomson, 1898). Esperimento Rutherford (1911): particelle (nuclei di elio) emesse ad alta energia verso una lamina d’oro. La presenza di particelle deviate a grandi angoli suggerisce che la carica positiva sia concentrata in una regione molto piccola (10-15 m) dell’atomo, il nucleo. 14 MODELLI ATOMICI THOMPSON (1898) SCOPERTA DELL’ELETTRONE E DEL PROTONE MODELLO A PANETTONE Facendoli interagire con un campo elettrico, Thomson dimostrò che i In un atomo gli elettroni raggi catodici erano particelle cariche negativamente (elettroni) e sono dispersi in una nube di ne misurò il rapporto carica/massa. Appurò anche l’esistenza di altre carica positiva uniforme, particelle, di carica opposta e di massa molto maggiore (protoni). generata dai protoni RUTHERFORD (1909) SCOPERTA DEL NUCLEO ATOMICO Studiando gli urti di atomi d’oro con particelle alfa (di carica +2), Ritherford si rese conto che la carica positiva doveva essere concentrata in un volume molto piccolo dell’atomo MODELLO PLANETARIO In un atomo gli elettroni orbitano attorno ad un condensato di carica positiva MODELLI ATOMICI BOHR (1913) CRITICITA’ DEL MODELLO PLANETARIO Secondo le leggi della dinamica Newtoniana e dell’elettromagnetismo classico, il moto dell’elettrone è il risultato dell’equilibrio tra forza centrifuga e forza di attrazione elettrostatica: Poiché l’elettrone è soggetto ad una accelerazione centripeta, come ogni carica in moto accelerato perde energia emettendo radiazione e alla fine precipita sul nucleo: l’atomo è instabile! Gli elettroni ruotano attorno al nucleo descrivendo solo alcune orbite privilegiate seguendo su tali orbite le leggi della fisica classica. Su queste orbite, l’elettrone non irradia: le orbite sono quindi stabili. L’emissione o l’assorbimento di luce corrispondono a un salto quantico fra due orbite stazionarie. L’energia di ogni orbita dipende solo dagli elettroni perché i nuclei stanno fermi IL MODELLO ATOMICO E LE RIGHE SPETTRALI Modello planetario (Rutherford, 1909): l’atomo è costituito da un nucleo pesante di carica positiva e da elettroni negativi “leggeri” che gli orbitano attorno. Conseguenze secondo la fisica classica: - qualunque orbita ellittica dovrebbe essere consentita - gli elettroni, essendo soggetti a un moto accelerato, dovrebbero irraggiare e cadere nel nucleo - lo spettro dell’irraggiamento dovrebbe essere continuo - dopo collisioni tra atomi, le frequenze di emissione di tutti gli elettroni dovrebbero cambiare, invece un atomo di gas (108 urti/sec) emette sempre le stesse righe. Formula di Rydberg-Ritz (1888): per calcolare empiricamente la frequenza delle righe spettrali dell’atomo di idrogeno. 1 1 1 RH Z 2 2 l n2 n1 2 RH 10967758.341 m-1 Modello di Bohr (1913): tre nuovi postulati da aggiungere al modello planetario di Rutherford: - esiste un insieme discreto di orbite stabili per gli elettroni, gli stati stazionari, con energie En, in cui essi non irraggiano. - l’atomo irraggia solo nella transizione, salto quantico, da uno stato stazionario all’altro, emettendo radiazione di frequenza n Ef Ei h - il momento angolare dell’ elettrone nelle orbite stabili è quantizzato secondo la regola (orbite circolari) Ln mvn rn n h 2 n quantizzazione dei raggi delle orbite circolari rn e delle energie En rn n 2 a0 Z a0 1 2 4 0 me En 4 0 2 2 me 4 Z 2 2 n2 Il modello di Bohr spiega la formula empirica di Rydberg-Ritz. Il modello non è adattabile a molti tipi di atomi, che saranno spiegati solo dalla meccanica quantistica propriamente detta. TRANSIZIONI ATOMICHE E MOLECOLARI shell chiuse E elettrone fotone hn = E nucleo ECCITAZIONE per assorbimento di un fotone per collisione con altri atomi. DISECCITAZIONE diversi meccanismi di emissione. ASSORBIMENTO L’atomo puo’ assorbire un fotone e compiere una transizione da uno stato ad energia inferiore E1 ad uno ad energia superiore E2. E2 E2 E1 E1 EMISSIONE SPONTANEA L’atomo in uno stato eccitato E2 passa “spontaneamente” in uno stato meno eccitato E1 emettendo un fotone di frequenza n = (E2-E1)/h E2 E2 E1 E1 EMISSIONE INCOERENTE : bassa direzionalita’, bassa monocromaticita’, bassa coerenza, bassa potenza. Tipicamente le molecole rimangono in stato eccitato per non piu’ di pochi nanosecondi. Il meccanismo di diseccitazione si chiama fluorescenza o se dura piu’ a lungo fosforescenza. MOLECOLE Le molecole sono più complesse e i livelli elettronici sono determinati anche dai movimenti interni della molecola VIBRAZIONI MOLECOLARI Oscillazioni armoniche attorno alla posizione di equilibrio ROTAZIONI MOLECOLARI Rotazioni attorno agli assi di simmetria I livelli energetici si infittiscono diventando delle bande EMISSIONE Energia Nelle molecole, il decadimento da uno stato eccitato puo’ accadere per passi successivi UV IR VIS MW La luce riemessa dopo l’assorbimento puo’ avere una frequenza diversa da quella assorbita. SPETTROSCOPIA SPETTRO: grafico dell’intensità della radiazione in funzione della lunghezza d’onda Spettro di assorbimento l nm) Spettro di emissione SPETTROGRAFO A PRISMA Lo spettro di assorbimento e di emissione degli atomi è a righe che corrispondono alle transizioni molto precise fra i livelli. Lo spettro di assorbimento e di emissione delle molecole è composto da righe cosí vicine da apparire continuo. FLUORESCENZA 1. L’assorbimento porta la molecola in uno stato elettronico eccitato 2. La molecola elimina parte dell’energia non radiativamente scendendo la scala dei livelli vibrazionali fino al livello rotovibrazionalmente fondamentale di S1 3. Per rilassarsi elettronicamente la molecola emette spontaneamente radiazione
Scarica