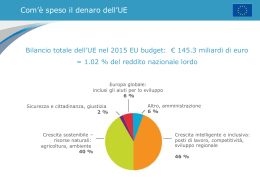
La razionalità economica e l’Health Technology Assessment per prendere le decisioni in sanità Rosanna Tarricone, PhD Direttore Scientifico EHTI Direttore CeRGAS-Università Bocconi Razionalità nelle scelte allocative in sanità • Risorse scarse sono allocate efficientemente quando: • MAX BENEFICI e MIN COSTO OPPORTUNITA’ • CONCETTO RELATIVO CHE RICHIAMA LA NECESSITA’ DI OPERARE DELLE SCELTE • DECISIONI ALLOCATIVE DIVENTANO ECONOMICAMENTE RAZIONALI SE CONFRONTATE CON LE CONSEGUENZE/IMPATTO SULLA SALUTE La valutazione economica è SEMPRE un’analisi comparativa Costi A PROGRAMMA A Conseguenze A Costi B PROGRAMMA B Conseguenze B SCELTA La scelta della tecnica di valutazioni economica A=B AMC Efficacia clinica A vs. B? A≠B Un effetto comune misurato in unità fisiche? Qualità di vita è il/un effetto importante? Effetti non comuni? Più di 1 effetto rilevante? ACE ACU ACB Le diverse tecniche di valutazione economica TIPO DI ANALISI ACE AMC ACB ACU MISURAZIONE/ VALUTAZIONE COSTI IDENTIFICAZIO NE CONSEGUENZE MISURAZIONE/ VALUTAZIONE CONSEGUENZE UNITA’ MONETARIE UNICO RISULTATO COMUNE ALLE ALTERNATIVE RAGGIUNTO A DIVERSI LIVELLI UNITA’ FISICHE* UNITA’ MONETARIE UNICO RISULTATO COMUNE ALLE ALTERNATIVE RAGGIUNTO ALLO STESSO LIVELLO NON NECESSARIO UNITA’ MONETARIE UNO O PIU’ EFFETTI NON NEC. COMUNI ALLE ALTERNATIVE E RAGGIUNTI A DIVERSI LIVELLI UNITA’ MONETARIE UNITA’ MONETARIE EFFETTI IN TERMINI DI SIA MORBILITA’ SIA DI MORTALITA’ RAGGIUNTI A DIVERSI LIVELLI QALYs Analisi costo-efficacia Analisi economica completa che misura i benefici in: Vite salvate, Anni di vita guadagnati, QALYs – quality adjusted life years (analisi costo-utilità) – outcome finali Unità di misura fisica e comune alle diverse tecnologie, gradi di efficacia diversi Obiettivo: massimizzare i guadagni in salute con il budget disponibile Analisi costo-efficacia: Le alternative di confronto • Il programma innovativo deve essere confrontato con la corrente pratica clinica, nell’ipotesi che essa rappresenti l’opzione migliore disponibile ai pazienti • Il comparatore in sintesi dovrebbe essere contemporaneamente: • corrente pratica clinica • opzione migliore disponibile ai pazienti • possibilmente la meno costosa • Se non esiste l’alternativa di confronto, poiché il programma innovativo copre bisogni precedentemente non soddisfatti, è necessario confrontare il programma con il “non fare niente”, che non sempre è tuttavia un’alternativa a costi zero Analisi costo-efficacia: Quali costi inserire nell’analisi? Dipende dalla prospettiva d’analisi… • COSTI DIRETTI SANITARI • Terapie farmacologiche • Degenza ospedaliera • Prestazioni di diagnostica strumentale • COSTI DIRETTI NON SANITARI • Trasporti • Servizi sociali • Assistenza informale • COSTI DI PRODUTTIVITÀ Società • Prestazioni riabilitative H SSN • Visite/consulenze specialistiche Settore pubblico + Pazienti • Esami di laboratorio Analisi costo-efficacia: Quali conseguenze inserire nell’analisi? • Misurazione delle conseguenze: • Esiti finali: anni di vita guadagnati, vite salvate, QALYs • Esiti intermedi: giorni di malattia evitati, riduzione della pressione arteriosa, eventi cardiovascolari maggiori evitati, giorni liberi da attacchi, eventi avversi evitati, etc. • Queste misure intermedie sono ammissibili nell’ACE a patto che esista una plausibile correlazione tra loro e la mortalità o sopravvivenza (es. diagnosi precoce del tumore) • Nel caso in cui non esista nessuna correlazione (per esempio non possiamo essere sicuri che la riduzione del numero di episodi emetici durante chemioterapia aumenti la sopravvivenza) bisogna condurre altre tecniche di valutazione parziale (es. analisi dei costi sorgenti ed evitati dei due antiemetici) – tali outcome non sono rilevati al fine di una efficiente allocazione delle risorse • Abbiano un “valore finito in sé” Analisi costo-efficacia: Quali conseguenze inserire nell’analisi? FONTE DEI DATI DI EFFICACIA: • Studi sperimentali – EFFICACY (efficacia teorica – dato robusto) • Trial clinici randomizzati • Studi osservazionali (non richiedono alcuna modificazione della corrente pratica clinica) – EFFECTIVENESS (efficacia reale – dato rilevante per il decisore pubblico) • Studi caso-controllo (retrospettivi) • Studi di follow-up (prospettici) • Parere degli esperti (metodo Delphi – almeno 3/4 round in forma anonima; metodo Delphi modificato – almeno 2 round in forma non anonima; panel di esperti – solamente 1 round in forma non anonima) • Modelli (rappresentazioni semplificate della realtà con l’obiettivo di descrivere i fenomeni reali tutte le volte in cui non è possibile la loro osservazione diretta) – in combinazione delle fonti sopra citate Analisi costo-efficacia: Condurre l’analisi incrementale CONFRONTO TRA COSTI CA => CB CA <= CB CA > CB CONFRONTO TRA EFFICACIA SCELTA EA < E B DOMINANZA: SI MANTIENE IL PROGRAMMA B (IL PROGRAMMA GOLD STANDARD) EA > E B COST-SAVING: SI ADOTTA IL PROGRAMMA INNOVATIVO A EA > E B SI CALCOLA IL RAPPORTO INCREMENTALE COSTO-EFFICACIA (RICE) Mantengo B Adotto A ??? RICE = CA - CB EA - EB Analisi costo-efficacia: Condurre l’analisi incrementale • Possibili approcci per interpretare RICE : • “League Table” • Valore “soglia” (20-30.000£/QALY; 50.000$/anno di vita guadagnato) • Valore definito in modo arbitrario (NICE) • Valore desunto per via deduttiva dalle decisioni di investimento prese in passato dal decisore pubblico • Impatto sul Budget RICE: Approccio “League Table” (Selected) Programs GP advice to stop smoking Cost/QALY UKP (1990 Prices) 260 Hip replacement 1,140 CABG for severe angina 1,590 GP control of total serum cholesterol 2,600 Breast cancer screening 5,340 Hospital haemodialysis 21,500 Adapted from Williams (1985) Analisi costo-efficacia: Condurre l’analisi incrementale • Possibili approcci per interpretare RICE : • “League Table” • Valore “soglia” (programmi sono giudicati sulla base del valore assoluto del RICE e sono costo-efficacia se al di sotto del valore soglia): • “Supposizioni” (US 50,000/QALY) • WTP (USD 25,000-428,000/QALY) • GDP (WB and WHO raccomandano un valore pari a 3 volte il PIL/procapite) • Altri programmi non sanitari (USD 4,200,000/LYG) • Valore desunto per via deduttiva dalle decisioni di investimento prese in passato dal decisore pubblico (£20-30,000/QALY) • Controllo della spesa? • Australia: >14% aumento/anno del “pharmaceutical benefits programme” • UK: risorse in aumento di £575mil nei primi 2 anni del NICE • Canada: +10% tra il 1997-2000 • Impatto sul Budget Budget Impact Analysis in Sanità Definizione • La BIA è una parte essenziale e complementare di una valutazione completa di una tecnologia sanitaria, sempre più richiesta – per ora solamente per fini regolatori * • La BIA ha lo scopo di stimare le conseguenze dell’adozione e della diffusione di una tecnologia sanitaria in termini finanziari in uno specifico contesto caratterizzato da limitata disponibilità di risorse • Non solo adozione di una nuova tecnologia MA anche differenziazione del mix dei servizi /trattamenti per la cura di una determinata condizione • Destinatari/Utilizzatori: management regionale, nazionale e aziendale (*) Mauskopf JA et al. Principles of Good Practice for Budget Impact Analysis: Report of the ISPOR Task Force on Good Research Practices-Budget Impact Analysis. Value in Health;10(5): 336-347 Il processo di analisi STATUS QUO ELEMENTI CHIAVE INNOVAZIONE Popolazione target totale NUOVO CONTESTO Popolazione target totale incidenza / prevalenza Programma di prevenzione primaria Popolazione malata NUOVA Popolazione malata % diagnosticati Strumento di diagnosi (screening) Popolazione da trattare NUOVA Popolazione da trattare Pratica clinica corrente Farmaco Intervento chirurgico Utilizzo delle risorse (ospedale e territorio) NUOVO Utilizzo delle risorse (ospedale e territorio) Costi unitari Costi unitari NUOVO Impatto sui costi Impatto sui costi DIFFERENZA (BUDGET IMPACT) Il processo di analisi per varie tipologie di innovazione STATUS QUO ELEMENTI CHIAVE INNOVAZIONE Popolazione target totale NUOVO CONTESTO Popolazione target totale incidenza / prevalenza Programma di prevenzione primaria Popolazione malata NUOVA Popolazione malata % diagnosticati Strumento di diagnosi (screening) Popolazione da trattare NUOVA Popolazione da trattare Pratica clinica corrente Farmaco Intervento chirurgico Utilizzo delle risorse (ospedale e territorio) NUOVO Utilizzo delle risorse (ospedale e territorio) Costi unitari Costi unitari NUOVO Impatto sui costi Impatto sui costi DIFFERENZA (BUDGET IMPACT) BIA vs. ACE BIA ACE Scopo Stima dell’impatto finanziario legato ad una specifica scelta Valutazione di costi e conseguenze di alternative Principio Sostenibilità economica Efficienza allocativa Logica Aziendale Economica Efficacia clinica Esclusa Inclusa Prospettiva Terzo pagante (ristretta) Società (ampia) Popolazione A confini “aperti” A confini “chiusi” Analisi dei costi Costi potenziali Diretti, indiretti, perdite di produttività Orizzonte temporale Breve-Medio periodo (1-5 anni) Lungo periodo (life-time) Impatto sul Budget Programma A Costo per Anno di Vita Salvato (ACE) 15,000 B 23,000 C 35,000 D 41,000 E 50,000 Impatto sul Budget A Costo per Anno di Vita Salvato (ACE) 15,000 Impatto sul Budget B 23,000 C 35,000 D 41,000 18,000,000 E 50,000 22,000,000 10,000,000 40,000,000 Programma 7,000,000 23,000,000 Lo stato dell’arte • Alcuni paesi hanno elaborato linee guida sulla BIA: Inghilterra, Stati Uniti, Spagna, Belgio, Canada, Francia e Ungheria • Il numero di studi pubblicati con oggetto la BIA è ad oggi scarso • Limiti: orizzonte temporale (2-3 anni); costo totale di una coorte Tipologie di modelli • Statico • Si ipotizza che la dimensione della popolazione e il mix dei pazienti, in termini di severità, siano costanti nel tempo • Dinamico • Si ipotizza che il nuovo trattamento/tecnologia abbia impatto sull’epidemiologia della malattia nel tempo La razionalità economica e l’impatto sul budget sono sempre sufficienti per prendere le decisioni? Il ruolo dell’Health Technology Assessment nell’introduzione di nuove tecnologie HELTH TECHNOLOGY ASSESSMENT CLINICA ECONOMI CA ETICA SOCIALE SINTESI DELLE EVIDENZE DIFFUSIONE IMPATTO SUI DECISORI ORGANIZZATIV A Impatto organizzativo Innovazione tecnologica può avere un impatto su: 1. Logistica e distribuzione degli spazi (es. Radiochirurgia “Cyberknife”) 2. Competenze e formazione del personale sanitario (es. “Elettrofisiologia” per impianto pace-makers) 3. Modalità di erogazione dei servizi sanitari (es. Telemedicina) Rilevanza dell’impatto organizzativo può influenzare l’organizzazione: 1. Singolo ospedale 2. Sistema sanitario regionale 3. SSN/Paese CASO. Sostituzione della Valvola Aortica per via Transapicale (TAVI) • Malattia: • Stenosi aortica calcifica: • 20% in 65-75 • 35% in 75-85 • 48% > 85 • Sopravvivenza se non trattata: • 2 anni (50% dei casi) • 5 anni (20% dei casi) • Procedura: • Inserimento bioprotesi valvolare in via percutanea: • Transfemorale • Transapicale (TAVI) • Popolazione target: • pazienti con stenosi aortica sintomatica severa con alto grado di mortalità operatoria • pazienti inoperabili (comorbilità) TAVI (2) • • • Comparatori: • Trattamento farmacologico • Valvuloplastica con palloncino • Sostituzione valvolare aortica per via chirurgica • Sostituzione valvolare aortica per via transfemorale Quale comparatore (next best) è quello giusto per la TAVI? • RCT servono per misurare piccole differenze significative tra diverse tecnologie: • Fattibile nel caso della TAVI? • Etico? • “Caso” per discutere il ruolo dei dati sperimentali vs “real-world” (es registri) Prime evidenze: • Mortalità più bassa per TAVI vs. trattamento farmacologico, valvuloplastica e sostituzione chirurgica: • “selezione” pazienti • Curva di esperienza chirurghi e intero staff (successo della procedura aumenta da 77% a 86% passando da 18 a 50 casi) TAVI (3). Impatto Organizzativo • Logistica e divisione degli spazi: • Sala operatoria “ibrida” oppure • Laboratori di emodinamica sterili • Sale cardiochirurgia con tecnologie di visualizzazione appropriate • Competenze e formazione personale: • Team multidisciplinare: • Emodinamisti • Cardiochirurghi con esperienza in sostituzioni valvolari • Anestestisti con esperienza in cardiochirurgia • Ecografista • Infermiere di sala • Modalità di erogazione della procedura e del servizio complessivo • Integrato (es. competenze e “teams”) TAVI (3.1). Impatto Organizzativo • Singolo ospedale: • Minimo 50 casi/anno • Sistema sanitario regionale: • Pianificazione coordinata degli investimenti in strutture, tecnologie e formazione professionale tra la rete ospedaliera della regione o macro-aree se regioni piccole e contigue TAVI (4). Conclusioni Tecnologia “breakthrough” (altamente innovativa): • Difficoltà nel trovare il “giusto” comparatore • Difficoltà nel decidere la reale necessità e fattibilità di condurre studi sperimentali (es. RCT) • Opportunità di sviluppare “Registri” (problematiche connesse al rigore metodologico!) • Impatto sul budget ≠ ACE (es. pazienti nuovi, aumento complessivo nr procedure) • Impatto organizzativo rilevante: • Singolo ospedale (logistica e organizzazione del lavoro in “team”) • Sistema regionale (pianificazione e distribuzione degli investimenti per rispondere efficientemente ed efficacemente ai bisogni della popolazione target) • SSN/Paese (spostamento continuo verso tecniche e procedure miniinvasive con implicazioni su formazione personale sanitario e pianificazione strategia degli investimenti tecnologichi e strutturali) Grazie per l’attenzione [email protected] [email protected]
Scarica