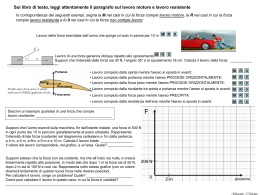
7. Il primo principio della termodinamica 6-10. Il 1° principio della termodinamica 7.7 Lavoro compiuto da un sistema Espansione: V aumenta, lavoro motore Compressione: V diminuisce, lavoro resistente Lavoro compiuto in una trasformazione isobara: lavoro compiuto dal fluido, mentre il pistone (di area S) si solleva di una altezza h (espansione) W = F h = p S h = p ΔV Quindi, W > 0 in un’espansione, W < 0 in una compressione 7.7 Lavoro compiuto da un sistema Il lavoro compiuto dal sistema è uguale, in un diagramma pressione -volume, all’area delimitata dal grafico e dall’asse dei volumi Trasformazione ciclica: il lavoro è l’area della parte di piano p-V racchiusa dalla linea che rappresenta la trasformazione Il lavoro non è una funzione di stato: non dipende solo dagli stati iniziale e finale, ma anche dal tipo di trasformazione 7.8 Primo principio della termodinamica L’energia interna del sistema aumenta di una quantità pari all’energia ricevuta mediante scambio di calore o di lavoro W(e) fatto dall’ambiente sul sistema. ΔU = Qtot + W(e)tot Siccome il lavoro compiuto dal sistema sull’ambiente è W= - W(e) ΔU = Qtot – Wtot Per convenzione: Q > 0, se calore assorbito dal sistema Q < 0, se calore ceduto dal sistema all’ambiente E’ una generalizzazione del principio di conservazione dell’energia. 7.9 Applicazioni: trasf. isocòre e isobare Trasformazione isocora: la variazione ΔV del volume è nulla, quindi W = p ΔV = 0 il lavoro è nullo e l’energia acquistata dal sistema si converte tutta in energia interna ΔU = Q Trasformazione isobara: l’energia acquistata dal sistema serve in parte ad aumentare l’energia interna (temperatura) e, in parte, a compiere lavoro p ΔV + ΔU = Q 7.10 Applicazioni: trasf. adiabatiche e cicliche Trasformazione adiabatica: il sistema non scambia calore con l’ambiente (Q = 0), quindi ΔU = - W espansione W > 0 ΔU < 0 raffreddamento compressione W<0 ΔU > 0 riscaldamento Grafico più inclinato rispetto alle isoterme Equazione di una trasf. adiabatica reversibile (gas perfetto) p1 V1γ = p2 V2γ dove, γ=cp/cv, rapporto tra i calori specifici a pressione costante e a volume costante Trasformazione ciclica: siccome l’energia interna è una funzione di stato, ΔU = 0, quindi, Q=W il lavoro totale compiuto dal sistema è uguale al calore scambiato tra il sistema e l’ambiente
Scarica